用于治疗转移性疾病的RANKL特异性试剂的制作方法
本发明涉及用于治疗癌症患者的rankl特异性拮抗剂,其识别并任选中和人血小板表达的核因子κ-b受体活化因子配体(prankl),还涉及鉴定先导候选试剂(leadcandidateagent)的方法和预测癌症患者转移潜能的方法。
背景技术:
大量的研究和开发领域专注于治疗癌症。正在开发的产品范围从激酶抑制剂到血管生成抑制剂、针对肿瘤靶标的单克隆抗体、细胞凋亡诱导剂、抗肿瘤疫苗和针对各种肿瘤靶标以及具有各种细胞毒性作用的常规化学治疗剂。癌症患者的预后主要由发生转移的风险来确定。
在转移期间,宿主细胞被募集到播散的肿瘤细胞以形成促进转移进展的特殊微环境(“小生境(niches)”),但是引导这些小生境组装的机制在很大程度上是未知的。labelle等人(pnas2014,e3053-3061)描述了例如血小板源而不是肿瘤细胞源的信号是迅速募集粒细胞到肿瘤细胞以形成“早期转移的小生境”所必需的。其描述了血小板在其通过循环进行转运的过程中与肿瘤细胞相互作用,从而形成血小板-肿瘤细胞聚集体,并通过多重机制增强转移。
gay等人(naturereviews2011,11:123-134)评述了血小板对肿瘤转移的作用。其中,在循环系统中,血小板可以保护肿瘤细胞免于免疫消除,并促进其在内皮细胞处的捕获,支持继发性损伤的建立。还描述了血小板对肿瘤细胞的粘附及其掺入血小板异聚集体(heteroaggregate)以保护肿瘤细胞免受nk细胞活性的影响。
骨转移是许多癌症的常见并发症,其导致严重的疾病负担和疼痛。jones等人(nature2006,440:692-696)描述了rank(nf-kb的受体活化因子)配体(rankl)对癌细胞迁移和骨转移的调控。rankl引发表达受体rank的人上皮癌细胞和黑色素瘤细胞的迁移。rank表达在一系列癌细胞系和患者癌细胞上。在黑色素瘤转移的小鼠模型中,在体内通过骨保护素中和rankl导致完全保护免于瘫痪,并且在骨中而不是在其它器官中肿瘤负荷显著降低。通过骨微环境产生的rankl被认为是rank阳性肿瘤细胞的沃土。
dougall等人(bonekeyreports2014,3:519)描述了rankl是破骨细胞功能和存活必需的介质,通过其同源受体rank起作用。临床前数据已经确定,通过rankl抑制来阻断肿瘤诱导的破骨细胞生成不仅可以防止骨破坏,而且还可以抑制已建立的骨转移进展,并延缓癌症模型中从头的骨转移(denovobonemetastases)的形成。在骨转移患者中,骨骼并发症是由破骨细胞活性增加驱动的,可以导致病理性骨折、脊髓压迫并需要放射治疗骨或骨科手术(统称为骨骼相关事件(sre))。描述了一种抗rankl的完全人单克隆抗体denosumab,用于预防或延缓已经转移到骨的实体瘤患者的sre。除了其在肿瘤诱导的骨质溶解、骨破坏和骨骼肿瘤进展中的核心作用之外,还出现与破骨细胞无关的rankl的直接前转移作用的新证据。例如,rankl还通过对表达rank的癌细胞的作用来刺激转移,导致侵袭和迁移增加。
tan等人(nature2011,470(7335):548-553)描述了募集成纤维细胞的肿瘤浸润性cd4+t细胞通过rankl-rank信号传导来刺激乳腺癌转移。
美国食品和药物管理局批准denosumab以商品名prolia用于具有骨质疏松风险的绝经后妇女,以及作为xgeva用于预防来自实体瘤的骨转移患者的sre。临床试验正在研究巨细胞瘤、伴有骨转移的多发性骨髓瘤和恶性高钙血症中的denosumab。
靶向rank/rankl的疗法,例如涉及rankl特异性结合剂,其中包括denosumab、重组rank-fc(schmiedeletal.2013,cancerres.73(2):683-94)或rankl-纳米抗体(wo2008142164a2)。描述了rankl结合肽抑制骨吸收和/或破骨细胞活性(wo2012163887a1)。
denosumab对晚期实体肿瘤患者骨转移的影响在一系列文献中有描述,例如,rolfochristian等人(expertopiniononbiologicaltherapy,vol.14,no.1,2014,pp15-26)、scagliottigiorgiovittorio等人(journalofthoraciconcology,vol.7,no.12,2012,pp1823-1829)、morikawak.等人(databaseembase,elseviersciencepublishers,amsterdam,xp002736136;和japanesejournaloflungcancer,vol.52,no.7,2012,pp1035-1040)、takeshiyuasa等人(oncotargetsandtherapy,vol.5,2012,pp221-229)、hilbewolfgang等人(magazineofeuropeanmedicaloncology,at,vol.6,no.2,2013,pp75-82)、lászlókopper(pathology&oncologyresearch,vol.18,no.4,2012,pp743-747)、sonyaj.snedecor等人(clinicaltherapeutics,vol.34,no.6,2012,pp1334-1349)、sarahpayton(naturereviewsurology,vol.9,no.1,2011,pp1-1)、wo2013/176469和databasewpi,thomsonscientific,london,gb,xp002736138;us2012/114665a1和wo01/08699a1)。
nakanishi等人(platelets2014,earlyonline1-7)描述了血小板增强由树突细胞(dc)介导的th2应答从而有助于过敏性炎症的作用。发现凝血酶受体激动剂肽(trap)激活的血小板表达rankl并诱导骨髓dc的成熟。
b.a.kerr等人(oncogene,vol.32,no.36,2013,pp4319-4324)描述了血小板控制转移前肿瘤与骨通讯交流的作用。
sharmadeva等人(journalofcellularphysiology,vol.229,no.8,2014,pp1005-1015)描述了血小板在肿瘤进展中的作用。描述了血小板保护肿瘤细胞免受宿主反应并促进肿瘤细胞的存活。
espositomark等人(pharmacologyandtherapeutics,gb,vol.151,no.2,pp222-233)描述了在骨转移中靶向肿瘤间质相互作用。描述了血小板分泌tgfβ和血小板聚集体的形成增加循环肿瘤细胞存活。
技术实现要素:
本发明的目的是提供转移性疾病的改善治疗方法和相应的抗转移剂。
该目的通过本发明的主题来解决。
本发明提供识别人血小板表达的核因子κ-b受体活化因子配体(prankl)的rankl特异性拮抗剂,其用于治疗癌症患者以预防或减少血液中的转移前病变(premetastaticleasons)。具体地,医疗用途包括预防或减少血小板与癌细胞的转移前循环细胞聚集体。这种聚集体具体包括血小板,其作为激活的血小板表达prankl。具体地,所述rankl特异性拮抗剂以有效量使用,以防止rank-rankl相互作用时的信号转导,该信号转导促进在血液中形成这种转移前的循环细胞聚集体时的转移,或者防止在血液中形成这样的转移前循环细胞聚集体。
特别地,结合和中和prankl将抑制
a)转移前肿瘤细胞的播散,
b)激活血小板和/或癌(或肿瘤)细胞以表达prankl或诱导rank-rankl信号传导,从而抑制细胞转化变为促转移的,和/或
c)发生血源性扩散(haematogeneousspread)的风险,可选地随后是转移形成。
当与癌细胞相互作用时,prankl明确证实是上调的。因此,通过如本文所述的试剂抑制或中和prankl,将下调转移前病变(premetastaticlesion)。
所述转移前病变通常涉及癌前病变(precursorlesion)的细胞,其特征在于,细胞在其癌变之前,或者癌细胞在其转移前的情况下的外观或性质的变化。
因此,本发明提供了新的治疗方法,其中用有效量的试剂对癌症患者进行治疗以预防或减少转移前病变。
具体地,所述癌细胞来自rank阳性的癌细胞。所述癌细胞可以是rank阳性的肿瘤形成癌细胞或肿瘤细胞,特别是涉及血液和血液形成器官的实体瘤细胞或rank阳性癌细胞,例如白血病。具体地,通过测定激活的血小板-癌细胞聚集体来鉴定转移前病变,该聚集体被认为是形成小生境的循环的转移前细胞簇,从而促进癌症转移或增加发生转移的风险,例如在远处器官或骨转移中。在与所述激活的血小板相互作用时,癌细胞可以转化成rankl阳性癌细胞,这是转移前病变的进一步特征。由于这样的血小板-癌细胞聚集体是血源性的,转移的风险或潜力也称为血液性或血源性。
所述试剂可以仅特异性识别和中和prankl,或交叉特异性识别各种形式的rankl。特别地,所述试剂是交叉反应性的,识别和可选地中和prankl和以下的至少之一或两者:可溶性核因子κ-b受体活化因子配体(srankl)和膜结合的核因子κ-b活化因子配体(mrankl)。
具体地,所述试剂识别rankl多肽,该多肽可以包括人rankl的全部氨基酸序列(seqid3),或prankl细胞外的部分中的表位,例如seqid3的aa69-aa317),特别是和rank竞争与rankl或prankl和可选的任何其它形式的rankl的结合,从而大幅(substantially)抑制rank-rankl信号传导。
具体地,所述试剂结合prankl,从而抑制prankl在癌细胞上激活其受体,例如播散性或转移性肿瘤细胞。
具体地,所述试剂与prankl单体或多聚体结合,比如在血小板表面上相互作用的rankl分子的多聚体,例如其中一个或多个prankl分子结合在血小板的表面上彼此相互作用,和/或与一个或多个不是血小板结合的rankl分子或srankl相互作用。这样的多聚体可以是二聚体,或三聚体或更高的多聚体,优选与血小板表面结合的prankl和/或从血小板表面裂解的prankl,和/或srankl,和/或mrankl形成复合物。因此,结合可以发生例如在所述血小板表面上,血小板和癌细胞之间的微环境中,或者在从血小板表面裂解prankl的循环中。
具体地,转移是血源性的,其中在远处器官(例如肺、肝、肠、皮肤、肌肉、脾脏、胰腺、肾、骨或脑中的任何一种)中肿瘤细胞聚集。具体地,可以有效地减少患有血液和淋巴系统原发性实体肿瘤或癌症的患者发生血源性转移性疾病的风险。
具体地,癌症患者处于患微小残留病和/或转移性疾病复发的风险或患有微小残留病和/或转移性疾病复发,可选地,其中患者的血液样品中具有可检测水平的循环肿瘤细胞,例如通过全血或其血液成分中播散的肿瘤细胞的数量,或通过特异性肿瘤细胞标记物确定。例如可检测数目的肿瘤细胞在至少5ml,或7.5ml或10ml的全血样品中是少于10个,或少于5个,或4、3、2或1个循环肿瘤细胞。
根据具体实施例,所述患者患有实体瘤,该实体瘤选自由上皮性肿瘤和间充质肿瘤,或内胚层、中胚层和/或外胚层起源的肿瘤,或血源性癌症(如白血病)组成的组。
具体地,所述患者患有乳腺癌、胰腺癌、胃癌、食管癌、肾细胞癌、肺癌、结肠/直肠/结肠直肠癌、黑色素瘤、前列腺癌、头颈癌,或白血病。
根据一个具体方面,将所述治疗与手术干预相结合以去除至少一部分肿瘤,和/或与放射治疗相结合,并且所述试剂施用于新辅助治疗或辅助治疗。因此,患者具体地正在准备或正在进行手术干预和/或放射治疗,或已经通过手术干预和/或放射疗法治疗,并且在手术之前或之后进一步用根据本发明的试剂进行治疗。根据具体实例,这种治疗可以在手术前1至30天,或在手术期间或手术后1至30天内开始,并且所述试剂可以在持续时间施用,例如1至12个月或甚至更长,其中所述试剂以规则间隔施用。手术干预是例如治疗性去除肿瘤块或活组织检查。手术被认为是将肿瘤细胞播散到血流中的特定危险因素,从而引起血小板-肿瘤细胞聚集体的形成。同样,放射治疗也可以引发肿瘤细胞的血源性扩散。因此,本发明的方法具体指出了与可能播散实体肿瘤细胞的手术和/或放射疗法结合。
根据一个具体方面,将所述试剂与辅助组合疗法或新辅助组合疗法(优选化学疗法、激酶抑制剂疗法和/或免疫疗法)组合施用于患者。这种组合疗法将特异性靶向所述癌细胞,例如任何肿瘤相关抗原,例如选自由上皮癌细胞标记物、可溶性因子或抗血管生成治疗组成的组。
根据一个具体方面,所述试剂选自由抗体、抗体片段、受体-融合蛋白(例如rank-fc融合蛋白)、肽(例如失活形式的骨保护素或其片段)、小分子(例如rank特异性有机小分子或适配子)组成的组。示例性的小分子是rankl的小分子抑制剂和tnf,如costee等人在annrheumdis2015;74:220-226,doi:10.1136/annrheumdis-2013-203700中描述的。具体实例是能够抑制rankl诱导的iκb和细胞外信号调节激酶(erk)磷酸化的丁二醇联苯羧酸酯的衍生物。例如,可以使用酯键被酮代替的化合物,例如具有下式特征的abd328和abd345:
具体地,所述试剂是人或人源化抗体,例如denosumab或其功能变体,或任何前述物质的抗原结合片段,或rank-fc融合蛋白。denosumab(amgen,thousandoaks,ca,usa)是对rankl特异性的完全人igg2单克隆抗体,其被描述为在具有多种转移性肿瘤的患者中抑制骨吸收标记物,并且正在多个临床试验中进行研究以预防和治疗骨转移。在化学上,它由2条重链和2条轻链组成。每条轻链由215个氨基酸组成。每条重链由448个氨基酸和4个分子内二硫化物组成。所述重链氨基酸序列由seqid1鉴定;所述轻链氨基酸序列由seqid2鉴定。
具体地,所述试剂包含fc抗体片段,例如人igg1fc,其被工程改造以降低fc效应子功能(例如其不显著结合fcγriiia或cd16),因此不显示显著的抗体依赖性细胞毒性(adcc)。包含点突变以降低fc效应子功能的示例性fc片段,其特征在于具有以下突变中的至少一个:e233p、l234v、l235a、δg236、a327g、a330s,其中命名是根据kabat的eu索引编号。
或者,所述试剂包含fc抗体片段,例如人igg1fc,其具有fc效应子功能(例如结合fcγriiia或cd16),例如adcc。这种试剂将具有细胞介导的免疫防御的额外优点,其中免疫系统的效应细胞主动摧毁靶细胞,该靶细胞是血小板和/或癌细胞,优选癌-血小板聚集体。
根据一个具体方面,试剂通过全身给药,优选通过静脉输注或推注给药,将所述试剂以治疗有效量施用于患者。
使用denosumab的现有技术治疗通常涉及皮下治疗。本发明将靶向激活的表达rankl的循环血小板或循环血小板-癌细胞聚集体。因此,静脉途径是特别优选的。
优选的剂量是例如范围为0.5mg至1000mg,优选1mg-400mg。如果皮下给药,优选的剂量范围为0.5mg-400mg。
本发明进一步提供了用于鉴定先导候选试剂的方法,其可有效预防或治疗癌症患者的转移前病变,或微小残留病和/或转移性疾病复发,例如准备或正在经历手术干预以去除至少一部分实体瘤和/或放射治疗的患者,或已经经历过这种手术干预和/或放射治疗的人,该方法包括在基于细胞的测定中筛选一种或多种测试试剂,该测定法包括以下步骤:
a)提供癌细胞培养物;
b)将所述细胞培养物与人血小板在反应混合物中与测试试剂接触;和
c)检测所述测试试剂是否
i)通过prankl抑制rank信号传导;和/或
ii)降低与所述癌细胞结合的血小板水平;
从而鉴定用于预防或治疗转移前病变的先导候选试剂,以及可选地其预防或治疗癌症患者中微小残留病和/或转移性疾病复发的潜力。
具体地,所述检测步骤c)涉及测试两者,是否所述测试试剂
i)通过prankl抑制rank信号传导;和
ii)降低与所述癌细胞结合的血小板水平。
具体地,激活的血小板用于这种筛选测定,例如凝血酶激活的血小板,或由癌或肿瘤细胞激活的血小板,例如由rankl阴性肿瘤细胞激活,以表达prankl。
具体地,该测定是功能性拮抗剂测定或中和测定,其测量假定的拮抗剂(测试试剂)抑制由激动剂(rankl)介导的受体(rank)信号传导的能力。例如,如果化合物大幅抑制受体介导的信号传导,则该化合物被鉴定为rankl特异性拮抗剂。
本发明还提供了预测癌症患者转移性潜能的方法,其包括
a)提供外周血或含有血小板的血液成分(fraction)的样品;
b)确定所述样品中的prankl表达并与参考值进行比较,差异表达指示转移前病变和增加发生远处转移的潜力。
例如,所述样品或血小板可以与具有确定的转移潜能的标准癌细胞孵育,并且可以确定血小板-癌细胞相互作用的rank信号传导水平以获得特定转移潜能的参考值。同样,可以用凝血酶激活所述血小板,并且可以与标准物相比确定所述样品中的prankl水平。
所述prankl表达是例如确定为prankl表达的水平,例如核苷酸序列或prankl多肽或其片段的表达。所述水平可以定性地确定,也可以半定量或定量确定。
所述参考值可以来自于阳性对照或阴性对照,或两者。所述阳性对照是例如代表患有转移性疾病状况的癌症患者的血小板的prankl表达水平。所述阴性对照是例如代表健康对照受试者的prankl表达水平。
附图说明
图1:肺转移模型使用rankl转染的黑色素瘤细胞。将转染以表达人rankl(rankl+)的小鼠b16-f10黑色素瘤细胞(atcc)(通过黑色鉴识)或对照细胞(亲本)注射到c57bl/6小鼠的尾静脉中。b16-f10细胞(每只小鼠100,000个细胞)。在通过血流经过心脏之后,恶性细胞播散到肺部。3周后分析动物肺部的转移负荷,当使用rankl+细胞时,rankl介导的信号传导增强,转移显著增加。这揭示在肺部显示较大的黑色面积和破坏的肺结构。
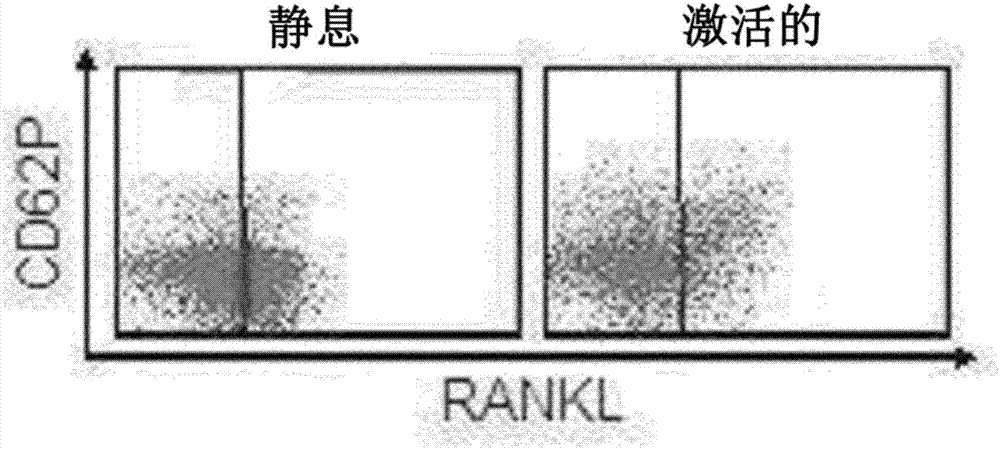
图2:rankl在静息和激活的凝血细胞上的表达。通过离心血液样品分离健康供体的人血小板,然后用0.2u/ml经典的血小板激动剂凝血酶(激活)刺激或者不处理(静息)。通过流式细胞术分析激活标记物p选择素(cd62p)和rankl的血小板表面表达。
图3:rank-fc-ko的结构。rank-fc-ko融合蛋白由人受体rank的胞外结构域(q25-p207;genbankreferencenp_0003830)和人igg1fc部分(p217-k447)(armoretal.2003,molimmunol.40(9):585-93;schmiedeletal.2013)组成,该人igg1fc部分含有氨基酸交换e233p/l234v/l235a/δg236/a327g/a330s以降低其亲和力并因此减少结合fc受体cd16。在这里,所有编号都是根据kabat[eu-索引]。
图4:肺转移模型使用rank-fc-ko。将亲本b16-f10黑色素瘤细胞注射到指定数量的c57bl/6小鼠(每只小鼠75,000)的尾静脉中。另外,不同组的小鼠用以下任一处理:在注射肿瘤细胞24小时前,通过施用3μg/g抗gpibα抗体进行血小板减少,rank-fc-ko(每只小鼠100μg,在肿瘤细胞注射当天,两天后和四天后重复)以及适当的对照(ctrl)作为指示。3周后处死小鼠并计数肺转移数。
图5:通过rankl阻断来阻止永生化mcf10a细胞中血小板诱导的(促转移)emt信号传导。通过实时定量pcr(a)rankl和(b)间充质表型zeb(锌指e-box结合同源盒1,左侧柱)和n钙粘蛋白(右侧柱)的标记物研究作为emt分析的标准模型mcf10a细胞(atcc)。为此,分离、逆转录rna,并通过常规技术对rna进行基于sybr-green的pcr。
(a)显示mcf10a细胞和适当的对照的靶标(rankl)与参照(rpl13)基因表达的比值。结果显示阴性对照和mcf10a细胞之间没有差异,从而排除mcf10a细胞本身表达rankl。
(b)在存在或不存在rankl中和抗体denosumab(10μg/ml)的情况下,在单独培养(未处理)或用血小板(血小板/肿瘤细胞的比例为5:1)培养2天后分析mcf10a细胞中促转移emt基因标志(genesignature)。血小板的存在引起zeb和n钙粘蛋白mrna表达作为促转移emt基因表达的标志物,所述表达通过denosumab的存在而显著降低。
图6:序列
denosumab重链和轻链氨基酸序列:
seqid1:重链
seqid2:轻链
人rankl氨基酸序列(genbank:aab86811.1):
seqid3:全长序列
图7:rankl的中和阻止血小板诱导的永生化mcf10a细胞的迁移。在存在或不存在rankl中和抗体denosumab或相应的同种型对照(每个5μg/ml)的情况下,将1*105mcf10a细胞单独(未处理)或与人血小板(1.5*105/μl)接种在transwell插入物(8μm孔径)的顶部小室。孵育24小时后,将egf(20ng/ml)加入到较低的小室中以作为化学引诱物。在总共孵育48h后,除去膜上侧不能动的细胞,同时将下侧的迁移细胞固定,用dapi染色并在显微镜下计数。
图8:肺转移模型使用血小板特异性rankl敲除(knockout)小鼠。rankl基因侧边为loxp位点(以下称为ranklfl/fl)的b6.129-tnfsf11tm1.1caob/j小鼠和含有巨核细胞/血小板(platetelet)特异性重组酶(以下称为pf4cre)的c57bl/6-tg(pf4-cre)q3rsko/j小鼠均获自jackson实验室(barharbor,meusa),经培养以产生ranklfl/flpf4cre/+敲除(ko)小鼠,其中在巨核细胞/血小板中,rankl被特异性敲除。为了测定血小板表达的rankl的作用,通过尾静脉在ranklfl/flpf4cre/+敲除(ko)小鼠或c57bl/6对照小鼠(ctrl)中注射b16-f10黑色素瘤细胞(每只小鼠75,000)(ko,n=8只动物;ctrl,n=5只动物)。3周后处死小鼠并计数肺转移数。
图9:rankl的中和阻止血小板诱导的sk-mel黑色素瘤细胞中的促转移emt信号传导。(a)使用抗rankl抗体(填充直方图)或相应同种型对照(虚线),然后用抗-小鼠-pe,通过流式细胞术分析sk-mel(atcc)细胞。观察到同种型对照和rankl特异性抗体结合之间没有差异,从而排除sk-mel细胞本身表达rankl。
(b)在单独培养(未处理)或用血小板(血小板/肿瘤细胞的比例为200:1)培养或用血小板和rankl中和抗体denosumab(5μg/ml)培养1天后分析sk-mel黑色素瘤细胞中促转移emt基因标志。然后通过实时定量pcr分析间充质表型zeb(锌指e-box结合同源盒1)、twist和波形蛋白(vimentin)的标记物。为此,分离、逆转录rna,并通过常规技术对rna进行基于sybr-green的pcr。
血小板的存在诱导所有三种标记基因的促转移mrna表达,所述表达通过denosumab的存在而显著降低。
具体实施方式
本文所用的术语“辅助”是指在手术干预和/或放射治疗期间或之后治疗癌症,例如用于改善治疗。
本文所用的术语“新辅助”是指在手术干预和/或放射治疗之前治疗癌症,例如用于改善治疗。
本文所用的术语“rankl特异性拮抗剂”是指化合物,其是rankl结合剂,其大幅中和rankl和/或降低或抑制rankl与其受体rank的结合,从而拮抗rank-rankl信号传导途径。
该试剂的拮抗功能的特征特别在于减少、抑制或预防由激动剂(rankl)激活的受体(rank)的细胞反应。拮抗剂特别地是竞争性拮抗剂,其可以在相同结合位点可逆地结合rankl或作为内源性受体干扰结合位点(活性位点),而不必激活所述受体。
所述试剂可以是任何合适的结合剂或配体,例如选自由下列组成的组:有机或无机小分子、碳水化合物、生物大分子、肽、蛋白质(这里也称为多肽)、肽类似物、肽模拟物、抗体,包括抗体的抗原结合片段,核酸、核酸类似物,以及任何前述的组合。在一些实施例中,所述rankl特异性拮抗剂是免疫治疗剂。所述试剂的具体实例选自由下列组成的组:抗体、受体或骨保护素(其为无活性的或呈现无活性的,以避免激动剂rankl与其受体rank结合)、受体-融合蛋白,例如rank-fc融合蛋白、肽、适体或小分子。
产生和表征拮抗剂的方法是本领域公知的。在优选实施例中,使用一种或多种基于细胞的测定法产生拮抗性结合剂并筛选预定义的性质。这种测定法通常涉及监测细胞对结合剂的反应,例如细胞存活、细胞死亡、细胞形态变化或转录激活,例如天然基因或报告基因的细胞表达。
重组多肽拮抗剂的产生优选使用表达系统来产生重组多肽,例如包括包含编码所述多肽的核苷酸序列的表达构建体或载体。
在一个实施例中,通过药物发现过程鉴定所述拮抗剂,例如包括使用含有潜在药物候选物的组合文库(随机或半随机)的筛选,例如肽文库、抗体文库或化合物文库。可以使用例如高通量的方式进行筛选,例如流式细胞术,并且可选地可以区分活性和非活性或阻断的rank/rankl相互作用。生物筛选可以旨在寻找特异性靶向prankl的新型拮抗剂。
通过“大幅降低或抑制”rank-rankl信号传导,意味着拮抗剂(i)抑制rankl与rank的结合超过50%,优选超过60%、70%、80%、90%或95%,或完全抑制这种结合;和/或(ii)功能性地抑制rankl诱导的途径,特别是rank刺激后的信号传导,例如mapk(丝裂原活化蛋白激酶)或src激酶的活性或参与转移形成的nf-κb信号,例如如在下面的实例部分所描述的肺模型中测定的。这种功能抑制是例如抑制转移形成超过约50%、60%、70%、80%、90%或95%,或完全抑制。
或者,所述功能抑制可以离体确定,例如通过在标准测定中erk1/2和src的激活引起的细胞骨架重排来确定癌细胞的迁移。具体地,可以通过测定通过多孔和/或细胞外基质模拟屏障的细胞部分来测量肿瘤细胞的迁移和侵袭潜能。这种功能抑制是例如抑制迁移和/或侵袭超过约50%、60%、70%、80%、90%或95%,或完全抑制。
也可以通过测定上皮-间充质转化(emt)基因标记(特别是通过靶向prankl癌细胞中的转移相关基因)的下调,来确定所述功能抑制,例如通过基于定量pcr的方法,确定e-钙粘蛋白(e-cadherin)、紧密连接蛋白(claudin)、snail或纤连蛋白中的任何一种。
本文所用的术语“抗体”指由抗体结构域组成或包含抗体结构域的多肽或蛋白质,其被认为是具有或不具有接头序列的免疫球蛋白的重链和/或轻链的恒定结构域和/或可变结构域。本文使用的抗体具有结合rankl抗原或这种抗原的一个或多个表位的特异性抗原结合位点,具体包括单个可变抗体结构域的cdr结合位点,例如vh、vl或vhh,或成对可变抗体结构域的结合位点,例如vl/vh对,包含vl/vh结构域对和恒定抗体结构域的抗体,例如fab、f(ab')、(fab)2、scfv、fv或全长抗体。
可以使用根据本发明的特异性抗体形式,例如包含或由单个可变抗体结构域(例如vh、vl或vhh)组成的抗体,或具有或不具有连接序列或铰链区的可变和/或恒定抗体结构域的组合,包括可变抗体结构域对,例如vl/vh对,包含vl/vh结构域对和恒定抗体结构域的抗体,例如重链抗体、fab、f(ab')、(fab)2、scfv、fd、fv或全长抗体,例如igg类型(例如,igg1、igg2、igg3或igg4亚型)、iga1、iga2、igd、ige或igm抗体。术语“全长抗体”可以用于涉及任何包含至少大部分fc结构域和通常存在于天然存在的抗体单体中的其它结构域的抗体分子。该短语在本文中用于强调特定的抗体分子不是抗体片段。
术语“抗体”应具体包括分离形式的抗体,其基本上不含针对不同靶抗原的其它抗体或包含抗体结构域的不同结构排列。然而,分离的抗体可以包含在组合制剂中,其含有分离的抗体与例如至少一种其它抗体比如具有不同特异性的单克隆抗体或抗体片段的组合。
术语“抗体”应适用于动物来源的抗体,包括人类物种,比如哺乳动物,比如人或鼠,或禽类,比如母鸡,该术语应特别包括基于动物来源序列的重组抗体,例如人类序列。
术语“抗体”进一步适用于具有不同物种起源序列的嵌合抗体,比如鼠源和人源的序列。
关于抗体使用的术语“嵌合”是指那些抗体,其中重链和轻链的每个氨基酸序列的一部分与源自特定物种或属于特定种类的抗体中的相应序列是同源的,而所述链的剩余区段与另一物种或种类中的相应序列同源。通常,轻链和重链的可变区模拟源自一种哺乳动物的抗体的可变区,而恒定部分与源自另一种的抗体序列是同源的。例如,所述可变区可以使用来自非人宿主生物体的容易获得的b细胞或杂交瘤,获自已知的来源,与源自例如人细胞制剂的恒定区组合。
术语“抗体”可进一步适用于人源化抗体。
关于抗体使用的术语“人源化”是指具有基本上源自非人物种的免疫球蛋白的抗原结合位点的分子,其中所述分子的剩余免疫球蛋白结构基于人免疫球蛋白的结构和/或序列。所述抗原结合位点可以包括融合到恒定结构域上的完整可变结构域,或仅包括在所述可变结构域中接枝到适当框架区(fr)上的互补决定区(cdr)。所述抗原结合位点可以是野生型或修饰过的,例如通过一个或多个氨基酸取代,优选修饰为更接近类似人免疫球蛋白。某些形式的人源化抗体保留所有cdr序列(例如包含来自小鼠抗体的所有六个cdr的人源化小鼠抗体)。其它形式具有相对于原始抗体改变的一个或多个cdr。
术语“抗体”可进一步适用于人抗体。
关于抗体使用的术语“人”理解为包含具有源自人种系(germline)免疫球蛋白序列的可变区和恒定区的抗体。本发明的人抗体可以包含不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或体外位点特异性诱变或通过体内体细胞突变引入的突变),例如在cdr中。人抗体包含从人免疫球蛋白文库或从一种或多种人免疫球蛋白转基因的动物分离的抗体。
术语“抗体”具体适用于任何类别或亚类的抗体。根据其重链的恒定结构域的氨基酸序列,抗体可以归属于抗体iga、igd、ige、igg和igm的主要类别中,其中几个可以进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。
所述术语进一步适用于单克隆或多克隆抗体,特别是重组抗体,该术语包含通过重组手段制备、表达、产生或分离的所有抗体和抗体结构,例如源自动物的抗体,例如包括人的哺乳动物,其包括来自不同来源的基因或序列,例如鼠抗体、嵌合抗体、人源化抗体或杂交瘤源的抗体。进一步的实例涉及从宿主细胞中分离的抗体,该宿主细胞经转化以表达所述抗体,或从抗体或抗体结构域的重组、组合文库中分离的抗体,或通过涉及剪接抗体基因序列到其它dna序列的任何其它方法制备、表达、产生或分离的抗体。
抗体结构域可以是天然结构的或通过诱变或衍生化修饰的,例如以修饰抗原结合性质或任何其它性质,例如稳定性或功能性质,例如结合fc受体fcrn和/或fcγ受体(fcgr)。如果包括通过环序列连接的抗体结构域连接的至少两条β链组成的β-桶结构,则认为多肽序列是抗体结构域。
应当理解术语“抗体”还指抗体的衍生物,特别是功能活性衍生物,本文还称为抗体的功能性变体。抗体衍生物理解为一种或多种抗体结构域或抗体和/或融合蛋白的任何组合,其中抗体的任何结构域可以融合在一种或多种其它蛋白质的任何位置,例如其它抗体,例如包括cdr环、受体多肽的结合结构,还有配体、支架蛋白、酶、毒素等的结合结构。所述抗体的衍生物可以通过各种化学技术如共价偶联、静电相互作用、二硫键合等与其它物质缔合或结合而获得。与抗体结合的所述其它物质可以是脂质、碳水化合物、核酸、有机分子和无机分子或其任意组合(例如peg,前药或药物)。在具体实施例中,所述抗体是包括药物的衍生物,例如以获得抗体-药物缀合物。具体地,所述抗体可以与标签一起使用。因此,所述抗体可以是包括标签的衍生物,例如用于分析或诊断目的,包括例如用作体内诊断。对于可使用的标签没有特别限制,只要其对抗体与其靶抗原的结合没有负面影响或负面影响可容忍。合适标签的实例包括his-标签、myc-标签、flag-标签、strep-标签、钙调蛋白-标签、gst-标签、mbp-标签和s-标签。在又一具体实施例中,所述抗体是包括标记的衍生物。本文所用的术语“标记”是指可直接或间接与所述抗体缀合以产生“标记”抗体的可检测化合物或组合物。所述标记本身是可以检测的,例如放射性同位素标记或荧光标记,或者在酶标记的情况下,可以催化可检测的底物化合物或组合物化学改变。
术语衍生物还包括抗体的片段、变体、类似物或同系物,例如具有特定的糖基化模式,例如由糖工程化产生,其是功能性的并且可以用作功能变体,例如结合特定靶标。
关于抗体序列的术语“糖工程化”是指具有修饰过的免疫原性的糖基化变体,adcc和/或cdc作为糖工程化的结果。所有抗体在重链恒定区中在保守位置含有碳水化合物结构,每个同种型具有不同的n-连接碳水化合物结构的排列,其可变地影响蛋白质组装、分泌或功能活性。igg1型抗体是在每个ch2结构域中在asn297处具有保守的n连接的糖基化位点的糖蛋白。连接到asn297上的两个复合双触角寡糖掩埋在ch2结构域之间,与多肽主链形成广泛的接触,并且它们的存在对于抗体介导效应子功能(例如抗体依赖性细胞毒性(adcc))是必需的。在n297处去除n-糖基,例如通过突变n297(例如突变为a),或t299,通常导致具有降低的adcc的糖基化抗体。
抗体糖基化的主要差异发生在细胞系之间,并且对于在不同培养条件下生长的给定细胞系甚至可以看到微小的差异。在细菌细胞中的表达通常提供非糖基化抗体。
抗体可以没有活性fc部分,因此,由不具有fcgr结合位点的抗体结构域组成,具体包含没有ch2结构域和ch3结构域的链的任何抗体,或包括缺乏fc效应子功能的抗体结构域,例如通过修饰来降低fc效应子功能,特别是消除或降低adcc和/或cdc活性。这样的修饰可以通过诱变来实现,例如在fcgr结合位点的突变或通过衍生物或试剂来干扰抗体的adcc和/或cdc活性,从而实现fc效应子功能的降低或fc效应子功能的缺乏,这通常理解为是指fc效应子功能小于未修饰(野生型)抗体的10%,优选小于5%,通过adcc和/或cdc活性测量。
本发明的抗体可以表现出或不表现fc效应子功能。虽然作用模式主要通过抑制肿瘤细胞微环境中的rankl-rank信号传导而不具有fc效应子功能,但fc可以通过形成免疫复合物从循环中募集补体并辅助消除靶标血小板-肿瘤细胞聚集体。
示例性抗体包括fc片段或fc片段的至少一部分,例如将结合位点维持在fcrn上,从而获得在体内具有实质(substantive)半衰期的抗体。
又一实例涉及fc的修饰以获得可能的adcc和/或cdc活性的减少,例如通过igg1转换为igg2亚型或通过修饰来减少与fc受体的结合,例如通过人igg1fc中的e233p和/或l234v和/或l235a和/或d265g和/或a327q和/或a330a和/或g236,删除和/或a327g和/或a330s,其中编号是根据kabat[eu-索引]。
进一步的实例涉及减少免疫原性的修饰,例如通过k.o.糖基化位点,例如n297q,其提供与凝集素受体的受损结合。
示例性抗体是denosumab,或其功能变体或其抗原结合片段,例如掺入igg2或任何其它免疫球蛋白类型或亚型的框架中。例如,可以将所述denosumab抗原结合位点或cdr序列掺入具有或不具有fc效应子功能的igg1抗体中。
应当理解术语“抗体”还指抗体的变体,包括具有亲本cdr序列的功能活性cdr变体的抗体和亲本抗体的功能活性变体抗体。例如,denosumab的功能变体可以如本文进一步描述进行工程化和使用。
具体地,源自本发明的抗体的抗体变体可以包括其(亲本抗体)至少一个或多个cdr区或cdr变体,例如重链可变区的至少3个cdr和/或轻链可变区的至少3个cdr,在至少一个cdr区或fr区中或在重链(hc)或轻链(lc)的恒定区中具有至少一个点突变,具有功能活性,例如特异性结合rankl抗原。
术语“变体”特别是指抗体,例如突变体抗体或抗体片段,例如通过诱变方法获得,特别是删除、交换、将插入物引入特定抗体氨基酸序列或区域或化学衍生氨基酸序列,例如在恒定结构域中工程化抗体稳定性、效应子功能或半衰期,或在可变结构域中改善抗原结合特性,例如通过本领域可获得的亲和力成熟技术。可以使用任何已知的诱变方法,包括在所需位置的点突变,例如通过随机化技术获得。在某些情况下,位置是随机选择的,例如用任何可能的氨基酸或选择优选的氨基酸来随机化所述抗体序列。术语“诱变”是指用于改变多核苷酸或多肽序列的任何公认的技术。优选的诱变类型包含易错pcr诱变、饱和诱变或其它定点诱变。
术语抗体的“功能活性变体”是指修饰该序列(亲本抗体或亲本序列)得到的序列,所述修饰通过一个或多个氨基酸的插入、删除或取代,或化学衍生化氨基酸序列中的一个或多个氨基酸残基,或核苷酸序列内的核苷酸,或任一个或两个序列末端,例如在cdr序列中n-末端和/或c-末端1、2、3或4个氨基酸和/或中心的1、2、3或4个氨基酸(即在cdr序列中间),其修饰不影响,特别是不损害该序列的活性。在对选择的靶抗原具有特异性的结合位点的情况下,抗体的功能活性变体仍然具有预定的结合特异性或基本上相同的生物活性,尽管这可以改变,例如将精细(fine)特异性改变为特异性表位、亲和力、亲合力、kon率或koff率等。例如,亲和力成熟抗体特别理解为功能活性变体抗体。因此,亲和力成熟抗体中的修饰的cdr序列理解为功能活性cdr变体。
优选地,使用具有高亲和力的试剂结合prankl,特别是具有高结合和/或低离散速率或高结合亲合力。所述结合亲和力的特征通常在于所述试剂的浓度,在该浓度处,结合位点的一半被占用,称为解离常数(kd,或kd)。通常,结合剂认为是具有kd<10-8m,优选kd<10-9m,甚至更优选kd<10-10m的高亲和性结合剂。
然而,在可选优选实施例中,单个抗原结合亲和力具有中等亲和力,例如其kd小于10-6m和高达10-8m,例如当与至少两种抗原结合时。
文中使用的术语“基本上相同的生物活性”是指通过基本上相同的活性指示的活性为可比或亲本抗体确定的活性的至少20%、至少50%、至少75%、至少90%,例如至少100%,或至少125%,或至少150%,或至少175%,或例如高达200%。
在优选的实施例中,亲本抗体的功能活性变体
a)是所述抗体的生物活性片段,该片段包括所述分子至少50%,优选至少60%、至少70%、至少80%、至少90%,或至少95%,最优选至少97%、98%或99%的序列;
b)是来自通过至少一个氨基酸取代、添加和/或删除的抗体,其中所述功能活性变体与该分子或其一部分具有序列同一性,例如至少50%序列同一性的抗体,优选至少60%,更优选至少70%,更优选至少80%,还更优选至少90%,甚至更优选至少95%,最优选至少97%、98%或99%;和/或
c)由抗体或其功能活性变体组成,另外还包含与多肽或核苷酸序列异源的至少一个氨基酸或核苷酸。
在本发明的一个优选实施例中,根据本发明的抗体的功能活性变体与上述变体基本相同,但分别与其多肽或核苷酸序列不同,因为其来自不同物种的同源序列。这些被称为天然存在的变体或类似物。
术语“功能活性变体”还包含天然存在的等位基因变体,以及突变体或任何其它非天然存在的变体。如本领域已知的,等位基因变体是(多)肽的替代形式,其特征在于具有基本上不改变多肽的生物学功能的一个或多个氨基酸的取代、删除或添加。
功能活性变体可以通过多肽或核苷酸序列中的序列改变来获得,例如通过一个或多个点突变,其中当与本发明组合使用时,所述序列改变保留或改善未改变的多肽或核苷酸序列的功能。这样的序列改变包括但不限于(保守)取代、添加、删除、突变和插入。
保守取代是在其侧链和化学性质相关的氨基酸家族内发生的取代。这些家族的实例是具有碱性侧链的氨基酸、具有酸性侧链的氨基酸、具有非极性脂肪族侧链的氨基酸、具有非极性芳香族侧链的氨基酸、具有不带电荷的极性侧链的氨基酸、具有小侧链的氨基酸、具有大侧链的氨基酸等等。
点突变特别理解为多核苷酸的工程化,其导致在不同氨基酸的一个或多个单(非连续)或双重氨基酸的取代或交换、删除或插入中,氨基酸序列的表达不同于非工程化的氨基酸序列。
优选的点突变是指具有相同极性和/或电荷的氨基酸的交换。在这方面,氨基酸是指由六十四个三联密码子编码的二十种天然存在的氨基酸。这20种氨基酸可以分为具有中性电荷、正电荷和负电荷的氨基酸:
所述“中性”氨基酸以及它们各自的三个字母和单个字母的代码和极性如下所示:
丙氨酸:(ala,a)非极性,中性;
天冬酰胺:(asn,n)极性,中性;
半胱氨酸:(cys,c)非极性,中性;
谷氨酰胺:(gln,q)极性,中性;
甘氨酸:(gly,g)非极性,中性;
异亮氨酸:(ile,i)非极性,中性;
亮氨酸:(leu,l)非极性,中性;
蛋氨酸:(met,m)非极性,中性;
苯丙氨酸:(phe,f)非极性,中性;
脯氨酸:(pro,p)非极性,中性;
丝氨酸:(ser,s)极性,中性;
苏氨酸:(thr,t)极性,中性;
色氨酸:(trp,w)非极性,中性;
酪氨酸:(tyr,y)极性,中性;
缬氨酸:(val,v)非极性,中性;和
组氨酸:(his,h)极性,正电荷(10%)中性(90%)。
带“正”电荷的氨基酸是:
精氨酸:(arg,r)极性,正电荷;和
赖氨酸:(lys,k)极性,正电荷。
带“负”电荷的氨基酸是:
天冬氨酸:(asp,d)极性,负电荷;和
谷氨酸:(glu,e)极性,负电荷。
相对于本文所述的抗体序列和同源物,“氨基酸序列同一性的百分比(%)”定义为候选序列中与特定多肽序列中的氨基酸残基相同的氨基酸残基的百分比,这是在比对序列并引入间隙(如果需要)之后,以实现最大百分比序列同一性,并且不考虑作为序列同一性的一部分的任何保守取代。本领域技术人员可以确定用于测量比对的合适参数,包括在被比较的序列的全长上实现最大比对所需的任何算法。
与术语“靶标”或“靶抗原”互换使用的术语“抗原”是指通过特异性识别抗原的试剂或能够特异性结合靶标的试剂识别的整个靶标分子或该分子的片段,例如抗体通过抗体结合位点的结合识别抗原。具体地,抗原的亚结构(例如多肽或碳水化合物结构,通常称为“表位”,例如免疫学相关的b细胞表位或t细胞表位)可以通过这种结合位点来识别。本文所用的术语“表位”特别是指可以完全构成特异性结合配偶体的分子结构,或者是如本文所述的试剂的结合位点的特异性结合配偶体的一部分。表位可以由碳水化合物、肽结构、脂肪酸、有机物质、生化物质或无机物质或它们的衍生物及它们的任何组合组成。如果表位包括在肽结构(例如肽、多肽或蛋白质)中,则其将通常包含至少3个氨基酸,优选5至40个氨基酸,更优选约10至20个氨基酸。表位可以是线性表位或构象表位。线性表位由多肽或碳水化合物链的一级序列的单个区段组成。线性表位可以是连续的或重叠的。构象表位由通过折叠多肽形成三级结构而聚在一起的氨基酸或碳水化合物组成,并且所述氨基酸不必在线性序列中彼此相邻。
本文所述的抗原是人rankl,特别是prankl,尽管prankl的特异性结合剂可以交叉特异性识别srankl和/或mrankl,或与prankl及srankl和mrankl两者中的任一(或两者)交叉反应。所述人prankl特别理解为源自人血小板(也称为凝血细胞)的rankl,例如在人血小板的表面上表达的抗原,优选通过激活的血小板,其可以用与其结合的拮抗剂靶定。所述血小板还可以与(rankl阴性)癌细胞相互作用以将这种癌细胞转化为本身能表达rankl的转移前病变。因此,所述拮抗剂也可以靶向表达rankl的癌细胞。所述prankl可以从血小板的表面分离或脱落,并被作为可溶性配体的拮抗剂抑制。当在血小板表面表达时,prankl不同于srankl的地方在于表位的可及性。mrankl可以由组织或癌细胞表达,并进一步与血小板和/或另一癌细胞相互作用。与其它形式的rankl相比,或与源自癌细胞或其它来源的细胞(如成骨细胞)的rankl相比,通过彻底分析prankl的氨基酸序列和糖基化模式,prankl的进一步结构差异是明显的。
术语“rankl”包含人rankl的任何变体、同种型和物种同系物,其由细胞天然表达并且结合到该细胞(例如人血小板或肿瘤细胞)表面,或者如在外周血样品中测定的,在循环中作为可溶性rankl存在。
prankl的优选表位掺入rankl抗原的细胞外部分,特别是prankl的细胞外部分或跨膜rankl的细胞外部分,例如在血小板或细胞表面可接近的表位。
本文所述的拮抗剂与rankl的表位结合,其导致大幅抑制rankl与其受体rank的结合,从而抑制信号传导途径。由于rankl促进表达rank的各种癌细胞的存活并诱导表达rank的各种癌细胞的迁移,所以本文所述的拮抗剂将通过预防或减少癌细胞或肿瘤细胞的转移前迁移和聚集来干扰癌细胞的增殖和转移。
本文所述的术语“转移”是指恶性肿瘤扩散到二级位点,例如远离原发肿瘤或原发性肿瘤的二级位点。这通常涉及癌细胞从原发性肿瘤分离,进入体内循环并固定到体内其它地方的正常组织内生长。这种原发性肿瘤理解为在癌症起源部位生长的肿瘤。在诊断时,认为造血系统疾病(白血病、淋巴瘤和骨髓瘤)是播散性的。但是,造血系统癌症也可以形成转移性肿瘤。虽然罕见,但已经报导了血液和淋巴系统癌症转移至肺、心脏、中枢神经系统和其它组织。转移性肿瘤细胞理解为具有产生转移的能力的细胞或已经是转移性肿瘤的一部分的细胞。具体地,本文所提及的原发性癌细胞和/或转移是rank阳性的,例如通过标准免疫组织化学或基于pcr的方法测定的。
原发性间充质肿瘤的实例是软组织肿瘤,例如来自肌肉、纤维组织和血管组织。
原发性中胚层肿瘤和/或外胚层肿瘤分别包括黑色素瘤和/或成釉细胞瘤和肺的原始神经外胚层肿瘤。
代表性的原发性上皮细胞癌包括乳腺癌、前列腺癌、肺癌、膀胱癌、子宫癌、卵巢癌、脑癌、头颈部癌、食管癌、胰腺癌、胃癌、生殖细胞癌和结肠直肠癌。
特别重要的rank阳性肿瘤疾病是乳腺癌、胰腺癌、胃癌、食管癌、肾细胞癌、肺癌、结肠/直肠/结肠直肠癌、黑色素瘤、前列腺癌、头颈癌,或与rank阳性肿瘤实体相关的其它疾病。
血癌中有白血病、淋巴瘤或骨髓瘤。
患有白血病的患者可以具体受益于如本文所述的抗rankl治疗,因为rank信号传导入白血病细胞可以例如增强其增殖潜力和/或改变其对抗癌治疗干预(例如用化疗和/或激酶抑制剂)的抗性。
治疗癌症和原发性肿瘤的患者通常保留有与癌症相关的微小残留病。也就是说,即使患者可以响应于治疗,通过临床措施来完全缓解疾病,但是一小部分癌细胞可能已经逃脱破坏而保留下来。这种残留群的类型和大小是患者持续治疗的重要预后因素。
在某些实施例中,患者在原发性癌症治疗(例如化疗、放射治疗和/或手术)之后患有微小残留病。本文所述的拮抗剂将特别与细胞减少性疗法或其它治疗性干预措施(例如免疫疗法)组合以治疗微小残留病,和/或作为维持治疗,例如在停止另一种癌症治疗之后作为长期治疗或延长治疗。此外,所述拮抗剂会延缓癌症或肿瘤的再生长或复发,或转移性疾病中转移形成的复发,例如至少1个月或以上。
具体的转移性肿瘤细胞是播散性肿瘤细胞,其倾向于在循环中产生转移前肿瘤细胞聚集体,引发远处器官中的转移形成。令人惊讶的是,播散的rank阳性肿瘤细胞可以与循环中的rankl阳性血小板聚集,这样的聚集体诱导转移形成。激活的血小板可以上调prankl,从而刺激肿瘤细胞上的rank,从而使它们预转移。因此,如本文所述有利地治疗的癌症患者患有主要通过血管转移的肿瘤疾病或癌症,而不是或较少通过淋巴管转移。
所述血小板-癌细胞聚集体理解为促转移或转移的预制体,特别是激活血小板以表达prankl时。这种预制体与转移瘤不同,因为聚集体存在于循环中,并且还没有像转移瘤一样在远处器官中生长成较大的质量。在这一点上,促转移血小板-癌细胞聚集体被认为是rank阳性肿瘤疾病的体现(embodiment)。
本文所用的术语“播散性肿瘤细胞”主要是指在具有肿瘤的患者的循环中发现的肿瘤细胞。虽然该术语通常不包含在循环中发现大多数肿瘤的血液肿瘤,但术语“播散性肿瘤细胞”也同样包括患有血癌的患者中的(前)转移性肿瘤细胞。血癌可以引起血小板与癌细胞的接触,可选地导致循环中的血小板-癌细胞接触聚集体一旦转移就会播散。血癌细胞获得穿透淋巴管或血管壁的能力,此后,它们能够通过血流将循环的(播散性)肿瘤细胞循环到体内的其它部位和组织,最终形成称为转移性或继发性肿瘤植入物的临床可检测的肿瘤。此外,prankl-rank信号传导可能引发血癌疾病进展。
本文中关于血小板-癌细胞聚集体使用的术语“促转移”如下理解。由于prankl阳性血小板聚集并随后结合rank阳性肿瘤细胞,并且启动rank-rankl信号传导,癌细胞或肿瘤细胞和/或血小板可以是促转移的,即促进转移。癌细胞与肿瘤微环境的各种成分之间的相互作用影响肿瘤进展和转移,尽管这些转移促进作用的分子机制尚未确定。鉴别和理解癌症-血小板或肿瘤-血小板交互的途径可导致靶向prankl的疗法的发展,以预防其最早阶段的转移,从而改善患者的结果。
“转移前病变”在此理解为前体病变,其特征在于癌症播散的早期细胞和分子事件,其导致产生促进转移的微环境(转移前的小生境)。令人惊讶的是,播散性肿瘤细胞会在募集凝血细胞(特别是表达prankl的激活的凝血细胞)时引起转移。通过与血小板的相互作用,可选地形成可检测的(促转移)血小板-癌细胞聚集体,并且在微环境中的rank-rankl信号传导时,所述癌细胞将变为转移前的,从而在其变成转移之前改变其外观或性质。因此,认为prankl是特征性区分哪些是转移前病变的细胞或哪些不是。因此,prankl是预防转移的新靶点或其最早开始时检测和预防转移的方法。
通过减少促转移血小板-癌细胞聚集体,器官特异性转移形成的风险大大降低。特别地,这指的是内脏转移或间皮转移,或靶器官如肝、肺、骨、肠、皮肤、肌肉、脾脏、脑或肾,并且在许多情况下是除了骨以外的靶点。内脏转移特别指内脏(身体的内部器官)中的转移,特别是胸腔内的转移,例如心脏或肺或腹部,例如肝脏、胰腺或肠。间皮转移是指在或位于间皮比如胸膜和腹膜中的癌细胞的生长。特别地,间皮转移可导致流体在由间皮围绕的空腔中积累,特别是胸膜和/或腹腔积液,例如由于转移引起的受影响的间皮的炎症反应和/或增加的渗透性导致。
本文所用的术语“转移潜能”是指发生微小残留病、转移性疾病复发、转移性癌症进展迅速的潜力,或转移性癌症显示对标准治疗的抗性的潜力,所述标准治疗例如化疗和/或免疫治疗。
增加的或高的转移潜力表明形成远处转移或转移到多个部位或器官,或局部,组织特异性、器官特异性或位点特异性转移的倾向。在癌症患者中显示出高转移潜力,其中在循环中确定了相对高负荷的播散性肿瘤细胞。特别地,与参考值相比,癌症患者的外周血样品将含有增加数量的可检测的表达prankl,或srankl或mrankl中的任一的血小板,或癌细胞和血小板的集合体(conglomerates)。高转移潜力的细胞系的实例是mda-mb-231(乳腺癌细胞系,来源于her2/neu阳性乳腺癌患者的转移部位,例如在atcc(马纳萨斯,弗吉尼亚)获得),或sk-mel-5(黑色素瘤细胞系,来源于恶性黑色素瘤患者的转移部位,例如在atcc(马纳萨斯,弗吉尼亚)获得)。
相比之下,低转移潜能指示低转移率或非转移性肿瘤。低转移潜能的rank阳性癌仅在循环中仅存在少量或有限量的肿瘤细胞。特别地,癌症患者的外周血样品将仅含有少量或有限量的可检测的表达prankl或prankl的血小板,或肿瘤细胞和血小板的集合体。低转移潜力的细胞系的实例是mcf-7(乳腺癌细胞系,来源于her2/neu阳性乳腺癌患者的转移部位,例如在atcc(马纳萨斯,弗吉尼亚)获得),或sk-br-3(乳腺癌细胞系,来源于her2/neu阳性乳腺癌患者的转移部位,例如在atcc(马纳萨斯,弗吉尼亚)获得)。
分析播散性肿瘤细胞和评估其在体内和体外转移潜能的方法是本领域公知的。可以通过prankl表达的特异性测定或通过测定血液样品中的转移前病变(特别是促转移血小板-癌细胞聚集体,或含有其一部分的血小板)的水平,来改善这些方法。
本文进一步描述的基于预测转移潜力的方法的预后测定可用于确定患者是否适当地用试剂(例如激动剂、拮抗剂、拟肽(peptidomimetic)、蛋白质、肽、核酸、小分子或其它药物候选物)治疗,以治疗癌症或其它与癌症相关的病症如转移性疾病。例如,这种测定可用于确定受试者是否应与化学治疗剂一起施用。
本文使用的术语“患者”是指温血哺乳动物,特别是人类。特别地,本发明的医疗用途形式或各治疗方法适用于需要预防或治疗癌症、肿瘤或转移性疾病的患者。所述患者可以患有早期或晚期疾病,或者有倾向患有这种疾病(例如通过遗传倾向)的患者。
本文所述的术语“药物组合物”是指适合施用于人的组合物,即含有药学上可接受的成分的组合物。优选地,药物组合物包括活性化合物或其盐以及载体、稀释剂或药物赋形剂如缓冲剂或张力调节剂。
本发明的拮抗剂特别提供在药物组合物中。考虑制备用于储存的稳定药物组合物。在具体实施例中,具有所需纯度的试剂与药学上可接受的载体、赋形剂或稳定剂混合,并且作为冻干制剂、水溶液或水包油乳液提供。通常,这样的组合物包括通过可接受的药学实践(参见例如remingtonspharmaceuticalsciences,16thedition(1980)mackpublishingco.)已知和要求的药学上可接受的载体。这种载体的实例包括无菌载体如盐水、林格氏液或葡萄糖溶液,可选地用合适的缓冲液缓冲至5至8范围内的ph。
用于体内施用的制剂将需要无菌。这通过无菌过滤膜或其它合适的方法过滤容易实现。
包括如本文所述使用的试剂的药物组合物的给药具体通过全身途径或通过肠胃外给药,例如通过静脉内、肌肉内或皮下途径给药,也可口服、鼻内、腹膜内(intraotically)、经皮、粘膜、局部(例如凝胶、药膏、洗剂、霜剂等)、腹腔内、肌肉内、肺内、阴道、肠胃外、直肠或眼内给药。用于肠胃外给药的示例性制剂包括适合于静脉内、肌肉内或皮下注射的那些,例如无菌溶液或悬浮液。
特别地,优选静脉内给药,例如作为静脉输注或作为大剂量注射。已知denosumab通过皮下途径给药。在靶向prankl的新指征中,denosumab试剂将会特别地被施用,使其在循环中可获得较长时间,因此,特别不优选或避免皮下途径。
本发明包含药物制剂,其含有治疗有效量的拮抗剂作为活性物质。
与本文所述的拮抗剂的任何术语“有效量”或“足够量”互换使用的术语“治疗有效量”是当施用到受试者时足以获得有益的或期望的结果(包括临床结果)的量或活性,因此,有效量或其同义词取决于其施用的背景。在疾病的情况下,可以使用治疗有效量的试剂来治疗、调节、减弱、逆转或影响疾病或状况,其受益于转移前病变、血小板-癌细胞聚集体或促转移肿瘤细胞聚集体的下调或减少,例如用于预防或治疗转移性疾病。有效量是指足以治疗、预防或抑制这些疾病或病症的化合物的量。对应于这种量的拮抗剂的量将根据各种因素而变化,例如给定的药物或化合物、药物制剂、给药途径、疾病或病症的类型、受试者或治疗的宿主的特性等,但是可以由本领域技术人员常规地确定。
此外,具有治疗有效量的拮抗剂的受试者(癌症患者)的治疗或预防方案可以由单次施用组成,或者包括一系列施用。例如,所述拮抗剂可以每年至少一次、每半年至少一次或每月至少一次施用。但是,在又一实施例中,对于给定的治疗,所述拮抗剂可以约每周一次至约每日施用于受试者。治疗期的长短取决于各种因素,例如疾病的严重性、患者的年龄、拮抗剂的浓度和活性。还将理解,用于治疗或预防的有效剂量可以在特定治疗或预防方案的过程中增加或减少。通过本领域已知的标准诊断测定可以导致剂量变化并变得明显。在某些情况下,需要长期给药。
提供给有需要的人类患者的拮抗剂的治疗有效量可以具体在0.5mg-1000mg,优选1mg-400mg,甚至更优选最多300mg、最多200mg、最多100mg或最多10mg,尽管可以指示更高剂量,例如用于治疗急性疾病状况,例如在准备外科手术时,或在外科手术后不久,当在手术后的1-7天内开始治疗时。皮下注射剂量的范围通常在0.5mg和400mg之间。
本文所用的术语“治疗”总是指治疗患者用于预防(即防止疾病或疾病状况)或治疗(即治疗疾病或疾病状况)的目的。患者的治疗通常在癌症的情况下是治疗性的。但是,如果患者患有原发性疾病,其处于疾病进展的风险或处于发生继发性疾病状态或副反应的风险,例如这取决于rank-rankl信号传导效应,所述治疗可以是预防性的。这种预防治疗在本文中也称为治疗或疗法,例如使用治疗有效量。
在一个实施例中,所述拮抗剂是给予患者的唯一治疗活性剂,例如作为疾病修复单一治疗剂。
或者,所述拮抗剂与一种或多种其它治疗剂组合施用,包括但不限于标准治疗,例如化疗治疗恶性疾病。
在联合治疗中,所述拮抗剂可以作为混合物施用,或者伴随一种或多种其它治疗方案,例如在同步治疗之前、同时或之后。
所述拮抗剂的生物学特性可以在细胞、组织和整个生物体实验中离体表征。如本领域已知的,药物通常在动物体内测试,包括但不限于小鼠、大鼠、兔、狗、猫、猪和猴,以测量药物治疗疾病或疾病模型的功效,或测量药物的药代动力学、药效学、毒性和其它性质。动物可以称为疾病模型。经常在小鼠中测试治疗剂,包括但不限于裸小鼠、scid小鼠、异种移植小鼠和转基因小鼠(包括敲入和敲除)。这种实验可以提供有用的数据,用于确定用作具有适当半衰期、效应子功能、凋亡活性和igg抑制活性的治疗剂的试剂的潜力。任何有机体(优选哺乳动物)可用于测试。例如,由于与人类、灵长类动物、猴的遗传相似性,它们可以是合适的治疗模型,因此可以用于测试试剂的功效、毒性、药代动力学、药效学、半衰期或其它性质。人体内物质的测试最终需要批准作为药物,这些实验在本文中有考虑。因此,本发明的拮抗剂可以在动物模型或人体中进行测试,以确定其治疗功效、毒性、免疫原性、药代动力学和/或其它临床特性。denosumab是具有良好的生物学特性的市售产品,尽管抗prankl效应抑制癌细胞与凝血细胞的相互作用的结果是令人惊讶的。
关于本文所述的rankl特异性试剂的术语“特异性”是指在异质分子群体中确定目标同源配体(rankl)的结合反应。因此,在指定条件下,例如免疫测定条件下,特异性结合其特定靶标的试剂不能以显著量与存在于样品中的其它分子结合。
特异性结合位点或特异性试剂通常仅识别靶标,并且不与其它靶标交叉反应。然而,所述特异性结合位点可以特异性地结合靶标的一个或多个表位、同种型或变体,或者与其它相关的靶抗原(例如同系物或类似物)交叉反应。
所述特异性结合意味着按照所选择的,结合在靶标的同一性,高、中或低结合亲和力或亲合力方面是选择性的。如果结合常数或结合动力学至少是10倍差异,优选至少是100倍差异,更优选至少1000倍,则通常达到了选择性结合。
术语“手术干预”在本文中也称为“手术”,是指手术移除,例如包括全部或部分肿瘤的活检、切去(resection)或切除(ectomy),特别是原发性肿瘤例如实体瘤和/或一种或多种转移瘤的活检、切去或切除。
根据具体实例,在肺转移小鼠模型中测试通过静息或激活的凝血细胞的rankl表达的作用。与未激活的凝血细胞相比,在人体系统中显示,激活的凝血细胞较高水平地表达rankl。
根据又一实例,使用rank-fc融合蛋白(schmiedeletal.2013,cancerres.73(2):683-94),其由人rank受体和人igg1的fc组成,并且其包括点突变以降低其对fc受体fcγriii、cd16的亲和力,其为233p/l234v/l235a/δg236/a327g/a330s(根据kabat的eu索引编号命名)。确定rank-fc融合蛋白对肺转移小鼠模型中转移形成的影响。已经显示,rank-fc融合蛋白中和rankl大约与凝血细胞减少一样有效。
其它实例可以显示prankl由血小板转移到rankl阴性肿瘤细胞,从而将肿瘤细胞转化为rankl阳性肿瘤细胞。也可以确定,prankl在肿瘤细胞中诱导促转移emt事件,并影响肿瘤细胞通过基质胶的迁移。在小鼠敲除模型中有条件地敲除巨核细胞和血小板中的rankl表达,事实上可以显示prankl诱导转移前病变,并且prankl抑制将抑制或减少转移形成。
参考以下实例将更充分地理解上述描述。但是,这些实例仅仅代表实施本发明的一个或多个实施例的方法,并且不应视为限制本发明的范围。
实例
实例1:在肺转移小鼠模型中通过rankl转染黑色素瘤细胞的rankl表达
用人rankl或亲本细胞系转染的小鼠黑色素瘤b16-f10细胞用于肺转移的小鼠模型中。转染的rankl阳性细胞的应用与亲本细胞(对照)相比导致动物肺中的转移负担大大增加(图1)。由于已知人rankl可以刺激小鼠rank,所以这些数据表明,接受rankl阳性肿瘤细胞的小鼠的转移负担增加是由于进入肿瘤细胞的rank信号传导增强。这也符合jones等人(2006)的研究,其显示,在旁分泌和/或自分泌刺激时rank阳性肿瘤细胞的转移增强。该实验证明,提供rankl用于超过正常情况下可用水平的rank刺激可增强转移潜能。其中rankl的转染模拟prankl对肿瘤细胞的贡献/转移。
实例2:激活的凝血细胞上的prankl表达
由于已知血小板促进肿瘤转移,因此分析血小板上潜在的rankl表面表达。虽然在静息血小板上可以检测到低水平的rankl,但在凝血酶激活血小板后获得了显著(profound)的rankl表面表达(图2)。因此,在与肿瘤细胞形成聚集体时也发生的血小板激活导致rankl表达的快速上调。所述上调的rankl随后可容易地用于在肿瘤细胞上相互作用并刺激rank。
实例3:rank-fc融合蛋白
制备含有人受体rank的细胞外部分和人免疫球蛋白g(higg1)的免疫受体-fc融合蛋白(图3)。由于igg1部分中的氨基酸交换(233p/l234v/l235a/δg236/a327g/a330s,armouretal.,1999,schmiedeletal.,2013),在生理条件下其抑制fc部分与cd16的结合,所述融合蛋白显示出明显降低了对fc受体(fcγriiia,cd16)的亲和力。与denosumab相比,该构建体显示与人和鼠rankl两者的结合,因此有利于在rankl中和的鼠模型中的使用(bossenetal.2006,jbiolchem281(2):13964-71;kostenuiketal.2009,jboneminerres24(2):182-95)。
实例4:在肺转移模型中rankl中和的作用
为了检查在体内激活表达的prankl的作用(例如在血流中包被循环肿瘤细胞后),应用黑色素瘤肺转移模型。亲本黑色素瘤细胞用于表征该模型中生理小鼠prankl的作用。血小板减少时转移数量急剧减少,这也与以前的报道一致。有趣的是,使用rank-fc-ko融合蛋白中和小鼠rankl导致少量转移,与在血小板减少时获得的结果相当(图4)。这些数据表明转移由prankl介导,它的中和可以预防转移形成。
实例5:rankl的中和阻止血小板诱导的永生化mcf10a细胞中促转移emt信号传导。
作为第一步,我们使用实时定量pcr来排除mcf10a细胞(emt分析的经典模型),它们本身表达rankl。这有助于确定肿瘤表达的rank的刺激不以独立于血小板的自分泌/旁分泌方式发生。如前所述,随后将mcf10a细胞与人血小板一起孵育以模拟血液中肿瘤细胞的血小板包被(koppetal.2009,cancerres69(19):7775-83;plackeetal2012,cancerres72(2):440-8;和plackeetal.2012,189(1):154-60)。在存在或不存在denosumab的情况下另外进行共培养以中和血小板源的rankl。zeb和n钙粘蛋白mrna的诱导的实时定量pcr分析表明血小板的存在诱导mcf10a细胞中两种促转移基因的表达。这通过用denosumab阻断rankl而大大降低,从而提供了明确的证据,即事实上,在形成聚集体时prankl介导血小板对肿瘤细胞的促转移作用,以及prankl的中和可以用于限制肿瘤细胞的转移潜能。
实例6:rankl的中和阻止血小板诱导的永生化mcf10a细胞的迁移。
由于恶性细胞的迁移潜能是它们形成转移能力的关键,我们研究了血小板源的rankl是否也影响肿瘤细胞迁移。为此,将mcf10a细胞用于transwell测定系统。在在transwell系统的上小室中存在或不存在同种型对照或denosumab的情况下,如上所述将mcf10a细胞与人血小板一起孵育以模拟血液中的肿瘤细胞的血小板包被。48小时后,测定沿egf梯度迁移到下小室的细胞数。我们观察到,血小板的存在明显增强了迁移细胞的数量,当血小板源的rankl被存在的denosumab中和时,这大大减少了。这表明prankl增强恶性细胞的迁移潜力,从而增强其在形成聚集体时的促转移表型,并且prankl的中和可用于限制肿瘤细胞的转移潜能(图7)。
实例7:肺转移模型使用血小板特异性rankl敲除小鼠。
为进一步检查prankl在体内的作用,采用b16-f10黑色素瘤肺转移模型。为了具体评估血小板表达的rankl的作用,饲养其中rankl含有flox位点的129-tnfsf11tm1.1caob/j小鼠(以下称为ranklfl/fl)和含有巨核细胞/血小板特异性重组酶的c57bl/6-tg(pf4-cre)q3rsko/j小鼠(以下称为pf4cre)以产生ranklfl/flpf4cre/+敲除(ko)小鼠,其中在巨核细胞/血小板中特别地敲除rankl。为了测定血小板表达的rankl的作用,通过尾静脉在ranklfl/flpf4cre/+敲除(ko)小鼠或c57bl/6对照小鼠(ctrl)中注射b16-f10黑色素瘤细胞(每只小鼠75,000)。与对照组相比,血小板中缺乏rankl导致ko中肺转移的数量大幅减少(图8)。这些数据进一步证实了在体内转移形成中prankl具体参与其中,并支持我们的方法,即中和prankl可以用于阻止转移。
实例8:rankl的中和阻止血小板诱导的sk-mel黑色素瘤细胞中前转移emt信号传导。
为了证实和扩展用永生化mcf10a细胞获得的结果,我们使用恶性黑色素瘤细胞系sk-mel(atcc)。流式细胞术分析排除了恶性细胞本身表达rankl以确定肿瘤表达的rank的刺激不以自分泌/旁分泌方式发生,而是依赖于血小板(图9a)。在图9b所示的实验中,如前所述,将sk-mel细胞与人血小板一起孵育以模拟血液中的肿瘤细胞的血小板包被。在存在或不存在denosumab(5μg/ml)的情况下进行共培养以中和血小板源的rankl。24h后,zebmrna的诱导的实时定量pcr分析表明,与mcf10a细胞一样,血小板的存在诱导了该促转移基因的表达,并且这通过用denosumab阻断血小板源的rankl而大大减少。对twist和波形蛋白的表达水平进行分析时也观察到类似的作用,这是转移形成/emt中涉及的另外两个基因。这些分析证实并扩展了我们利用图5描述的mcf10a细胞获得的发现,并提供了进一步的证据,即事实上,在形成聚集体时prankl介导血小板对肿瘤细胞的促转移作用,以及prankl的中和可以用于限制肿瘤细胞的转移潜能。
序列表
<110>普罗比奥康有限责任公司
<120>用于治疗转移性疾病的rankl特异性试剂
<130>pr001p
<160>3
<170>bissap1.3
<210>1
<211>452
<212>prt
<213>人工序列
<220>
<223>重链
<400>1
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesersertyr
202530
alametsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyilethrglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspproglythrthrvalilemetsertrppheaspprotrp
100105110
glyglnglythrleuvalthrvalserseralaserthrlysglypro
115120125
servalpheproleualaproserserlysserthrserglyglythr
130135140
alaalaleuglycysleuvallysasptyrpheprogluprovalthr
145150155160
valsertrpasnserglyalaleuthrserglyvalhisthrphepro
165170175
alavalleuglnserserglyleutyrserleuserservalvalthr
180185190
valproserserserleuglythrglnthrtyrilecysasnvalasn
195200205
hislysproserasnthrlysvalasplyslysvalgluprolysser
210215220
cysasplysthrhisthrcysproprocysproalaprogluleuleu
225230235240
glyglyproservalpheleupheproprolysprolysaspthrleu
245250255
metileserargthrprogluvalthrcysvalvalvalaspvalser
260265270
hisgluaspprogluvallyspheasntrptyrvalaspglyvalglu
275280285
valhisasnalalysthrlysproargglugluglntyrasnserthr
290295300
tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn
305310315320
glylysglutyrlyscyslysvalserasnlysalaleuproalapro
325330335
ileglulysthrileserlysalalysglyglnproarggluprogln
340345350
valtyrthrleuproproserargaspgluleuthrlysasnglnval
355360365
serleuthrcysleuvallysglyphetyrproseraspilealaval
370375380
glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro
385390395400
provalleuaspseraspglyserphepheleutyrserlysleuthr
405410415
valasplysserargtrpglnglnglyasnvalphesercysserval
420425430
methisglualaleuhisasnhistyrthrglnlysserleuserleu
435440445
serproglylys
450
<210>2
<211>215
<212>prt
<213>人工序列
<220>
<223>轻链
<400>2
gluilevalleuthrglnserproglythrleuserleuserprogly
151015
gluargalathrleusercysargalaserglnservalargglyarg
202530
tyrleualatrptyrglnglnlysproglyglnalaproargleuleu
354045
iletyrglyalaserserargalathrglyileproaspargpheser
505560
glyserglyserglythraspphethrleuthrileserargleuglu
65707580
progluaspphealavalphetyrcysglnglntyrglyserserpro
859095
argthrpheglyglnglythrlysvalgluilelysargthrvalala
100105110
alaproservalpheilepheproproseraspgluglnleulysser
115120125
glythralaservalvalcysleuleuasnasnphetyrproargglu
130135140
alalysvalglntrplysvalaspasnalaleuglnserglyasnser
145150155160
glngluservalthrgluglnaspserlysaspserthrtyrserleu
165170175
serserthrleuthrleuserlysalaasptyrglulyshislysval
180185190
tyralacysgluvalthrhisglnglyleuserserprovalthrlys
195200205
serpheasnargglyglucys
210215
<210>3
<211>317
<212>prt
<213>智人
<400>3
metargargalaserargasptyrthrlystyrleuargglyserglu
151015
glumetglyglyglyproglyalaprohisgluglyproleuhisala
202530
proproproproalaprohisglnproproalaalaserargsermet
354045
phevalalaleuleuglyleuglyleuglyglnvalvalcysserval
505560
alaleuphephetyrpheargalaglnmetaspproasnargileser
65707580
gluaspglythrhiscysiletyrargileleuargleuhisgluasn
859095
alaasppheglnaspthrthrleugluserglnaspthrlysleuile
100105110
proaspsercysargargilelysglnalapheglnglyalavalgln
115120125
lysgluleuglnhisilevalglyserglnhisileargalaglulys
130135140
alametvalaspglysertrpleuaspleualalysargserlysleu
145150155160
glualaglnprophealahisleuthrileasnalathraspilepro
165170175
serglyserhislysvalserleusersertrptyrhisasparggly
180185190
trpalalysileserasnmetthrpheserasnglylysleuileval
195200205
asnglnaspglyphetyrtyrleutyralaasnilecysphearghis
210215220
hisgluthrserglyaspleualathrglutyrleuglnleumetval
225230235240
tyrvalthrlysthrserilelysileproserserhisthrleumet
245250255
lysglyglyserthrlystyrtrpserglyasnsergluphehisphe
260265270
tyrserileasnvalglyglyphephelysleuargserglygluglu
275280285
ileserilegluvalserasnproserleuleuaspproaspglnasp
290295300
alathrtyrpheglyalaphelysvalargaspileasp
305310315
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺