一种富硒产谷胱甘肽复合菌及其制备方法和应用与流程
本发明涉及一种富硒产谷胱甘肽复合菌(SGP)及其制备方法和应用,属于微生物发酵领域,是利用微生物发酵的方法生产有机硒、还原型谷胱甘肽和益生菌,以及其在人或动物肝病防护方面的应用。
背景技术:
肝病的起因有:1、外界的因素包括病毒感染,像甲肝病毒或乙肝病毒从外界侵入体内,这是最常见的一种外来致病因素;2、用药不当,肝脏的代谢器官会受到损害;俗话说“是药三分毒”,吃的药太多、太杂、剂量大,超过肝脏的承受能力从而诱发肝病;3、另外像饮酒,大量的饮酒,长期的酗酒,肝脏同样也会受到伤害;4、自身的肝脏也可以由于免疫性的紊乱导致肝脏的损伤,所以内外两种因素都可以造成肝脏组织的损伤。这些损坏因素迟迟不能剔除,慢慢发展,就会演变成肝纤维化,最后发展到肝硬化,甚至于癌变。“药食同源”是中华原创医学之中对人类最有价值的贡献之一;中医历来强调“药疗不如食疗”,食疗成为现代人追求返璞归真、健康饮食的最佳选择;让人们在享受美食的过程中祛除病痛,避免了打针、吃药,甚至手术之苦;因此,一些食源性的产品在肝病的预防和治疗中的作用引起了人们的广泛关注。
硒是人体必需的14种微量元素之一,具有抗癌、保护心脏、抗肝脏坏死、防治近视和白内障、解毒、提高免疫力、延缓衰老和增强生殖功能等多种药理作用。硒作为人体的清道夫,能有效清除体内的自由基,其抗氧化作用为维生素E的400倍;硒是生物体内谷胱甘肽过氧化物酶(GSH-Px)的重要组成部分,以硒代半胱氨酸的形式存在于其活性中心,而GSH-Px为肝内重要的抗氧化酶,能抑制过氧化反应,分解过氧化物,清除自由基,从而修复膜分子的损伤。因此,硒与肝病的关系日益受到重视。
还原性谷胱甘肽(GSH)是一种重要的生理活性物质,科学研究表明GSH具有抗氧化、清除自由基、解酒护肝、增强免疫力、美容防晒、抗辐射、延缓衰老、抗癌等功能。GSH具有广谱的解毒作用,对机体有毒化合物,如丙烯腈、氟化物、一氧化碳、重金属、有机溶剂、酒精、致癌物质等中毒均有一定的解毒作用,能与之结合并促进其排出体外。从而保护我们不受汽车尾气、致癌物、传染病、酒精等有毒物质的侵害。肝脏是人体中GSH含量最高最丰富的器官,肝脏的重要功能是解毒作用,当肝脏中GSH偏低时,会导致毒性物质代谢下降,无法排出体内有毒物质从而造成肝功能的伤害。如慢性酒精中毒患者,其肝 细胞中线粒体的GSH含量过低,在代谢过程中所产生的活性氧无法被GSH中和,从而会导致细胞的死亡和肝硬化等疾病。适当补充GSH有利于肝脏功能的恢复,还可抑制酒精性脂肪肝的形成,保肝护肝。GSH在增强食品营养价值和强化食品风味的同时对人体又有保健作用,在食品抗氧化剂发展中具有广阔的应用前景。
益生菌是指投入后通过改善宿主肠道菌群生态平衡而发挥有益作用,达到提高宿主(人和动物)健康水平和健康状态的活菌制剂及其代谢产物,主要包括乳酸菌、双歧杆菌、放线菌、酵母菌。益生菌添加剂是利用生物技术生产的微生物添加剂的一种。被美国FDA(食品及药物管理局)认证为可作为食品添加剂的菌种,并广泛应用于食品和制药行业。其作用机制通常认为有:(1)益生菌可作为活菌,进入胃肠道后繁殖力增强,促进微生物繁殖和增强活性,能有效抑制病原微生物的繁殖,调节胃肠道微生态平衡,参与病原微生物菌群的生存竞争,排斥病原菌在胃肠道粘膜表面的附着,协助机体消除毒素及其代谢产物。(2)增强机体免疫力和抗病力,防止毒素和废物的吸收,对人和动物消化系统起到保健作用;(3)益生菌分泌的多种消化酶和未知生长因子,维生素、SOD、活性肽、辅酶等营养成分具有促生长作用,分泌的蛋白酶、淀粉酶和脂肪酶活性,参与食物的降解、消化,提高机体对营养物质的利用率。
肠道微生态系统与肝脏的联系:肝脏是人体最大的腺器官,80%的血供来自门静脉。门静脉血富含自肠道吸收的各种营养物质,同时也含有肠道细菌产生的各种代谢产物、微量的肠源性内毒素及肠道易位的细菌,肝脏的多种生物功能均与肠道菌群有着密切的联系。一方面肝脏分泌的结合型胆汁酸在小肠对肠道的致病菌有抑制作用,游离型胆汁酸在大肠内通过调节pH值而调节肠道菌群平衡;另一方面肠道菌群的代谢产物对肝脏的脂肪、蛋白质、糖、维生素、激素等代谢过程有重要的调节作用。双歧杆菌等的酸性代谢产物如乙酸、丁酸等通过肝脏的转化作用参与宿主的能量代谢。肠道有益菌通过其酸性代谢产物还可降低肠道产氨、产尿素酶细菌的生长,并可利用氨作为氮源合成蛋白质,减轻肝脏的解毒负荷。此外,肠道免疫反应释放的大量促炎性细胞因子、肠源性内毒素可以通过门静脉进入肝脏,激活肝脏免疫细胞如枯否氏细胞等,释放一系列炎症介质,进一步对肠黏膜以及远端组织器官造成影响。由此可见,肝脏的多种生物学功能与肠道正常微生态环境有着密切的联系。
硒的补充可以通过摄入无机硒或有机硒而得以实现。由于无机硒的毒性较高,因而限制了它的广泛使用;有机硒的安全性能和利用率虽然远远优于无机硒,但纯的硒代蛋氨酸价格昂贵,因此必须寻找一种有机硒的廉价生产方法。利用微生物如酵母或乳酸菌等益生菌将无机硒生物转化为有机硒,被公认为是一条安全高效的途径。许多研究表明一些酵母菌在生长 过程中细胞内可产生GSH。利用益生菌在富硒的同时并获得高产量的GSH,这无疑会扩大益生菌的应用范围。
技术实现要素:
本发明的目的在于提供一株高产谷胱甘肽酿酒酵母NAU-LYH-SGS,该菌株分类命名为:酿酒酵母(Saccharomyces cerevisiae),于2015年11月30日保存于中国典型培养物保藏中心(中国武汉武汉大学),菌种保藏编号CCTCC NO:M 2015717。
本发明的另一目的在于提供一种富硒产谷胱甘肽复合菌。
本发明的另一目的在于提供一种富硒产谷胱甘肽复合菌的制备方法。
本发明的又一目的在于提供上述富硒产谷胱甘肽复合菌的应用。
本发明涉及一种简单、低成本生产的富硒产谷胱甘肽复合菌食品或饲料添加剂具有保护肝损伤的作用。在含有无机硒源的发酵液中加入复合菌,通过工业化发酵生产,其中的益生菌能将无机态的硒转变成有机态的硒,并同时高产GSH得到一种可同时发挥有机硒,GSH和复合益生菌等多重作用的生物制品。用该生物制品饲喂四氯化碳(CCl4)诱导的肝纤维化的大鼠,能明显缓解肝脏纤维化。该产品具有绿色、营养、安全、性价比高等特点,是一种具有保肝护肝作用的新型食品或饲料添加剂。
本发明的目的通过以下技术方案实现:
高产GSH菌株的分离与鉴定:
本发明首先提供一株高产谷胱甘肽酿酒酵母NAU-LYH-SGS,该菌株分类命名为:酿酒酵母(Saccharomyces cerevisiae),于2015年11月30日保存于中国典型培养物保藏中心(中国武汉武汉大学),菌种保藏编号CCTCC NO:M 2015717。
主要生物学特性:显微镜下观察,菌株细胞为近圆形,大小(4.1-8.2)微米*(5.2-9.5)微米,不产生醭膜;以多端芽殖进行无性繁殖;无假菌丝,有子囊孢子产生;琼脂平板上30℃培养24-36h后,菌落乳白色、隆起、表明光滑湿润,有光泽、质地均匀、边缘较整齐。最适生长温度30℃,pH 6.0。
该菌株的26S rDNA D1/D2区域具有SEQ ID No.1所示的碱基序列,与Genbank现有酿酒酵母(Saccharomyces cerevisiae)同一区域碱基序列同源性均达到99%。
上述的产谷胱甘肽酿酒酵母NAU-LYH-SGS在制备富硒产谷胱甘肽复合菌中的应用。
一种富硒产谷胱甘肽复合菌,采用以下步骤制备:
(1)将无机硒源加入发酵培养基中,使发酵培养基中的硒浓度达到0.4~0.7mg/L;
(2)将酿酒酵母种子液和嗜酸乳杆菌种子液分别接种于步骤(1)所制备的发酵培养基中;
(3)在发酵温度为25~32℃,pH值为5.0~6.0,DO为80%~90%的条件下发酵60~80h;
(4)将发酵液离心后得菌体细胞,将所得到的菌体细胞洗涤并低温干燥后得到富硒产谷胱甘肽复合菌。
上述的富硒产谷胱甘肽复合菌,其在于按体积百分比计,所述的酿酒酵母种子液和嗜酸乳杆菌种子液的接种量分别为8%~10%和1%~2%。
所述发酵培养基的配方为:葡萄糖15~25g/L,酵母浸膏20~35g/L,玉米浆干粉5~10g/L,L-半胱氨酸3~8g/L,调节pH 5.0~7.0;
所述的无机硒源为含硒量为0.5~5mg/ml的亚硒酸钠溶液。
所述酿酒酵母种子液的制备过程为:将酿酒酵母接种于酿酒酵母斜面活化培养基上,20~30℃,培养30~40h,如此连续活化3~5次后,再接种于酿酒酵母液体活化培养基中,20~30℃,200~250r/min,摇床培养30~40h,得到酿酒酵母种子液;
所述嗜酸乳杆菌种子液的制备过程为:将嗜酸乳杆菌接种于嗜酸乳杆菌斜面活化培养基上,30~40℃,培养30~40h,如此连续活化3~5次后,再接种于嗜酸乳杆菌液体活化培养基中,30~40℃,培养30~40h,得到嗜酸乳杆菌种子液。
所述酿酒酵母斜面活化培养基的配方:酵母浸膏10g/L、蛋白胨20g/L、葡萄糖20g/L、琼脂20g/L、水1000ml,pH为5.5~6.0;
所述嗜酸乳杆菌斜面活化培养基的配方:蛋白胨10g/L,酵母膏5g/L,葡萄糖20g/L,牛肉膏10g/L,乙酸钠5g/L,柠檬酸三铵2g/L,吐温80 1ml,MgSO4·7H2O 0.58g/L,MnSO4·4H2O 0.05g/L,K2HPO4 2g/L,琼脂20g/L,水1000ml,pH为6.2~6.4;
所述酿酒酵母液体活化培养基的配方:不加琼脂的酿酒酵母斜面活化培养基;
所述嗜酸乳杆菌液体活化培养基的配方:不加琼脂的嗜酸乳杆菌斜面活化培养基。
所述的酿酒酵母为上述的酿酒酵母菌株CCTCC NO:M 2015717;所述的嗜酸乳杆菌优选为菌种保藏编号为CGMCC NO:1.1878的嗜酸乳杆菌菌株。
一种富硒产谷胱甘肽复合菌的制备方法,包括以下步骤:
(1)将无机硒源加入发酵培养基中,使发酵培养基中的硒浓度达到0.4~0.7mg/L;
(2)将酿酒酵母种子液和嗜酸乳杆菌种子液分别接种于步骤(1)所制备的发酵培养基中;
(3)在发酵温度为25~32℃,pH值为5.0~6.0,DO为80%~90%的条件下发酵60~80h;
(4)将发酵液离心后得菌体细胞,将所得到的菌体细胞洗涤并低温干燥后得到富硒产谷胱甘肽复合菌。
上述的富硒产谷胱甘肽复合菌在制备具有保肝护肝作用的食品或饲料添加剂中的应用。
上述富硒产谷胱甘肽复合菌(SGP)的详细制备过程为:
将无机硒源加入发酵培养基中,使发酵培养基中硒浓度达到0.4~0.7mg/L;酿酒酵母种子液(Saccharomyces cerevisiae)和嗜酸乳杆菌(Lactobacillus acidophilus)种子液分别以8%~10%(v/v)和1%~2%(v/v)的接种量接种于添加了有机硒的发酵培养基中,在发酵温度为25~32℃,pH值为5.0~6.0,DO为80%~90%的条件下发酵60~80h。所得富硒产谷胱甘肽复合菌发酵液经离心后,得菌体细胞,经去离子水洗涤2~3次后,低温干燥制得富硒产谷胱甘肽复合菌。
所获得的富硒产谷胱甘肽复合菌中:胞内有机硒含量为36.1~40.2μg/g;胞内GSH含量为32.5~35.1mg/g;酿酒酵母和嗜酸乳杆菌的活菌数分别达到1.2~2.5×1010CFU/g和1.6~2.3×1012CFU/g。所得富硒产谷胱甘肽复合菌于4℃储存备用。
所述的菌种:
酿酒酵母菌(Saccharomyces cerevisiae):本专利自主分离得到,该菌株分类命名为:NAU-LYH-SGS,2015年11月30日保存于中国典型培养物保藏中心(武汉)。菌种保藏编号CCTCC NO:M 2015717。
嗜酸乳杆菌(Lactobacillus acidophilus):购自中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心,简称CGMCC,菌株代号为CGMCC NO:1.1878;
所述的无机硒源:配制含硒量为0.5~5mg/ml的亚硒酸钠溶液,100~125℃,高压灭菌备用。
发酵培养基(g/L):葡萄糖15~25,酵母浸膏20~35,玉米浆干粉5~10,L-半胱氨酸3~8,调节pH 5.0~7.0,115℃灭菌20min,备用。
本发明所述的具有保护肝损伤作用的富硒产谷胱甘肽复合菌中,所述的酿酒酵母种子液和嗜酸乳杆菌种子液分别通过如下方法获得:
1)将保存在4℃的酿酒酵母接种于酿酒酵母斜面活化培养基上,20~30℃,培养30~40h;如此连续活化3~5次后,再接种于酿酒酵母液体活化培养基中,20~30℃,220r/min,摇床培养30~40h,得到酿酒酵母种子液;
2)将保存在4℃的嗜酸乳杆菌接种于嗜酸乳杆菌斜面活化培养基上,30~40℃,培养30~40h;如此连续活化3~5次后,再接种于嗜酸乳杆菌液体活化培养基中,30~40℃,培养30~40h,得到嗜酸乳杆菌种子液;
其中,所述的斜面活化培养基配方如下:
酿酒酵母斜面活化培养基(g/L):酵母浸膏10g、蛋白胨20g、葡萄糖20g、琼脂20g、水1000ml,pH为5.5~6.0,115℃,高压蒸汽灭菌15min,备用;
嗜酸乳杆菌斜面活化培养基(g/L):蛋白胨10g,酵母膏5g,葡萄糖20g,牛肉膏10g,乙酸钠5g,柠檬酸三铵2g,吐温80 1ml,MgSO4·7H2O,0.58g,MnSO4·4H2O,0.05g,K2HPO4 2g,琼脂20g,水1000ml,pH为6.2~6.4;115℃,高压蒸汽灭菌15min,备用;
所述的液体活化培养基:斜面活化培养基中不加琼脂。
本发明根据有机硒、GSH和益生菌都能降低肝纤维化原理。首先从自然界中分离得到一株高产GSH的酵母菌株。通过培养基和发酵条件的优化,进一步提高GSH的产量。而后将此高产GSH酵母菌株和嗜酸乳杆菌为菌种,将其接种于含亚硒酸钠的培养基中,通过发酵生产出具有机硒、GSH和益生菌等多重作用的食品或饲料添加剂,将该添加剂饲喂给CCl4诱导的肝纤维化的大鼠,能够有效缓解大鼠的肝纤维化。
本发明的有益效果
本发明提供了富硒产谷胱甘肽复合菌添加剂(SGP)。本发明还提供了富硒产谷胱甘肽复合菌添加剂的制备方法。所获得的富硒产谷胱甘肽复合菌添加剂中胞内有机硒含量为36.1~40.2μg/g;胞内GSH含量为32.5~35.1mg/g;酿酒酵母和嗜酸乳杆菌的活菌数分别达到1.2~2.5×1010CFU/g和1.6~2.3×1012CFU/g。
本发明中涉及的益生菌为酿酒酵母菌和嗜酸乳杆菌,是被美国FDA(食品及药物管理局)认证为可作为食品添加剂的益生菌,并能运用于食品和制药行业。其发酵所产的有机硒和GSH能有效缓解肝损伤和纤维化,无毒副作用、安全可靠。本发明的富硒产谷胱甘肽复合益生菌同时发挥有机硒,GSH和益生菌的多重功效,具有良好的护肝作用。该产品作为新型食品添加剂应用于肝损伤的保护,生产工艺简单,对环境无污染。将是一种绿色、营养、安全、性价比高的新型食品或饲料添加剂。
附图说明
图1为SGP对CCl4诱导的肝损伤和纤维化大鼠血清ALT和AST水平的影响
其中,(A)血清ALT活性.(B)血清AST活性
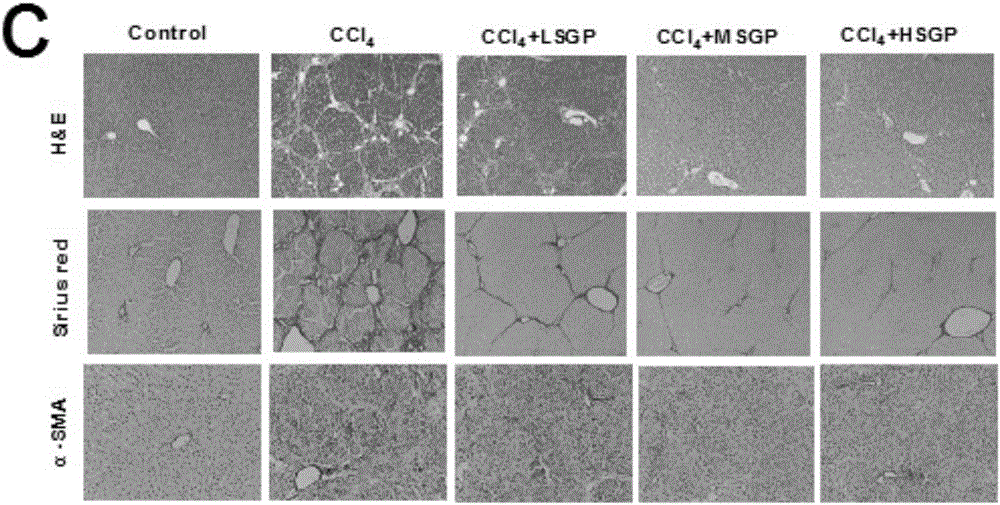
图2为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内组织病理学变化的影响
其中,H&E、天狼星红(Sirius red)染色(100×)和α-SMA的免疫组化(200×)
图3为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内组织天狼星红染色阳性区域的形态学定量
图4为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内羟脯氨酸含量的影响
图5为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内α-SMA和Collagen-I基因和蛋白表达水平的影响
图6为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内α-SMA和Collagen-I蛋白的表达的定量分析
其中,G为Collagen-I蛋白,H为α-SMA蛋白
图7为SGP对CCl4诱导的肝损伤和纤维化大鼠肝内α-SMA和Collagen-I mRNA表达水平的影响
其中,I为Collagen-I蛋白,J为α-SMA蛋白
具体实施方式
实施例1:高产GSH菌株的分离与鉴定
称量样品(未加工的蜂蜜)10g,放入盛有90mL无菌生理盐水的三角烧瓶中,振荡20min,制成菌悬液,吸取0.1mL菌悬液接种于YM培养基,30℃培养箱培养24h。(YM培养基配方(g/L):葡萄糖10,蛋白胨5,酵母浸膏3,麦芽提取物3,pH自然,115℃灭菌20min。)
根据菌落特征和液体中细胞学形态将不同种类酵母菌进行分离,分别进行产GSH发酵培养,摇床150rpm,温度30℃,培养48h。进一步筛选得到一株GSH产量较高的菌株,经鉴定为酿酒酵母(Saccharomyces cerevisiae),将其命名为NAU-LYH-SGS,并于2015年11月30日保存于中国典型培养物保藏中心(武汉),菌种保藏编号CCTCC NO:M 2015717。
主要生物学特性:显微镜下观察,菌株细胞为近圆形,大小(4.1-8.2)微米*(5.2-9.5)微米,不产生醭膜;以多端芽殖进行无性繁殖;无假菌丝,有子囊孢子产生;琼脂平板上30℃培养24-36h后,菌落乳白色、隆起、表明光滑湿润,有光泽、质地均匀、边缘较整齐;最适生长温度30℃,pH 6.0;
该菌株的26S rDNA D1/D2区域具有SEQ ID No.1所示的碱基序列,与Genbank现有酿 酒酵母(Saccharomyces cerevisiae)同一区域碱基序列同源性均达到99%。
实施例2:富硒产谷胱甘肽复合菌(SGP)的制备
1.菌种:
酿酒酵母菌(Saccharomyces cerevisiae):本专利自主分离得到,该菌株分类命名为:Saccharomyces cerevisiae NAU-LYH-SGS,2015年11月30日保存于中国典型培养物保藏中心(中国武汉武汉大学),菌种保藏编号CCTCC NO:M 2015717。
嗜酸乳杆菌(Lactobacillus acidophilus):购自中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心,简称CGMCC,菌株代号为CGMCC NO:1.1878。
2.配制无机硒源:
配制含硒量为1.0mg/ml的亚硒酸钠溶液800ml,115℃,高压蒸汽灭菌30min,备用。
3.配制培养基:
(1)酿酒酵母斜面活化培养基:酵母浸膏10g、蛋白胨20g、葡萄糖20g、琼脂20g、水1000ml,pH为5.5~6.0,115℃,高压蒸汽灭菌15min,备用;
(2)嗜酸乳杆菌斜面活化培养基:蛋白胨10g,酵母膏5g,葡萄糖20g,牛肉膏10g,乙酸钠5g,柠檬酸三铵2g,吐温80 1ml,MgSO4·7H2O 0.58g,MnSO4·4H2O 0.05g,K2HPO4 2g,琼脂20g,水1000ml,pH为6.2~6.4;115℃,高压蒸汽灭菌15min,备用;
(3)所述酿酒酵母液体活化培养基的配方:不加琼脂的酿酒酵母斜面活化培养基;
(4)所述嗜酸乳杆菌液体活化培养基的配方:不加琼脂的嗜酸乳杆菌斜面活化培养基。
(5)发酵培养基(g/L):葡萄糖20,酵母浸膏30,玉米浆干粉8,L-半胱氨酸6,调节pH 6.0,115℃灭菌20min,备用。
4.菌种的活化与种子液的获得:
将保存在4℃的酿酒酵母接种于酿酒酵母斜面活化培养基上,28℃,培养32h;如此连续活化3次后,再接种于1L酿酒酵母液体活化培养基中,28℃,220r/min,摇床培养32h,得到酿酒酵母种子液;
将保存在4℃的嗜酸乳杆菌接种于嗜酸乳杆菌斜面活化培养基上,37℃,培养32h;如此连续活化3次后,再接种于200mL嗜酸乳杆菌液体活化培养基中,37℃,培养32h,得到嗜酸乳杆菌种子液。
5.发酵罐培养:
30L全自动搅拌发酵罐装发酵培养基10L,将无机硒源(Na2SeO3)在发酵起始阶段添加到发酵培养基中,使发酵培养基中硒浓度为0.6mg/L。酿酒酵母种子液和嗜酸乳杆菌种子液的接种量分别为10%(v/v)和2%(v/v)。发酵培养条件为:30℃,pH 6.0,DO 85%,培养72h。
6.发酵结果:
所得富硒产谷胱甘肽复合菌发酵液经离心后,得菌体细胞,经去离子水洗涤3次后,低温干燥得到富硒产谷胱甘肽复合菌。测得细胞内有机硒含量为38.4μg/g,胞内GSH含量为34.1mg/g,酵母和乳酸菌活菌数量分别达到1.5×1010CFU/g和2.1×1012CFU/g。所得富硒产谷胱甘肽复合菌于4℃储存备用。
实施例3:大鼠动物试验
1材料与方法
1.1.化学制剂
主要试剂:RNAiso Plus(TaKaRa),PrimeScriptTM RT Master Mix(RR036A TaKaRa),Premix TaqTM(RR901A TaKaRa),Ultra SYBR Mixture(北京康为世纪生物科技有限公司),BCA蛋白测定试剂盒(碧云天生物技术研究所)。Collagen I和α-SMA一抗(Abcam),GAPDH一抗(美国CST公司),辣根过氧化物酶标记的二抗(Sigma),ECL化学发光检测试剂盒(南京诺维赞生物技术有限公司),CCl4(南京寿德研究所),SGP由实施例2制备。
1.2.动物试验方法
40只雄性Wistar大鼠体重(200±20克)购于扬州大学实验动物中心。大鼠适应环境1周后用于试验。将其随机分为5组,每组8只。分组如下:(A)对照组,(B)CCl4组,(C)SGP低剂量饲喂组(CCl4+LSGP),(D)SGP中剂量饲喂组(CCl4+MSGP)和(E)SGP高剂量饲喂组(CCl4+HSGP)。A组腹腔注射橄榄油(2mL/kg),每周两次连续8周。B-E组腹腔注射CCl4(2mL/kg,2:3的橄榄油),每周两次连续8周。(C-E)组每天分别灌胃低剂量LSGP(0.5g/kg体重),中剂量MSGP(0.5g/kg体重),高剂量HSGP(0.5g/kg体重)的SGP持续8周。LSGP,MSGP和HSGP组中大鼠所摄取的有机硒的量分别为19.2μg/kg,38.4μg/kg和57.6μg/kg体重;GSH的摄取量分别为17.1mg/kg,34.1mg/kg和51.2mg/kg体重;SGP组中大鼠每天摄取的S.cerevisiae和L.acidophilus的活菌数分别约为1.5×1010和22.1×1012CFU/g。
1.3.血清生化分析
将血液在4℃,5000g下离心5分钟,获得血清。用自动生化分析仪测定血清中的ALT和AST。
1.4.组织病理学检查和免疫组化
首先将大鼠肝脏样品固定在10%福尔马林中而后进行HE染色和天狼星红染色。而后使用计算机成像系统(Image-Pro Plus version 6.0;Media Cybernetics,MD,USA)对肝纤维化进行定量分析。对于免疫组织化学分析,肝脏切片用α-SMA一抗孵育4℃过夜,随后滴加适量生物素标记二抗工作液,37℃孵育30分钟。最后,使用DAB显色剂显色3分钟。
1.5.肝内羟脯氨酸含量测定
每克肝脏湿重中羟脯氨酸含量测定按照试剂盒说明书进行(南京建成生物工程研究所)。
1.6.Real-time PCR检测肝组织中Collagen I和α-SMA的mRNA相对表达量
根据GenBank中大鼠GAPDH、Collagen I和α-SMA的mRNA序列,遵循荧光定量PCR引物设计原则,利用Premier 5.0设计引物,各引物由上海Invitrogen有限公司合成。具体序列如表1所示。总RNA的提取采用TRIZOL试剂盒(TaKaRa,China)按照说明书操作进行,最后通过1.5%琼脂糖凝胶电泳和蛋白核酸测定仪检测所提取的RNA的质量。Real-time PCR反应体系与PCR扩增条件参照TaKaRa公司PrimeScript RT-PCR Kit试剂盒说明书。Real-time PCR扩增在美国应用生物系统公司(ABI)生产的7300 Real-time PCR System上进行。结果用2-ΔΔCT表示。
表1引物序列
1.7.Western blotting检测肝组织中Collagen I和α-SMA的蛋白的相对表达量
称取一定量的肝脏组织,加入10倍体积的组织裂解液匀浆,冰浴30min后,4℃12000r/min离心30min,取上清,BCA试剂盒蛋白定量,组织总蛋白加入上样缓冲液煮沸 变性。30g蛋白经15%SDS-PAGE分离后转移到PVDF膜,3%BCA室温封闭2h,加入一抗4℃过夜,TBS-Tween洗膜后加HRP标记的二抗,室温孵育2h,加入ECL发光液,经EC检测系统检测各组Collagen I和α-SMA蛋白的表达。
2.结果:
2.1.SGP对血清ALT和AST水平的影响
血清生化指标的变化如图1所示(A为血清ALT活性,B为血清AST活性):与对照组相比,CCl4组中血清ALT和AST水平显著升高(P<0.05)。与CCl4组相比,LSGP,MSGP和HSGP组中血清ALT和AST水平显著降低(P<0.05)。与LSGP组相比,MSGS和HSGS组中血清ALT和AST水平显著降低(P<0.05)。但MSGP和HSGP组之间血清ALT和AST的水平无显著差异(P>0.05)。
2.2.SGP对肝内组织病理学变化的影响
H&E染色表明(图2,其中包括H&E、天狼星红(Sirius red)染色(100×)和α-SMA的免疫组化(200×)):对照组中,肝脏切片表现为由正常的中央静脉和细胞结构组成的肝小叶。CCl4组中,肝脏组织出现纤维化小结节,炎症,气球样变和坏死。低中高剂量的SGP均可改善CCl4诱导的肝脏病变,但MSGP和HSGP对由CCl4诱导的肝脏病变的改善作用相对于LSGP更为明显。
2.3.SGP对肝内胶原蛋白沉积的影响
为了评价SGP对CCl4诱导的大鼠肝纤维化的影响,我们使用天狼星红对肝脏切片进行染色,用于检测肝内胶原蛋白的沉积(图3)。CCl4组中,在肝的门静脉区和汇管区有大量的胶原蛋白的沉积。LSGP对CCl4诱导的胶原蛋白的沉积有轻微的降低作用,MSGP和HSGP可明显降低由CCl4诱导的胶原蛋白的沉积。通过纤维化定量软件(Image-Pro Plus version 6.0)可得到一致的结果,LSGP,MSGP和HSGP在不同程度上均能改善大鼠的肝纤维化。
2.4.SGP对肝内星状细胞激活的影响
为了更好的说明SGP对CCl4诱导的大鼠肝纤维化的保护作用,我们用免疫组化法检测肝内α-SMA蛋白(一种星状细胞激活的标志物)的表达。如图5所示:CCl4组中,在肝汇管区和肝血窦周围有大量的α-SMA蛋白的表达。LSGP对CCl4诱导的α-SMA蛋白的表达有轻微的降低作用,MSGP和HSGP可明显降低由CCl4诱导的α-SMA蛋白的表达。
2.5.SGP对肝内羟脯氨酸含量的影响
肝内羟脯氨酸(hydroxyproline)的含量是反映肝脏纤维化的一个重要指标。如图4所示:与对照组相比,CCl4组中肝内hydroxyproline含量显著升高(P<0.05)。与CCl4组相比,LSGP,MSGP和HSGP组中肝内hydroxyproline含量显著降低(P<0.05)。与LSGP组相比,MSGP和HSGP组中肝内hydroxyproline含量显著降低(P<0.05)。但MSGP和HSGP组之间肝内hydroxyproline含量无显著差异(P>0.05)。
2.6.SGP对肝内Collagen I和α-SMA基因和蛋白表达水平的影响
与对照组相比较,CCl4组中α-SMA和Collagen I基因和蛋白的表达水平显着增加(P<0.05,图6和图7)。与CCl4组相比,LMSP,MSP和HMSP组的α-SMA和Collagen I基因和蛋白的表达水平均显着降低(P<0.05,图6和图7)。与LSGP组相比,MSGP和HSGP组中α-SMA和Collagen I基因和蛋白的表达水平显著降低(P<0.05)。然而,在MSGP和HSGP组之间,α-SMA和Collagen I基因和蛋白的表达水平没有显著差异。(P>0.05,图6和图7)。
图1~7中.(A)血清ALT活性.(B)血清AST活性.(C)H&E、天狼星红(Sirius red)染色(100×)和α-SMA的免疫组化(200×)。(D)天狼星红染色阳性区域的形态学定量。(E)肝内羟脯氨酸的含量。(F)肝内α-SMA和Collagen-I蛋白水平的表达。(G-H)肝内α-SMA和Collagen-I蛋白的表达的定量分析。(J-I)肝内α-SMA和Collagen-I mRNA水平的表达。所有试验结果均以means±SD表示(n=8),数据组之间所标字母不同时表示相互之间差异显著(P<0.05)。
本发明提供了富硒产谷胱甘肽复合菌。本发明还提供了富硒产谷胱甘肽复合菌的发酵方法。其发酵所产的有机硒、GSH和益生菌活菌能有效缓解肝纤维化,无毒副作用、安全可靠。该培养物作为新型食品添加剂应用于肝损伤的防护,生产工艺简单,对环境无污染,将是一种绿色、营养、安全、性价比高的新型食品或饲料添加剂。
- 还没有人留言评论。精彩留言会获得点赞!