一种检测长爪沙鼠感染幽门螺旋杆菌的方法与流程
本发明涉及检测长爪沙鼠感染幽门螺旋杆菌的方法。
背景技术:
幽门螺旋杆菌(Helicobacter pylori)形态特征与弯曲菌类似,革兰阴性,呈螺形、S型或海鸥展翅状,在胃粘液层中常呈鱼群样排列,传代培养后活在不利环境条件下可变成杆状或球形。菌体一端或两端可有多根鞭毛。幽门螺旋杆菌为微需氧细菌,最适生长温度为35-37℃。营养要求高,需血液或血清,生长时还需要一定湿度。球形变的细菌,通常处于休眠状态,在体外难以传代培养,但在体内环境条件适宜时可转化成螺旋形细菌。
此类菌主要以隐性感染形式存在于长爪沙鼠(拉丁文学名:Meriones Unguiculatus;英文名:Mongolian gerbil)的胃窦部,可引起宿主不同程度的病理反应从而导致慢性胃炎、胃溃疡、肠化生甚至胃癌的发生。模型动物感染螺杆菌时,可引起诱发一些并发疾病,严重影响实验动物质量并对实验数据的可靠性产生潜在的干扰。此外幽门螺旋杆菌在人和长爪沙鼠间可以相互传播,携带幽门螺旋杆菌的长爪沙鼠可以通过接触传播给饲养人员和实验人员,造成人员感染。
目前,长爪沙鼠幽门螺旋杆菌感染的检测方法主要有病原学、血清学、尿素酶试验及分子生物学方法:
(1)细菌分离培养。取胃窦和胃体组织,在特殊的培养基和微氧环境下培养分离该菌。本方法检测需要对动物进行处死取材,成本较高实验周期长,需要培养3-6d,生化鉴定试验操作繁琐,耗时费力。虽然培养出细菌后可以确诊,但其假阴性率较高。
(2)血清学检测。运用ELISA方法来检测血清或粪便中抗幽门螺旋杆菌特异性抗体。免疫学方法操作简便,可在同一时间内检测大量样品,但长爪沙鼠作为一种正在实验动物化的动物,没有很好的抗体适用于ELISA检测。
(3)PCR检测。直接检测粪便、肠内容物及胃组织中该菌体的DNA。但该方法大多需要将动物处死后取动物组织、肠内容物以及活体检测粪便。由于 长爪沙鼠主要生活在荒漠地带,所以其粪便含水量较低,不利于细菌生存,故粪便检测幽门螺旋杆菌的假阴性率也比较高。
长爪沙鼠是实验动物中使用非常广泛及数量颇多的动物,据文献报道,长爪沙鼠是作为幽门螺旋杆菌致病性研究的重要实验动物,在幽门螺旋杆菌感染的条件下,长爪沙鼠会出现胃炎、胃溃疡、肠化生甚至出现胃癌。幽门螺旋杆菌的感染可对饲养人员和实验人员造成伤害并且可对实验数据的可靠性产生严重的干扰。
基于目前的各种检测方法,还需要一种操作相对简易、结果可靠且成本低廉的检测实验长爪沙鼠活体感染幽门螺旋杆菌的方法。
技术实现要素:
本发明的目的在于提供一种检测更容易、更可靠且成本低廉的实验长爪沙鼠活体感染幽门螺旋杆菌的方法。
因此,本发明提供了一种检测长爪沙鼠(拉丁文学名:Meriones Unguiculatus;英文名:Mongolian gerbil)感染幽门螺旋杆菌(Helicobacter pylori)的方法,其包括以下步骤:步骤一:对所述长爪沙鼠禁食不禁水以排空其胃中的消化物;步骤二:向所述长爪沙鼠的胃中灌生理盐水或水;步骤三:从所述长爪沙鼠的胃中抽取液体;步骤四:以所述液体为样本提取基因组;步骤五:进行巢式PCR:以所述基因组为模板使用第一对引物进行第一轮PCR获得第一PCR产物;以所述第一PCR产物为模板使用第二对引物进行第二轮PCR获得第二PCR产物;步骤六:检测所述第二PCR产物,当检测到所述第二PCR产物的大小与其预期的大小相同,或所述第二PCR产物的序列与其预期的序列相同时,那么确认所述长爪沙鼠感染所述幽门螺旋杆菌。在设计本发明的巢式PCR的扩增的片段时,一般来讲,第一PCR产物的大小为300-800bp,优选为400-600bp;第二PCR产物的大小为80-150bp,优选为80-120bp。
在本发明中,所述第一对引物为SEQ ID No.1和SEQ ID No.2;所述第二对引物为SEQ ID No.3和SEQ ID No.4。
在本发明中,所述长爪沙鼠禁食不禁水的时间为18-36小时,优选为20-28小时。
在本发明中,在所述步骤二中,使用灌胃针向所述长爪沙鼠的胃中灌所述生理盐水或水0.3-0.6ml。
在本发明中,在所述步骤三中,抽取液体的体积70-120μL。
在本发明中,在第一轮PCR的反应程序如下:92-98℃预变性0-10min;92-98℃变性0.5-2min、40-55℃退火0.5-2min、65-78℃延伸0.5-2min,循环20-45次;65-78℃终延伸0-15min;优选第一轮PCR的反应程序如下:94-96℃预变性2-5min;94-96℃变性0.5-1min、42-47℃退火0.5-1min、70-73℃延伸0.5-1min,循环25-35次;70-73℃终延伸2-10min。
在本发明中,在第二轮PCR的反应程序如下:92-98℃预变性0-7min;92-98℃变性15-60sec、43-58℃退火15-60sec、65-78℃延伸15-60sec,循环20-45次;65-78℃终延伸0-15min;优选第二轮PCR的反应程序如下:94-96℃预变性30-180sec;94-96℃变性20-40sec、46-51℃退火20-40sec、72℃延伸20-40sec,循环25-35次;70-73℃终延伸1-5min。
在本发明中,第一轮PCR的体系中各组分的比例关系如下:
模板:SEQ ID No.1:SEQ ID No.2:10倍的的PCR缓冲液:DNA聚合酶:水=10-100ng:0.5-1.5μmol:0.5-1.5μmol:4-6μL:0.5-3U:32-48μL;优选模板:SEQ ID No.1:SEQ ID No.2:10倍的PCR缓冲液:DNA聚合酶:水=20-40ng:0.5-1μmol:0.5-1μmol:4-6μL:0.5-1U:38-42μL;更优选模板:SEQ ID No.1:SEQ ID No.2:2×PCR Master Mix或2×PreMix rTaq:水=20-40ng:0.5-1μmol:0.5-1μmol:23-28μL:17-25μL。其中2×PCR Master Mix购自Thermo公司;2×PreMix rTaq购自Thermo公司。并且2×PCR Master Mix或2×PreMix rTaq中的组分以说明书中为准。
在本发明中,在第二轮PCR的体系中各组分的比例关系如下:
模板:SEQ ID No.3:SEQ ID No.4:10倍的的PCR缓冲液:DNA聚合酶:水=10-100ng:0.5-1.5μmol:0.5-1.5μmol:4-6μL:0.5-3U:32-48μL;优选模板:SEQ ID No.3:SEQ ID No.4:10倍的PCR缓冲液:DNA聚合酶:水=20-40ng:0.5-1μmol:0.5-1μmol:4-6μL:0.5-1U:38-42μL;更优选模板:SEQ ID No.3:SEQ ID No.4:2×PCR Master Mix或2×PreMix rTaq:水=20-40ng:0.5-1μmol:0.5-1μmol:23-28μL:17-25μL。其中2×PCR Master Mix购自Thermo公司;2×PreMix rTaq购自Thermo公司。在进行第二轮PCR时,为了方便起见,也可以直接上向第一轮PCR的体系中补加适量的DNA聚合酶(例如0.5-3U或0.5-1U的DNA聚合酶)和用于第二轮PCR的上述适量的SEQ ID No.3和SEQ ID No.4。
本发明还提供了一种巢式PCR扩增幽门螺旋杆菌的引物,其中第一对引物为SEQ ID No.1和SEQ ID No.2,第二对引物为SEQ ID No.3和SEQ ID No.4。
本发明的优点:
(1)动物存活:相对于传统的幽门螺旋杆菌检测方法,该方法通过胃液对其进行检测,对动物伤害较小,能够保证动物的存活,动物可以继续用做其他实验。这对于动物实验特别是与幽门螺旋杆菌相关的实验至关重要。
(2)操作简单,例如采用2×PCR Master Mix预混酶,需2步PCR就可得到幽门螺旋杆菌感染情况。
(3)检测速度快:相对于传统方式,该方法能够较快速直观的反应出幽门螺旋杆菌感染情况。
(4)实验结果认定较为简单、客观:该方法结果的判读可以根据琼脂糖凝胶电泳图中条带目的条带的有无或者直接测序来完成,使检测结果的判读更加简单、客观。
(5)成本低廉,本实验只需要微量样品DNA提取试剂盒和普通PCR引物及DNA聚合酶。相对于细菌体外培养等方式,成本相对较低。
附图说明
图1是对十只人为感染幽门螺旋杆菌的长爪沙鼠胃液提取的DNA只进行第一轮PCR后的PCR产物电泳图。其中,泳道1-10依次为十只长爪沙鼠胃液样品的PCR产物,各个泳道的上样体积相同。
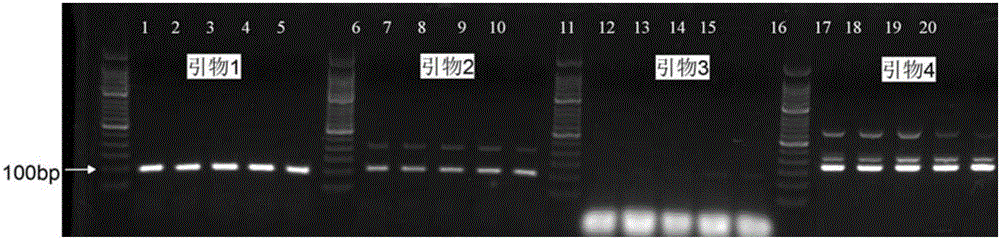
图2是使用第二对引物至第五对引物进行第二轮PCR后进行的电泳图。其中,各个泳道的上样体积相同。泳道1-5为使用第二对引物扩增的PCR产物;泳道6-10为使用第三对引物扩增的PCR产物;泳道11-15为使用第四对引物扩增的PCR产物;泳道16-20为使用第五对引物扩增的PCR产物;泳道1、泳道6、泳道11和泳道16的PCR退火温度为44.8℃;泳道2、泳道7、泳道12和泳道17的PCR退火温度为46.1℃;泳道3、泳道8、泳道13和泳道18的PCR退火温度为48.3℃、泳道4、泳道9、泳道14和泳道19的PCR退火温度为51.3℃、泳道5、泳道10、泳道15和泳道20的PCR退火温度为55.3℃。
图3是胃液中检测幽门螺旋杆菌检测阈值的电泳图。其中泳道1-8分别为2×108CFU/ml、2×107CFU/ml、2×106CFU/ml、2×105CFU/ml、2×104CFU/ml、 2×103CFU/ml、2×102CFU/ml和2×10CFU/ml的幽门螺旋杆菌菌液提取基因组后作为模板进行巢式扩增的PCR产物,各个泳道的上样体积相同。
图4是检测十只感染幽门螺旋杆菌长爪沙鼠胃液检测幽门螺旋杆菌的电泳图。其中,泳道1-10依次为十只长爪沙鼠胃液样品的PCR产物,各个泳道的上样体积相同。
具体实施方式
下面结合实施例,进一步说明本发明。
实验动物:雄性普通级长爪沙鼠10只,8周龄,体重50-60g。所有长爪沙鼠均来自首都医科大学实验动物部,饲养于控制温湿度的普通环境中【SYXK(京)2013-0005】。
幽门螺旋杆菌:标准菌株ATCC43504由中国食品药品检定研究院实验动物资源研究所提供。
试剂和仪器:哥伦比亚血琼脂基础培养基(OXOID公司,批号CM0331);无菌脱纤维羊血(北京路桥技术有限公司);MGC微需氧产气袋与密封培养盒(三菱瓦斯化学株式会社),幽门螺旋杆菌诊断试剂盒(YZB/闽0455-2009,福建三强生物化工有限公司),微量样品基因组DNA提取试剂盒(天根生化科技(北京)有限公司,批号:DP316),PCR Master Mix(2×)预混酶(K0171,Thermo Scientific),低熔点琼脂糖(A8350,Amresco),PCR仪(Applied Biosystems公司),电泳仪(BIO-RAD公司),凝胶成像系统(BIO-RAD公司),压力蒸汽灭菌器(Triumph公司产品),超净工作台,灭菌灌胃针,灭菌手术器械(眼科剪、眼科镊等)。
在下面的实施例中提取的基因组可以用紫外分光光度计进行定量。
实施例1
采用仅进行一次PCR的方法活体检测幽门螺旋杆菌
将无菌脱纤维羊血加入高压灭菌后的哥伦比亚琼脂基础培养基中,倾倒于培养皿中制备平板,制成含5%脱纤维羊血的哥伦比亚琼脂平板。将幽门螺旋杆菌接种于哥伦比亚血琼脂平板上,至于密封培养盒中,进行常规的36℃微需氧培养48h后,将菌苔用无菌生理盐水制成含菌量为109CFU/mL浓度的菌液,分装成小份,至-80℃冰箱备用,2周内用完。
取10只健康的长爪沙鼠分别用0.5mL菌液灌胃,连续灌胃3次,每次间隔24h。所有长爪沙鼠灌胃前禁食不禁水24h。灌胃结束后普通环境饲养10周。
提取上述人为感染幽门螺旋杆菌的长爪沙鼠胃液的方法:首先对人为感染幽门螺旋杆菌的长爪沙鼠禁食不禁水24h,以便排空其胃中消化物。使用灌胃针给长爪沙鼠灌胃0.5ml生理盐水。等待1min左右后,再用灌胃针伸入长爪沙鼠胃中抽取其胃中液体放入离心管中(约100μL)。
幽门螺旋杆菌DNA的提取:使用天根生化科技(北京)有限公司天根的微量样品基因组DNA提取试剂盒(DP316)提取长爪沙鼠胃液幽门螺旋杆菌基因组。
设计了第一对引物用于第一轮PCR,上游引物F1如SEQ ID No.1所示;下游引物R1如SEQ ID No.2所示。
第一轮PCR反应体系加样如下:
提取的幽门螺旋杆菌基因组20ng
10μmol的上游引物F1(SEQ ID No.1)1μL;
10μmol的下游引物R1(SEQ ID No.2)1μL;
2×PCR Master Mix 10μL;
ddH2O至20μL。
第一轮PCR反应程序:95℃预变性5min;95℃变性30sec、45℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。
完成第一轮PCR后,取PCR产物进行2%的琼脂糖凝胶电泳,扩增目的条带为499bp(见图1)。根据电泳图发现只进行一轮PCR不能很好地扩增出目的条带,检测结果出现假阴性率较高。
实施例2
巢式PCR中的第二轮PCR的引物对的筛选
设计了4对用于第二轮PCR的引物并通过琼脂糖凝胶电泳检测其准确性和特异性。
其中,第二对引物中的上游引物F2如SEQ ID No.3所示,下游引物R2如SEQ ID No.4所示;第三对引物中的上游引物F3如SEQ ID No.5所示,下游引物R3如SEQ ID No.6所示;第四对引物中的上游引物F4如SEQ ID No.7所 示,下游引物R4如SEQ ID No.8所示;第五对引物中的上游引物F5如SEQ ID No.9所示,下游引物R5如SEQ ID No.10所示。
实验方法为使用天根生化科技(北京)有限公司天根的微量样品基因组DNA提取试剂盒(DP316)直接提取幽门螺旋杆菌基因组,幽门螺旋杆菌浓度为2×109CFU/ml。使用幽门螺旋杆菌基因组为模版,实施例1的引物序列进行第一轮PCR;然后以第一轮PCR的产物为模板,以第二对引物至第五对引物、不同退火温度进行第二轮PCR,以筛选出合适的引物和退火温度。
第一轮PCR反应体系加样及反应条件如实施例1。
第二轮PCR反应体系加样如下:
第一轮PCR产物20ng;
10μmol的上游引物1μL;
10μmol的下游引物1μL;
2×PCR Master Mix 10μL;
ddH2O至20μL。
第二轮PCR反应程序:95℃预变性5min;95℃变性30sec、分别在44.8℃、46.1℃、48.3℃、51.3℃、55.3℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。
分别取4对引物的第二轮PCR产物进行2%的琼脂糖凝胶电泳,目的条带为100bp(如图2),并对所述PCR产物测序,测序结果与Pubmed数据进行比对后,100%正确。
根据电泳图可得,使用第二对引物(即上游引物为SEQ ID No.3,下游引物为SEQ ID No.4的引物对)扩增出的目的条带单一,具有较高的准确性和特异性。故使用第二对引物作为第二轮PCR的引物。
实施例3
活体检测幽门螺旋杆菌检测阈值
检测前对健康长爪沙鼠(即没有感染幽门螺旋杆菌的长爪沙鼠)禁食不禁水24h,以便排空其胃中消化物。使用灌胃针给长爪沙鼠灌胃0.5ml生理盐水。等1min左右后,再用灌胃针伸入长爪沙鼠胃中抽取其胃中液体放入离心管中。
将10只长爪沙鼠的胃液混合,然后从混合的胃液中取出180μL加入浓度为2×109CFU/ml浓度的幽门螺旋杆菌20μL,混匀后倍比稀释为浓度2× 108CFU/ml、2×107CFU/ml、2×106CFU/ml、2×105CFU/ml、2×104CFU/ml、2×103CFU/ml、2×102CFU/ml和2×10CFU/ml的混合液。
用试剂盒为天根微量样品基因组DNA提取试剂盒(DP316)提取不同浓度混合液中幽门螺旋杆菌基因组。
第一轮PCR反应体系加样如下:
提取的幽门螺旋杆菌基因组40ng;
10μmol的上游引物F1(SEQ ID No.1)1μL;
10μmol的下游引物R1(SEQ ID No.2)1μL;
2×PCR Master Mix 10μL;
ddH2O至20μL。
第一轮PCR反应程序:95℃预变性5min;95℃变性30sec、45℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。
第二轮PCR反应体系加样如下:
第一轮PCR产物40ng;
10μmol的上游引物F2(SEQ ID No.3)1μL;
10μmol的下游引物R2(SEQ ID No.4)1μL;
2×PCR Master Mix 10μL;
ddH2O至20μL。
第二轮PCR反应程序:95℃预变性5min;95℃变性30sec、51.3℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。
取不同浓度的幽门螺旋杆菌混合液提取的基因组进行巢式PCR扩增后的产物(即第二轮的PCR产物)进行2%的琼脂糖凝胶电泳(见图3)并测序以及Pubmed数据库BLAST结果。
从分析结果可以看出,活体检测幽门螺旋杆菌的检出限为2×102CFU/ml,该检出限说明本发明的方法检测具有比现有技术灵敏度高的特点,完全能够满足后续的实验需要。
实施例4
活体检测人为感染幽门螺旋杆菌长爪沙鼠
将无菌脱纤维羊血加入高压灭菌后的哥伦比亚琼脂基础培养基中,倾倒于培养皿中制备平板,制成含5%脱纤维羊血的哥伦比亚琼脂平板。将幽门螺旋杆菌接种于哥伦比亚血琼脂平板上,至于密封培养盒中,进行常规的36℃微需氧培养48h后,将菌苔用无菌生理盐水制成含菌量为109CFU/mL浓度的菌液,分装成小份,至-80℃冰箱备用,2周内用完。取10只健康的长爪沙鼠分别用0.5mL菌液灌胃,连续灌胃3次,每次间隔24h。所有长爪沙鼠灌胃前禁食不禁水24h。灌胃结束后普通环境饲养10周。
提取上述人为感染幽门螺旋杆菌的长爪沙鼠胃液的方法:首先对人为感染幽门螺旋杆菌的长爪沙鼠禁食不禁水24h,以便排空其胃中消化物。使用灌胃针给长爪沙鼠灌胃0.5ml生理盐水。等待1min左右后,再用灌胃针伸入长爪沙鼠胃中抽取其胃中液体放入离心管中(约100μL)。
幽门螺旋杆菌DNA的提取:使用天根生化科技(北京)有限公司天根的微量样品基因组DNA提取试剂盒(DP316)提取长爪沙鼠胃液幽门螺旋杆菌基因组。
PCR反应扩增:
PCR体系具体加样:第一轮PCR:以上述提取的基因组为模板30ng、2×PreMix rTaq 10μL、加入第一对引物的上游引物F1(SEQ ID No.1)(10μM)1μL和下游引物R1(SEQ ID No.2)(10μM)1μL、然后以ddH2O补至20μL进行第一轮PCR反应,以F1和R1为扩增引物的第一轮PCR反应程序:94℃预变性5min;94℃变性30sec、45℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。第二轮PCR:将第一轮PCR产物作为模板,再以F2(SEQ ID No.3)和R2(SEQ ID No.4)为扩增引物的第二轮PCR扩增,反应体系为:模板30ng、2×PreMix rTaq 10μL、第二对引物的上游引物F2(SEQ ID No.3)(10μM)1μL和下游引物R2(SEQ ID No.4)(10μM)1μL、然后以ddH2O补至20μL进行第二轮PCR反应,以F2和R2为扩增引物的第二轮PCR反应程序:95℃预变性5min;95℃变性30sec、51.3℃退火30sec、72℃延伸30sec,循环35次;72℃终延伸5min。
琼脂糖凝胶电泳:
巢式PCR扩增后的产物(即第二轮的PCR产物)进行2%的琼脂糖凝胶电泳,扩增目的条带为100bp(见图4)。
实施例5
对以实施例4相同方法人为感染幽门螺旋杆菌的10只长爪沙鼠的胃液、胃组织、十二指肠内容物及结肠粪便分别进行DNA提取(即对同一只人为感染幽门螺旋杆菌的长爪沙鼠分别提取其胃液、胃组织、十二指肠内容物及结肠粪便的DNA)后,接着以获得DNA分别为模板,以如实施例4相同的巢式PCR(包括第一轮引物的第一对引物和第二轮引物的第二对引物相同)进行检测,并琼脂糖凝胶电泳,对于扩增出目的条带(结合测序结果)的视为阳性。
快速尿素酶检测方法:使用胃幽门螺旋杆菌诊断试剂盒(福建三强生物化工有限公司),使用前去底物酶标条的盖子,每孔加入酶促反应液2滴(或100μL),待药膜完全溶解后,用洁净镊子将杀死受感染的动物后提取的胃黏膜放入药液中,在10℃-30℃条件下孵育5分钟,观察结果。采用目测法,衬白纸在自然光线下观察各孔内胃组织粘膜组织边缘药液颜色变化。幽门螺旋杆菌阴性为黄色,幽门螺旋杆菌阳性为浅红色至玫瑰红色。
结果:胃液样品和胃组织样品中检出10只长爪沙鼠均感染幽门螺旋杆菌,检出率100%;十二指肠内容物样品中检出9只长爪沙鼠感染幽门螺旋杆菌,检出率为90%;结肠粪便样品中检出1只长爪沙鼠感染幽门螺旋杆菌,检出率为10%;快速尿素酶试验检出10只长爪沙鼠感染幽门螺旋杆菌,检出率100%。但是使用胃组织检测对长爪沙鼠会有损害,不利于使用长爪沙鼠继续进行后续的实验,也就失去了活体检测的意义,因此,综合起来看,胃液样品的检测效果最优,并且对于长爪沙鼠的损伤甚微,可以作为长期监测类似长爪沙鼠等实验动物幽门螺旋杆菌感染的无创检测方法。统计上述实验所得结果,如表1所示。结果用检测言行结果比例表示,分别说明各种方法的检测阳性率。
表1
“+”为阳性,“-为阴性”。
- 还没有人留言评论。精彩留言会获得点赞!