一种提高深海弹性蛋白酶稳定性的复合保护剂及其制备方法与流程
本发明涉及一种提高深海弹性蛋白酶稳定性的复合保护剂及其制备方法,属于生物技术技术领域。
背景技术:
弹性蛋白酶(elastase)是一类能够水解不溶性弹性蛋白的蛋白水解酶,其作用底物弹性蛋白主要分布于血管、肺部和皮肤等结缔组织中,因此弹性蛋白酶可以作为治疗高血脂症、防止动脉粥样硬化、消除皮肤焦痂、碎屑等的生化药物。由于弹性蛋白酶能够专一降解结缔组织中坚韧的弹性纤维组分,因此弹性蛋白酶可以作为理想的肉类嫩化剂用于食品加工业。由于弹性蛋白和革兰氏阳性细菌肽聚糖的肽段部分序列具有相似性,因此弹性蛋白酶有时也可以作为溶菌酶。溶菌酶可用作天然的食品防腐剂,现已广泛应用于水产品、肉食品、蛋糕、清酒、料酒及饮料中的防腐,还可以添入乳粉中,使牛乳人乳化,以抑制肠道中腐败微生物的生存,同时直接或间接地促进肠道中双歧杆菌的增殖。溶菌酶还具有多种药理作用,它具有抗菌、抗病毒、抗肿瘤的功效,目前医用溶菌酶其适应症为细菌感染引起的角膜炎、眼内炎、鼻炎和皮肤脓肿等。
酶的失活是限制酶制剂工业生产和应用的重要因素,酶的稳定化的主要方法有3种,即添加保护剂、化学修饰和固定化处理。由于方法简单、成本低廉和易于操作等多方面原因,添加保护剂是目前工业和医药领域提高酶稳定性的最重要手段。保护剂主要通过以下方式来提高酶的热稳定性:(1)糖类和多元醇类物质属于多羟基化合物,加入酶的水溶液后,会与水分子相互作用,改变水的表面张力,使酶与水之间形成溶剂层,增强酶的稳定性;(2)保护剂的羟基与酶的酰胺基以氢键的方式相互作用,从而促进酶的热稳定性;(3)保护剂不会改变酶分子内在构象的稳定性,但保护剂的存在对酶分子中一些肽链和氨基酸残基的展开十分不利,从而减少酶分子间的相互作用;(4)保护剂为小分子物质,易于进入酶分子的空隙中,可阻止部分导致酶失活的物质接近酶活性中心,从而保护了酶的活力。复合保护剂能够综合糖和多元醇的优点,它与酶之间的结合更加紧密复杂,从而为酶提供更好的保护效果。
正交实验设计(Orthogonal experimental design)是研究多因素多水平的一种设计方法,它是根据正交性从全面试验中挑选出部分有代表性的点进行试验,这些有代表性的点具备了“均匀分散,齐整可比”的特点。正交试验设计是一种高效、快速、经济的实验设计方法。
地球上80%的生物存在于海洋,海洋生物资源总量巨大。海洋微生物因其独特的生活环境,分泌的蛋白酶可能具有特殊的性质和潜在用途。细菌Pseudoalteromonas sp.CF6-2是从中国南海2441m深的海底沉积物中分离得到。研究表明,CF6-2能够分泌一种新型M23家族蛋白酶,该酶对弹性蛋白和肽聚糖都具有很高的降解活性,对多种致病性革兰氏阳性细菌,特别是耐甲氧西林的多抗金葡菌具有很高的裂解活性,在治疗细菌感染等医疗方面以及化妆品等方面都具有很好的应用潜力。作为长期适应深海低温环境的结果,该酶的热稳定性很差,在较低温度下就极易失活,这严重影响了该酶的开发应用。因此,发明Pseudoalteromonas sp.CF6-2分泌的弹性蛋白酶的复合保护剂将为该酶的应用开发奠定基础。
技术实现要素:
本发明针对现有技术的不足,提供一种提高深海弹性蛋白酶稳定性的复合保护剂及其制备方法。
本发明技术方案如下:
一种提高深海弹性蛋白酶稳定性的复合保护剂,每升组分如下:
葡萄糖49.54~371.57g,海藻糖94.58~472.91g,甘油12.5~62.5mL,蔗糖21.39~85.57g,50mM Tris-HCl溶液定容至1L,pH8.0~9.0。
根据本发明优选的,所述复合保护剂,每升组分如下:
葡萄糖185.78~371.57g,海藻糖236.46~472.91g,甘油12.5~25mL与蔗糖21.39~85.57g,50mM Tris-HCl溶液定容至1L,pH8.0~9.0。
根据本发明优选的,保护效果最好的复合保护剂,每升组分如下:
葡萄糖371.57g,海藻糖472.91g,甘油25mL,蔗糖85.57g,50mM Tris-HCl溶液定容至1L,pH8.0~9.0。
上述提高深海弹性蛋白酶稳定性的复合保护剂的制备方法,步骤如下:
按比例将葡萄糖、海藻糖、甘油、蔗糖加入50mM Tris-HCl、pH8.0~9.0的溶液中,搅拌均匀,在60~70℃静置3~5小时,溶质完全溶解,50mM Tris-HCl、pH8.0~9.0溶液定容,制得提高深海弹性蛋白酶稳定性的复合保护剂。
上述复合保护剂在提高深海弹性蛋白酶稳定性中的应用。
根据本发明优选的,上述应用,其特征在于,深海弹性蛋白酶在复合保护剂中的质量浓度为15~25mg/ml。
根据本发明优选的,所述深海弹性蛋白酶为菌种保藏编号为CCTCC M 2010189的深海细菌(Pseudoalteromonas sp.)CF6-2胞外分泌的蛋白酶。
根据本发明进一步优选的,所述深海弹性蛋白酶的制备方法如下:
(1)取菌种保藏编号为CCTCC M 2010189的深海细菌(Pseudoalteromonas sp.)CF6-2接种于发酵培养基中,在18~22℃培养25~30h,制得发酵液;
(2)取步骤(1)制得的发酵液,一次离心,取上清液,经透析后,二次离心,取上清,上清液经DEAE-Sepharose Fast Flow层析柱纯化后,用0~0.3M NaCl溶液进行梯度洗脱,制得深海弹性蛋白酶。
根据本发明更优选的,所述步骤(1)的发酵培养基组分如下,均为重量百分比:
0.2%酵母粉,1.2%心管粉,0.005%CaCl2和0.015%Na2HPO4,人工海水余量,pH8.0。
所述心管粉是由牛心管按常规步骤经过脱脂、冻干、研磨、过20目筛后制得。
根据本发明优选的,所述步骤(2)的透析条件为,用pH 9.0的50mM Tris-HCl缓冲液透析过夜。
根据本发明优选的,所述步骤(2)的一次离心条件为,在5℃、10000g离心10min。
根据本发明优选的,所述步骤(2)的二次离心条件为,在5℃、10000g离心15min。
根据本发明优选的,所述步骤(2)中上清液经过DEAE-Sepharose Fast Flow层析柱的速度为2ml/min。
有益效果
1、本发明所述提高深海弹性蛋白酶稳定性的复合保护剂能够显著提高酶制剂的热稳定性,与弹性蛋白酶液混合后在37℃下保存3天后,仍保持80%左右的酶活,5天后仍有60%左右的酶活,在4℃保存7个月后,仍保持90%以上的酶活,解决了深海弹性蛋白酶长期保存容易失活的问题;
2、本发明所述的提高深海弹性蛋白酶稳定性的复合保护剂原料易得、制备步骤简单、成本低廉,具有巨大的应用前景。
附图说明
图1.不同浓度的葡萄糖、蔗糖、海藻糖和甘油对深海弹性蛋白酶的稳定性影响柱状图;
A、0分钟时的酶活;B、30分钟时的酶活;
图2.多种复合保护剂对深海弹性蛋白酶的稳定性的影响;
图3.复合保护剂9号对深海弹性蛋白酶在37℃时的稳定性的影响;
图4.复合保护剂9号对深海弹性蛋白酶在4℃时的稳定性的影响;
图5.复合保护剂9号对多种其它酶制剂的稳定性的影响。
具体实施方式
下面结合实施例对本发明的技术方案做进一步阐述,但本发明所保护范围不限于此。
生物材料来源
深海细菌(Pseudoalteromonas sp.)CF6-2为现有已知菌株,来源于中国典型培养物保藏中心,菌种保藏编号为CCTCC M 2010189。
人工海水由购自青岛海之盐水族科技有限公司的海水素配制而成,配制方法参照该产品的产品说明书。
心管粉制备方法如下:将新鲜的牛心管外壁的脂肪去除干净,切成1平方厘米左右大小的块状,经真空冷冻干燥仪干燥48小时后用打磨机磨成粉状,过20目筛后即得发酵所用的心管粉,于-20℃保存。
葡萄糖、蔗糖、海藻糖与甘油购自国药集团化学试剂有限公司。
实施例1
一种提高深海弹性蛋白酶稳定性的复合保护剂,每升组分如下:
葡萄糖371.57g,海藻糖472.91g,甘油25mL,蔗糖85.57g,50mM Tris-HCl溶液定容至1L,pH9.0。
上述提高深海弹性蛋白酶稳定性的复合保护剂的制备方法,步骤如下:
将葡萄糖371.57g,海藻糖472.91g,甘油25mL,蔗糖85.57g加入200ml浓度为50mM Tris-HCl、pH9.0的溶液中,搅拌均匀,65℃静置4小时待溶质完全溶解,再加入50mM Tris-HCl、pH9.0的溶液定容至1L。115℃高温高压灭菌30min,置于室温备用。
实施例2
一种提高深海弹性蛋白酶稳定性的复合保护剂,每升组分如下:
葡萄糖371.57g,海藻糖472.91g,甘油25mL,蔗糖85.57g,50mM Tris-HCl溶液定容至1L,pH8.0。
制备方法同实施例1。
实施例3
深海弹性蛋白酶的制备方法如下:
(1)取菌种保藏编号为CCTCC M 2010189的深海细菌(Pseudoalteromonas sp.)CF6-2接种于发酵培养基中,在20℃培养28h,制得发酵液;
所述步骤(1)的发酵培养基组分如下,均为重量百分比:
0.2%酵母粉,1.2%心管粉,0.005%CaCl2和0.015%Na2HPO4,人工海水余量,pH 8.0;
(2)取步骤(1)制得的发酵液,在5℃10000g离心10min,取上清液,上清液用pH9.0的50mM Tris-HCl缓冲液透析过夜后,在5℃10000g离心15min,取上清,上清液经DEAE-Sepharose Fast Flow层析柱纯化后,以2ml/min速度穿过DEAE-Sepharose Fast Flow层析柱后,用0~0.3M NaCl溶液进行梯度洗脱,制得深海弹性蛋白酶。
(3)取步骤(2)制得的酶液,在冷冻干燥机Heto Power Dry LL3000中冻干(-55℃,48h),制得深海弹性蛋白酶的干粉。将上述制得的干粉溶解在50mM Tris-HCl(pH为9.0)中,质量浓度为100mg/ml,过滤除菌。
对比例1
保护剂,每升组分如下:
蔗糖1.25g,壳聚糖2.5g,山梨醇2.5g,pH7.0的磷酸氢二钠-磷酸二氢钠溶液定容至1L。
对比例2
保护剂,每升组分如下:
葡萄糖185.78g,海藻糖94.58g,甘油25mL,蔗糖21.39g,pH9.0的50mM Tris-HCl溶液定容至1L(即复合保护剂4号)。
试验例1
不同浓度的葡萄糖、蔗糖、海藻糖和甘油对pseudoalteirn的酶活力稳定性的影响:
以缓冲液50mM Tris-HCl(pH9.0)为溶液,分别配置不同浓度的葡萄糖溶液(247.71g/L,371.57g/L,495.43g/L)、海藻糖溶液(236.46g/L,472.91g/L,709.37g/L)、甘油溶液(62.50mL/L,125mL/L,187.5mL/L)、蔗糖溶液(213.93g/L,427.86g/L,641.79g/L)。将上述弹性蛋白酶酶液与各种糖或多元醇溶液按照1:4的体积比进行混合,置于37℃水浴锅中,于30min之后检测残余酶活。同样的酶液与缓冲液保温同样时间作为对照。结果如图1所示,37℃时,在缓冲液中保温30min后,酶液的残余活性降至10%以下,说明该深海弹性蛋白酶非常不耐高温;在371.57g/L葡萄糖、472.91g/L海藻糖、62.50mL/L甘油或427.86g/L蔗糖中分别保温30min后,仍保持50%左右的残余酶活。
试验例2
复合稳定剂的设计及其对深海弹性蛋白酶的稳定性的影响:
以试验例1中葡萄糖、海藻糖、甘油和蔗糖的浓度为参考,通过正交实验设计得到9种复合稳定剂的配方(表1,2)。
表1.复合保护剂的正交设计表L9(34)
表2.正交设计L9(34)的因素和水平
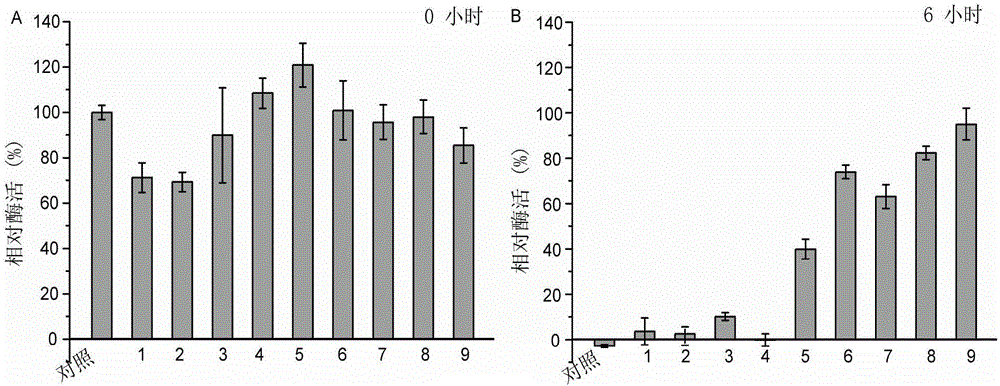
以50mM Tris-HCl(pH9.0)为缓冲液,根据表1与表2的配方分别配置9种复合保护剂。将上述深海弹性蛋白酶液与各种复合保护剂按照1:4的体积比进行混合,置于37℃水浴锅中,分别于6h之后检测残余酶活。同样的弹性蛋白酶液与缓冲液保温同样时间作为对照。结果如图2所示,37℃时,在复合保护剂6号,8号与9号中保温6h后,该酶仍保持80%以上的残余酶活。复合保护剂6号,8号与9号的配比为葡萄糖(g):海藻糖(g):甘油(mL):蔗糖(g)=185.78~371.57:236.46~472.91:12.5~25:21.39~85.57,是本发明优选的复合保护剂。其中,复合保护剂9号的质量比为葡萄糖(g):海藻糖(g):甘油(mL):蔗糖(g)=371.57:472.91:25:85.57,是本发明优选的最优复合保护剂。复合保护剂4号的质量比为葡萄糖(g):海藻糖(g):甘油(mL):蔗糖(g)=185.78:94.58:25:21.39,对于弹性蛋白酶几乎没有保护作用。
试验例3
实施例1复合保护剂(复合保护剂9号)对深海弹性蛋白酶的稳定性的影响
根据实施例1制得复合保护剂(复合保护剂9号),根据实施例3制得深海弹性蛋白酶酶液。将上述深海弹性蛋白酶酶液与复合保护剂9号按照1:4的体积比进行混合,置于37℃水浴锅中,分别于1,2,3,4,5天之后检测残余酶活。将上述深海弹性蛋白酶酶液与复合保护剂9号按照1:4的体积比进行混合,置于4℃冰箱中,分别于1,2,4,5,6,7月之后检测残余酶活。结果如图3所示,酶液与复合保护剂9号混合后,在37℃下保存3天,仍保持80%左右的酶活,5天后仍有60%左右的酶活。结果如图4所示,酶液与复合保护剂9号混合,在4℃保存7个月后,仍保持90%以上的酶活。
试验例4
复合保护剂9号对多种其它酶制剂的稳定性的影响
Myroilysin是一种海洋来源的新型M12家族的弹性蛋白酶,最适pH为9.0(Chen et.al.,2009,AEM)。将浓度为0.2mg/mL的myroilysin酶液与复合保护剂9号按照1:4的体积比进行混合,置于37℃水浴锅中,于一定时间后检测残余酶活。同样的酶液与缓冲液保温同样时间作为对照。结果如图5A所示,myroilysin酶与复合保护剂9号混合后,在37℃下保存5天,仍保持80%左右的酶活;没有加入复合保护剂的对照组,酶液在1天后就完全失活。
根据实施例2制得复合保护剂9-1号。复合保护剂9-1号pH为8.0,其它成分与复合保护剂9号一致。E40是一种海洋来源的新型脂酶(Li et.al.,2015,JBC);lysostaphin是一种商品化的M23家族的溶菌酶(L9043,Sigma),这两种酶制剂的最适pH为8.0。将E40和lysostaphin分别与复合保护剂9-1号按照1:4的体积比进行混合,置于37℃水浴锅中,于一定时间后检测残余酶活。同样的酶液与缓冲液保温同样时间作为对照。结果如图5B所示,E40与复合保护剂9-1号混合后,在37℃下保存3h,仍保持70%左右的酶活,80h后仍保持40%左右的酶活;没有加入复合保护剂的对照组,酶液在20min后就完全失活。图5C显示,lysostaphin与复合保护剂9-1号混合后,在37℃下保存60h,仍保持70%左右的酶活,80h后仍保持60%左右的酶活;没有加入复合保护剂的对照组,酶液在40h后仅存10%以下的酶活。
试验例5
对比例1所述的保护剂pH为7.0(保护剂使用的缓冲液是pH为7.0的磷酸缓冲液),适用于提高β-甘露聚糖酶的稳定性。β-甘露聚糖酶在pH4~7.5之间活性较高。随着pH的升高,壳聚糖会逐渐析出,并且磷酸缓冲液的缓冲范围是pH5.7~8.0,因此该保护剂无法在pH8.0以上的环境下使用,因此无法提高碱性蛋白酶的稳定性,其适用范围受限。
对比例2为复合保护剂4号,如图2所示,复合保护剂4号对弹性蛋白酶几乎没有保护作用,但是复合保护剂6号,8号与9号可以非常明显地提高弹性蛋白酶的热稳定性,可见葡萄糖:海藻糖:甘油:蔗糖的不同配比对复合保护剂的效果影响很大。
- 还没有人留言评论。精彩留言会获得点赞!