结合透明质酸的合成肽聚糖、制备和使用方法与流程
相关申请的交叉引用本申请根据35U.S.C.§119(e)条款要求2011年5月24日提交的美国临时申请顺序号61/489,602和2011年10月24日提交的美国临时申请顺序号61/550,621的优先权。所述两个临时申请的公开内容通过引用结合到本文中。
技术领域:
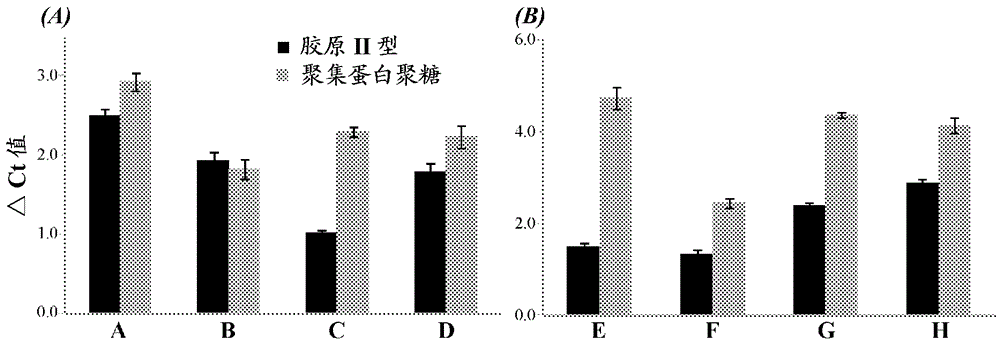
本发明涉及结合透明质酸的合成肽聚糖领域及形成和使用所述结合透明质酸的合成肽聚糖的方法。发明背景和概述关节软骨是用于保护体内骨骼的重要组分。具体地说,关节软骨通过为骨运动提供近乎无摩擦表面以及还为关节提供耐压强度,而起保护关节连接的骨免受损伤的作用。关节软骨大体上包括来源于以下3个主要组分的胞外基质(ECM):胶原支架、透明质酸(HA)和聚集蛋白聚糖。关节软骨的材料组成规定了组织生物学、化学和力学性质。健康软骨的胞外基质(ECM)主要由胶原原纤维(15-22%湿重II型胶原)、蛋白聚糖(4-7%湿重)、糖蛋白、水(60-85%)和电解质组成,产生具有深度依赖性结构和力学各向异性的粘弹性组织。软骨降解和磨损是骨关节炎(OA)的标志。在OA的初始阶段,聚集蛋白聚糖(软骨中的一种主要蛋白聚糖)是被降解的早期组分。聚集蛋白聚糖单体是具有共价连接的糖胺聚糖(GAG)侧链的蛋白质核心,所述糖胺聚糖侧链通过球形结构域和连接蛋白与丝状透明质酸结合。蛋白酶(例如聚集蛋白聚糖酶(aggrecanase))在特定部位切割聚集蛋白聚糖产生不能与HA再结合的蛋白质片段和游离GAG链。取而代之的是,这些游离GAG链从基质中突出,这不仅降低耐压强度,而且还启动促炎细胞因子和基质金属蛋白酶增加。已表明聚集蛋白聚糖的存在降低蛋白酶的扩散,保护基础性胶原纤维免于蛋白水解性切割。聚集蛋白聚糖丢失甚至发生在正常软骨中,并且不与OA直接相关。然而,II型胶原的丢失被视为不可逆过程,导致过早磨损。骨关节炎是最常见的关节炎形式,仅美国就累及2700万人。骨关节炎最普遍的症状包括剧痛、关节变硬及触痛和炎性关节。骨关节炎的晚期会导致关节软骨完全降解、引起关节不能移动和基础性骨损伤。估计在美国关节炎的直接成本约为每年$1855亿。虽然生活方式改变和多种药物常常用于治疗骨关节炎,但在有缺陷软骨的再生和缓解因软骨丢失引起的症状方面几乎没有成效。不能终止骨关节炎的进程和修复已有损伤,这一点通常导致侵入性终末期软骨置换手术。因此,十分需要骨关节炎的替代治疗选择。本公开内容描述了用于软骨再生的改进的生物材料,包括可用来恢复受累患者的受损软骨的结合透明质酸的合成肽聚糖以及形成和使用合成肽聚糖的方法。此外,设计结合透明质酸的合成肽聚糖以在功能上模拟聚集蛋白聚糖,抵抗聚集蛋白聚糖酶降解,并限制蛋白水解性降解。聚集蛋白聚糖中所见的天然氨基酸序列的缺乏使这些分子较不易被蛋白水解性切割。考虑了下列编号的实施方案,且所述实施方案不是限制性的:1.一种结合透明质酸的合成肽聚糖,其包含与聚糖缀合的合成肽,其中合成肽包含透明质酸结合序列。2.条款1的合成肽聚糖,其中所述合成肽包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。3.条款1或条款2的合成肽聚糖,其中所述合成肽包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。4.条款1-3中任一项的合成肽聚糖,其中所述聚糖选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。5.条款1-4中任一项的合成肽聚糖,其中所述聚糖选自硫酸软骨素和硫酸角质素。6.条款1-5中任一项的合成肽聚糖,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。7.条款1-6中任一项的合成肽聚糖,其中将所述合成肽聚糖冻干。8.式PnGx的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;和其中G为聚糖。9.式(PnL)xG的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;和其中G为聚糖。10.式P(LGn)x的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;和其中G为聚糖。11.式PnGx的化合物,其中n为MWG/1000;其中MWG是G舍入精确到1kDa的分子量;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;和其中G为聚糖。12.式(PnL)xG的化合物,其中n为MWG/1000;其中MWG是G舍入精确到1kDa的分子量;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;和其中G为聚糖。13.条款8-12中任一项的化合物,其中所述合成肽包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。14.条款8-13中任一项的化合物,其中所述合成肽包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。15.条款8-14中任一项的化合物,其中所述聚糖选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。16.条款8-15中任一项的化合物,其中所述聚糖选自硫酸软骨素和硫酸角质素。17.条款8-16中任一项的化合物,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。18.一种工程改造的胶原基质,其包含聚合胶原、透明质酸和结合透明质酸的合成肽聚糖。19.条款18的工程改造的胶原基质,其中所述胶原选自I型胶原、II型胶原、III型胶原、IV型胶原、IX型胶原、XI型胶原及其组合。20.条款18或19的工程改造的胶原基质,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。21.条款18-20中任一项的工程改造的胶原基质,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。22.条款18-21中任一项的工程改造的胶原基质,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。23.条款18-22中任一项的工程改造的胶原基质,其中所述合成肽聚糖的聚糖组分选自硫酸软骨素和硫酸角质素。24.条款18-23中任一项的工程改造的胶原基质,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。25.条款18-24中任一项的工程改造的胶原基质,其中所述基质作为组织移植物是有效的。26.条款25的工程改造的胶原基质,其中将所述组织移植物植入患者中。27.条款18-24中任一项的工程改造的胶原基质,其中所述基质是凝胶的形式。28.条款27的工程改造的胶原基质,其中通过注射将所述凝胶给予患者。29.条款18-24中任一项的工程改造的胶原基质,其中所述基质作为细胞体外培养的组成成分是有效的。30.条款29的工程改造的胶原基质,其中所述基质还包含外源细胞群。31.条款30的工程改造的胶原基质,其中所述细胞选自软骨细胞和干细胞。32.条款31的工程改造的胶原基质,其中所述干细胞选自成骨细胞、骨原细胞(osteogeniccell)和间充质干细胞。33.条款18-32中任一项的工程改造的胶原基质,其还包含一种或多种养分。34.条款18-33中任一项的工程改造的胶原基质,其还包含一种或多种生长因子。35.条款18-34中任一项的工程改造的胶原基质,其中将所述基质灭菌。36.一种用于软骨细胞或干细胞体外培养的组合物,其包含结合透明质酸的合成肽聚糖。37.条款36的组合物,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。38.条款36或条款37的组合物,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。39.条款36-38中任一项的组合物,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。40.条款36-39中任一项的组合物,其中所述合成肽聚糖的聚糖组分选自硫酸软骨素和硫酸角质素。41.条款36-40中任一项的组合物,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。42.条款36-41中任一项的组合物,其中所述干细胞选自成骨细胞、骨原细胞和间充质干细胞。43.条款36-42中任一项的组合物,其还包含一种或多种养分。44.条款36-43中任一项的组合物,其还包含一种或多种生长因子。45.条款36-44中任一项的组合物,其中将所述组合物灭菌。46.一种用于生物材料软骨或骨置换组合物的添加剂,其包含结合透明质酸的合成肽聚糖用于添加至已有的生物材料软骨或骨置换材料中。47.条款46的添加剂,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。48.条款46或条款47的添加剂,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。49.条款46-48中任一项的添加剂,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。50.条款46-49中任一项的添加剂,其中所述聚糖选自硫酸软骨素和硫酸角质素。51.条款46-50中任一项的添加剂,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。52.一种治疗患者的关节炎的方法,所述方法包括给予患者结合透明质酸的合成肽聚糖的步骤,其中所述合成肽聚糖减轻与关节炎相关的症状。53.条款52的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。54.条款52或条款53的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。55.条款52-54中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。56.条款52-55中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。57.条款52-56中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。58.条款52-57中任一项的方法,其中所述关节炎是骨关节炎。59.条款52-57中任一项的方法,其中所述关节炎是类风湿性关节炎。60.条款52-59中任一项的方法,其中通过注射将所述合成肽聚糖给予患者。61.条款60的方法,其中所述注射是关节内注射。62.条款60的方法,其中所述注射是注射到患者的关节囊中。63.条款52-62中任一项的方法,其中所述合成肽聚糖使用针或输注装置给予。64.条款52-63中任一项的方法,其中所述合成肽聚糖起润滑剂的作用。65.条款52-64中任一项的方法,其中所述合成肽聚糖防止骨-骨连接(boneonbonearticulation)或防止软骨丢失。66.一种制备生物材料或骨软骨置换物的方法,所述方法包括将合成肽聚糖和现有的生物材料或骨软骨置换物混合的步骤。67.条款66的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。68.条款66或条款67的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。69.条款66-68中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。70.条款66-69中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。71.条款66-70中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。72.一种降低或防止患者的透明质酸降解的方法,所述方法包括给予患者结合透明质酸的合成肽聚糖。73.条款72的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。74.条款72或条款73的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。75.条款72-74中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。76.条款72-75中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。77.条款72-76中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。78.条款72-77中任一项的方法,其中通过注射将所述合成肽聚糖给予患者。79.条款78的方法,其中所述注射是关节内注射。80.条款78的方法,其中所述注射是注射到患者的关节囊中。81.条款72-80中任一项的方法,其中透明质酸降解的速率降低。82.一种纠正或改正患者的组织缺陷的方法,所述方法包括将结合透明质酸的合成肽聚糖给予缺陷组织中,其中所述缺陷被纠正或改正。83.条款82的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。84.条款82或条款83的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。85.条款82-84中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。86.条款82-85中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。87.条款82-86中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。88.条款82-87中任一项的方法,其中通过注射将所述合成肽聚糖给予患者。89.条款88的方法,其中所述注射为皮下。90.条款82-89中任一项的方法,其中所述缺陷是外观缺陷(cosmeticdefect)。91.一种皮肤填充剂,其包含结合透明质酸的合成肽聚糖。92.条款91的皮肤填充剂,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。93.条款91或条款92的皮肤填充剂,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸(GC)或与N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。94.条款91-93中任一项的皮肤填充剂,其还包含透明质酸。95.一种降低或防止胶原降解的方法,所述方法包括以下步骤:在胶原存在下使结合透明质酸的合成肽聚糖与透明质酸接触,和降低或防止胶原降解。96.条款95的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。97.条款95或条款96的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:。98.条款95-97中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。99.条款95-98中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。100.条款95-99中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。101.条款95-100中任一项的方法,其中透明质酸降解的速率降低。102.一种增加工程改造的胶原基质的孔尺寸的方法,所述方法包括以下步骤:将胶原、透明质酸和结合透明质酸的合成肽聚糖混合,和增加基质的孔尺寸。103.条款102的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。104.条款102或条款103的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:。105.条款102-104中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。106.条款102-105中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。107.条款102-106中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。108.条款102-107中任一项的方法,其中将所述基质灭菌。109.条款102-108中任一项的方法,其中所述基质还包含软骨细胞或干细胞。110.条款109的方法,其中所述干细胞选自成骨细胞、骨原细胞和间充质干细胞。111.条款102-110中任一项的方法,其中所述基质还包含一种或多种养分。112.条款102-111中任一项的方法,其中所述基质还包含一种或多种生长因子。113.一种降低或防止硫酸软骨素降解的方法,所述方法包括以下步骤:在胶原存在下使结合透明质酸的合成肽聚糖与透明质酸接触,和降低或防止硫酸软骨素降解。114.条款113的方法,其中所述合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。115.条款113或条款114的方法,其中所述合成肽聚糖的肽组分包含选自以下的氨基酸序列:。116.条款113-115中任一项的方法,其中所述合成肽聚糖的聚糖组分选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。117.条款113-116中任一项的方法,其中所述聚糖选自硫酸软骨素和硫酸角质素。118.条款113-117中任一项的方法,其中所述合成肽聚糖对聚集蛋白聚糖酶具有抗性。119.条款113-118中任一项的方法,其中硫酸软骨素降解的速度降低。120.前述条款中任一项的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述合成肽聚糖的肽组分具有与肽的C端连接的甘氨酸-半胱氨酸(GC)。121.前述条款中任一项的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述合成肽聚糖的肽组分具有与肽的N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。122.前述条款中任一项的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述合成肽聚糖对基质金属蛋白酶有抗性。123.条款122的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述基质金属蛋白酶是聚集蛋白聚糖酶。124.前述条款中任一项的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述合成肽聚糖的剂量的浓度范围为约0.01uM-约100uM。125.前述条款中任一项的合成肽聚糖、化合物、工程改造的胶原基质、组合物、添加剂、方法或皮肤填充剂,其中所述合成肽聚糖的剂量的浓度范围为约0.1uM-约10uM。附图简述图1显示产生结合透明质酸的合成肽聚糖的实施方案的反应示意图。反应步骤用粗体字详细说明。图公开了SEQIDNO:35。图2显示基于所注射的BMPH的量(mg)的N-[β-马来酰亚胺丙酸]酰肼三氟乙酸盐(下文称为“BMPH”)吸光度(215nm)的标准曲线。利用标准曲线测定偶联反应期间所消耗的BMPH的量。图3显示结合透明质酸的合成肽聚糖与固定化透明质酸(HA)的结合。使9个HA结合肽(例如GAHWQFNALTVRGGGC(SEQIDNO:35);下文称为“GAH”或“mAGC”)与官能化糖胺聚糖(例如硫酸软骨素,下文称为“CS”)骨架连接。合成肽聚糖的浓度自0.01µM增加到100µM。图4显示通过流变频率扫描(rheologicalfrequencysweep)测定的合成肽聚糖的HA结合(图A)。以5.012Hz的振荡频率分析HA混合物的储能模量。在此频率下,提供明显的负荷,同时保持HA链的完整性。统计分析(α=0.05)表明HA+CS和HA显著不同(标为*),且HA+10.5GAH-CS和HA+CS显著不同(标为**)。图B是图A所示相同数据的替代示图。图5显示胶原原纤维形成期间胶原I型+处理组的浊度的量化。每3分钟测量313nm处的吸光度。1小时后(即时间点数20),所有处理组具有完全成形的网。就最大吸光度或至半最大吸光度的时间而言,处理组间不存在显著差异(α=0.05)。图6显示根据施用的每秒1%工程应变由胶原凝胶承受的压缩工程应力。统计分析(α=0.05)表明,除在5%、7.5%和10%工程应变下所分析的工程应力以外,加入10.5GAH-CS导致峰值工程应力的显著差异。图7显示以0.5012Hz的振荡频率测量的胶原混合物的储能模量。统计分析(α=0.05)表明,加入10.5GAH-CS导致胶原凝胶(标为*)的储能模量显著增加。图8显示因向混合物中加入透明质酸酶所致HA混合物的百分比降解(图A)。通过HA混合物动态粘度的变化测定百分比降解。最初进行混合物的动态粘度测量,该测量用作基线,自该基线计算百分比降解。在加入透明质酸酶,充分混合样品,并移液到流变仪载物台后,并且在加入透明质酸酶和动态粘度测量之间已过去约2分钟,作为0小时时间点。统计分析表明在0小时和2小时两个时间点,10.5GAH-CS样品的百分比降解有显著差异(α=0.05)。图B显示相同数据表示为因加入透明质酸酶所致HA混合物的归一化动态粘度(均值±SE,n=3)。在加入透明质酸酶前,最初进行混合物的动态粘度测量,这些值用作基线,自该基线计算归一化动态粘度。通过取在加入透明质酸酶后各测量的动态粘度,将该值除以所述样品的初始动态粘度,来得出归一化动态粘度。进行了统计分析(α=0.05),在0小时和2小时两个时间点,在10.5GAH-CS样品归一化降解中观察到显著差异。图9显示与各个软骨ECM重复样品(replicate)缔合的CI支架的代表性冷冻SEM图像(放大倍数10,000x,比例条5µm)。图片A表示CI对照。图片B表示CI+HA+CS。图片C表示CI+HA+10.5GAH-CS。图10显示在整个50小时持续时间内暴露于MMP-I的ECM重复样品中的CI的百分比降解(均值±SE,n=3)。不同处理的统计分析(p<0.05)显示所有3种处理(CI对照、CI+HA+CS和CI+HA+10.5GAH-CS)彼此显著不同。图11显示在用和不用IL-1β刺激的培养基中8天培养期内的累积硫酸软骨素(CS)丢失。CS丢失通过DMMB测定法测量。加入mAGC对支架中的CS丢失具有显著效果(p<0.001)。**表示不用聚集蛋白聚糖模拟物制备的支架和用mAGC制备的支架间的统计显著性。+表示用和不用IL-1β处理的支架的统计显著性(p<0.05)。条(bar)表示平均值±SEM(n=3)。图12显示在用和不用IL-1β刺激的培养基中8天培养期内的累积胶原分解。胶原分解通过Sircol测定法测量。加入聚集蛋白聚糖模拟物对支架中的胶原丢失具有显著效果(p<0.02)。**表示不用聚集蛋白聚糖模拟物制备的支架和用mAGC制备的支架间的统计显著性。+表示用和不用IL-1β处理的支架的统计显著性(p<0.05)。条表示平均值±SEM(n=3)。图13表示离体研究肽聚糖的功效的平台。使用0.5%胰蛋白酶从牛软骨移出物中除去天然聚集蛋白聚糖。通过DMMB测定法证实聚集蛋白聚糖的去除。图表示较之于阳性对照被除去的聚集蛋白聚糖的量。图14显示监测肽聚糖通过软骨基质扩散的测定法。Y轴表示自用/不用肽聚糖处理的聚集蛋白聚糖消耗的软骨填充物(aggrecan-depletedcartilageplug)读取的DMMB测定法吸光度值的差异。X轴表示从软骨关节面至软骨下骨的距离。条表示平均值差异±SEM(n=3)。图15显示牛软骨移出物的番红O和抗生物素蛋白-生物素染色。通过基质进行中央矢状切割,并分别探测残留的聚集蛋白聚糖(上图,暗染色)和生物素(下图,暗染色)。胶原II型结合肽聚糖[WYRGRLGC(SEQIDNO:36);“mAG(II)C”]通过移出物扩散。该组织切片的较高放大倍数(20X)表明mAG(II)C穿透约200um进入组织。图16显示软骨移出物的抗生物素蛋白-生物素染色。肽聚糖(mAG(II)C和mAGC)通过软骨移出物扩散。图像表明各个穿透的深度(暗染色)。图公开了SEQIDNO:58。图17显示在聚集蛋白聚糖消耗的(AD)移出物中加入肽聚糖增加压缩刚度(compressivestiffness)。与胶原II型结合肽聚糖(mAG(II)C)相比,加入HA结合肽聚糖(mAGC)显著恢复软骨移出物的刚度至较高程度。表示为*的显著性说明AD和AD+mACG强化的移出物之间压缩刚度的增加(p<0.005)。数据表示为均值±SEM(n=5)。图18(A)显示与MMP-13结合的探针的示意图。BHQ-3blackhole猝灭剂3和CY5.5分别在695nm处吸收和发射。箭头和斜体字表示切割位点。图公开了SEQIDNO:59。(B)显示在含和不含MMP-13的探针活性的浓度概况:左,96孔微量培养板的荧光成像截面;右,荧光发射强度(695nm)的恢复。图19显示在手术后4、6和8周用和不用肽聚糖治疗的Sprague-Dawley大鼠中通过MMP-13探针所表明的炎症程度。图20显示OA诱导后6周和8周显示受损膝的Sprague-Dawley大鼠膝关节(分别为图片A和图片D)、用肽聚糖治疗的受损膝(分别为图片B和图片E)和骨关节炎诱导手术后6周的正常膝(图片C)的x射线图像。图21显示Sprague-Dawley大鼠的微CT,表明OA诱导手术后6和8周新的软骨再生长。图片A和图片D分别显示OA诱导后6周和8周的受损膝。图片B和图片E分别显示肽聚糖治疗后的受损膝。图C显示正常膝。图22显示向胶原支架中加入mAGC增加储能模量和压缩刚度。胶原支架上的频率扫描(A)表明0.1-2.0Hz范围内的储能模量增加。类似地,当随mAGC的加入制备支架时压缩刚度(B)值显示增加。显著性表示为*(p<0.0001)。数据表示为均值±SEM(n=5)。图23显示在用和不用IL-1β刺激的培养基中8天培养期内的累积硫酸软骨素(CS)丢失。CS丢失通过DMMB测定法测量。支架组成(A-H)见表3。加入mAGC对支架中的CS丢失具有显著效果(p<0.001)。*表示支架A和C及支架E和G间的统计显著性(p<0.05)。条表示平均值±SEM(n=3)。图24显示在用和不用IL-1β刺激的培养基中8天培养期内的累积胶原分解。胶原分解通过Sircol测定法测量。支架组成(A-H)描述于表3。加入聚集蛋白聚糖模拟物对支架中的胶原丢失具有显著效果(p<0.02)。*表示支架A和C及支架E和G之间的统计显著性(p<0.05)。条表示平均值±SEM(n=3)。图25显示由培养在非对齐的(A)和对齐的(B)胶原支架中的牛软骨细胞表达的聚集蛋白聚糖和胶原II型的实时PCR分析。将各值归一化至内源GAPDH表达。加入mAGC在统计学上分别改变聚集蛋白聚糖和胶原II型表达(p聚集蛋白聚糖<0.02和p胶原<0.001)。在未对齐和对齐的支架之间聚集蛋白聚糖和胶原II型表达也有统计差异(p<0.001)。类似地,用和不用IL-1β处理的支架之间聚集蛋白聚糖和胶原II型表达不同(p<0.01)。支架组成(A-H)描述于表3。条表示平均值±SEM(n=4)。说明性实施方案的详细描述本文所用的“结合透明质酸的合成肽聚糖”意指与聚糖缀合的合成肽,其中所述肽包含透明质酸结合序列。本文如下对本发明的各种实施方案进行了描述。在本文描述的一个实施方案中,提供结合透明质酸的合成肽聚糖。结合透明质酸的合成肽聚糖包含与聚糖缀合的合成肽,其中所述合成肽包含透明质酸结合序列。在另一个实施方案中,描述了式PnGx的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;且其中G为聚糖。在又一个实施方案中,描述了式(PnL)xG的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;和其中G为聚糖。在另一个实施方案中,描述了式P(LGn)x的化合物,其中n为1-20;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;且其中G为聚糖。在又一个实施方案中,描述了式PnGx的化合物,其中n为MWG/1000;其中MWG是G舍入精确到1kDa的分子量;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;和其中G为聚糖。在另一个实施方案中,描述了式(PnL)xG的化合物,其中n为MWG/1000;其中MWG是G舍入精确到1kDa的分子量;其中x为1-20;其中P为包含透明质酸结合序列的约5-约40个氨基酸的合成肽;其中L为接头;和其中G为聚糖。为了本公开内容的目的,前述段落中描述的结合透明质酸的合成肽聚糖和化合物统称为“结合透明质酸的合成肽聚糖”或“合成肽聚糖”。在上述肽实施方案中的每一个中,合成肽聚糖可包含5-15个肽分子(n为5-15)、5-20个肽分子(n为5-20)、1-20个肽分子(n为1-20)或1-25个肽分子(n为1-25)。在一个实施方案中,n选自1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24和25个肽分子。在本文描述的另一个说明性实施方案中,提供工程改造的胶原基质。所述基质包含聚合胶原、透明质酸和结合透明质酸的合成肽聚糖。在另一个实施方案中,提供用于软骨细胞或干细胞体外培养的组合物。该组合物包含本公开内容描述的任何结合透明质酸的合成肽聚糖。在本文描述的另一个实施方案中,提供增加工程改造的胶原基质的孔尺寸的方法。该方法包括将胶原、透明质酸和结合透明质酸的合成肽聚糖混合和增加基质的孔尺寸的步骤。在又一个说明性实施方案中,降低患者的软骨磨损或侵蚀的方法。该方法包括给予患者结合透明质酸的合成肽聚糖的步骤,其中所述合成肽聚糖降低软骨的磨损或侵蚀。在一个实施方案中,软骨侵蚀或磨损可由关节炎引起。在一个实施方案中,软骨侵蚀或磨损可由老化、肥胖、创伤或损伤、解剖异常、遗传疾病、代谢失衡、炎症等引起。在又一个说明性实施方案中,提供治疗患者的关节炎的方法。该方法包括给予患者结合透明质酸的合成肽聚糖的步骤,其中所述合成肽聚糖减轻与关节炎相关的症状。在另一个说明性实施方案中,提供降低或防止患者的透明质酸降解的方法。该方法包括给予患者结合透明质酸的合成肽聚糖。在另一个说明性实施方案中,提供降低或防止胶原降解的方法。该方法包括在胶原存在下使结合透明质酸的合成肽聚糖与透明质酸接触和降低或防止胶原降解的步骤。在又一个说明性实施方案中,提供用于纠正或改正患者的组织缺陷的方法。该方法包括给予缺陷组织结合透明质酸的合成肽聚糖,其中所述缺陷被纠正或改正。在本文描述的另一个说明性实施方案中,提供皮肤填充剂。填充剂包含结合透明质酸的合成肽聚糖。在一个实施方案中,填充剂还包含透明质酸。在又一个实施方案中,提供用于生物材料软骨或骨置换组合物的添加剂。添加剂包含结合透明质酸的合成肽聚糖用于添加至已有的生物材料软骨或骨置换物中。在本文描述的另一个实施方案中,提供制备生物材料或骨软骨置换物的方法。该方法包括将合成肽聚糖和现有的生物材料或骨软骨置换材料混合的步骤。在各种实施方案中,合成肽聚糖的肽组分包含式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2(SEQIDNO:1)的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,和其中X1-X8为非酸性氨基酸。在另一个实施方案中,合成肽聚糖的肽组分可包含或可以是式B1-X1-B2-X2-X3-X4-X5-X6-X7-X8-X9-B3的氨基酸序列,其中X9存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,其中B3为碱性氨基酸,和其中X1-X9为非酸性氨基酸。在另一个实施方案中,合成肽可包含或可以是式B1-X1-X2-X3-X4-X5-X6-X7-X8-B2-X9-B3的氨基酸序列,其中X8存在或不存在,其中B1为碱性氨基酸,其中B2为碱性氨基酸,其中B3为碱性氨基酸,和其中X1-X9为非酸性氨基酸。本文所用的“碱性氨基酸”选自赖氨酸、精氨酸或组氨酸。本文所用的“非酸性氨基酸”选自丙氨酸、精氨酸、天冬酰胺、半胱氨酸、谷氨酰胺、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。在本文描述的各种说明性实施方案中,合成肽聚糖的肽组分可包含选自以下的氨基酸序列:。在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸和/或与肽的N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。在本文描述的各种实施方案中,合成肽聚糖的肽组分包含前述段落描述的任何氨基酸序列或与这些氨基酸序列的任一个有80%、85%、90%、95%、98%或100%同源性的氨基酸序列。可以包括的作为结合透明质酸的合成肽聚糖的肽组分的其它肽包括描述于Amemiya等,Biochem.Biophys.Acta,第1724卷,第94-99页(2005)中的肽,所述文献通过引用结合到本文。这些肽具有Arg-Arg基序并包括选自以下的肽:。在上述肽实施方案中的每一个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸。在上述肽实施方案中的每一个中,肽可具有与肽的N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。在本文描述的各种实施方案中,合成肽聚糖的肽组分包含前述段落描述的任何氨基酸序列或与这些氨基酸序列的任一个有80%、85%、90%、95%、98%或100%同源性的氨基酸序列。在其它实施方案中,描述于Yang等,EMBOJournal,第13卷,第286-296页(1994)(通过引用结合到本文)和Goetinck等,J.Cell.Biol.,第105卷,第2403-2408页(1987)(通过引用结合到本文)的肽可用于本文描述的结合透明质酸的合成肽聚糖,包括选自以下的肽:RDGTRYVQKGEYR(SEQIDNO:52)、HREARSGKYK(SEQIDNO:53)、PDKKHKLYGV(SEQIDNO:54)和WDKERSRYDV(SEQIDNO:55)。在这些实施方案的每个中,肽可具有与肽的C端连接的甘氨酸-半胱氨酸。在这些实施方案的每个中,肽可具有与肽的N端连接的甘氨酸-半胱氨酸-甘氨酸(GCG)。在其它实施方案中,合成肽聚糖的肽组分包含与这些氨基酸序列的任一个有80%、85%、90%、95%、98%或100%同源性的氨基酸序列。在各种实施方案中,本文描述的合成肽聚糖的肽组分可通过包含一个或多个保守氨基酸取代而被修饰。如本领域技术人员熟知的,通过保守取代改变肽的任何非关键氨基酸不应显著改变该肽的活性,因为置换氨基酸的侧链应能够与被置换的氨基酸侧链形成类似的键和接触。非保守取代是可行的,只要这些取代不过分影响肽的透明质酸结合活性。如本领域众所周知的,氨基酸的“保守取代”或肽的“保守取代变体”是指这样的氨基酸取代,其保持:1)肽的二级结构;2)氨基酸的电荷或疏水性;和3)侧链的庞大性(bulkiness)或这些特性的任一个或多个。用作说明性的众所周知的术语“亲水残基”是指丝氨酸或苏氨酸。“疏水残基”是指亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸或丙氨酸等。“带正电荷的残基”是指赖氨酸、精氨酸、鸟氨酸或组氨酸。“带负电荷的残基”是指天冬氨酸或谷氨酸。具有“庞大侧链”的残基是指苯丙氨酸、色氨酸或酪氨酸等。表1给出说明性保守氨基酸取代的列表。表1对于以下氨基酸用以下氨基酸置换丙氨酸D-Ala,Gly,Aib,β-Ala,L-Cys,D-Cys精氨酸D-Arg,Lys,D-Lys,OrnD-Orn天冬酰胺D-Asn,Asp,D-Asp,Glu,D-GluGln,D-Gln天冬氨酸D-Asp,D-Asn,Asn,Glu,D-Glu,Gln,D-Gln半胱氨酸D-Cys,S-Me-Cys,Met,D-Met,Thr,D-Thr谷氨酰胺D-Gln,Asn,D-Asn,Glu,D-Glu,Asp,D-Asp谷氨酸D-Glu,D-Asp,Asp,Asn,D-Asn,Gln,D-Gln甘氨酸Ala,D-Ala,Pro,D-Pro,Aib,β-Ala异亮氨酸D-Ile,Val,D-Val,Leu,D-Leu,Met,D-Met亮氨酸Val,D-Val,Met,D-Met,D-Ile,D-Leu,Ile赖氨酸D-Lys,Arg,D-Arg,Orn,D-Orn甲硫氨酸D-Met,S-Me-Cys,Ile,D-Ile,Leu,D-Leu,Val,D-Val苯丙氨酸D-Phe,Tyr,D-Tyr,His,D-His,Trp,D-Trp脯氨酸D-Pro丝氨酸D-Ser,Thr,D-Thr,allo-Thr,L-Cys,D-Cys苏氨酸D-Thr,Ser,D-Ser,allo-Thr,Met,D-Met,Val,D-Val酪氨酸D-Tyr,Phe,D-Phe,His,D-His,Trp,D-Trp缬氨酸D-Val,Leu,D-Leu,Ile,D-Ile,Met,D-Met在一个实施方案中,适用于本文所述分子的保守氨基酸取代不改变由下式组成的基序:B1-X1-X2-X3-X4-X5-X6-X7-X8-B2式,B1-X1-B2-X2-X3-X4-X5-X6-X7-X8-X9-B3式、B1-X1-X2-X3-X4-X5-X6-X7-X8-B2-X9-B3式或Arg-Arg基序。在本文描述的各种实施方案中,本文所述合成肽聚糖的聚糖(例如糖胺聚糖,简写为GAG或多糖)组分可选自葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、乙酰肝素、肝素、角蛋白、硫酸角质素和透明质酸。在一个实施方案中,聚糖选自硫酸软骨素和硫酸角质素。在另一个说明性实施方案中,聚糖是硫酸软骨素。在本文描述的一个实施方案中,结合透明质酸的合成肽聚糖包含与硫酸软骨素缀合的(GAHWQFNALTVRGG(SEQIDNO:2))10,其中肽聚糖分子中的每个肽分别与硫酸软骨素连接。在本文描述的另一个实施方案中,结合透明质酸的合成肽聚糖包含与硫酸软骨素缀合的(GAHWQFNALTVRGGGC(SEQIDNO:35))11,其中肽聚糖分子中的每个肽分别与硫酸软骨素连接。在上述肽实施方案中的每一个中,肽数目可选自1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24和25个肽分子。在本文描述的各种实施方案中,合成肽聚糖对聚集蛋白聚糖酶具有抗性。本领域中聚集蛋白聚糖酶的特征为已知切割聚集蛋白聚糖的任何酶。在一个说明性方面,结合透明质酸的合成肽聚糖可被灭菌。本文所用的“灭菌”或“使灭菌”或“无菌的”意指通过除去不需要的污染物(包括但不限于内毒素和感染因子(infectiousagent)),对结合透明质酸的合成肽聚糖消毒。在各种说明性实施方案中,结合透明质酸的合成肽聚糖可使用常规灭菌技术消毒和/或灭菌,常规技术包括环氧丙烷或环氧乙烷处理、气体等离子体灭菌(gasplasmasterilization)、γ放射(例如1-4毫拉德γ辐射或1-2.5毫拉德γ辐射)、电子束和/或用过酸(例如过乙酸)灭菌。可采用不会不利影响结合透明质酸的合成肽聚糖的结构和活体营养(biotropic)性质的灭菌技术。在一个实施方案中,可对结合透明质酸的合成肽聚糖进行一个或多个灭菌过程。在另一个说明性实施方案中,对结合透明质酸的合成肽聚糖进行过滤除菌。可将结合透明质酸的合成肽聚糖包装在任何类型的容器(包括塑料包覆物(wrap)或箔包覆物)中,并可进一步灭菌。结合透明质酸的合成肽聚糖可在无菌条件下制备,例如通过冻干,其可容易地采用本领域技术人员熟知的标准技术实现。在本文描述的各种实施方案中,结合透明质酸的合成肽聚糖可与以下混合:无机物、氨基酸、糖、肽、蛋白质、维生素(例如抗坏血酸)或层粘连蛋白、胶原、纤连蛋白、透明质酸、血纤蛋白、弹性蛋白或聚集蛋白聚糖或生长因子(例如表皮生长因子、血小板衍生生长因子、转化生长因子β或成纤维细胞生长因子)和糖皮质激素(例如地塞米松)或粘弹性改变剂,例如离子和非离子水溶性聚合物;丙烯酸聚合物;亲水聚合物,例如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;纤维素类聚合物和纤维素类聚合物衍生物,例如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、甲基纤维素、羧甲基纤维素和醚化纤维素;聚乳酸、聚乙醇酸、乳酸和乙醇酸共聚物或其它聚合剂(天然的和合成的两者)。在本文描述的各种实施方案中,合成肽聚糖的肽组分按照本领域技术人员熟知的固相肽合成方案合成。在一个实施方案中,肽前体按照众所周知的Fmoc方案在固相载体上合成,用三氟乙酸从载体上切割,并按照本领域技术人员已知方法通过层析法纯化。在本文描述的各种实施方案中,合成肽聚糖的肽组分利用本领域技术人员熟知的生物技术的方法合成。在一个实施方案中,通过本领域技术人员已知的重组DNA技术,将编码所需肽的氨基酸序列信息的DNA序列连接至表达质粒(例如掺入亲和标签用于肽的亲和纯化的质粒)中,将该质粒转染至宿主生物用于表达,然后按照本领域技术人员已知方法(例如通过亲和纯化),将肽从宿主生物或生长培养基中分离。重组DNA技术方法描述于Sambrook等,“MolecularCloning:ALaboratoryManual”,第3版,ColdSpringHarborLaboratoryPress,(2001)(通过引用结合到本文),并且为技术人员所熟知。在本文描述的各种实施方案中,采用本领域技术人员已知方法,在还原剂的存在下,通过使肽的游离氨基与聚糖的醛官能团反应,使结合透明质酸的合成肽聚糖的肽组分与聚糖缀合,以产生肽聚糖缀合物。在一个实施方案中,按照本领域技术人员已知方法,通过使聚糖与偏过碘酸钠反应,来形成聚糖(例如多糖或糖胺聚糖)的醛官能团。在一个实施方案中,通过使聚糖的醛官能团与3-(2-吡啶基联硫基)丙酰基酰肼(PDPH)反应以形成中间体聚糖,并且进一步使中间体聚糖与含有游离硫醇基的肽反应,使合成肽聚糖的肽组分与聚糖缀合,以产生肽聚糖缀合物。在又一个实施方案中,可修饰合成肽聚糖的肽组分的序列以包括甘氨酸-半胱氨酸区段来提供聚糖或聚糖-接头缀合物的连接点。在本文描述的任何实施方案中,交联剂可以是N-[β-马来酰亚胺丙酸]酰肼(BMPH)。虽然前述段落中描述了具体的实施方案,但是可通过使用将肽与聚糖(例如多糖或糖胺聚糖)缀合的任何公知方法,制备本文所述结合透明质酸的合成肽聚糖。这可包括通过连接基团(例如二价接头)直接或间接的共价、离子或氢键键合。通常通过缀合物各个组分上的酸、醛、羟基、氨基或联亚氨基之间形成酰胺、酯或亚氨基键,使肽与聚糖共价键合,来形成缀合物。所有这些方法是本领域已知的,或进一步描述于本申请的实施例部分或HermansonG.T.,BioconjugateTechniques,AcademicPress,第169-186页(1996)(通过引用结合到本文)。接头通常包含约1-约30个碳原子,更通常约2-约20个碳原子。通常使用较低分子量接头(即具有约20-约500的近似分子量的接头)。另外,本文考虑缀合物的接头部分的结构修饰。例如,接头中可包括氨基酸,并且可对缀合物的接头部分进行多个氨基酸取代,包括但不限于天然存在的氨基酸以及可获自常规合成方法的氨基酸。另一方面,可使用β、γ和更长链的氨基酸替换一个或多个α氨基酸。另一方面,可通过改变包括在其中的氨基酸的数目或通过包括更多或更少的β、γ或更长链的氨基酸,使接头缩短或延长。类似地,可以改变本文所述接头的其它化学片段的长度和形状。在本文描述的各种实施方案中,接头可包括在每种情况下独立选自以下的一个或多个二价片段:亚烷基、亚杂烷基、亚环烷基、亚环杂烷基、亚芳基和亚杂芳基,其每个任选被取代。本文所用的亚杂烷基表示这样的基团,其由直链或支链亚烷基中一个或多个碳原子被在每种情况下独立选自氧、氮、磷和硫的原子置换而产生。在一个备选实施方案中,接头不存在。在本文描述的一个实施方案中,提供工程改造的胶原基质。结合透明质酸的合成肽聚糖的前述实施方案适用于本文描述的工程改造的胶原基质。在一个实施方案中,所述工程改造的胶原基质包含聚合胶原、透明质酸和结合透明质酸的合成肽聚糖。在一个实施方案中,所述工程改造的胶原基质包含聚合胶原和结合透明质酸的合成肽聚糖。在各种说明性实施方案中,可在胶原在溶液中聚合之前、期间或之后,加入交联剂(例如碳二亚胺、醛、lysl-氧化酶、N-羟基琥珀酰亚胺酯、亚氨基酯、酰肼和马来酰亚胺)以及各种天然交联剂(包括京尼平(genipin)等)。在各种说明性实施方案中,本文使用的制备工程改造的胶原基质的胶原可以是任何类型的胶原,包括单独或任何组合的胶原I-XXVIII型,例如,可使用胶原I型、II型、III型和/或IV型。在一些实施方案中,用于制备工程改造的胶原基质的胶原选自I型胶原、II型胶原、III型胶原、IV型胶原、IX型胶原、XI型胶原及其组合。在一个实施方案中,使用市售可获得的胶原(例如Sigma,St.Louis,MO)形成工程改造的胶原基质。在一个备选实施方案中,胶原可自含粘膜下层的组织材料(例如肠、膀胱或胃组织)纯化。在又一个实施方案中,胶原可自尾肌腱纯化。在另一个实施方案中,胶原可自皮肤纯化。在不同方面,除结合胶原的合成肽聚糖以外,胶原还可含有内源或外源加入的非胶原蛋白质,例如纤连蛋白或丝蛋白质、糖蛋白和多糖等。通过本文所述方法制备的工程改造的胶原基质可呈组织移植物的形式(例如呈凝胶形式),其在植入或注射部位可呈现与其缔合的组织的特有特征。在一个实施方案中,工程改造的胶原基质是可植入患者中的组织移植物。在另一个实施方案中,工程改造的胶原基质可通过注射给予患者。在任一个实施方案中,基质可呈例如凝胶或粉末形式。在一个实施方案中,所述工程改造的胶原基质中的胶原构成基质的约40-约90干重(wt)%、基质的约40-约80干重%、基质的约40-约70干重%、基质的约40-约60干重%、基质的约50-约90干重%、基质的约50-约80干重%、基质的约50-约75干重%、基质的约50-约70干重%或基质的约60-约75干重%。在另一个实施方案中,所述工程改造的胶原基质中的胶原构成基质的约90干重%、约85干重%、约80干重%、约75干重%、约70干重%、约65干重%、约60干重%、约50干重%、约45干重%、约40干重%或约30干重%。在一个实施方案中,凝胶形式中基质的最终胶原浓度为约0.5-约6mg/mL、约0.5-约5mg/mL、约0.5-约4mg/mL、约1-约6mg/mL、约1-约5mg/mL或约1-约4mg/mL。在一个实施方案中,基质的最终胶原浓度为约0.5mg/mL、约1mg/mL、约2mg/mL、约3mg/mL、约4mg/mL或约5mg/mL。在一个实施方案中,所述工程改造的胶原基质中结合透明质酸的合成肽聚糖构成基质的约2-约60干重(wt)%、基质的约2-约50干重%、基质的约5-约50干重%、基质的约10-约50干重%、基质的约10-约20干重%、基质的约10-约30干重%、基质的约10-约25干重%、基质的约15-约30干重%或基质的约15-约45干重%。在另一个实施方案中,所述工程改造的胶原基质中结合透明质酸的合成肽聚糖构成基质的约2干重%、约5干重%、约10干重%、约15干重%、约20干重%、约25干重%、约30干重%、约35干重%、约40干重%、约45干重%或约50干重%。在另一个实施方案中,所述工程改造的胶原基质包含透明质酸,所述工程改造的胶原基质中的透明质酸构成基质的约2-约60干重(wt)%、基质的约2-约50干重%、基质的约5-约50干重%、基质的约10-约50干重%、基质的约10-约20干重%、基质的约10-约30干重%、基质的约10-约25干重%、基质的约15-约30干重%或基质的约15-约45干重%。在另一个实施方案中,所述工程改造的胶原基质中的透明质酸构成基质的约2干重%、约5干重%、约10干重%、约15干重%、约20干重%、约25干重%、约30干重%、约35干重%、约40干重%、约45干重%或约50干重%。在一个实施方案中,所述工程改造的胶原基质包含透明质酸和结合透明质酸的合成肽聚糖。工程改造的胶原基质中的透明质酸和结合透明质酸的合成肽聚糖构成基质的约10-约60干重(wt)%、基质的约20-约60干重%、基质的约30-约60干重%、基质的约40-约60干重%、基质的约10-约50干重%、基质的约20-约50干重%、基质的约25-约50干重%、基质的约30-约50干重%或基质的约25-约40干重%。在另一个实施方案中,所述工程改造的胶原基质中的透明质酸和结合透明质酸的合成肽聚糖构成基质的约10干重%、约15干重%、约20干重%、约25干重%、约30干重%、约35干重%、约40干重%、约50干重%、约55干重%、约60干重%或约70干重%。在一个说明性方面,工程改造的胶原基质可被灭菌。本文所用的“灭菌”或“使无菌”或“无菌的”意指通过除去不需要的污染物(包括但不限于内毒素、核酸污染物和感染因子)将基质消毒。在各种说明性实施方案中,可采用常规灭菌技术对工程改造的胶原基质消毒和/或灭菌,常规灭菌技术包括酸性pH下的戊二醛鞣、甲醛鞣、环氧丙烷或环氧乙烷处理、气体等离子体灭菌、γ放射(例如1-4毫拉德γ辐射或1-2.5毫拉德γ辐射)、电子束和/或用过酸(例如过乙酸)灭菌。可以使用不会不利影响基质的结构和活体营养性质的灭菌技术。在一个实施方案中,可对工程改造的胶原基质进行一个或多个灭菌过程。在说明性实施方案中,还可在聚合之前,对含胶原的溶液灭菌或消毒。工程改造的胶原基质可包装在任何类型的容器(包括塑料包覆物或箔包覆物)中,并可进一步灭菌。在任何的这些实施方案中,工程改造的胶原基质还可包含外源细胞群。所加入的细胞群可包含一种或多种细胞群。在各种实施方案中,细胞群包含非角质化或角质化上皮细胞群或选自以下的细胞群:内皮细胞、中胚层衍生细胞、间皮细胞、滑膜细胞、神经细胞、神经胶质细胞、成骨细胞、成纤维细胞、软骨细胞、肌腱细胞、平滑肌细胞、骨骼肌细胞、心肌细胞、多能祖细胞(例如干细胞,包括骨髓祖细胞)和骨原细胞。在一些实施方案中,细胞群选自软骨细胞和干细胞。在一些实施方案中,干细胞选自成骨细胞、骨原细胞和间充质干细胞。在各种实施方案中,工程改造的胶原基质可用一种或多种细胞类型组合接种。在各个方面,本发明的工程改造的胶原基质或工程改造的移植物构建体可与养分组合,所述养分包括无机物、氨基酸、糖、肽、蛋白质、维生素(例如抗坏血酸)或层粘连蛋白、纤连蛋白、透明质酸、血纤蛋白、弹性蛋白或聚集蛋白聚糖或生长因子(例如表皮生长因子、血小板衍生生长因子、转化生长因子β或成纤维细胞生长因子)和糖皮质激素(例如地塞米松)或粘弹性改变剂,例如离子和非离子水溶性聚合物;丙烯酸聚合物;亲水聚合物,例如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;纤维素类聚合物和纤维素类聚合物衍生物,例如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、甲基纤维素、羧甲基纤维素和醚化纤维素;聚乳酸、聚乙醇酸、乳酸和乙醇酸共聚物或其它聚合剂(天然的和合成的两者)。在其它说明性实施方案中,可在加入细胞之前、同时或之后加入交联剂,例如碳二亚胺、醛、lysl-氧化酶、N-羟基琥珀酰亚胺酯、亚氨基酯、酰肼和马来酰亚胺以及天然交联剂,包括京尼平等。如上所述,按照一个实施方案,可在胶原聚合后或在胶原聚合期间将细胞加入工程改造的胶原基质或工程改造的移植物构建体中。包含细胞的工程改造的胶原基质可随后注射入或植入宿主中用作工程改造的移植物构建体。在另一个实施方案中,工程改造的胶原基质上或工程改造的胶原基质内的细胞可体外培养预定的一段时间,以在植入或注射入患者中前增加细胞数目或诱导所需重塑(remodeling)。在本文描述的一个实施方案中,提供用于软骨细胞或干细胞体外培养的组合物(即用于细胞体外培养而无需随后植入或注射入患者中)。体外培养的组合物包含结合透明质酸的合成肽聚糖。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述体外培养的组合物。在各个方面,用于本发明体外培养的组合物可与养分组合,所述养分包括无机物、氨基酸、糖、肽、蛋白质、维生素(例如抗坏血酸)或层粘连蛋白、纤连蛋白、透明质酸、血纤蛋白、弹性蛋白或聚集蛋白聚糖或生长因子(例如表皮生长因子、血小板衍生生长因子、转化生长因子β或成纤维细胞生长因子)和糖皮质激素(例如地塞米松)。在一些实施方案中,用于体外培养的组合物包括选自以下的干细胞:成骨细胞、骨原细胞和间充质干细胞。在各种实施方案中,用于体外培养的组合物可用一种或多种细胞类型组合接种。在一个说明性方面,可将用于体外培养的组合物灭菌。本文所用的“灭菌”或“使灭菌”或“无菌的”意指通过除去不需要的污染物(包括但不限于内毒素、核酸污染物和感染因子)对组合物消毒。前述段落提供的灭菌程序、方法和实施方案同样适用于本文所述用于体外培养的组合物。可使用体外培养组合物以扩增细胞群用于植入或注射入患者中。在本文描述的一个实施方案中,提供用于生物材料软骨置换组合物的添加剂。添加剂包含结合透明质酸的合成肽聚糖以添加到现有的生物材料软骨置换材料中。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述添加剂。本文所用短语“现有的生物材料软骨置换材料”意指可用于置换机体中受损、缺陷或缺失软骨的生物相容性组合物。各种类型的现有的生物材料软骨置换组合物是本领域众所周知的并在考虑之内。例如,现有的生物材料软骨或骨置换组合物包括DeNovo®NT天然组织移植物(Zimmer)、MaioRegen™(JRILimited)或由Biomet生产的冷冻保存的骨关节组织系列。在一个实施方案中,提供制备生物材料或骨软骨置换的方法。该方法包括将合成肽聚糖和现有的生物材料或骨软骨置换材料混合的步骤。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在一个实施方案中,提供治疗患者的关节炎的方法。该方法包括给予患者结合透明质酸的合成肽聚糖的步骤,其中所述合成肽聚糖减轻与关节炎相关的一种或多种症状。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在各种实施方案中,用于治疗关节炎的方法的合成肽聚糖减轻与关节炎相关的一种或多种症状。本领域已知与关节炎有关的各种症状包括但不限于疼痛、僵硬、触痛、炎症、肿胀、发红、发热和可动性降低。关节炎的症状可存在于关节、肌腱或机体的其它部位。本文所用的“减轻”意指防止或完全或部分缓解关节炎的症状。在各种实施方案中,关节炎是骨关节炎或类风湿性关节炎。骨关节炎和类风湿性关节炎的发病机制和临床症状是本领域众所周知的。在该方法的一个实施方案中,合成肽聚糖在给药后起润滑剂的作用或防止软骨丢失。在另一个实施方案中,合成肽聚糖防止患者的骨连接。例如,合成肽聚糖抑制软骨减少或软骨受损的患者的骨-骨连接。在一个实施方案中,提供降低或防止患者的ECM组分降解的方法。例如,提供降低或防止患者软骨中的ECM组分降解的方法。该方法包括给予患者结合透明质酸的合成肽聚糖。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在一个实施方案中,合成肽聚糖对基质金属蛋白酶(例如聚集蛋白聚糖酶)有抗性。在另一个实施方案中,提供降低或防止患者的透明质酸降解的方法。该方法包括给予患者结合透明质酸的合成肽聚糖。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在另一个实施方案中,提供降低或防止胶原降解的方法。该方法包括在胶原存在下使结合透明质酸的合成肽聚糖与透明质酸接触并降低或防止胶原降解的步骤。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在另一个实施方案中,提供降低或防止硫酸软骨素降解的方法。该方法包括在胶原存在下使结合透明质酸的合成肽聚糖与透明质酸接触并降低或防止硫酸软骨素降解的步骤。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。“降低”ECM组分降解(例如透明质酸、胶原或硫酸软骨素降解)意指分别完全或部分降低透明质酸、胶原或硫酸软骨素的降解。在一个实施方案中,降低患者的透明质酸降解意指降低透明质酸降解的速率。例如,描述于本申请实施例部分的图8显示在加入合成肽聚糖时,透明质酸和结合透明质酸的合成肽聚糖的混合物的透明质酸降解的速率显著降低。在一个实施方案中,降低胶原降解意指降低胶原降解的速率。例如,描述于本申请实施例部分的图10显示在透明质酸和结合透明质酸的合成肽聚糖存在下,在加入合成肽聚糖时胶原降解的速率显著降低。在一个实施方案中,降低硫酸软骨素降解意指降低硫酸软骨素降解的速率。例如,描述于本申请实施例部分的图11显示在结合透明质酸的合成肽聚糖存在下,在加入合成肽聚糖时硫酸软骨素降解的速率显著降低。在本文描述的一个实施方案中,提供用于纠正或改正患者的组织缺陷的方法。该方法包括将透明质酸和结合透明质酸的合成肽聚糖给予组织缺陷中,其中所述缺陷被纠正或改正。结合透明质酸的合成肽聚糖的前述实施方案适用于本文所述方法。在一个实施方案中,组织缺陷是外观缺陷。下列实施方案适用于本文所述方法,其中将结合透明质酸的合成肽聚糖给予患者。在各种实施方案中,结合透明质酸的合成肽聚糖可被注射或植入(例如掺入软骨修复组合物或装置中)。在本文描述的一些实施方案中,注射为关节内注射。在本文描述的另一个实施方案中,注射为注射到患者的关节囊中。在其它实施方案中,注射为皮下注射,如在皮肤填充剂的情况下。用于注射的合适手段包括针(包括显微操作针)、注射器或输注装置。在一个说明性实施方案中,与结合透明质酸的合成肽聚糖一起使用给予患者的药物制剂包含:a)药学活性量的结合透明质酸的合成肽聚糖;b)药学上可接受的pH缓冲剂以提供约pH4.5-约pH9范围的pH;c)约0-约300毫摩尔浓度范围的离子强度调节剂;和d)约0.25%-约10%总配方或任何个别组分a)、b)、c)或d)或者a)、b)、c)和d)的任何组合的浓度范围内的水溶性粘度调节剂。在本文描述的各种实施方案中,pH缓冲剂是技术人员已知的那些缓冲剂,包括例如乙酸盐、硼酸盐、碳酸盐、柠檬酸盐和磷酸盐缓冲剂以及盐酸、氢氧化钠、氧化镁、磷酸一钾、碳酸氢盐、氨、碳酸、盐酸、柠檬酸钠、柠檬酸、乙酸、磷酸氢二钠、硼砂、硼酸、氢氧化钠、二乙基巴比土酸和蛋白质,以及各种生物缓冲剂,例如TAPS、Bicine、Tris、Tricine、HEPES、TES、MOPS、PIPES、二甲胂酸盐或MES。在本文描述的各种实施方案中,离子强度调节剂包括本领域已知的那些离子强度调节剂,例如甘油、丙二醇、甘露糖醇、葡萄糖、右旋糖、山梨糖醇、氯化钠、氯化钾和其它电解质。有益粘度调节剂包括但不限于离子和非离子水溶性聚合物;交联丙烯酸聚合物,例如聚合物的“卡波姆”家族,例如可以Carbopol®商标市购获得的羧基聚亚烷基;亲水聚合物,例如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;纤维素类聚合物和纤维素类聚合物衍生物,例如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、甲基纤维素、羧甲基纤维素和醚化纤维素;树胶例如西黄蓍胶和黄原胶;藻酸钠;明胶、透明质酸及其盐、脱乙酰壳多糖、吉兰糖(gellan)或其任何组合。通常使用非酸性粘度增强剂(例如中性或碱性剂),以利于实现制剂所需的pH。在本文描述的各种实施方案中,注射用制剂可适宜配制为无菌非水性溶液剂或为干燥形式(例如冻干形式)以与合适的溶媒(例如无菌无热原水)联用。可采用本领域技术人员熟知的标准制药技术,容易地实现在无菌条件下(例如通过冻干)的注射用制剂的制备。在一个实施方案中,通过加入结合透明质酸的合成肽聚糖,增加含有透明质酸的溶液的粘度。在本文描述的各种实施方案中,可通过采用合适的配制技术,例如掺入提高溶解度的组成成分例如甘露糖醇、乙醇、甘油、聚二乙醇、丙二醇、泊洛沙姆(poloxomer)和本领域技术人员已知的其它组成成分,来提高用于制备通过注射给予的制剂的结合透明质酸的合成肽聚糖的溶解度。在本文描述的各种实施方案中,可配制通过注射给予的制剂以用于即时释放和/或改良释放。改良释放制剂包括延时、持续、脉冲、受控、靶向和程序化释放制剂。因此,结合透明质酸的合成肽聚糖可配制成固体、半固体或触变性液体以作为提供活性化合物改良释放的植入贮库制剂而给予。这类制剂的说明性实例包括涂药支架和共聚合dl-乳酸乙醇酸(PGLA)微球体。在另一个实施方案中,适当时,可连续给予结合透明质酸的合成肽聚糖或包含结合透明质酸的合成肽聚糖的组合物。在本文描述的任何实施方案中,结合透明质酸的合成肽聚糖可以单独给予或与合适的药用载体或稀释剂组合给予。可选择用于结合透明质酸的合成肽聚糖制剂的稀释剂或载体成分使得它们不会减弱所需的结合透明质酸的合成肽聚糖的效果。结合透明质酸的合成肽聚糖制剂可呈任何合适形式。合适剂型的实例包括结合透明质酸的合成肽聚糖的水性溶液剂,例如等渗盐水、5%葡萄糖或其它众所周知的药学上可接受的液体载体(例如醇、二醇、酯和酰胺)中的溶液剂。可通过标准方法,例如通过在实验室动物模型或临床试验中确立剂量反应曲线,来确定结合透明质酸的合成肽聚糖的合适剂量。在本文描述的各种实施方案中,结合透明质酸的合成肽聚糖的剂量可随患者状况、待治疗的疾病状态、给药途径和组织分布和其它治疗性治疗共同使用的可能性而显著变化。作为说明,结合透明质酸的合成肽聚糖的合适剂量(以单次推注或在一定时间内给予)包括约1ng/kg-约10mg/kg、约100ng/kg-约1mg/kg、约1μg/kg-约500μg/kg或约100μg/kg-约400μg/kg。在这些实施方案的每个中,剂量/kg是指每千克患者质量或体重的剂量。在其它说明性方面,有效剂量的范围可为约0.01μg-约1000mg/剂、约1μg-约100mg/剂或约100μg-约50mg/剂或约500μg-约10mg/剂或约1mg-10mg/剂或约1-约100mg/剂或约1mg-5000mg/剂或约1mg-3000mg/剂或约100mg-3000mg/剂或约1000mg-3000mg/剂。在一个实施方案中,结合透明质酸的合成肽聚糖的合适剂量包括以下范围的浓度:约0.01uM-约100uM、约0.05-约100uM、约0.1uM-约100uM、约0.1uM-约50uM、约0.1uM-约20uM、约0.1uM-约10uM、约0.5uM-约10uM、约0.5uM-约50uM和约0.5uM-约100uM。在另一个实施方案中,结合透明质酸的合成肽聚糖的合适剂量包括以下浓度:约0.01uM、0.1uM、0.2uM、0.5uM、1uM、2uM、5uM、10uM、20uM、50uM和100uM。结合透明质酸的合成肽聚糖可在赋形剂中配制。在本文描述的任何实施方案中,赋形剂可具有约0.4mg/ml-约6mg/ml范围的浓度。在各种实施方案中,赋形剂浓度的范围可为约0.5mg/ml-约10mg/ml、约0.1mg/ml-约6mg/ml、约0.5mg/ml-约3mg/ml、约1mg/ml-约3mg/ml、约0.01mg/ml-约10mg/ml和约2mg/ml-约4mg/ml。在其中结合透明质酸的合成肽聚糖作为软骨修复组合物或装置的部分(例如用于植入的凝胶)植入的实施方案中,可以使用上述任何合适的制剂。可以采用用于给予结合透明质酸的合成肽聚糖的任何有效方案。例如,结合透明质酸的合成肽聚糖可作为单剂量或作为多剂量每日方案给予。此外,交错方案,例如每周1-5天可用作每日治疗的备选方式。在本文描述的各种实施方案中,患者用结合透明质酸的合成肽聚糖的多次注射治疗。在一个实施方案中,用结合透明质酸的合成肽聚糖给患者注射多次(例如约2直到约50次),例如以12-72小时间隔或以48-72小时间隔。可以最初注射后数天或数月的间隔,给予患者另外的结合透明质酸的合成肽聚糖注射。在本文所述任何实施方案中,要了解,在肽部分、聚糖部分或两者中不同的两种或更多种结合透明质酸的合成肽聚糖的组合可用来替换单个的结合透明质酸的合成肽聚糖。还要认识到,在前述实施方案中,化合物、组合物和方法的某些方面呈现在列表的备选中,例如,作为说明,G和P的任一种或多种的选择。因此要了解,本发明的各种备选实施方案包括所述列表中的各个成员,以及所述列表中的各种亚组。所述组合的每一种要理解为本文通过列表予以描述。在下面的说明性实施例中,术语“聚集蛋白聚糖模制物”和“模拟物”与术语“结合透明质酸的合成肽聚糖”作为同义词使用。实施例1肽合成采用Symphony肽合成仪(ProteinTechnologies,Tucson,AZ),利用Knorr树脂上的FMOC方案,合成所有的肽。粗制肽用TFA从树脂上释放出来,并且使用Grace-Vydac218TPC-18反相柱和水/乙腈0.1%TFA的梯度,在AKTAexplorer(GEHealthcare,Piscataway,NJ)上通过反相层析法纯化。在从树脂上释放之前,通过增加与丹酰基-Gly(Sigma)的额外偶联步骤,制备丹酰基修饰肽。肽结构通过质谱法证实。如上所述制备下列肽:GAHWQFNALTVRGGGC(SEQIDNO:35)、KQKIKHVVKLKGC(SEQIDNO:56)和KLKSQLVKRKGC(SEQIDNO:57)。实施例2硫酸软骨素官能化和合成肽聚糖形成产生聚集蛋白聚糖模拟物(即GAH)的反应示意图可参见图1。使用过碘酸钠(ThermoScientific,Waltham,MA)以氧化CS,来实现硫酸软骨素(CS)(Sigma,St.Louis,MO)的官能化。通过改变反应持续时间和过碘酸钠浓度,控制通过氧化反应产生的醛基的数目,数值见表2。表2详述了获得所需醛数目/CS链的过碘酸钠浓度和反应持续时间。通过逐步的化学反应(图1所示的示意图),假定每CS链所连接的BMPH的数目等于所产生的醛的数目和所连接的透明质酸(HA)结合肽的数目。根据过碘酸钠的反应持续时间和浓度,肽的数目(平均值)/CS链见表2。表2过碘酸钠浓度(mM)反应持续时间(小时)醛数目/CS链1024320247.230248.520489304810.5对于所有氧化反应,以20mg/mL保持CS浓度恒定。在0.1M乙酸钠缓冲液(pH5.5)中,使测定量的CS和过碘酸钠反应并避光达规定的一段时间。使用ÄKTAPurifierFPLC(GEHealthcare,Piscataway,NJ),通过用填充聚丙烯酰胺珠(Bio-RadLaboratories,Hercules,CA)的Bio-ScaleMiniBio-Gel柱进行凝胶过滤层析法,以除去过碘酸钠,来完成反应。用于脱盐过程的运行缓冲液为1x磷酸缓冲盐水(PBS,pH7.4,Invitrogen,Carlsbad,CA)。使50M过量的N-[β-马来酰亚胺丙酸]酰肼三氟乙酸盐(BMPH,Pierce,Rockford,IL)与含脱盐的氧化CS的1xPBS反应。BMPH的酰肼端起反应,通过新产生的醛与官能化CS共价连接,形成席夫碱中间体。将氰基硼氢化钠(5M,Pierce)加入反应中以还原席夫碱中间体亚胺至更稳定的胺。通过在去离子水中的FPLC脱盐,从溶液中除去过量的BMPH。由于ÄKTAPurifierFPLC的吸光度检测能力,因此测量过量BMPH的量。小尺寸和低分子量的BMPH(297.19g/mol)导致其在单独的晚得多的时间点上从柱上洗脱。由于其多个单键和偶尔双键的存在,BMPH在215nm波长(单键的特性)和254nm波长(双键的特性)两者处产生强的吸收光谱。因此,绘制标准曲线,使已知的BMPH质量与215nm吸收光谱的积分面积关联,图2。以此标准曲线,测定过量BMPH的质量。从原始反应质量减去过量BMPH质量可供确定在反应中消耗的BMPH的质量。利用消耗的质量,计算与氧化CS结合的BMPH的数目。将收集的CS-BMPH产物冷冻、冻干并保存在-80°摄氏温度下。通过Mummert鉴定HA结合肽序列。对鉴定出的序列作略微修饰产生用于该研究的特定HA结合序列GAHWQFNALTVRGGGC(SEQIDNO:35)(注释为GAH)。该肽由Genscript(Piscataway,NJ)生产并购自Genscript。包括半胱氨酸氨基酸以供通过硫醚键形成与BMPH的马来酰亚胺基团偶联。该反应以1:1比例进行,以假定与官能化CS结合的BMPH的数目将等于所连接的GAH肽的数目的假设。将以相对于每链所偶联的BMPH的数目1摩尔过量的GAH肽溶于二甲亚砜(DMSO,Sigma)中,并且以15分钟间隔,一次四分之一的体积加入CS-BMPH溶液中。在最后一次加入GAH肽后,使反应进行2小时。在这段时间内,过量GAH肽形成颗粒。在纯化溶液以获得GAH官能化CS之前,使溶液通过Acrodisc0.8µm孔径过滤器(Pall,PortWashington,NY)以除去过量肽颗粒。然后用去离子水使溶液通过ÄKTAPurifierFPLC以纯化GAH-CS化合物。然后将所收集的化合物冷冻在-80°摄氏温度下,并冻干,产生所需聚集蛋白聚糖模拟物。根据实验室惯例,将聚集蛋白聚糖模拟物命名为(所连接的肽的数目)(肽序列的头3个字母)-(被官能化的GAG缩写),即对于聚集蛋白聚糖模拟物,3GAH-CS表示官能化至硫酸软骨素GAG骨架的3GAHHA结合肽。实施例3合成肽聚糖与透明质酸的结合合成肽聚糖与固定化透明质酸结合将透明质酸(HA,来自马链球菌(Streptococcusequi),Sigma)以4mg/mL的浓度在4℃下固定至96孔板(Costar,blk/clr,Corning,Corning,NewYork)过夜。将生物素标记的GAH肽以1个生物素-GAH/CS链的浓度通过BMPH与官能化CS结合。未标记的GAH肽与CS的其余未反应的醛结合。利用标准生物素-链霉抗生物素检测方法测定聚集蛋白聚糖模拟物与固定化HA结合的程度。HA表面的封闭用含1%牛血清白蛋白(BSA,SeraCareLifeSciences,Milford,MA)的1xPBS溶液进行1小时。在用1xPBS洗涤后,将生物素标记的聚集蛋白聚糖模拟物在孔中温育30分钟,然后用1xPBS洗涤。将链霉抗生物素-辣根过氧化物酶(R&DSystems,Minneapolis,MN)溶液加入各孔中,允许反应20分钟。在反应完成和洗涤后,加入色原溶液(SubstrateReagentPack,R&DSystems),并显色15分钟。在15分钟时,将硫酸(Sigma)直接加入各孔中以终止反应。然后将孔板在M5SpectraMax读板仪(MolecularDevices,Sunnyvale,CA)上在450和540nm波长处读数。通过减去所产生的2个吸光度读数,确定由结合的生物素标记的聚集蛋白聚糖模拟物产生的吸光度。1个GAH肽/聚集蛋白聚糖模拟物用生物素标记的GAH肽置换,将现标记的聚集蛋白聚糖模拟物与固定化HA一起温育。市售可获得的生物素检测产品(通过链霉抗生物素和HRP)表明模拟物与固定化HA结合的程度(见图3)。以1µM的浓度开始,在固定化HA存在下,聚集蛋白聚糖模拟物具有剂量依赖性增加,证实了模拟物与HA结合。然而,不进行模拟物的结合亲和力的测定,因为固定化的HA的量不确定。流变仪得到的合成肽聚糖与透明质酸的结合制备HA溶液以测试聚集蛋白聚糖模拟物在更加生理相关的情况下与HA结合的能力。通过溶液储能模量的改进来推断聚集蛋白聚糖模拟物与HA结合的能力,表明HA被模拟物交联。在1xPBSpH7.4中建立多个处理以测试聚集蛋白聚糖模拟物结合HA的能力:2.5wt%HA对照、CS:HA摩尔比为25:1的HA+CS、25:1的HA+3GAH-CS、25:1的HA+7.2GAH-CS、25:1的HA+10.5GAH-CS。使用AR-G2流变仪(TAInstruments,NewCastle,DE),进行频率(0.1–100Hz,2.512Pa)和应力(0.1–100Pa,1.0Hz)扫描以测量各溶液的储能模量。流变学研究物质在响应外加力时的流动,并且在测量粘弹性材料时常常使用。具体地说,流变仪根据对于外加力的物质反馈测定储能模量和损耗模量。储能模量是被物质弹性吸收的能量的量的度量,而损耗模量描述通过热而丧失的能量的量。大的储能模量表明具有更大刚性的弹性结构的凝胶样物质;而小的储能模量和大的损耗模量表明不会弹性保持外加负荷的粘性材料。高分子量HA(约1.5MDa)是极粘性的材料,其因通过HA链缠结所形成的假凝胶所致,弹性地保持一部分外加负荷。所产生的聚集蛋白聚糖模拟物含有多种HA结合肽,其可充当承担模拟物与HA适当结合的HA链交联剂类型。在含高分子量HA的溶液中,假设聚集蛋白聚糖模拟物可增加溶液的刚性,产生较大的储能模量。较大的储能模量可表明大量HA交联,证实了混合物中存在的聚集蛋白聚糖模拟物和HA链之间有强的结合亲和力。测定了聚集蛋白聚糖模拟物的多种形式,其差别在于每官能化CS链所连接的GAH肽的数目(平均为3、7.2或10.5)。图4中所示实验的结果表明,加入CS显著(α=0.05)降低HA溶液的储能模量。加入与CS有关的密集负电荷有助于展开HA链,放松HA缠结的程度,并除去储存外加能量的假凝胶。证实了这样的假设,随着每CS的GAH肽数目从3增加到10.5,混合物的储能模量也增加。这种增加可归因于每聚集蛋白聚糖模拟物具有较高的GAH肽数目的两个有益属性。第一,每CS连接的GAH肽越多,模拟物的亲合力越高,导致模拟物与HA分子较强的结合。第二,每CS连接的GAH肽越多,模拟物作为HA分子之间的交联剂起作用的可能性越大。两种作用促成更多的凝胶样混合物,导致所测量的储能模量更大。模拟物和HA间较弱的结合不能恢复假凝胶,并且不能够储存来自流变仪的外加能量。储能模量的增加证实了图3所示模拟物与固定化HA的强结合。特别在10.5GAH肽/CS链下,储能模量显著(α=0.05)高于HA+CS对照,达到与HA对照类似的储能模量。实施例4合成肽聚糖压缩研究胶原凝胶形成和浊度为了模拟天然软骨胞外基质,利用胶原将HA和聚集蛋白聚糖模拟物聚集体俘获在天然支架内。胶原II型(CII)获自两个不同的商业来源(Affymetrix,SantaClara,CA和Sigma)。根据天然组分分解,在TES缓冲液(60mMTES、20mMNa2HPO4、0.56MNaCl,化学品来自Sigma)pH7.6中制备软骨ECM组分的混合物,其中CII构成70干重%,HA和聚集蛋白聚糖模拟物/CS对照的组合形成混合物的其余30干重%。凝胶中CII的终浓度为2mg/mL。样品由CII对照、CII+HA+CS对照和CII+HA+聚集蛋白聚糖模拟物(10.5GAH-CS)组成。为了防止过早的原纤维生成和凝胶形成,将溶液在酸性pH下保持在冰上。将组分的溶液混合物放入384孔板(Greinierblk/clr,Monroe,NC)中,置于37℃和生理pH下以开始原纤维生成,在M5SpectraMax中以313nm进行监测以确定凝胶形成。当用不同处理包括CII时,CII不能够形成凝胶(参见补充资料)。因此,胶原I型(CI,高浓度大鼠尾胶原1型,BDBiosciences,Bedford,MA)被用于凝胶形成。对于CI,使用相同的处理和程序,只是组分质量变为4mg/mL的CI终浓度。对于下列所有实验均使用CI。进行用CI的浊度测定,以测量软骨重复(replicate)的形成,结果见图5。如所证实的,加入HA+10.5GAH-CS不影响胶原纤维的原纤维生成。所有处理都遵循类似的曲线,并在大致相同的时间达到类似的吸光度峰值。HA+10.5GAH-CS处理具有较高的初始吸光度,这是由于聚集蛋白聚糖模拟物在1xPBS溶液中趋向形成自我聚集体,而不是由于过早的CI原纤维形成。在最初的HA流变仪试验期间认识到10.5GAH-CS的聚集,但所述聚集不抑制聚集蛋白聚糖模拟物与HA结合的能力。胶原凝胶性能测试采用20毫米平行板几何结构(parallelplategeometry)(TAInstruments),使用AR-G2流变仪,进行基于胶原的凝胶压缩试验和频率扫描。375µL凝胶混合物在冰上制备,并移取至流变仪基板。将几何结构降低至1mm的间隙距离(gapdistance),并将溶液加热至37℃。利用湿度收集器防止凝胶脱水,同时允许混合物在2小时内胶凝。通过从浊度数据到胶凝数据所显示的时间,来确定该2小时数值。在2小时时间后,压缩或振荡凝胶,这取决于试验。压缩试验以每秒1%(10µm)的工程应变速率进行。测量几何顶部(geometryhead)的间隙距离和法向力。频率扫描测量了在频率以10为底的对数从0.1增加至1Hz期间所产生的凝胶的储能模量。对于各处理,测量了同时的法向力和位移,并计算工程应力和应变。如图6所示,包括聚集蛋白聚糖模拟物显著(α=0.05)增加凝胶复合体的耐压强度。胶原+HA+AGG模拟物的峰值工程应力在9%的工程应变时达到7.5kPa,而胶原+HA+CS对照在4%时达到4.8kPa的峰值,胶原对照在15%应变时达到4.2kPa的峰值。两个因素促使CI+HA+10.5凝胶的耐压强度增加,第一是模拟物吸水的能力,第二是聚集蛋白聚糖模拟物的HA交联能力。在天然软骨中,由HA和CS提供的俘获负电荷的优势吸引水分,并延迟其从软骨中扩散。当将压缩力施于软骨时,水不能够向外扩散进入滑液囊中。保持这种不可压缩的水增加结构的耐压强度。类似地,在所测试的凝胶复合体中,在凝胶中包括与CS相关的负电荷提供相同的吸引。如图6中可见,CS和10.5GAH-CS处理两者都具有增加的耐压强度。CS处理不固定在CI复合体内(它不与HA结合),因此在少量压缩变形后,CS及其吸引的水从复合体中扩散进入周围的流体中。CS和水从复合体的扩散降低复合体的耐压强度,使所得凝胶的压缩特征类似于胶原支架对照的压缩特征。相比之下,10.5GAH-CS与交织的HA结合。因此,需要高得多的压缩应力来克服模拟物与HA的结合并引起CS和所吸引的水从复合体中扩散。其次,聚集蛋白聚糖模拟物用作HA交联剂的能力导致HA和模拟物的较高程度的俘获。实际上,HA交联性质在胶原复合体内产生大的聚集体,这与天然聚集蛋白聚糖/HA聚集体类似。聚集蛋白聚糖模拟物和天然聚集蛋白聚糖间的主要差异是分子的大小。仅聚集蛋白聚糖的蛋白质骨架重达约220kDa,而聚集蛋白聚糖模拟物整体仅重约30kDa。因此,具有超过100个与HA结合的聚集蛋白聚糖分子的天然聚集体复合体,产生比聚集蛋白聚糖模拟物可产生的大得多的聚集体。然而,通过用作HA链间的交联剂,聚集蛋白聚糖模拟物可产生其自身的聚集体形式,这也描述了天然聚集体的主要特性:体积大的带负电荷的结构。将剪切负荷通过流变试验施于上述CI凝胶中,对聚集蛋白聚糖模拟物作为HA交联剂的作用进行了进一步研究。这些实验的结果可见于图7。包括10.5GAH-CS显著(α=0.05)增加所形成的凝胶的储能模量。通过模拟物与HA结合所产生的网络补充了CI基质的已有刚性,使得通过剪切负荷所施加的能量的弹性吸光度增加。该研究是重要的,因为它验证了10.5GAH-CS的交联能力和替代聚集体形式的产生。实施例5合成肽聚糖对透明质酸降解的防护使用AR-G2测定了HA溶液的动态粘度值。高分子量HA溶液具有高粘度,这是由于长链长度导致的大量链缠结所致。透明质酸酶(II型,来自SheepTestes,Sigma)切割HA链,产生具有较少缠结的较短的链。较短的HA链将具有可测量的较低粘度。将HA溶液与100单位/mL透明质酸酶一起温育。使用具有恒定角频率和振荡应力的时基扫描,最初及在2和4小时时间点测定动态粘度。样品(以0.5wt%HA)由HA、HA+CS和HA+10.5GAH-CS组成。以75:1处理:HA摩尔比加入处理值。通过将所测粘度减初始粘度的差除以初始粘度,来计算各测量的百分比降解。Pratta等人和Little等人的研究已表明聚集蛋白聚糖在防止软骨组分降解中的重要性。骨关节炎中软骨基质的破坏始于聚集蛋白聚糖蛋白聚糖的切割。除去蛋白聚糖的富含GAG的区域使其余组分CII和HA暴露于降解酶中。认识到聚集蛋白聚糖在防止降解中的重要性,进行了研究以测定聚集蛋白聚糖模拟物在防止HA降解中的能力。HA溶液的粘度依赖于HA链的大小。因缠结所致,较大的HA链会产生较高的粘度。当暴露于透明质酸酶中时,HA链被切成较小单位。因此,HA的大小和HA缠结的量降低。这种降低促使所测粘度的类似降低。在透明质酸酶存在下,HA溶液的粘度的百分比变化将提供关于HA已进行降解的量的关键信息。图8表示HA对照相对于相关处理的百分比降解。正如所见,AGG模拟物GAH显著降低HA的降解速率,这就表明了在其对ECM组分的保护中起类似于天然AGG的作用。初始测量了无透明质酸酶(TES缓冲液替换透明质酸酶体积)的各个处理的粘度,并用作百分比降解计算的基线。0小时时间点包括加入透明质酸酶,混合溶液,移取到流变仪中,并开始机器的平衡运行。因此,0小时时间点出现在加入透明质酸酶后约2分钟。高浓度的透明质酸酶(25单位/mL)被用于模拟最差可能情况。另外,HA分子被分散于溶液中,而非紧紧交织入胶原网络中。正如图8所见,在0小时时间点,HA对照和HA+CS处理两者具有几乎完全降解的HA溶液。相比之下,加入10.5GAH-CS显著(α=0.05)降低HA降解的量。实际上,10.5GAH-CS的存在增加粘度高于基线值。认为加入透明质酸酶切割一些过量的HA。这允许10.5GAH-CS更好地交联剩余的完整链,产生更致密的凝胶,所述凝胶产生更大的粘度。在2小时时间点,HA对照和HA+CS两者几乎完全降解,其百分比降解高于90%,但具有10.5GAH-CS的HA溶液具有显著(α=0.05)较低的百分比降解。最后,在4小时时间点,所有处理都已降解,其百分比降解均高于90%。在3个时间点中,10.5GAH-CS不能够完全防止HA降解,但与HA对照和HA+CS的降解相比,大大降低降解速率。这种降低的速率表明,10.5GAH-CS防止HA链的降解。认为这种防止通过竞争抑制HA链上的透明质酸酶切割点实现。模拟物与HA链的非共价结合,加上HA链的逐步降解速率似乎证实了这种理念。另外,10.5GAH-CS溶液的降解速率仍被认为是人为升高的。模拟物在HA溶液中温育时,形成了HA+10.5GAH-CS聚集体。然而,这些聚集体不均匀地扩散到整个溶液体积中。因此,在进行测量前,类似于其它样品,将这些溶液混合。溶液的混合破坏聚集体,移出10.5GAH-CS,并暴露出透明质酸酶切割点。甚至在4小时时间点后,当据推测发生完全降解时,仍发生HA+10.5GAH-CS的大量聚集。在致密基质(像软骨的ECM)中,有可能10.5GAH-CS不仅仅会显著降低降解速率,而且还抑制HA降解。实施例6低温扫描电子显微镜术(CryoScanningElectronMicroscopy,SEM)如浊度测量所述,在SEM板于37℃过夜形成基于ECM的构建体。将SEM板固定到夹具上,并投入液氮浆(liquidnitrogenslush)中。在转移到GatanAlto2500预真空室(pre-chamber)中时,对样品抽真空。在室内,冷却至-170℃,使用冷却的解剖刀在样品上产生随意的断裂表面。在-85℃下使样品升华15分钟,接着用铂溅射涂布120秒。在溅射涂布后,将样品移至显微镜载物台,在-130℃下拍摄图像。以10,000x的放大倍数获得代表性图像,如图9所示。图片A显示CI对照,其特征在于主要原纤维间广泛交联和相对小的基质孔尺寸。图片B显示CI+HA+CS,含有广泛交联,但由于存在大的HA链而具有较大的孔尺寸。图片C显示CI+HA+10.5GAH-CS,说明了除非常大的孔尺寸外显著较小程度的交联。AGG模拟物可与HA结合,产生妨碍CI交联的相对大的笨重的复合体。如在代表性图像中可定性的,加入HA+CS对胶原原纤维直径的变化没有作用,但HA+CS样品的确具有较大的代表性空隙空间。与对照组相比,加入具有HA的AGG模拟物由于有限数量的小原纤维直径而产生较小的胶原原纤维直径的变化,并且样品的空隙空间总体增加。AGG模拟物与HA分子的结合产生被俘获在胶原支架内的聚集体复合体,并且因位阻所致在较大原纤维间排除较小的原纤维形成。实施例7胶原保护如前所述,在8孔分室的载玻片中产生仅含有胶原、含有胶原+HA+CS或含有胶原+HA+10.5GAH-CS的基于ECM的构建体。最终样品体积为200µL,由0.8mg的胶原I型组成。按照生产商说明书详述的方案,激活浓度为0.133mg/mL的基质金属蛋白酶-I(MMP-I,R&DSystems,Minneapolis,MN)。简单地说,将已溶于生产商的缓冲液(50mMTris,10mMCaCl2,150mMNaCl,0.05%Brij-35,pH7.5)中的MMP-1与等体积的25mMAPMA(Sigma)在DMSO中于37℃混合2小时以激活该酶。激活后,将MMP-1溶液在水中稀释2倍,并作为100µL上清液加入样品中。在轻轻振荡的同时,使样品在37℃下温育。在加入初始酶溶液后25小时,除去上清液,用一批新的酶更换。在与酶温育总共50小时后,从分室的载玻片中取出剩余凝胶,用去离子水洗涤以除去任何酶溶液或降解产物,并重新溶于12MHCl中。将样品用水稀释以达到6MHCl的终浓度,在110℃下水解过夜。水解后,按照Reddy等人开发的方案(ClinBiochem,1996,29:225-9),分析羟脯氨酸(hyp)的量。简单地说,将水解样品在室温下用CholramineT溶液(0.56M)温育25分钟,然后加入Elrich试剂,随后在65℃下载绿体显色20分钟。在载绿体显色后,在分光光度计以550nm的波长对样品读数。将吸光度读数与获自已知胶原浓度的吸光度读数进行比较,以测定各样品中剩余胶原的量。用0.8mg的CI构建各重复样品,并且在降解后,用Reddy等人开发的方案测定CI的剩余量,并将其换算成根据一组CI标准物的CI量。从初始CI中减去剩余CI,除去初始CI,再乘以100,求出百分比降解。3种处理的百分比降解见图10。所有处理彼此显著不同(p<0.05)。具体地说,AGG模拟物样品的百分比降解(CI+HA+10.5GAH-CS=41.0%)比其它2种处理(CI=64.5%和CI+HA+CS=74.7%)的显著较低(p<0.05)。AGG模拟物的存在显著降低CI降解。AGG模拟物的存在可充当降解酶的切割位点的阻碍。通过产生具有被牢牢俘获在胶原支架内的HA的大的聚集体,AGG模拟物可占据接近胶原的空间,防止酶进入降解部位。实施例8肽聚糖通过软骨基质扩散软骨移出物获自3月龄牛膝关节的承重区。从收获的软骨移出物中除去天然聚集蛋白聚糖,留下主要由II型胶原和残余GAG组成的基质。这通过用含0.5%(w/v)胰蛋白酶的HBSS于37℃处理移出物3小时来实现(图13)。在胰蛋白酶处理后,将移出物在HBSS中洗涤3次,并用20%FBS温育以使残留的胰蛋白酶活性失活。将肽聚糖以10µM浓度溶于蒸馏水中,通过在室温下每10分钟将10µL溶液放在表面上,持续1小时,以通过软骨移出物的关节面扩散(图14)。正常软骨和聚集蛋白聚糖消耗的软骨分别用1XPBS处理作为阳性和阴性对照。在扩散后,移出物用1XPBS洗涤3次,并保存在-20℃下直到进一步测定。通过将组织的中矢状切面用链霉抗生物素-辣根过氧化物酶染料染色,证实肽聚糖的扩散。链霉抗生物素染料与生物素标记的分子结合,并以褐色描绘(图15和图16)。实施例9体积压缩试验在具有能够检测0.01-50N范围的法向力的力传感器的ARG2流变仪(TAInstruments)中,进行位移受控的无侧限压缩(unconfinedcompression)。将移出物粘在疏水印制载玻片(hydrophobicprintedslide)(Tekdon)底部,在1XPBS浴中覆盖。将20mm直径不锈钢平行板几何顶部降低直到进行最初的接触。使用数字测微计(Duratool)测量移出物高度。通过逐步加载将0-30%名义应变(以5%间隔)的压缩荷载施加于移出物,所述逐步加载包括5秒的递增持续时间(即1.0%/秒的应变速率)和30秒的保持时间。根据线性拟合模型,通过利用平衡应力值(在各保持部分(holdsection)期间计算)相对于各个应变值的斜率获得压缩刚度值。对于体积压缩(bulkcompression)所测支架包括:1)正常软骨,2)聚集蛋白聚糖消耗的软骨(AD),和3)AD+mAGC(图17)。与胶原II型结合肽聚糖(mAG(II)C)相比,添加HA结合肽聚糖(mAGC)显著恢复软骨移出物的刚度至较高程度。实施例10动物模型Sprague-Dawley大鼠(250~300g)用于手术。横切髌腱、前十字韧带和后十字韧带及内侧、外侧侧副韧带。对内侧和外侧半月板进行完整半月板切除。膝关节囊用吸收性缝线修复,皮肤用4-0单丝尼龙缝合。在第4周开始,每周一次给予10μl1μmmAGC。在手术后4、6和8周,在用和不用肽聚糖治疗的Sprague-Dawley大鼠中,通过MMP-13探针(图18)表明炎症程度(图19)。Sprague-Dawley大鼠膝关节的X射线图像显示OA诱导后6周和8周的受损膝(图20,分别为图片A和图片D)、用肽聚糖治疗的受损膝(图20,分别为图片B和图片E),及骨关节炎诱导手术后6周的正常膝(图片20,图片C)。Sprague-Dawley大鼠的微CT表明OA诱导手术后6和8周新软骨的再生长。显示了OA诱导后6周和8周的受损膝(图21,分别为图片A和图片D)、肽聚糖治疗后的受损膝(图21,分别为图片B和图片E)和正常膝(图21,图片C)。实施例11试剂肽GAHWQFNALTVRGGGC(SEQIDNO:35)(GAH)购自Genscript(Piscataway,NJ)。N-[β-马来酰亚胺丙酸]酰肼三氟乙酸盐(BMPH)购自Pierce(Rockford,IL)。大鼠尾I型胶原购自BDBiosciences(Bedford,MA)。人重组白介素-1β购自Peprotech(RockyHill,NJ)。所有其它供应品购自VWR(WestChester,PA)或Sigma-Aldrich(St.Louis,MO),除非另有说明。实施例12胶原支架合成在pH为7.6的TES缓冲液(60mMTES,20mMNa2PO4,0.56MNaCl)中制备胶原支架。在其各个相应部分描述了用于机械试验和体外炎症模型研究的支架组成。所有溶液都保持在冰上,直到原纤维生成在37℃下启动。通过在37℃下将胶原溶液置于9.4特斯拉的磁体(ChemagneticsCMX400)的等中心点(isocenter)处1小时,来产生对齐的胶原支架,而类似地但在无磁性暴露的情况下,制备非对齐的凝胶。将含有胶原溶液的载玻片平行地置于磁场中,使胶原纤维朝向与载玻片底垂直的方向。然后在湿度控制的室中将凝胶保持在37℃下24小时以防止蒸发。实施例13流变力学试验在应力控制的ARG2流变仪(TAInstruments)上使用20mm直径不锈钢平行板几何顶部进行剪切和压缩试验。在20mm直径疏水印制的载玻片(Tekdon)上制备胶原支架。对于剪切试验,降低几何顶部直到在950µm的间隙高度下发生接触。进行初步的频率和应力扫描以测定线性的应力非依赖性储能模量范围。然后在0.1-2Hz的频率范围内用0.2Pa的振荡应力对所有凝胶进行频率扫描。对于压缩试验,降低几何顶部直到在1000µm的间隙高度与支架发生接触。通过逐步加载将0-30%名义应变(以5%间隔)的压缩荷载施加于胶原支架,所述逐步加载包括5秒的递增持续时间(即1.0%/秒的应变速率)和30秒的保持时间。根据线性拟合模型,通过利用平衡应力值(在各保持部分期间计算)相对于各个应变值的斜率获得压缩刚度值。用于力学试验的胶原支架组成为:1)非对齐胶原,2)对齐胶原,3)非对齐的胶原+mAGC,和4)对齐的胶原+mAGC。整体力学分析(BulkMechanicalAnalysis):不考虑纤维排列,聚集蛋白聚糖模拟物mAGC提高支架的整体力学性质(图22)。对于剪切试验,对于非对齐和对齐的胶原凝胶,0.5Hz处的储能模量值分别为104.1±3.6Pa和49.9±5.4Pa。对于非对齐和对齐的凝胶,向胶原支架中加入mAGC显示储能模量分别显著增加至113.9±4.6Pa和76.6±3.6Pa(p<0.001)。与对齐凝胶相比,非对齐凝胶显示较高的储能模量(p<0.0001)。对于压缩试验,对齐支架的压缩刚度(2478±250Pa)低于非对齐支架(3564±315Pa)(p<0.001)。向这些支架系统中加入mAGC分别增加对齐和非对齐支架的压缩刚度至4626±385Pa和5747±306Pa,(p<0.0001)。实施例14体外炎症模型接种软骨细胞的胶原支架用IL-1β刺激,并评价降解产物。软骨细胞分离:自在屠宰24小时内获自屠宰场(DutchValleyVeal)的3月龄牛膝关节收获原代软骨细胞。从股骨外侧髁削下150-200µm厚的软骨切片,在无血清DMEM/F-12培养基(50µg/mL2-磷酸抗坏血酸、100µg/mL丙酮酸钠、0.1%牛血清白蛋白、100单位/mL青霉素、100µg/mL链霉素和25mMHEPES)中洗涤3次后,用3%胎牛血清(FBS)和0.2%胶原酶-P(RochePharmaceuticals)在37℃下消化6小时。释放出的软骨细胞通过70µm细胞滤器过滤,在补充了10%FBS的上文所列培养基中以1000rpm离心3次各5分钟。将细胞沉淀重新悬浮于10%FBS补充培养基中,以10,000个细胞/mL接种到10cm培养皿中在37℃、5%CO2潮湿培养箱中直到汇合。支架制造:在达到汇合时,细胞用胰蛋白酶消化,以10,000个细胞/mL包封在胶原支架内(表3),处理前使之平衡3天。表3:体外试验的支架组成未对齐胶原实验设置对齐胶原实验设置A:胶原+CS+HA+IL-1βE:胶原+CS+HA+IL-1βB:胶原+CS+HAF:胶原+CS+HAC:胶原+mAGC+HA+IL-1βG:胶原+mAGC+HA+IL-1βD:胶原+mAGC+HAH:胶原+mAGC+HA炎症模型:在补充5%FBS和抗生素(100单位/mL青霉素和100µg/mL链霉素)的化学成分确定的培养基中,将构建体用或不用20ng/mLIL-1β温育。每两天更换培养基。将取出的培养基提取物保存在-80℃下直到进一步试验。降解测定法:通过采用二甲基亚甲蓝(DMMB)染料测定法测量细胞培养基中释放的CS来监测GAG降解,并用6-硫酸软骨素标准曲线计算。类似地,使用生产商指定方案(Bio-Color),采用Sircol胶原测定法,监测细胞培养基中的I型胶原降解。GAG和胶原降解报告为8天培养期内的累积释放。蛋白水解性降解分析:当支架包含mAGC时,释放到细胞培养基中的CS和胶原的量显著降低(图11、12、23和24)(分别为pCS<0.001和p胶原<0.02)。与非对齐的胶原纤维相比,对齐的胶原凝胶显示释放到培养基中的CS和胶原在统计学上较高(p<0.001)。如本文所述,结合透明质酸的合成肽聚糖能够保护支架中的HA和基础性胶原纤维免于蛋白水解性切割。结合透明质酸的合成肽聚糖的合成利用CS的软骨保护益处。已显示CS下调基质金属蛋白酶产生。本文描述的我们的合成肽聚糖设计允许CS链与HA连接,防止两种分子的降解。通过将合成肽聚糖置入富含蛋白水解酶的环境中,其防止ECM组分过度丢失的能力已得到证实。实施例15实时PCR在细胞培养研究后,将构建体保存在4℃下的RNAlater溶液(Ambion)中少于1周。按照生产商的方案,使用NucleospinRNAII(Clontech),提取总mRNA。从所有样品提取的mRNA使用Nanodrop2000分光光度计(ThermoScientific)定量,并使用HighCapacitycDNA反转录酶试剂盒(AppliedBiosystems),反转录为cDNA。采用具有下列引物的Taqman基因表达测定法(AppliedBiosystems)进行实时PCR:GAPDH(Bt03210913_g1)、聚集蛋白聚糖(Bt03212186_m1)和胶原II型(Bt03251861_m1)。制备60ngcDNA模板用于两种目的基因和内源基因的每20µL反应。采用TaqmanPCRMasterMix和7500实时PCR系统(AppliedBiosystems)进行实时PCR分析。使所报道的数据归一化至GAPDH基因表达。mRNA表达分析:胶原对齐、聚集蛋白聚糖模拟物的存在和用IL-1β刺激显著影响聚集蛋白聚糖(p对齐<0.001、p肽聚糖<0.02和pIL-1β<0.001)和胶原II型表达(p对齐<0.01、p肽聚糖<0.001和pIL-1β<0.015)。mAGC的存在限制CS从支架中过度丢失,这导致较低的聚集蛋白聚糖表达(p<0.02)(图25)。mAGC的存在还限制胶原降解。然而,在降解期间,胶原II型表达依赖于胶原丢失的程度(图25)。在非对齐支架中,胶原II型表达的水平高于在无mAGC的情况下制备的支架,而在对齐的胶原支架中,胶原II型的水平高于用mAGC制备的支架(p<0.05)。实施例16统计分析每个实验重复两次,各数据集至少n=3。力学试验数据的统计显著性用双因素ANOVA(用对齐和肽聚糖添加作为因素)进行分析。细胞培养数据采用三因素ANOVA(用对齐、肽聚糖添加和IL-1β处理作为因素)进行分析。事后Tukey成对比较(α=0.05)用来直接比较各系统中用或不用聚集蛋白聚糖模拟物制备的支架。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1