一种具有预防治疗肥胖作用的三萜化合物制备方法及其用途与流程
本发明涉及天然药物技术领域,具体涉及一种五加植物中分离的具有预防治疗肥胖作用的三萜化合物齐墩果酸3-o-[β-d-吡喃葡萄糖-(1→3)]-β-d-吡喃半乳糖-(1→2)-α-l-吡喃阿拉伯糖苷(glycosidest-e2)的制备方法及其用途,尤其是在制备预防肥胖作用的食品及预防治疗肥胖作用的药品、保健品方面的用途。
背景技术:
近几十年,随着生活水平不断提高,生活方式不断改变,肥胖症的发病率呈逐年增加之势,并且低龄化趋势明显。肥胖人群的快速增多造成了严重的社会和经济挑战。另外肥胖也是癌症、糖尿病、高血压、高血脂、代谢症候群等各种成人疾病的原因,所以治疗肥胖是预防很多疾病的方法。
目前,研究报道较多的减肥化药的减肥机理明确,药效研究深入,但是其具有副作用大的缺点;相对于减肥化药,中药成分复杂,研究中药减肥所用的实验模型比较简单,机理研究处于较低水平,而且对中药的活性成分研究不够深入。而本发明以中草药五加植物为原料,从中分离得到一种三萜化合物,对其从分子水平进行减肥机理的研究。五加植物的活性成分有很多生物活性,但是其减肥作用目前尚无相关研究报道。
小鼠前脂肪细胞3t3-l1是用来研究脂肪形成分子机制的模型之一。诱导前脂肪细胞3t3-l1分化进入成熟的脂肪细胞中。分化后,成熟脂肪细胞就有了细胞内脂质。这个过程就叫脂肪形成.脂肪细胞储藏过量的能量在身体中并且释放一些控制许多不同信号通路的脂肪因子。脂肪细胞的分化带来细胞表型、激素平衡和转录因子表达的改变。
在前脂肪细胞分化为脂肪细胞的过程中,pparγ和c/ebpα调控相关基因的表达,对于脂肪积聚起关键的作用。本发明通过体外培养小鼠3t3-l1前脂肪细胞,检测三萜化合物对其增殖和分化的影响,及对相关调控因子ppapγ和c/ebpα的表达变化。同时通过对ampk表达的检测,结果表明磷酸化ampk能通过抑制转录因子pparγ和c/ebpα的表达来抑制脂肪前体细胞的分化。
技术实现要素:
本发明的目的在于提供一种五加植物中具有预防治疗肥胖作用的三萜化合物glycosidest-e2及其分离制备技术方法。
本发明的化合物能通过ampk-pparγ-c/ebpα机制显著抑制脂肪形成,可以在药品、食品、保健品等领域作为一种更安全、更有效的预防治疗肥胖作用的活性成分的应用。
本发明涉及一种式1三萜化合物glycosidest-e2的制备方法,其特征在于,包括以下步骤:
(1)提取:将干燥五加植物用甲醇和/或乙醇为溶剂,在30~80℃提取1~3次,合并后减压回收溶剂后得浸膏;
(2)脱脂:步骤(1)浸膏用石油醚进行脱脂处理;
(3)提取:步骤(2)脱脂后浸膏上大孔树脂柱,用30%-100%的乙醇梯度洗脱,收集60%-95%乙醇部分,合并后回收乙醇,干燥至干膏;将干膏用硅胶拌匀,通过硅胶柱层析,用按体积比氯仿∶甲醇∶水为25-50∶1∶0、15-25∶1∶0、10-15∶1∶0、5-10∶1∶0.1梯度洗脱,其中,5-10∶1∶0.1部分再用按体积比氯仿∶甲醇∶水为5-10∶1∶0.1、4-6∶1∶0.15梯度洗脱,收集5-10∶1∶0.1部分,除去溶媒,经葡聚糖凝胶柱sephadexlh-20,以75%-100%甲醇洗脱得到式1化合物。
所述的五加为糙叶五加(acanthopanaxhenryi(oliv.)harms)、细柱五加(acanthopanaxgracilistylusw.w.smith)、吴茱萸五加(acanthopanaxevodiaefoliusfranch.)、藤五加(acanthopanaxleucorrhizus(oliv.)harms)、红毛五加(acanthopanaxgiraldiiharms)、短梗五加(acanthopanaxbrachypusharm)、柔毛五加(acanthopanaxgracilistylusw.w.smithvar.vilosulus(harms)li)、刺五加(acanthopanaxsenticosus(rupr.maxim.)harms)、无梗五加(acanthopanaxsessiliflorus(rupr.maxim)seem)、白毛五加(acanthopanaxdivaricatusvar.albeofructus)、唐五加(acanthopanaxseboldianusmakino)、岛五加(acanthopanaxkoreanum)、异柱五加(acanthopanaxsieboldianusmakino)、民家氏五加(acanthopanaxdivaricatusf.inermis)、智异山五加(acanthopanaxchiisanesis)中的一种或多种。
本发明中所述的五加优选为糙叶五加。
本发明中所述的提取方法为加热回流提取、闪式提取、超声提取、冷浸提取中的一种或多种。
本发明中所述三萜化合物glycosidest-e2能通过ampk-pparγ-c/ebpα机制显著抑制脂肪形成。
本发明中所述三萜化合物glycosidest-e2可用于制备具有预防治疗肥胖作用的药品、保健品。
本发明中所述三萜化合物glycosidest-e2可用于制备具有预防肥胖作用的食品。
在本发明中,如无特殊说明,当化合物名称与结构式存在矛盾时,以结构式为准。
本行业的技术人员也应该了解,本发明式1所述的结构式有多种命名方式,本发明仅使用其中的一个名称,使用其他名称命名的式1所述结构式的制备方法或用途,在不脱离本发明范围的前提下,都应落入要求保护的范围内。
附图说明
图1三萜化合物glycosidest-e2对细胞活性的影响
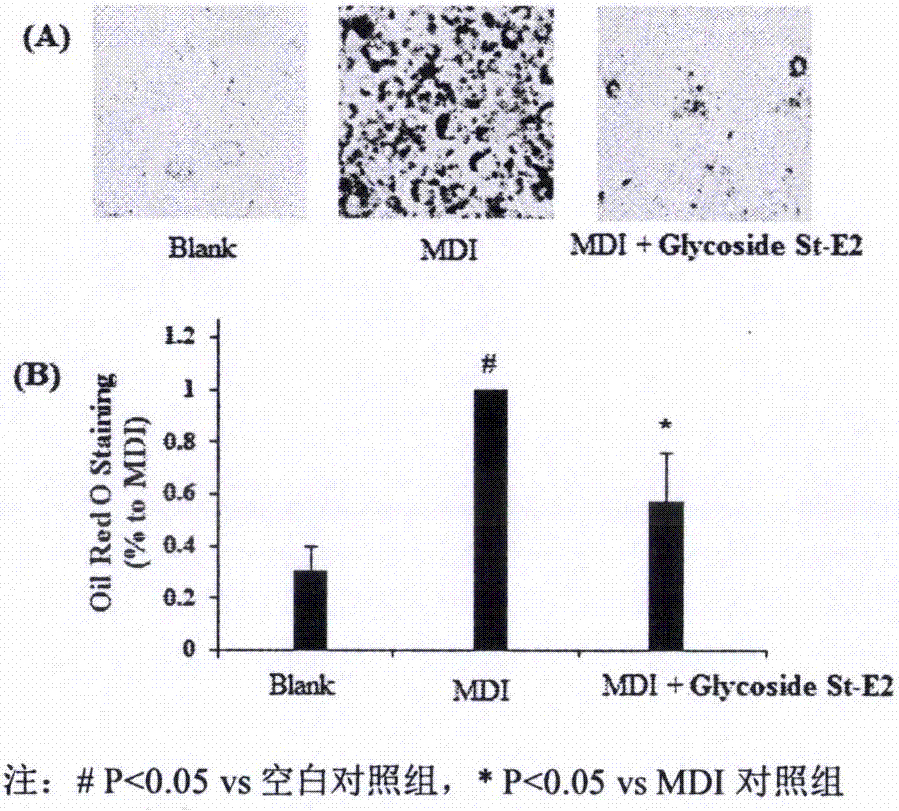
图2三萜化合物glycosidest-e2对脂肪积累的影响
图3三萜化合物glycosidest-e2对脂肪形成基因pparγ和c/ebpα的表达影响
图4三萜化合物glycosidest-e2对pparγ和c/ebpα的蛋白水平表达影响
图5三萜化合物glycosidest-e2对ampk通路的影响
具体实施方式:
结合具体实施方式对本发明作进一步说明,但本发明的内容并不仅仅限于所列举的实施方式。
实施例1
(1)提取:将干燥糙叶五加(含根、茎、叶)10kg粉碎,用100l乙醇为溶剂,在80℃下加热回流提取3次,合并后减压回收溶剂后得浸膏;
(2)脱脂:步骤(1)浸膏用石油醚进行脱脂处理;
(3)提取:步骤(2)脱脂后浸膏上d101大孔树脂柱,用30%-95%的乙醇梯度洗脱,收集80%-95%乙醇部分,合并后回收乙醇,干燥至干膏;将干膏用硅胶拌匀,通过硅胶柱层析,用按体积比氯仿∶甲醇∶水为42∶1∶0、24∶1∶0、14∶1∶0、9∶1∶0.1梯度洗脱,其中,9∶1∶0.1部分再用按体积比氯仿∶甲醇∶水为8∶1∶0.1、6∶1∶0.15梯度洗脱,收集8∶1∶0.1部分,除去溶媒,经葡聚糖凝胶柱sephadexlh-20,以85%甲醇洗脱得到式1化合物。
实施例2
(1)提取:将干燥细柱五加30kg粉碎,用200l甲醇为溶剂,在75℃加热回流提取3次,合并后减压回收溶剂后得浸膏;
(2)脱脂:步骤(1)浸膏用石油醚进行脱脂处理;
(3)提取:步骤(2)脱脂后浸膏上ab-8大孔树脂柱,用30%-100%的乙醇梯度洗脱,收集60%-95%乙醇部分,合并后回收乙醇,干燥至干膏;将干膏用硅胶拌匀,通过硅胶柱层析,用按体积比氯仿∶甲醇∶水为30∶1∶0、20∶1∶0、12∶1∶0、8∶1∶0.1梯度洗脱,其中,8∶1∶0.1部分再用按体积比氯仿∶甲醇∶水为10∶1∶0.1、5∶1∶0.15梯度洗脱,收集10∶1∶0.1部分,除去溶媒,经葡聚糖凝胶柱sephadexlh-20,以80%甲醇洗脱得到式1化合物。
实施例3
(1)提取:将干燥吴茱萸五加25kg用180l甲醇为溶剂,在78℃下加热回流提取2次,合并后减压回收溶剂后得浸膏;
(2)脱脂:步骤(1)浸膏用石油醚进行脱脂处理;
(3)提取:步骤(2)脱脂后浸膏上大孔树脂柱,用40%-100%的乙醇梯度洗脱,收集80%-95%乙醇部分,合并后回收乙醇,干燥至干膏;将干膏用硅胶拌匀,通过硅胶柱层析,用按体积比氯仿∶甲醇∶水为36∶1∶0、22∶1∶0、13∶1∶0、9∶1∶0.1梯度洗脱,其中,9∶1∶0.1部分再用按体积比氯仿∶甲醇∶水为8∶1∶0.1、4∶1∶0.15梯度洗脱,收集8∶1∶0.1部分,除去溶媒,经葡聚糖凝胶柱sephadexlh-20,以90%甲醇洗脱得到式1化合物。
实施例4
将上述实施例1~3中制备所得的glycosidest-e2进行结构鉴定,结果如下:
化合物glycosidest-e2为白色粉末,liebermmann-burchard和molish反应均为阳性,hr-esi-msm/z:935.4925[m+na]+,结合nmr图谱,分子式为c53h86o21,计算其不饱和度为11。
结构鉴定数据:1h-nmr(400mhz,pyridine-d5):δ0.85,0.97,1.00,1.03,1.13,1.30和1.34(均是3h,s,h-23,24,25,26,27,29和30),1个宽单峰烯氢信号5.28(brs,1h,h-12),3个糖的端基氢信号4.85(1h,brs,ara-h-1),5.28(1h,d,j=7.7,glu-h-1)和5.40(1h,d,j=7.8,gla-h-1),c-3次甲基质子信号3.30(1h,m,h-3);13c-nmr(100mhz,pyridine-d5):δ16.0(c-25),17.3(c-24),17.3(c-26),19.0(c-6),24.2(c-11),24.3(c-16andc-30),26.6(c-27),27.1(c-2),28.6(c-23),28.8(c-15),31.4(c-20),33.7(c-7),33.8(c-29),34.0(c-22),34.7(c-21),37.5(c-10),39.3(c-1),40.2(c-4),40.4(c-8),42.5(c-18),42.6(c-14),47.0(c-19),47.2(c-17),48.4(c-9),56.4(c-5),61.9(gla-c-6),63.1(glc-c-6),66.0(ara-c-5),69.0(ara-c-4),70.2(gla-c-4),72.0(glc-c-4),74.0(gla-c-2),75.8(gla-c-3),75.9(glc-c-2),76.8(gla-c-5),78.2(ara-c-2),78.8(glc-c-3),79.0(glc-c-5),83.5(ara-c-3),89.4(c-3),105.4(glc-c-1),105.7(gla-c-1),105.8(ara-c-1),123.1(c-12),145.3(c-13),180.6(c-28)。
实施例5
将上述实施例1~3中制备所得的glycosidest-e2进行如下药理学实验:
实验内容:
(1)细胞培养和脂肪细胞分化
将小鼠3t3-l1脂肪前体细胞,在含1%青霉素-链霉素和10%新生牛血清(nbcs)的dmem培养基中培养,温度37℃,co2含量5%。3t3-l1脂肪前体细胞在6孔培养皿中培养和分化成脂肪细胞。简言之,将3t3-l1脂肪前体细胞培养至出现细胞汇合。汇合两天后(第0天),将细胞在含25mm的葡萄糖,0.5mmibmx,1μm地塞米松(dex),1μg/ml胰岛素(mdi)和10%胎牛血清(fbs)的dmem培养基中孵化。48小时后(第2天),细胞在含10%fbs、1μg/mlmdi和不同浓度glycosidest-e2的dmem培养液中进行孵化。两天后,更换为含10%fbs、1μg/mlmdi的dmem培养液,继续培养两天(第4天到第6天)。
(2)glycosidest-e2的细胞毒性
细胞增殖情况使用细胞增殖mts试剂盒,根据生产厂商操作说明进行。小鼠3t3-l1脂肪前体细胞按5*103/孔接种于96孔板中,使用含10%nbcs的dmem培养液培养24小时,随后,更换含不同浓度glycosidest-e2(1μg/ml,5μg/ml)及10%nbcs的dmem培养液。48小时后,每孔加入20μlmts溶液,继续孵育4小时,终止培养,选择490nm波长,在versa酶标仪上测定各孔吸光度值(甲臜浓度,该浓度与活细胞数目成正比)。
(2)油红o染色实验
用红油o染色法观察细胞内脂质聚集。3t3-l1细胞用pbs缓冲液洗涤两次,然后在10%pbs-甲醛溶液中固定一小时。用60%的异丙醇冲洗后,使用0.5%油红o室温下染色30分钟,水洗4次除去多余的染料。在显微镜下观察染色细胞。随后,每孔加入3ml100%的异丙醇提取细胞中的染料。提取的染料转移到96孔板,在versa酶标仪上测定各孔500nm下的吸光度值。
(3)rna提取和pcr
使用geneallrriboex总rna提取试剂盒和qiazol溶解试剂提取3t3-l1细胞中的总rna。以提取出来的总rna为合成cdna第一链的模板,按照试剂盒描述的使用方法,使用powercdna合成试剂盒进行逆转录。用steponeplus实时荧光定量rt-pcr系统检测pcr产物,使用steponev2.1软件,以gapdh为内参,比较ct法确定pparγ和c/ebpα的相对表达水平。目标cdna扩增的上游引物和下游引物如表1所示。
表1用于mpparγ、mc/ebpα、及mgapdh的rt-pcr引物序列
(4)蛋白印记分析
收集培养和分化的细胞,用含蛋白酶抑制剂混合物(sigma,曼海姆,德国)的ripa缓冲液(50mmtris-hcl,ph7.5,0.15mnacl,1%np-40,0.1%sds,1mmdtt及1mmpmsf)置冰上裂解。总细胞裂解物于4℃下13000转/分离心20分钟除去不溶物。用bca试剂盒测定蛋白总量。westernblottingpparγ,c/ebpα,phosphoampkα,ampkα使用兔多克隆抗体一抗,辣根过氧化物酶hrp标记亲和纯化山羊抗兔igg二抗,内参gapdh使用鼠多克隆抗体一抗,辣根过氧化物酶hrp标记亲和纯化山羊抗鼠igg二抗。pvdf膜购自millipore(billerica,ma,usa),蛋白分析检测试剂购自bio-rad(hercules,ca,usa).
(5)统计分析
结果以独立实验的平均值±sd表示,统计方法用t检验。所有的统计结果用spss统计软件分析。当p<0.05时显示有显著性差异。
结果:
(1)化合物glycosidest-e2对细胞活性的影响
mts分析检测用于确定合适的试验浓度,3t3-l1细胞使用不同浓度的(1和5μg/ml)的化合物glycosidest-e2进行处理,其实验结果如图1所示。从图1可以看出,当浓度为5μg/ml时,glycosidest-e2表现出明显的细胞毒性,但为1μg/ml时,细胞存活率基本不受影响,因而后续试验采用的浓度不高于1μg/ml。
(2)化合物glycosidest-e2对脂肪积累的影响
通过油红o染色试剂盒测定化合物glycosidest-e2脂肪堆积。如图2所示,正常组基本没有脂肪,加入胰岛素后脂肪累积增多,但加入胰岛素的同时加入三萜化合物glycosidest-e2可有效抑制脂肪的形成。结果显示化合物glycosidest-e2能够抑制3t3-l1脂肪细胞中的脂肪形成。
(3)化合物glycosidest-e2对pparγ和c/ebpα表达的作用
上述结果表明,glycosidest-e2可以抑制3t3-l1脂肪细胞脂质堆积,而pparγ和c/ebpα是涉及脂肪形成的重要基因。为了探讨glycosidest-e2抑制肥胖的作用机制,化合物glycosidest-e2对pparγ和c/ebpα的mrna水平和蛋白水平的影响进行了研究。已充分分化的3t3-l1细胞在浓度分别在含0.5和1μg/mlglycosidest-e2的培养液中培养48小时,然后进行rt-pcr检测。结果显示化合物glycosidest-e2显著降低了两种脂肪形成基因pparγ和c/ebpα的表达(如图3所示),化合物glycosidest-e2也抑制了pparγ和c/ebpα的蛋白表达水平(如图4所示)。试验结果显示glycosidest-e2通过在mrna和蛋白质水平抑制pparγ和c/ebpα的表达,从而降低脂肪细胞的分化。
(4)化合物glycosidest-e2通过ampk控制脂肪形成
为了进一步研究ampk,一个pparγ和c/ebpα的上游因子,是否在脂肪细胞分化过程中被化合物glycosidest-e2激活,研究测定了磷酸化ampkα的蛋白含量。结果表明,与单纯加入胰岛素(mdi)相比,加入了glycosidest-e2的细胞中磷酸化ampkα蛋白明显增加(图5)。表明化合物glycosidest-e2能通过激活ampk抑制脂肪形成。
以上实施例显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,而不是以任何方式限制本发明的范围,在不脱离本发明范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!