一种近岸海水中大肠杆菌的检测方法与流程
本发明涉及常见菌检测技术领域,特别涉及近海岸大肠杆菌检测方法。
背景技术:
近年来,随着我国经济的高速发展和人民生活水平的不断提高,近岸海水,尤其是海水浴场成为夏季人们休闲活动的重要场所。但由于我国城市污水处理系统不够完善,很多未经处理的污水直接排入近海水域,对海水浴场的公共健康安全造成极大威胁。大肠杆菌,分类于肠杆菌科,归属于埃希氏菌属。与人类肠道疾病密切相关,在卫生学中被用作饮用水、食品、娱乐用水等粪源性污染卫生指标。同时,由于与其他肠道病原菌在外界的存活时间近似,使其成为国际上公认的卫生监测指示菌。因此,对海水中大肠杆菌的监测能够有效的评估海水浴场的公共健康安全。
然而现阶段针对大肠杆菌的检测主要为选择性培养法,分子生物学方法等,且其多为针对食品中大肠杆菌的检测方法。对于近岸海水中大肠杆菌的检测,仅有关杰等提出的基于选择性培养的检测方法。但该方法耗时长,且无法测定不可培养的大肠杆菌数量。
技术实现要素:
为了解决现有技术中的问题,本发明提供一种近岸海水中大肠杆菌的检测方法,解决现有技术中基于选择性培养基方法检测大肠杆菌耗时长,人力物力消耗大、无法定量海水中不可培养的大肠杆菌的问题。
本发明的技术方案为:一种近岸海水中大肠杆菌的检测方法,包括如下步骤:
(1)大肠杆菌DNA提取
采用抽滤系统将海水中细菌截留在微孔滤膜上,并提取膜上DNA。
(2)扩增目的片段
查阅相关文献,获得针对大肠杆菌特有的大肠杆菌碱性磷酸酶(phoA)基因设计的引物,目的片段大小约622bp,引物信息如下:
上游引物:TACAGGTGACTGCGGGCTTATC
下游引物:CTTACCGGGCAATACACTCACTA
利用菌种(阳性对照)以及海水环境样品进行PCR扩增实验。反应体系:2×PCR Master Mix 13μL、ddH2O 9μL、上游引物(8-10μM)1μL、下游引物(8-10μM)1μL、DNA 1μL。PCR程序:90-95℃预变性5或10min;90-95℃变性20-60s,55--60℃退火50-60s,65-75℃延伸40-50s,30-40个循环;65-75℃终延伸10-15min。
对PCR产物进行琼脂糖凝胶电泳检测,并切胶回收目的条带中的DNA片段。
(3)构建标准质粒模板
DNA片段经纯化后与T载体恒温连接过夜。连接结束后,利用热击法将连接获得的标准质粒导入大肠杆菌感受态中。挑取阳性克隆,提取质粒并测序检验。测序正确的质粒用于标准质粒模板使用。
(4)建立Q-PCR定量标准曲线
提取完成后测定质粒浓度,并计算质粒模板的准确拷贝数。
根据估计的海水样品病原菌浓度,选择合适的质粒模板浓度,对质粒提取液进梯度稀释并建立定量标准曲线。反应体系:2×SYBR Green QPCR Mix 10μL、ddH2O 7μL、上游引物(8-10μM)1μL、下游引物(8-10μM)1μL、样品DNA 1μL。Q-PCR程序:90-95℃预变性3-5min;90-95℃变性10-20s,55-60℃退火30-40s,64-75℃延伸30-40s,30-40个循环。反应完成后以Ct值和log拷贝数建立标准曲线。
(5)环境样品大肠杆菌数测定
采用Q-PCR技术测定大肠杆菌DNA浓度。反应体系:2×SYBR Green QPCR Mix 10μL、ddH2O 7μL、上游引物(8-10μM)1μL、下游引物(8-10μM)1μL、样品DNA 1μL。Q-PCR程序:90-95℃预变性3-5min;90-95℃变性10-20s,55-60℃退火30-40s,64-75℃延伸30-40s,30-40个循环。然后按照定量标准曲线将Ct值转换成拷贝数,从而定量环境样品中大肠杆菌的浓度。
本发明的有益效果是:与当下基于选择性培养法检测相比,本发明方法有以下优点:首先,缩短了检测时间,由原方法的10-12天,缩短为1天,在完成标准曲线的情况下仅需3-4个小时。其次,克服了原方法无法测定不可培养大肠杆菌的问题,提高了鉴别的准确度。
附图说明
图1.琼脂糖凝胶电泳图,从左到右依次是Marker d1、d2都是大肠杆菌的菌种(阳性对照)海水样品x1南浴场东浴场西浴场空白;
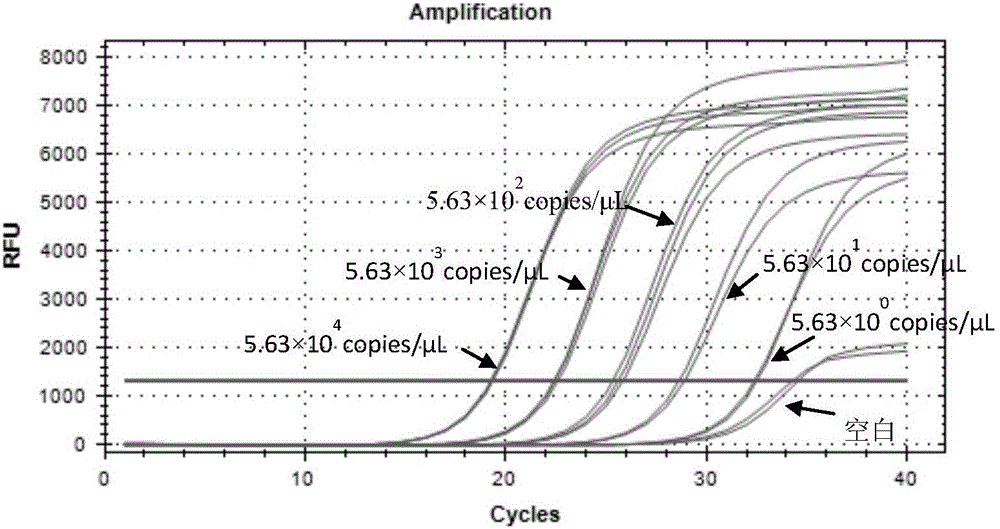
图2.5.63×100~5.63×104copies/μL范围内Q-PCR定量曲线图;
图3.Q-PCR溶解曲线图,其中溶解曲线呈现单峰,表明模板中扩增产物特异是单一产物;
图4.Q-PCR所得Ct值与log拷贝数之间的线性关系图。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
采用抽滤系统将海水中细菌截留在孔径为0.22μm的微孔滤膜上,用E.N.Z.A.TM Water DNA Kit试剂盒(Omega,USA)提取膜上DNA,具体步骤参见试剂盒说明书。
采用针对大肠杆菌特有的大肠杆菌碱性磷酸酶(phoA)基因设计的引物,目的片段大小约622bp,引物信息如下:
上游引物:TACAGGTGACTGCGGGCTTATC
下游引物:CTTACCGGGCAATACACTCACTA
利用菌种(阳性对照)以及海水环境样品进行PCR扩增实验。反应体系:2×PCR Master Mix 13μL、ddH2O 9μL、上游引物(10μM)1μL、下游引物(10μM)1μL、DNA 1μL。PCR程序:95℃预变性5min;95℃变性1min,57℃退火1min,72℃延伸40s,35个循环;72℃终延伸10min。
使用PCR仪将切胶回收的DNA片段经纯化后与PGM-18载体在16℃下恒温连接。连接结束后,全量(10μL)加入含100μL大肠杆菌E.coli DH5α感受态细胞的1.5mL离心管中,混匀后冰浴30分钟,42℃水浴热激180s,冰浴1min后加入约1mL LB液体培养基在37℃,180转,振荡培养2h左右;10000rpm离心2min,去除上清液,将沉淀吸打混匀,取约100μL涂布于含氨苄青霉素(50μg/mL)的LB固体选择培养基上,封口后37℃倒置培养过夜。
用无菌牙签随机挑取单菌落约15个,在含有氨苄青霉素(50μg/mL)的LB液体选择培养基中震荡培养2h。以上述菌液为模板,采用载体专用引物RV-M+M13-47进行PCR扩增筛选阳性克隆,并用1%的琼脂糖凝胶电泳检测阳性克隆。将阳性克隆对应的菌液,在5mL含有100μg/mL氨苄青霉素的LB培养液中过夜培养。提取质粒并测序检验。
提取完成后测定质粒浓度,并计算质粒模板的准确拷贝数。对质粒提取液进梯度稀释,在5.63×100~5.63×104copies/μL范围内建立定量标准曲线。反应体系:2×SYBR Green QPCR Mix 10μL、ddH2O 7μL、上游引物(10μM)1μL、下游引物(10μM)1μL、样品DNA 1μL。Q-PCR程序:95℃预变性3min;95℃变性10s,57℃退火30s,72℃延伸30s,40个循环。反应完成后以Ct值和log拷贝数建立标准曲线。
采用Q-PCR技术测定大肠杆菌DNA浓度。反应体系:2×SYBR Green QPCR Mix 10μl、ddH2O 7μL、上游引物(10μM)1μL、下游引物(10μM)1μL、DNA 1μL;Q-PCR程序:95℃预变性3min;95℃变性10s,57℃退火30s,72℃延伸30s,40个循环。然后按照定量标准曲线将Ct值转换成拷贝数,从而定量环境样品中大肠杆菌的浓度。
本发明为涉及近海大肠杆菌的定量检测提供了技术支持。为能快速准确的测定近岸海水浴场,海洋排污口,海水养殖区中大肠杆菌数量,评估其公共卫生风险,发明人所在课题组运用该检测方法分别测定2015年7月和10月份、秦皇岛养殖区固定站位及2016年1、3、5月份海水浴场,海洋排污口大肠杆菌数量,并取得良好效果。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!