具有聚集诱导荧光增强特性的β‑半乳糖苷酶传感器的合成及应用的制作方法
本发明属于生物化学材料领域,涉及一种β-半乳糖苷酶荧光传感器、合成方法及应用。
背景技术:
β-半乳糖苷酶是一种常用的检测转录效率和基因转染效率的酶,也是细胞衰老和原发性卵巢癌的一种重要生物标记物。β-半乳糖苷酶的缺乏会导致β-半乳糖唾液酸沉积症及Morquio B综合征。并且,近年来,β-半乳糖苷酶被广泛应用于乳糖不耐症的替代疗法研究。β-半乳糖苷酶的重要生理作用激发了科学家们对其检测方法的研究,比如目前常用的检测β-半乳糖苷酶的方法有:生物化学发光法、磁共振法、单光子发射计算机断层扫描法(SPECT)、正电子发射计算机断层显像法(PET)、比色法及荧光法等。在这些检测方法中,荧光传感器由于具有操作简单、灵敏度高、检测限低、可应用于细胞内或活体成像等优点受到了科学家们的广泛关注。目前,检测β-半乳糖苷酶的荧光传感器还较少,并且,大部分的β-半乳糖苷酶荧光传感器所采用的荧光分子在高浓度时极易发生荧光猝灭,即聚集诱导荧光猝灭现象(aggregation caused quenching,ACQ)。这种现象迫使研究人员在检测过程中只能使用稀溶液,导致检测信噪比低,限制了这些β-半乳糖苷酶荧光传感器的实际应用。
2001年,唐本忠等人发现了一种在溶液状态下呈现无荧光或弱荧光,但是在聚集态呈现强荧光的特殊荧光分子,并将这种特殊的发光现象称为聚集诱导荧光(aggregation induced emission,AIE)效应。具有AIE效应的荧光分子由于具有高荧光量子产率、强抗漂白性、无需低浓度下检测等优点,为Turn-on型的荧光传感器分子的设计提出了新的思路。其中四苯乙烯类分子(tetraphenylethylene,TPE)更是设计AIE类荧光传感器的热门分子。本发明利用TPE分子的AIE特性,通过调节TPE分子的聚集/解聚过程,设计一种基于TPE分子的β-半乳糖苷酶荧光传感器,具有选择性强、灵敏度高、抗漂白能力强、能够在活细胞中检测β-半乳糖苷酶的特点。
技术实现要素:
本发明的内容是一种具有聚集诱导荧光增强特性的β-半乳糖苷酶荧光传感器、合成方法及其应用。实现本发明目的的技术解决方案是:一种β-半乳糖苷酶荧光传感器,具有如下结构:
该目标化合物具有聚集诱导荧光增强特性,即在溶液状态下具有弱荧光,聚集状态下具有强荧光。
一种β-半乳糖苷酶荧光传感器的合成方法,合成路线如下:
第一步:4-溴二苯甲酮与4,4’-二甲氧基二苯甲酮在四氯化钛作用下发生McMurry反应,生成具有聚集诱导荧光增强特性的化合物2;
第二步:化合物2与4-吡啶硼酸在[1,1’-双(二苯基磷)二茂铁]二氯化钯的催化作用下发生Suzuki偶联反应,生成化合物3;
第三步:化合物4与对羟基苯甲醛在NaOH作用下反应生成化合物5;
第四步:化合物5和还原剂硼氢化钠反应生成化合物6;
第五步:化合物6与三溴化磷作用,生成化合物7;
第六步:化合物7与化合物3在甲苯中回流得到化合物8;
第七步:化合物8在碳酸钾的作用下生成目标化合物1,利用乙酸乙酯、石油醚和二氯甲烷为混合溶剂重结晶提纯后,目标化合物1的结构经1H NMR、13C NMR和高分辨质谱鉴定。
一种β-半乳糖苷酶荧光传感器的应用:
在目标化合物1中含有一个吡啶盐结构和一个β-吡喃半乳糖苷结构,赋予了该化合物一定的水溶性,因此,该传感器可以用于水样检测,简单实用。在本发明中,用于检测β-半乳糖苷酶的溶剂为PBS缓冲溶液(5mM,pH 7.4,含1%的DMSO,目标化合物1的浓度为10μM),向溶液中加入8.0U/mL的β-半乳糖苷酶,在37℃下孵化,检测溶液荧光强度随时间的变化情况,结果表明,在37℃下孵化10min后,溶液的荧光强度基本达到饱和。
在10μM的目标化合物1的PBS溶液中加入不同浓度的β-半乳糖苷酶,在37℃下孵化10min后,测定目标化合物1的荧光强度随β-半乳糖苷酶浓度的变化情况。在0.8至4.8U/mLβ-半乳糖苷酶浓度范围内目标化合物1的荧光强度呈现良好的线性关系。
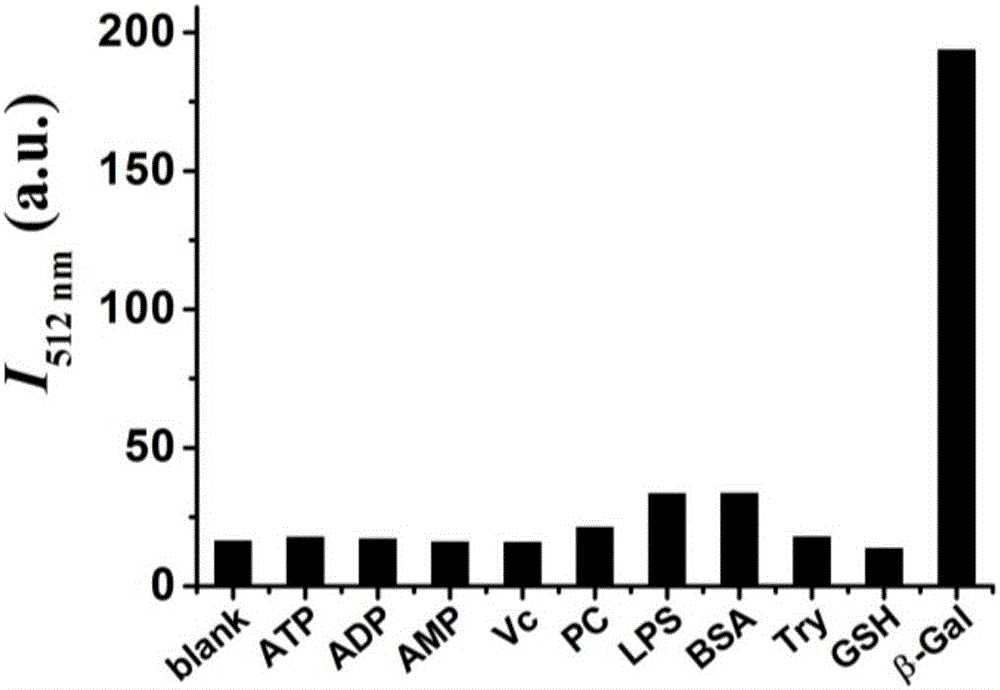
向目标化合物1的溶液中加入β-半乳糖苷酶后,目标化合物1中的β-吡喃半乳糖苷结构被酶水解发生键的断裂,并进一步发生消除反应生成化合物3。而化合物3的水溶性较差,在水溶液中更倾向于生成聚集态,因而溶液荧光大大增强。为了了解目标化合物1对β-半乳糖苷酶的选择性,本发明对常见生物分子如ATP、ADP、AMP、磷脂酰胆碱(PC)、脂多糖(LPS)、牛血清白蛋白(BSA)、酪氨酸(Try)、谷胱甘肽(GSH)及维生素C(Vc)与目标化合物1反应前后的荧光强度也进行了测定,结果表明,除β-半乳糖苷酶外其他生物分子与目标化合物1反应前后的荧光强度均没有明显增强。
人卵巢癌细胞(OVCAR3)β-半乳糖苷酶荧光成像:文献报道β-半乳糖苷酶在OVCAR3细胞中过表达,在HeLa细胞中不表达。本发明分别测定了目标化合物1在OVCAR3细胞和HeLa细胞中的荧光成像情况,进一步说明目标化合物1在细胞内β-半乳糖苷酶荧光成像方面的特异性和应用潜力。目标化合物1用二甲基亚砜(DMSO)溶解准确配制成1mM的母液,然后再用培养基稀释成5μM的稀释液。移取200μL的稀释液分别加入到OVCAR3细胞和HeLa细胞培养皿中,于室温下孵育40min,用PBS缓冲溶液冲洗细胞培养皿洗去多余染料分子。在405nm激发下用共聚焦荧光显微镜观察细胞的荧光成像情况,采集450-550nm的荧光信号进行荧光成像。结果表明,目标化合物1仅在β-半乳糖苷酶过表达的OVCAR3细胞中呈现强的荧光信号,而同样条件下,在不表达β-半乳糖苷酶的HeLa细胞中荧光较弱,说明目标化合物1对细胞内β-半乳糖苷酶成像具有特异性。
发明人通过简单的设计与合成,将目标化合物1成功用于β-半乳糖苷酶检测。与现有技术相比,本发明合成步骤简单,较易大规模生产和应用,克服了传统染料分子易漂白、仅能在稀溶液中检测的缺点。
附图说明
图1(a)在10μM化合物1的PBS缓冲溶液中加入不同浓度的β-半乳糖苷酶,37℃孵化10min后荧光发射光谱的变化;(b)10μM化合物1在512nm处荧光强度与β-半乳糖苷酶浓度的关系及线性拟合曲线图。
图2在10μM化合物1的PBS缓冲溶液中分别加入100μM的ATP、ADP、AMP、Vc、PC、LPS,或100μg/mL的BSA、Try、GSH或12.8U/mL的β-半乳糖苷酶,在512nm处荧光强度变化的柱状图。
图3化合物1与OVCAR3细胞或HeLa细胞37℃下孵化40min后的激光共聚焦显微成像照片。(a)化合物1与HeLa细胞在37℃下孵化40min后的明场照片;(b)化合物1与HeLa细胞在37℃下孵化40min后的荧光照片;(c)为(a)与(b)的叠加图;(d)化合物1与OVCAR3细胞在37℃下孵化40min后的明场照片;(e)化合物1与OVCAR3细胞在37℃下孵化40min后的荧光照片;(f)为(d)与(e)的叠加图。
具体实施方式
本实施例中所用的原料均为已知化合物,可以由商业途径获得,或可按相关文献设计方法合成。
实施例1
目标化合物1的合成
(1)化合物2的合成:将锌粉(1.56g,24mmol)、4-溴二苯甲酮(313mg,1.2mmol)4,4’-二甲氧基二苯甲酮(242mg,1.0mmol)加入无水四氢呋喃中,将悬浮液在搅拌下冷却到0℃。然后用注射器缓慢滴入四氯化钛(2.276g,12mmol),0℃下继续搅拌30min后,混合液回流4h。冷却,搅拌下滴入碳酸钠溶液直至无气泡产生为止。加入二氯甲烷和饱和食盐水分液、萃取,有机相用饱和食盐水洗涤三次,有机相用无水硫酸钠干燥、浓缩、柱层析分离后得到化合物2,产率为29%。核磁表征数据为:1H NMR(400MHz,CDCl3)δ7.21(d,J=4.6Hz,2H),7.20(m,3H),7.00(m,2H),6.95–6.87(m,6H),6.67–6.61(m,4H),3.76(s,3H),3.75(s,3H).
(2)化合物3的合成:将化合物2(236mg,0.50mmol)、4-吡啶苯硼酸(90mg,0.73mmol)、Pd(dppf)Cl2(80mg,0.10mmol)、CH2Cl2(1mL)、Bu4NI(25mg,0.07mmol)和碳酸钾水溶液(2M,10mL)加入甲苯(20mL)中,将混合液在氮气保护条件下回流16h。冷却,加入二氯甲烷和饱和食盐水分液、萃取,有机相用饱和食盐水洗涤三次,有机相用无水硫酸钠干燥、浓缩、柱层析分离后得到化合物3,产率63%。核磁表征数据为:1H NMR(400MHz,CDCl3)δ8.62(d,J=5.9Hz,2H),7.48(d,J=6.1Hz,2H),7.41(d,J=8.3Hz,2H),7.14–7.12(m,5H),7.06–7.04(m,2H),7.00–6.94(m,4H),6.67–6.63(m,4H),3.75(s,6H)。
(3)化合物5、6、7按照文献报道方法(Nat.Protoc.,2014,9,27;Synthesis,2010,13,2201)合成。
(4)化合物8的合成:将化合物3(20.0mg,0.043mmol)和化合物7(24.2mg,0.047mmol)溶于甲苯中,80℃下反应过夜。反应液冷却后进行柱层析分离得到化合物8,产率87%。核磁表征数据为:1H NMR(400MHz,MeOD)δ8.92(br,2H),8.29(br,2H),7.75(br,2H),7.52(br,2H),7.38–6.86(m,14H),6.66(br,3H),5.74(br,2H),5.46–5.25(m,4H),4.33(br,1H),4.16(br,2H),3.71(s,6H),2.16(s,3H),2.02(s,6H),1.98(s,3H).13C NMR(101MHz,MeOD)δ170.60,170.51,170.04,169.85,158.85,158.70,157.89,156.16,149.48,143.97,143.53,142.66,137.73,135.60,135.50,132.57,132.38,132.27,131.08,130.83,130.56,129.91,128.31,128.25,128.19,127.95,127.91,127.79,127.68,127.21,126.31,124.37,124.27,117.25,113.01,112.78,98.24,70.82,70.77,68.70,67.25,62.73,61.13,54.27,19.57,19.30,19.18,13.13.高分辨质谱表征数据为:HRMS:906.34871,[M]+。
(5)化合物1的合成:将化合物8(15mg,0.015mmol)溶于3mL甲醇中,加入碳酸钾(8.4mg,0.061mmol)于室温下搅拌1h,之后加入氯仿。混合物用饱和食盐水洗三次,有机相用无水硫酸钠干燥后浓缩,用乙酸乙酯、石油醚和二氯甲烷为混合溶剂重结晶,产率92%。核磁表征数据为:1H NMR(400MHz,d6-DMSO)δ9.14(d,J=6.3Hz,2H),8.43(d,J=5.5Hz,2H),7.87(d,J=7.8Hz,2H),7.51(d,J=7.2Hz,3H),7.28–6.81(m,13H),6.70(t,J=8.6Hz,3H),5.72(s,2H),5.31(s,1H),4.83–4.81(m,3H),3.67(s,6H),3.55–3.52(m,3H).13C NMR(101MHz,d6-DMSO)δ158.61,158.46,154.64,150.64,148.70,144.86,143.70,142.15,138.02,135.67,135.65,132.58,132.49,132.46,132.42,132.04,131.25,130.76,129.21,128.74,128.64,128.53,128.41,128.30,128.14,127.93,127.05,126.55,124.76,121.21,117.20,116.90,113.90,113.68,101.21,100.85,76.02,73.82,70.71,68.42,62.35,60.73,55.42.高分辨质谱表征数据为:HRMS:738.30674,[M]+。
实施例2
β-半乳糖苷酶传感器性能测试
(1)β-半乳糖苷酶传感器响应时间测定:取20μL化合物1的DMSO溶液(1mM)于2mL PBS缓冲溶液中,加入8.0U/mL的β-半乳糖苷酶,混合液在37℃下孵化不同的时间,测定混合溶液的荧光强度随孵化时间的变化,结果表明,10min后,荧光强度基本达到饱和。
(2)β-半乳糖苷酶传感器荧光滴定测试:取20μL化合物1的DMSO溶液(1mM)于2mL PBS缓冲溶液中,然后加入不同量的β-半乳糖苷酶的PBS溶液,混合溶液在37℃下孵化10min后,测定加入不同浓度β-半乳糖苷酶后溶液的荧光发射光谱(Ex=344nm),在0.8U/mL至4.8U/mL β-半乳糖苷酶浓度范围内混合液的荧光强度呈现良好的线性关系(如图1所示)。
(3)β-半乳糖苷酶传感器的选择性测试:取20μL化合物1的DMSO溶液(1mM)于2mL PBS缓冲溶液中,然后分别加入100μM的ATP、ADP、AMP、Vc、PC、LPS,或100μg/mL的BSA、Try、GSH或12.8U/mL的β-半乳糖苷酶,混合溶液在37℃下孵化10min,然后测定溶液的荧光发射光谱(Ex=344nm)。结果表明,除β-半乳糖苷酶外的其他生物分子与目标化合物1反应前后的荧光强度均没有明显增强(如图2所示),说明该荧光传感器可以选择性识别β-半乳糖苷酶。
实施例3
人卵巢癌细胞(OVCAR3)β-半乳糖苷酶荧光成像:OVCAR3细胞经过复苏接种于含10%胎牛血清的RPMI 1640培养基中。HeLa细胞经过复苏接种于含10%胎牛血清的DEME培养基中。两种细胞在37℃、5%CO2、100%饱和湿度的培养箱中培养。然后在18mm盖玻片上培养24h,待用。
将两种细胞分别浸入含5μM化合物1的培养基中,在37℃、5%CO2、100%饱和湿度的培养箱中培养40min后,倒出培养基,用新鲜培养基清洗细胞3遍。分别在激光共聚焦荧光显微镜下观察,并对其进行明场和暗场下拍照(如图3所示)。结果表明,目标化合物1仅在β-半乳糖苷酶过表达的OVCAR3细胞中呈现强的荧光信号,而同样条件下,在不表达β-半乳糖苷酶的HeLa细胞中荧光较弱,说明目标化合物1对细胞内β-半乳糖苷酶成像具有特异性。
- 还没有人留言评论。精彩留言会获得点赞!