一种减毒增亮、复制可控的HSV重组病毒及制备方法和应用与流程
本发明属于生物技术领域,具体涉及一种减毒增亮、复制可控的hsv重组病毒及制备方法和应用,涉及辅助hsv重组病毒跨单突触示踪的aav辅助病毒体系的构建,以及该工具病毒系统在大脑神经环路顺行跨单突触示踪、神经系统靶向基因转导及溶瘤治疗等中的应用。
背景技术:
大脑是人体最复杂的器官,至今我们依旧对其知之甚少,揭示大脑运行机制是科学家们梦寐以求的目标。2013年美国和欧盟“脑计划”先后启动掀起了脑科学研究的热潮。研究神经网络的结构是理解大脑工作机制以及治疗疾病或损伤条件下脑功能障碍的重要基础,然而解析大脑庞大而又极其复杂的神经网络并非易事,首先需要建立高效追踪神经环路结构的示踪工具及方法。美国的“推进创新神经技术脑研究计划(brain)”首先是一种新技术,研究新技术和新工具是这项计划的重点。研究神经网路结构和功能的新技术和新工具的不断出现将大大促进脑科学的研究发展。
解析神经环路的示踪剂主要是利用神经元的轴突转运功能。传统的化合物示踪剂(如fluorogold、phal等)能沿轴突转运但因不能跨突触,只能标记局部神经元的形态。上世纪70年代研究者开始利用嗜神经病毒做环路示踪。此技术主要运用嗜神经病毒能感染神经元且复制的子代病毒能够跨突触感染相连神经元的特性,另外病毒在每一个神经元中能自我复制不会衰减,同时也放大了环路中神经元的标记信号,所以嗜神经病毒成为天然的追踪神经网络结构的载体工具。病毒跨突触示踪现已成为解析神经环路的强有力技术,得到了广泛应用。利用分子病毒学、反向遗传学等技术对工具病毒进行优化改造已研发出越来越多的示踪病毒,业已在精密复杂神经网络的鉴定、结构及功能研究中发挥了重要作用,而且新示踪工具的出现提供了脑科学许多新的研究视点。
目前常用的嗜神经病毒主要有来源于α疱疹病毒科的伪狂犬病毒(pseudorabiesvirus,prv)和单纯疱疹病毒(herpessimplexvirus,hsv)以及棒状病毒科的狂犬病毒(rabiesvirus,rv),其它还有水疱性口炎病毒(vesicularstomatitisvirus,vsv)、辛德比斯病毒(sindbisvirus,sv)等。通过遗传改造实现了嗜神经病毒沿轴突定向运输,大多数病毒如prvbartha株和rv是逆向跨突触感染,vsv两个方向都可以传播。在转基因小鼠中通过利用cre重组酶或禽类细胞tva-enva系统,已实现将rv靶向标记特定的神经元类型和逆向跨单突触示踪。相对的能特异顺行跨突触示踪的是hsv-1h129株,不过对其的优化改造现还远远滞后于其它嗜神经病毒,特别是目前尚缺乏顺行跨单突触工具病毒示踪系统。目前已有报道中用表达荧光蛋白的h129追踪环路结构的文献较少,lichinglo等在h129胸苷激酶基因中插入loxp-stop-loxp(lsl)控制序列、红色荧光及tk基因,只有被cre重组酶剪切之后lsl后面的红色荧光才能表达。重组病毒在cre转基因小鼠小脑浦肯野细胞、视觉等神经环路进行了示踪研究。alicee.mcgovern等构建了表达egfp的重组病毒hsv-1h129-egfp,通过感染动物上呼吸道示踪上行感觉神经通路。j.patrickcard等构建了3种表达不同荧光蛋白的重组h129病毒,通过对基底神经环路和视觉神经系统的示踪标记,进一步证实h129及其重组病毒具有良好的顺行跨突触传播特性。
单纯疱疹病毒为人类易感病毒之一,其感染后具有潜伏、发病及复发的复杂性。hsv属于疱疹病毒科、α疱疹病毒亚科,有hsv-1和hsv-2两种亚型,两型核酸序列同源性高达50%,但感染方式与临床表现却不相同。hsv病毒粒子核心为双链dna基因组,外包以二十面体衣壳,衣壳外为含大量病毒蛋白的间质皮层,最外层是锚定病毒糖蛋白的包膜。hsv基因组为线性dna分子,大小约152kb,由共价连接的长片段(l)和短片段(s)组成,每一片段均含单一序列和反转重复序列,病毒感染后基因组会环化。hsv基因组碱性核苷酸鸟苷酸和胞苷酸的含量(gc含量)较高,达68.3%,为分子克隆和遗传改造构成了一定难度。hsv-1基因组编码七十多种orfs,约半数的编码基因转录方向是从左至右,但有37个基因的阅读框方向是从右至左。hsv-1h129(dixrd,etal.comparativeneurovirulenceofherpessimplexvirustype1strainsafterperipheralorintracerebralinoculationofbalb/cmice.infectimmun1983;40(1):103–12)是从一个脑炎患者脑部分离的毒株,在啮齿类动物研究中h129是严格按顺向跨突触传播的,和神经冲动传递的方向一致,非常适合于神经输出环路如感觉神经网络的示踪和功能研究。另外hsv具有大的dna基因组,遗传改造的空间大,便于将大片段外源基因或多个转基因同时引入病毒基因组。hsv感染宿主范围广,能有效感染啮齿类动物和灵长类动物等,所以h129成为人们倍受关注的顺行环路示踪病毒工具。不过目前可用于环路示踪的h129工具病毒很少、且普遍存在毒性大、灵敏度弱等问题,因此开展对hsvh129的优化改造、构建低毒、高亮、特异、灵活的hsv工具病毒以及建立顺行跨单突触hsv示踪系统很有必要。
技术实现要素:
本发明的目的在于提供了一种减毒增亮、复制可控的新型hsv重组病毒。
本发明的目的在于提供了一种减毒增亮、复制可控的hsv重组病毒的构建方法及其扩增制备、浓缩纯化方法。
本发明的目的在于提供了一种减毒增亮、复制可控的hsv重组病毒的应用,该重组hsv病毒可应用于动物大脑神经环路标记、顺行跨单突触示踪、基因靶向转导、溶瘤、疫苗构建、病毒复制与致病机理分析、抗病毒药物筛选等方面,具有广泛的应用价值。
为了实现以上目的,本发明采用如下技术方案:
本发明的设计思路为:
hsv-1h129毒株为脑炎病人临床分离株,具有严格顺向跨突触传播的特性。但野生型病毒毒力强,小鼠中枢感染h129后一般只能存活3-5天,不利于开展神经环路示踪及功能活动等研究。为构建减毒、复制可控、灵活携带外源基因的h129重组病毒,设计将病毒ul23基因编码的胸苷激酶(thymidinekinase,tk)敲除。tk是hsv感染神经元等非分裂型细胞复制的必需基因,属于早期基因,编码376个氨基酸。胸苷激酶是胸腺嘧啶合成补救途径中所必需的酶,通过使胸腺嘧啶磷酸化为dttp,参与dna的合成,在神经组织感染复制及潜伏型感染中具有重要作用。
申请人将h129tk基因完全缺失,设计引物克隆ul23(tk)基因两侧上下游同源臂序列,同源臂不含任何tk基因序列,从而构建tk基因缺失的重组病毒h129δtk。为便于将基因表达框或多种感兴趣基因克隆入基因组重组靶点,设计引入含多个限制性内切酶酶切位点的多克隆位点(mcs)接头,这样可大大方便后续分子遗传操作。
一种减毒增亮、复制可控的hsv重组病毒构建方法包括:
(1)同源臂克隆及靶向质粒构建
抽提纯化hsv-1h129病毒基因组dna,以其为模板,克隆tk基因上游同源臂序列1465bp,所用引物为uhas-f:5'gctagcagtgggccaaaaagcctagc3';uhas-r:5'aagcttacgcacgggtgttgggtcgtttg3';克隆下游同源臂序列1476bp,所用引物为dhas-f:5'aagcttgttcgaggccacacgcgtcac3';dhas-r:5'ctcgaggggaaagtccgtgatggtgc3';克隆的上下游同源臂片段分别通过nhei、hindiii及xhoi、hindiii酶切后连入pcdna3.1+载体,命名为ph129δtk;
以ph129δtk为模板,利用引物对h129δtk-linker-f:5'tcaagcttaattaagttaacatcgatcctgcaggcgcgccgttcgaggccacacgcgtc3';h129δtk-linker-r:5'gccggatccaaatgagtcttcggac3';进行扩增,扩增产物经hindiii、bamhi酶切回收后连入经同样酶切的ph129δtk骨架载体,构建获得上下游同源臂中间插入多克隆位点接头的靶向质粒,命名为ph129δtk-linker,测序验证完全正确;
(2)克隆构建插入同源臂间的外源基因增强表达盒
利用pcdna3.1(+)克隆载体,将带有nhei、kpni酶切位点的泛素启动子(hubc)片段和带有xbai、apai酶切位点的转录增强元件wpre,经酶切连入pcdna3.1(+)载体获得pcdna3.1-hubc-wpre载体;然后将荧光基因通过kpni、xbai酶切位点连到hubc和wpre中间;后续整体克隆pcr获得hubc-荧光基因-wpre-pa整个表达框大片段,通过paci和asci酶切位点连入前期构建好的敲除tk的靶向载体ph129δtk-linker,经酶切、测序证明载体构建成功,命名为ph129δtk-hubc-荧光基因-wpre-pa。
重组病毒构建荧光基因选择绿色荧光基因(egfp)或红色荧光基因(tdtomato)。
(3)减毒、tk缺失、高灵敏的hsv重组病毒制备
抽提靶向穿梭载体ph129δtk-hubc-荧光基因-wpre-pa,酶切线性化后和提取的h129病毒基因组共转染293t细胞,待细胞全部病变后收样置于-80℃冰箱;经反复冻融取样感染新细胞确定是否有重组病毒产生,重组成功的病毒样品经过挑斑纯化将野生型病毒去除,获得纯化的重组病毒。
减毒增亮、复制可控的hsv重组病毒可做以下几方面应用:
(1)在神经系统基因转导或环路示踪中的应用:
验证实验中将重组病毒rh129δtk-hubc-tdtomato-wpre300nl立体定位注射小鼠海马dg脑区,3天后灌流切片成像。重组病毒只局限在注射部位海马dg区表达红色荧光,全脑其它脑区无标记,说明tk缺失重组病毒在中枢神经元是复制缺陷型,跨突触能力丢失;另外缺失tk基因的重组h129病毒表现出明显低毒性,中枢感染小鼠观察2周后状态良好、无小鼠死亡,而野生株h129感染后小鼠一般3-5天死亡,说明tk缺失重组病毒毒性显著降低,该减毒型重组病毒可作为神经系统基因转导载体。
(2)顺行跨单突触环路示踪研究
为实现利用tk缺失hsv工具病毒进行细胞特异、顺行跨单突触示踪,另外构建了系列cre依赖、补偿表达tk蛋白的辅助腺相关病毒,两种病毒联用可进行特定脑区特定细胞类型的顺行一级输出环路追踪。验证实验中将辅助病毒立体定位注射dat-cre小鼠腹侧被盖区(ventraltegmentalarea,vta)脑区,感染后小鼠状态良好;3周后同位点注射rh129δtk-hubc-tdtomato-wpre病毒,10天后灌流切片成像。vta多巴胺能神经元一级输出标记到的脑区包括有基底核团、未定带、下丘脑、中央丘脑、外侧缰核等核团。跨单突触标记的神经元形态清晰,而且具有很好的特异性。
辅助病毒为将融合基因插入paav-ef1a-doublefloxed-hchr2(h134r)-eyfp-wpre-hghpa的asci和nhei酶切位点之间获得;所述的融合基因为荧光基因和tk基因中间引入隔有自剪切多肽t2a(self-cleaving2apeptide,2a)的序列。
神经环路示踪研究的应用对象不仅限于小鼠,还能应用于斑马鱼、大鼠、豚鼠、雪貂、树鼩、非人灵长类猴等动物的神经环路标记。
(3)溶瘤活性研究
tk缺失hsv病毒感染去分化的非分裂细胞为复制缺陷型,不能复制扩增子代病毒。而该病毒可有效地感染分裂旺盛细胞如肿瘤细胞等并实现自身复制。用构建的重组hsv能感染小鼠神经母细胞瘤neuro-2a细胞系并复制扩增,最终裂解杀死瘤细胞。
本发明与现有技术相比,具有以下优点和效果:
1.建立了灵活、高效的tk缺失重组病毒构建系统,通过克隆同源臂并引入多克隆位点接头,非常便于后续分子遗传操作插入大基因或多个转基因;
2.本发明制备了一对稳定高丰度表达绿色或红色荧光的hsv重组病毒,其具有感染可视化特点,便于开展相关研究;
3.构建的新型重组病毒毒性大为降低、携带外源基因能高丰度表达,用于神经环路示踪不用像以前病毒版本需做免疫组化;低毒高灵敏的新型hsv病毒可作为神经系统高效的基因转导及基因治疗载体;
4.基于新型rhsv和aav辅助病毒建立了严谨、高效、特异的顺行跨单突触示踪系统,能有效的全脑范围内追踪特定脑区特定类型神经元的单级输出调控网络;
5.本发明hsv工具病毒感染宿主范围广,不仅限于啮齿类动物小鼠、大鼠,还适用于斑马鱼、雪貂、树鼩、非人灵长类猴等动物的脑科学研究。
附图说明
图1为减毒、tk缺失、便于外源基因表达框插入的靶向质粒构建示意图。
tk基因位于基因组反义链、表达方向从右至左;所示同源臂方向相较tk而言。外源基因表达框方向和原tk基因方向相反。
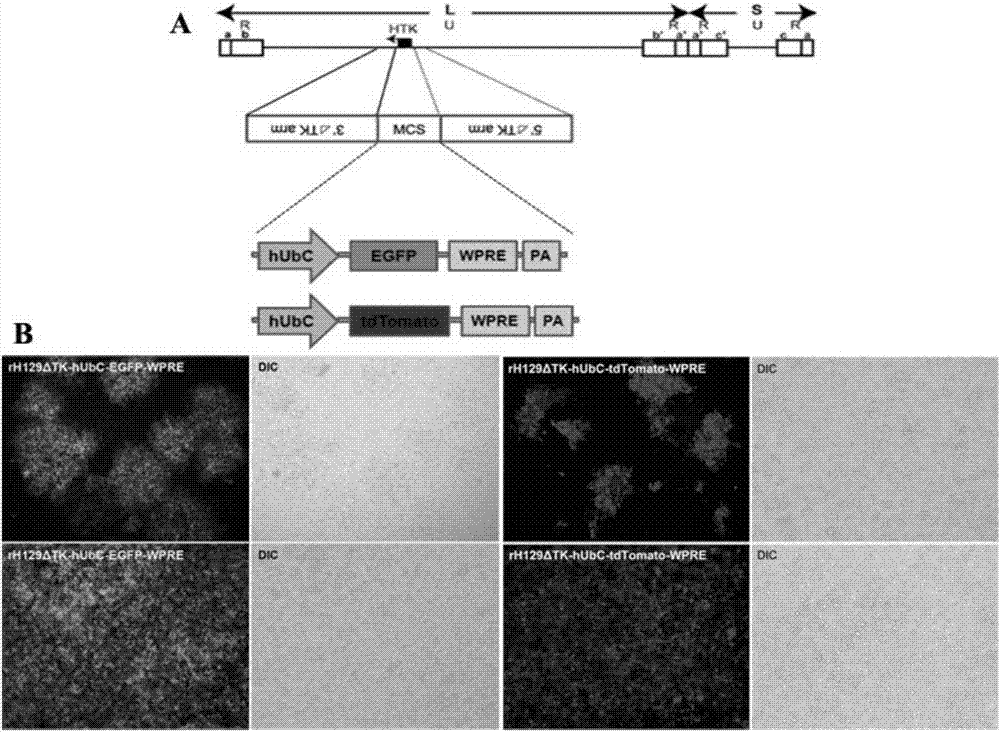
图2为携带绿色或红色荧光蛋白基因的tk缺失型h129重组病毒构建示意图及其重组、纯化制备。
a:tk缺失、高表达荧光的h129重组病毒构建策略示意图;
b:重组病毒挑斑纯化及扩增制备。
图3为新型重组病毒rh129δtk-hubc-tdtomato-wpre感染标记小鼠海马dg区,3天后灌流切片成像结果。
图4为构建的3种cre依赖、含不同荧光并表达tk的aav核心质粒转染293t细胞验证结果。
a:cre依赖、tk和egfp融合表达的aav核心质粒构建示意图;
b:cre依赖、含不同荧光并表达tk的aav核心质粒转染293t细胞荧光表达情况。
图5为基于新型hsv的顺行跨单突触示踪系统追踪vta多巴胺能神经元的一级输出环路。
a:cre依赖、补偿表达tk的aav辅助病毒立体定位注射dat-cre小鼠vta脑区,3周后同位点注射rh129δtk-hubc-tdtomato-wpre重组病毒,10天后灌流切片成像;
b:腹侧被盖区vta多巴胺能神经元顺行单突触标记到终纹床核(bnst)神经元;
c:vta多巴胺能神经元顺行单突触标记到外侧缰核(lhb)神经元;
d:vta多巴胺能神经元一级输出调控丘脑室旁核(pv)神经元。
图6为rh129δtk-hubc-egfp-wpre重组病毒高效感染并裂解神经母细胞瘤neuro-2a细胞图。
具体实施方式
本发明所述技术方案,如未特别说明,均为本领域的常规技术。所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1:
tk敲除、灵活携载外源基因的靶向穿梭质粒,其构建方法如下:
为构建tk基因缺失的重组病毒,首先根据ncbi查询的h129基因组序列(genbank:gu734772.1),设计引物克隆tk基因两侧同源臂序列,其中不保留任何tkcds序列。选择克隆上游同源臂序列1465bp,下游同源臂序列1476bp。
抽提纯化hsv-1h129病毒基因组dna,以其为模板,如图1所示,克隆上游同源臂片段1465bp,所用引物为uhas-f:5'gctagcagtgggccaaaaagcctagc3';uhas-r:5'aagcttacgcacgggtgttgggtcgtttg3';克隆下游同源臂片段长1476bp,所用引物为dhas-f:5'aagcttgttcgaggccacacgcgtcac3';dhas-r:5'ctcgaggggaaagtccgtgatggtgc3';由于hsv基因组整体gc含量高,同源臂序列gc含量近70%,片段并不易克隆。摸索条件成功克隆了两个同源臂,接着分别通过nhei、hindiii及xhoi、hindiii酶切后连入pcdna3.1+载体,命名为ph129δtk;
为在同源臂中间引入含多个酶切位点的多克隆位点接头,以ph129δtk为模板,设计引物对h129δtk-linker-f:5'tcaagcttaattaagttaacatcgatcctgcaggcgcgccgttcgaggccacacgcgtc3';h129δtk-linker-r:5'gccggatccaaatgagtcttcggac3';设计引入的6种内切酶-hindiii-paci-hpai-clai-sbfi-asci-识别序列位于正向引物5'端,pcr扩增片段长773bp,经hindiii、bamhi酶切回收后连入经同样酶切的ph129δtk骨架载体,构建获得上下游同源臂中间插入多克隆位点接头的靶向质粒,命名为ph129δtk-linker,测序验证完全正确;构建完成的靶向质粒有了此多克隆位点接头可以满足多种克隆需要,大大方便了后续克隆外源基因或控制表达元件插入靶向载体。
实施例2:
外源基因高丰度表达盒克隆及构建插入靶向载体,其步骤如下:
外源基因表达框通过多克隆位点接头插入到含同源臂序列的靶向载体。为实现外源基因高丰度表达,启动子选择高效启动转录的泛素启动子,泛素系统广泛存在于真核生物,其基因家族中的泛素启动子能显著增强基因表达的长效性、稳定性,且基本不受组织细胞的限制。同时在基因orf的下游引入土拨鼠肝炎病毒转录后调控元件(wpre),wpre能稳定rna、明显增强外源蛋白表达能力。为制备示踪神经回路的h129tracer,荧光报告基因选择信号强的增强型绿色荧光基因egfp或红色中最亮的tdtomato基因。
具体步骤包括:将带有nhei、kpni酶切位点的泛素启动子(hubc)(genbankid,gi:1304127)片段及带有xbai、apai酶切位点的转录增强元件wpre(genbankid,gi:939058940)片段,经酶切连入pcdna3.1(+)载体获得pcdna3.1-hubc-wpre载体;
将egfp或tdtomato基因,通过kpni、xbai酶切位点连到pcdna3.1-hubc-wpre载体的hubc和wpre中间;后续设计引物pcr克隆获得hubc-egfp-wpre-pa或hubc-tdtomato-wpre-pa整个表达框大片段,所用引物为ufwpa-f:5'ccttaattaagcgccgggttttggcgcctcccgcg3'和ufwpa-r:5'ttggcgcgccatagagcccaccgcatccccagc3'。切胶回收纯化荧光基因表达框大片段后经asci和paci双酶切后连入前期构建好的敲除tk基因靶向载体ph129δtk-linker,经酶切、测序证明荷载荧光基因的靶向穿梭载体构建成功,得到靶向穿梭载体ph129δtk-hubc-egfp-wpre-pa或靶向穿梭载体ph129δtk-hubc-tdtomato-wpre-pa。
实施例3:
减毒增亮、复制可控的hsv重组病毒的获得:
抽提靶向穿梭载体ph129δtk-hubc-egfp-wpre-pa或ph129δtk-hubc-tdtomato-wpre-pa,酶切线性化后和提取的h129病毒基因组共转染hek293t细胞,6小时后换液含2%胎牛血清的维持培养基;观察细胞全部变圆病变后(一般感染后24-48小时)收样置于-80℃冰箱;经三次反复冻融、6500g离心10分钟去净细胞碎片,吸取10μl病毒上清感染vero细胞,1天后观察感染细胞有无荧光表达来确定新型病毒是否重组成功;后期取重组成功的病毒上清连续10倍梯度稀释后感染vero细胞,吸附1小时后铺琼脂(含5%胎牛血清的dmem培养基和2%琼脂1:1混合)。48-72hr后待病毒斑形成后,在倒置荧光显微镜下进行挑斑;新型重组病毒经过6轮左右的挑斑纯化将野生型病毒去除,获得纯化的新型重组病毒rh129δtk-hubc-egfp-wpre或rh129δtk-hubc-tdtomato-wpre。两种重组病毒的构建示意图、挑斑纯化及扩增制备见图2。
实施例4:
rh129δtk-hubc-egfp-wpre或rh129δtk-hubc-tdtomato-wpre病毒的扩增、浓缩、纯化:
非洲绿猴肾上皮vero细胞系或乳仓鼠肾细胞bhk-21用于增殖hsv病毒。培养传代比例为1:3-6。细胞培养条件:含10%fbs、1%双抗的dmem培养基,病毒重组制备及扩增用含2%fbs的维持培养基;37℃、5%co2的培养条件下进行培养。
hsv重组病毒(rh129δtk-hubc-egfp-wpre或rh129δtk-hubc-tdtomato-wpre)以moi=0.01接种感染vero细胞,观察细胞全部表达荧光、约24-48小时后待细胞病变变圆后收集细胞上清,置于-80℃冰箱暂存;浓缩前6500g离心10分钟去除细胞碎片,经0.45μm滤膜过滤后50000g离心3hr,病毒沉淀重悬后再经20%蔗糖溶液50000g离心3hr,去上清、小心重悬病毒后少量多管分装、置于-80℃冰箱保存,避免反复冻融。
实施例5:
hsv重组病毒在脑神经环路示踪中的应用:
为测试hsv重组病毒的动物中枢感染特性,将重组病毒rh129δtk-hubc-tdtomato-wpre300nl立体定位注射小鼠海马dg脑区,在感染后3天麻醉动物,用0.9%(v/v)生理盐水灌流;然后用4%(v/v)多聚甲醛固定,取出脑组织浸泡于4%(v/v)多聚甲醛溶液中,然后将脑组织先置于20%(v/v)蔗糖溶液中1天,然后置于30%(v/v)蔗糖溶液中2天;将脑组织底部切平,置于底座上包埋冰冻1小时后切片;脑片制备好后使用共聚焦荧光显微镜观察。
成像结果如图3所示,hsv病毒感染中枢神经元后荧光得到高效表达,可以直接镜检拍照,相对的从国外购买的hsv重组版本标记神经元在成像前需做免疫组化,需进一步放大荧光信号。增敏的重组病毒只局限在注射部位海马dg区表达红色荧光,全脑其它脑区无标记,说明本发明提供的hsv重组病毒在中枢神经元是复制缺陷型,跨突触能力丢失,标记神经元胞体形态清楚、神经纤维也清晰可见;另外本发明提供的hsv重组病毒神经毒性显著降低,中枢感染小鼠观察2周后状态良好、无小鼠死亡,而野生株h129感染后小鼠一般3-5天死亡,说明本发明提供的hsv重组病毒毒性确实大为降低,这些都为建立hsv顺行跨单突触示踪系统打下了良好基础,另外该低毒增敏型重组病毒也可作为神经系统基因干预或治疗的载体备选。
实施例6:
cre依赖、含不同荧光并辅助表达tk的aav病毒载体构建
为实现利用tk缺失hsv工具病毒进行细胞特异、顺行跨单突触示踪,另外构建了系列cre依赖、补偿表达tk蛋白的三种含有不同荧光基因的辅助腺相关病毒:
tk和绿色荧光基因共表达的raav-ef1α-dio-egfp2atk-wpre载体;
tk和核定位红色荧光共表达的raav-ef1α-dio-(hismcherry-2a-tk)-wpre载体;
tk和核定位蓝色荧光基因共表达的raav-ef1α-dio-(hisbfp-2a-tk)-wpre辅助aav载体。
本实施例以构建raav-ef1α-dio-egfp2atk-wpre载体为例进行说明:
构建方法如下:设计荧光蛋白基因和tk基因融合表达,中间引入隔有自剪切多肽t2a(self-cleaving2apeptide,2a)序列;egfp-2a-tk融合pcr片段,其核苷酸序列为seqidno.1所示,egfp-2a-tk融合pcr片段胶回收纯化后经asci和nhei酶切后连入经同样酶切的aav核心骨架载体paav-ef1a-doublefloxed-hchr2(h134r)-eyfp-wpre-hghpa(addgeneplasmid#20298),该构建将20298质粒中原先的hchr2(h134r)-eyfp序列替换成egfp-2a-tk序列,而且egfp2atk相对ef1α启动子是倒向的;如图4中a所示,egfp-2a-tk两边为dio双loxp序列(loxp一对、lox2722一对且每一队中lox方向相反),dio为doublefloxedinverseorf的缩写。cre重组酶可以特异的将双loxp序列间的倒向序列翻转过来,外源基因和启动子方向变一致,从而启动目的基因的表达。
raav-ef1α-dio-(hismcherry-2a-tk)-wpre的构建方法与上述相同,唯一不同的是插入asci和nhei酶切位点之间的融合基因为hismcherry和tk基因中间引入隔有自剪切多肽t2a(self-cleaving2apeptide,2a)序列。
raav-ef1α-dio-(hisbfp-2a-tk)-wpre的构建方法与上述相同,唯一不同的是插入asci和nhei酶切位点之间的融合基因为hisbfp和tk基因中间引入隔有自剪切多肽t2a(self-cleaving2apeptide,2a)序列。
构建成功的三种aav核心质粒转染293t细胞验证结果如图4中b所示。三种cre依赖、携带不同荧光的tk辅助表达质粒只有和cre质粒共转染时才表达相应荧光,无cre质粒共转染则不表达荧光,无泄漏表达,有着很好的特异性。aav病毒利用实验室建立的杆状病毒新制备系统进行包装生产。
实施例7:
hsv重组病毒在顺行跨单突触环路示踪研究中的应用:
tk基因是hsv在感染神经元内复制的必需基因,如前所述本发明提供的hsv重组病毒感染神经元不能启动复制,为复制缺陷型、不会跨突触传播。在常用的cre-line转基因小鼠模型中,本发明提供的hsv重组病毒配合使用cre依赖补偿表达tk的aav辅助病毒可实现特定脑区、细胞类型特异、顺行跨一级突触输出环路的全脑追踪。
验证实验中将辅助病毒raav-ef1α-dio-egfp2atk-wpre立体定位注射dat-cre小鼠vta脑区,密切观察感染后小鼠状态,发现感染小鼠状态良好;3周后同位点注射rh129δtk-hubc-tdtomato-wpre重组病毒300nl,每天观测感染后小鼠,发现小鼠状态良好,未出现耸毛、厌食等症状,说明本发明提供的tk缺失型hsv重组病毒在条件性复制情况下毒力较弱,不会导致感染小鼠产生明显的不良反应或症状;根据前期标记经验,在hsv感染后第10天处理麻醉动物,用0.9%(v/v)生理盐水灌流充分;然后用4%(v/v)多聚甲醛固定,取出脑样浸泡于4%(v/v)多聚甲醛溶液中,然后将脑组织先置于20%(v/v)蔗糖溶液中1天,然后置于30%(v/v)蔗糖溶液中2天;将脑组织底部切平,置于底座上包埋冰冻1小时后切片;脑片制备好后使用共聚焦荧光显微镜观察。
如图5所示,dat-cre小鼠注射部位只有vta多巴胺能神经元特异表达cre重组酶,只有在这些特异的多巴胺能神经元依靠cre重组酶方能启动aav辅助病毒携带的tk和gfp基因表达,可视化被标记上绿色。待aav感染表达3周,荧光蛋白和tk蛋白得到充分表达后,同位点注射rh129δtk-hubc-tdtomato-wpre重组病毒,该hsv表达tdtomato红色荧光。10天后灌流切片成像可见注射部位有不少绿红色共标的黄色标记神经元,这些就是真正的startercell。在这些startercell中由于tk蛋白补偿表达,rh129δtk-hubc-tdtomato-wpre重组病毒得以复制扩增,子代病毒顺行沿轴突运输到突触前,然后跨突触感染突触后神经元,而突触后神经元不再有tk蛋白补偿,基因组缺失tk基因的hsv不能实现复制从而不能继续顺行跨突触传播,而跨突触过去的缺陷病毒携带的tdtomato基因因为是由广谱的泛素启动子驱动能够正常高丰度表达,把突触后神经元点亮,从而整体就实现了从特异startercell顺行跨单突触的一级输出网络全脑示踪。
实验中vta多巴胺能神经元一级输出标记到的脑区包括有基底核团、未定带、下丘脑、中央丘脑、外侧缰核等核团。跨单突触标记的神经元形态清晰,纤维标记得也很清楚;从缰核标记结果可以看出本发明提供的hsv重组病毒顺行跨单突触示踪还具有很好的特异性,vta多巴胺能神经元顺行跨单突触标记到外侧缰核神经元(lhb),而缰核中部等神经元无荧光标记,说明vta多巴胺能神经元特异性直接调控缰核外侧部的神经元,而非缰核全部神经元。
实施例8:
hsv重组病毒溶瘤活性研究,其步骤是:
在6孔细胞培养板中接种8╳105个肿瘤细胞系neuro-2a细胞,在37℃、5%(v/v)co2的培养条件进行培养。待第二天汇合度达到90%时,将rh129δtk-hubc-egfp-wpre病毒按照moi=0.1感染肿瘤细胞系neuro-2a,分别在感染后0h,24h,应用倒置荧光显微镜观察。结果如图6所示,rh129δtk-hubc-egfp-wpre能有效感染肿瘤细胞系,并稳定表达绿色荧光蛋白。感染后细胞逐渐病变变圆,3天左右细胞会裂解死亡。说明本发明提供的tk缺失型hsv重组病毒能够高效感染肿瘤细胞,并实现病毒复制、裂解杀死肿瘤细胞。
最后,还需要注意的是,上述实施例中的实验方法,如无特殊说明,均为常规方法,并且以上列举的仅是本发明的若干个实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
sequencelisting
<110>中国科学院武汉物理与数学研究所
<120>一种减毒增亮、复制可控的hsv重组病毒及制备方法和应用
<130>一种减毒增亮、复制可控的hsv重组病毒及制备方法和应用
<160>7
<170>patentinversion3.1
<210>1
<211>1902
<212>dna
<213>人工序列
<400>1
atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggac60
ggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctac120
ggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccacc180
ctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaag240
cagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttc300
ttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctg360
gtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcac420
aagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaac480
ggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgcc540
gaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600
tacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtc660
ctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaaggag720
ggcagaggaagtctgctaacatgcggtgacgtcgaggagaatcctggcccaatggcttcg780
tacccctgccatcaacacgcgtctgcgttcgaccaggctgcgcgttctcgcggccatagc840
aaccgacgtacggcgttgcgccctcgccggcaacaagaagccacggaagtccgcctggag900
cagaaaatgcccacgctactgcgggtttatatagacggtcctcacgggatggggaaaacc960
accaccacgcaactgctggtggccctgggttcgcgcgacgatatcgtctacgtacccgag1020
ccgatgacttactggcaggtgctgggggcttccgagacaatcgcgaacatctacaccaca1080
caacaccgcctcgaccagggtgagatatcggccggggacgcggcggtggtaatgacaagc1140
gcccagataacaatgggcatgccttatgccgtgaccgacgccgttctggctcctcatatc1200
gggggggaggctgggagctcacatgccccgcccccggccctcaccctcatcttcgaccgc1260
catcccatcgccgccctcctgtgttacccggccgcgcgataccttatgggcagcatgacc1320
ccccaggccgtgctggcgttcgtggccctcatcccgccgaccttgcccggcacaaacatc1380
gtgttgggggcccttccggaggacagacacatcgaccgcctggccaaacgccagcgcccc1440
ggcgagcggcttgacctggctatgctggccgcgattcgccgcgtttacgagctgcttgcc1500
aatacggtgcggtatctgcagggcggcgggtcgtggcgggaggattggggacagctttcg1560
gggacggccgtgccgccccagggtgccgagccccagagcaacgcgggcccacgaccccat1620
atcggggacacgttatttaccctgtttcgggcccccgagttgctggcccccaacggcgac1680
ctgtataacgtgtttgcctgggccttggacgtcttggccaaacgcctccgtcccatgcac1740
gtctttatcctggattacgaccaatcgcccgccggctgccgggacgccctgctgcaactt1800
acctccgggatggtccagacccacgtcaccacccccggctccataccgacgatctgcgac1860
ctggcgcgcacgtttgcccgggagatgggggaggctaactga1902
<210>2
<211>26
<212>dna
<213>人工序列
<400>2
gctagcagtgggccaaaaagcctagc26
<210>3
<211>29
<212>dna
<213>人工序列
<400>3
aagcttacgcacgggtgttgggtcgtttg29
<210>4
<211>27
<212>dna
<213>人工序列
<400>4
aagcttgttcgaggccacacgcgtcac27
<210>5
<211>26
<212>dna
<213>人工序列
<400>5
ctcgaggggaaagtccgtgatggtgc26
<210>6
<211>59
<212>dna
<213>人工序列
<400>6
tcaagcttaattaagttaacatcgatcctgcaggcgcgccgttcgaggccacacgcgtc59
<210>7
<211>25
<212>dna
<213>人工序列
<400>7
gccggatccaaatgagtcttcggac25
- 还没有人留言评论。精彩留言会获得点赞!