感染混合物及其制备方法与流程
本发明涉及T淋巴细胞
技术领域:
,尤其涉及一种感染混合物及其制备方法。
背景技术:
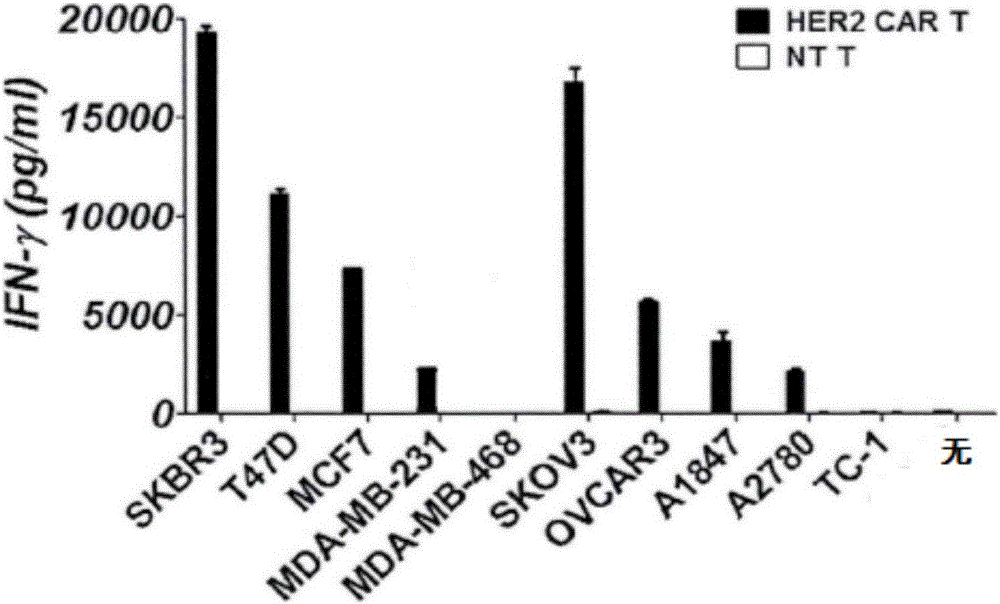
:CAR-T细胞(ChimericantigenreceptorTcell,嵌合抗原受体T细胞)即是表达嵌合抗原受体修饰的T细胞,而CAR-T细胞的嵌合抗原受体(Chimericantigenreceptor,CAR)包括胞膜外抗原结合区、铰链区和胞内信号传导区三部分构成。其中,胞膜外抗原结合区是一段单链可变区结构域(singlechainFvdomain,scFv),具有特异性识别并结合TAA(tumor-associatedantigen,肿瘤相关性抗原)的功能。scFv的构成是将单克隆抗体的重链可变区(thevariableregionofheavychain,VH)和轻链可变区(thevariableregionoflightchain,VL)用一可弯曲的多肽接头(Linker)将VH和VL连接起来,构成VH-Linker-VL或VL-Linker-VH。铰链区通常是由免疫球蛋白超家族组成,比如CD8、CD28和IgG。胞内信号传导区包括共刺激分子(costimulatorymolecule,CM)和免疫受体酪氨酸活化基序(immunoreceptortyrosine-basedactivationmotifs,ITAM),其中,CM通常为CD28,ITAM通常为CD3ζ或FcεRIγ。表达CAR的T细胞可通过scFv直接识别并结合肿瘤细胞表面的TAA,CAR将信号传入T细胞内,激活T细胞分泌细胞因子包括穿孔素、颗粒酶、INF-γ、TNF-a等,从而发挥杀伤肿瘤细胞作用。因此,CAR-T细胞是MHC非限制性的。CAR-T细胞将抗体-抗原特异性结合能力以及T细胞介导的杀伤功能结合于一体,是免疫抗肿瘤治疗的重要方法。嵌合性抗原受体方法应用的关键是确定一种肿瘤相关性抗原,在肿瘤细胞表面高表达,而在正常组织中无表达或者低表达。原癌基因人上皮生长因子受体2(humanepidermalgrowthfactorreceptor2,Her-2/neu)又称HER2或c-erbB-2基因,在多种肿瘤的发病及临床进程中发挥重要作用,体外与动物实验己明确显示Her-2/neu基因扩增、蛋白过度表达在致瘤转化和肿瘤发展中起着关键作用。研究证实:30%以上的人类肿瘤组织中,如乳腺癌、卵巢癌、子宫内膜癌、输卵管癌、宫颈癌、前列腺癌、胃癌、唾液腺癌、舌癌、头颈部鳞癌、非小细胞性肺癌等,均伴有Her-2/neu基因的扩增及p185蛋白的过度表达,而正常组织中p185蛋白为阴性或微量表达。而在乳腺癌中,大约有1/3的病人过表达HER2蛋白。过表达HER2蛋白使肿瘤的侵袭性更强,是乳腺癌病人预后不良的独立的危险因素。尽管抗HER2单克隆抗体(如曲妥株单抗)在临床的应用使部分病人获益,但是其价格昂贵,很大程度上限制了其大规模临床应用。HER2蛋白位于细胞表面,容易被抗体识别,因此,HER2蛋白可作为CAR-T细胞抗肿瘤治疗的一个理想靶点。然而,现有技术中并未提供表达抗HER2单克隆抗体的CAR-T细胞,即现有的CAR-T细胞并不能以HER2蛋白为靶向而直接识别并结合HER2蛋白,导致CAR无法将信号传入T细胞内,而无法分泌杀伤高表达HER2蛋白的肿瘤细胞的细胞因子。技术实现要素:本发明的主要目的在于提供一种感染混合物,旨在通过该感染混合物感染T细胞而获得表达抗HER2单克隆抗体的CAR-T细胞。为实现上述目的,本发明提供一种感染混合物的制备方法,所述感染混合物用于感染T细胞而制备CAR-T细胞,所述感染混合物的制备方法包括步骤如下:构建CAR表达载体,其中,所述CAR表达载体的CAR包括胞膜外抗原结合区、铰链区和胞内信号传导区,所述胞膜外抗原结合区为用于结合HER2蛋白的chA21scFv,所述胞内信号传导区为CD28-X-ITAM,所述X为ICOS、CD137、CD134、CD80或者CD86共刺激分子;包装所述CAR表达载体,而制得感染混合物。优选地,所述构建CAR表达载体的过程中,包括步骤如下:获取所述chA21scFv的基因片段、所述铰链区的基因片段、所述CD28的基因片段、所述X的基因片段以及所述ITAM的基因片段;提供引导链,基因融合所述引导链与所述chA21scFv的基因片段,而形成引导链-chA21scFv;基因融合所述铰链区的基因片段、所述CD28的基因片段、所述X的基因片段和所述ITAM的基因片段,而形成铰链区-CD28-X-ITAM;基因融合所述引导链-chA21scFv和所述铰链区-CD28-X-ITAM,而形成引导链-chA21scFv-铰链区-CD28-X-ITAM;将所述引导链-chA21scFv-铰链区-CD28-X-ITAM接入载体,而获得CAR表达载体。优选地,获取所述chA21scFv的基因片段、所述铰链区的基因片段、所述CD28的基因片段、所述X的基因片段以及所述ITAM的基因片段的过程中,包括步骤如下:获取并激活PMBCs;提取所述PMBCs的mRNA并反转录为cDNA;分别提供所述铰链区的引物、所述CD28的引物、所述X的引物和所述ITAM的引物,且均以所述PMBCs的cDNA为模板,分别进行PCR扩增,而获得所述铰链区的基因片段、所述CD28的基因片段、所述X的基因片段以及所述ITAM的基因片段;提供所述chA21scFv的模板DNA和所述chA21scFv的引物,并进行PCR扩增,而获得所述chA21scFv的基因片段。优选地,所述CAR表达载体为CAR表达病毒质粒。优选地,所述包装所述CAR表达载体的过程中,包括步骤如下:将12~20μg的包装质粒与12~20μg的所述CAR表达病毒质粒通过培养基共混,而获得质粒混合物;将所述质粒混合物与35~45μl的脂质体通过培养基共混,而获得混合液;将所述混合液转染真核细胞,而获得所述真核细胞的上清液;浓缩所述上清液,而制得感染混合物。优选地,所述X为ICOS共刺激分子。此外,为实现上述目的,本发明还提供一种如上所述的感染混合物的制备方法制备的感染混合物。本发明感染混合物可以感染T细胞而制得CAR-T细胞,该CAR-T细胞表达chA21scFv而识别和结合肿瘤细胞表面高表达的HER2蛋白,并通过胞内信号传导区将信号传入T细胞,从而活化T细胞,促进T细胞分泌细胞因子,该细胞因子进而可以杀伤高表达HER2蛋白的肿瘤细胞。而且,胞内信号传导区整合了CD28共刺激分子以及X共刺激分子,可使T细胞持续活化增殖,细胞因子持续分泌,增强杀伤肿瘤细胞作用。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的内容获得其他的附图。图1为本发明实施例1制备的CAR表达载体的基因结构图;图2为ELISA法检测本发明实施例1制备的CAR-T细胞及现有的NT-T细胞分别与HER2+/-肿瘤细胞的共培养后的IFN-γ分泌量的柱状图;图3为ELISA法检测本发明实施例1制备的CAR-T细胞及现有的NT-T细胞分别与HER2+/-肿瘤细胞的共培养后的IL-2分泌量的柱状图;图4为ELISA法检测本发明实施例1制备的CAR-T细胞的HER2特异性的统计图;图5为51Cr释放试验检测本发明实施例1制备的CAR-T细胞对乳腺癌细胞的特异性杀伤作用的统计图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供一种感染混合物的制备方法,包括步骤如下:S1、构建CAR表达载体,其中,CAR表达载体的CAR包括胞膜外抗原结合区、铰链区和胞内信号传导区,胞膜外抗原结合区为用于结合HER2蛋白的chA21scFv,胞内信号传导区为CD28-X-ITAM,X为ICOS、CD137、CD134、CD80或者CD86共刺激分子;S2、包装CAR表达载体,而制得感染混合物。本发明感染混合物的制备方法通过构建CAR表达载体,并包装CAR表达载体而获得感染混合物,该感染混合物感染T细胞后而制得CAR-T细胞,由于该CAR表达载体表达抗HER2单克隆chA21,从而可以识别和结合肿瘤细胞表面高表达的HER2蛋白,并通过胞内信号传导区将信号传入T细胞,从而T细胞激活,促进T细胞分泌细胞因子,该细胞因子进而可以杀伤高表达HER2蛋白的肿瘤细胞。该制备方法高效、简单、成本低。需要说明的是,在该CAR的结构中,chA21为采用表面包埋法(surfaceepitopemaskingmethod,SEM)生产的人源化单克隆抗体A21,是一种抗ErbB2抗体,其具有很强的结合特异性和抑瘤活性;chA21可特异性识别HER2胞外区C-端的第I结构域,远离HER2受体二聚化功能位,因此,本发明以抗HER2的chA21为基础构建CAR-T细胞;chA21scFv由chA21单克隆抗体的重链可变结构域和轻链可变结构域通过多肽接头连接形成,由于不少供应商或科研机构已经成功合成chA21scFv,且合成方法也为现有技术,故该chA21scFv可以直接由供应商或科研机构提供。铰链区可以是CD3、CD4、CD8、或者CD28,具体视实际情况而定。胞内信号传导区的共刺激分子X可为ICOS、CD137、CD134、CD80或者CD86共刺激分子,均可起到传导信号的作用,实现T细胞持续活化增殖,细胞因子持续分泌,增强杀伤肿瘤细胞的目的;胞内信号传导区的ITAM通常为CD3ζ或者FcεRIγ。进一步地,在步骤S1中,构建CAR表达载体的过程中,具体包括步骤如下:S10、获取chA21scFv的基因片段、铰链区的基因片段、CD28的基因片段、X的基因片段以及ITAM的基因片段;S11、提供引导链,基因融合引导链与chA21scFv的基因片段,而形成引导链-chA21scFv;S12、基因融合铰链区的基因片段、CD28的基因片段、X的基因片段和ITAM的基因片段,而形成铰链区-CD28-X-ITAM;S13、基因融合引导链-chA21scFv和铰链区-CD28-X-ITAM,而形成引导链-chA21scFv-铰链区-CD28-X-ITAM;S14、将引导链-chA21scFv-铰链区-CD28-X-ITAM接入载体,而获得CAR表达载体。通过PCR扩增技术和重叠PCR技术,将chA21scFv的基因片段、铰链区的基因片段、CD28的基因片段、X的基因片段以及ITAM的基因片段进行基因融合,而构建CAR表达载体,其构建方式高效、简单。需要说明的是,该引导链优选为人CD8α引导链,人CD8α引导链可以从人CD8α细胞中提取,也可以从相应的供应商中获取,而人CD8α引导链的引物可由相应的供应商提供。进一步地,步骤S10具体包括步骤如下:S100、获取并激活PMBCs(peripheralbloodmononuclearcells,外周血单核细胞);S101、提取PMBCs的mRNA并反转录为cDNA;S102、分别提供铰链区的引物、CD28的引物、X的引物和ITAM的引物,且均以PMBCs的cDNA为模板,分别进行PCR扩增,而获得铰链区的基因片段、CD28的基因片段、X的基因片段以及ITAM的基因片段;S103、提供chA21scFv的模板DNA和chA21scFv的引物,并进行PCR扩增,而获得chA21scFv的基因片段。通过PMBCs获得T细胞的mRNA,然后将mRNA反转录为cDNA,从而为不同种类的T细胞的基因片段的扩增提供了模板,同时通过现有的chA21scFv的模板DNA和chA21scFv的引物对chA21scFv进行PCR扩增,显然,上述PCR扩增高效、简便,有利于提供CAR表达载体的构建。进一步地,CAR表达载体为CAR表达病毒质粒,换而言之,步骤S14中,将引导链-chA21scFv-铰链区-CD28-X-ITAM接入了病毒载体,而形成了CAR表达病毒质粒,其中,该病毒载体可以是逆转录病毒或者慢病毒,并通过质粒的形式存在。进一步地,在步骤S2中,包装CAR表达载体的过程中,具体包括步骤如下:S20、将12~20μg的包装质粒与12~20μg的CAR表达病毒质粒通过培养基共混,而获得质粒混合物;S21、将质粒混合物与35~45μl的脂质体通过培养基共混,而获得混合液;S22、将混合液转染真核细胞,而获得真核细胞的上清液;S23、浓缩上清液,而制得感染混合物。通过对CAR表达载体的包装而制得感染混合物,可以提高CAR表达病毒质粒的感染效率,从而提高CAR-T细胞的制备效率。现通过实施例1对本发明感染混合物及其制备方法、感染混合物感染T细胞而制备CAR-T细胞的过程、以及CAR-T细胞的抗HER2效果做进一步解释和说明,在该CAR-T细胞中,CAR的胞内信号传导区的X共刺激分子优选为ICOS共刺激分子,CAR-T细胞具体构建方式参见如下详述的内容。同理,根据下述的构建方式,可以构建X共刺激分子为其他共刺激分子时的CAR-T细胞,至于X共刺激分子的引物序列可以从NCBI的GenBank中查找获得,X共刺激分子的引物可以相应的商家中购买获得,也可以自行设计。实施例1一、本发明实施例所用到的材料及试剂1、人外周血单核细胞三位健康志愿者的外周血单核细胞来源于北京大学深圳医院肿瘤介入科。2、细胞系人乳腺癌细胞株SKBR3,T47D,MCF-7,MDA-MB-231和卵巢癌细胞株SKOV3,0VCAR3,A1847和A2780,以及HER2阴性的肿瘤细胞株MDA-MB-468(购买于ATCC)。TC-1是HPV-16转染的小鼠肺癌细胞,用来作为人HER2阴性表达的对照,也购买于ATCC。293T细胞购买于ATCC。3、试剂(1)RPMI-1640培养基(Invitrogen公司)(2)灭活胎牛血清(Invitrogen公司)(3)青一链霉素10000U/ml10000IU/ml(Invitrogen公司)(4)抗CD3/抗CD28磁珠(Invitrogen公司)(5)重组人白介素-2(IL-2)(PeproTech公司)(6)DMSO(二甲基亚砜)(Invitrogen公司)(7)0.25%胰酶(Invitrogen公司)(8)LTS1077淋巴细胞分层液(上海研谨生物科技有限公司)(9)mRNA提取试剂盒(Invitrogen公司)(10)反转录试剂盒(Invitrogen公司)(11)PCR试剂盒(Invitrogen公司)(12)PCR产物纯化试剂盒(Qiagen公司)(13)含有人源化抗HER2的chA21scFv的质粒PEE14-chA21(中国科技大学提供)(14)人CD8α引导链(CD8αleader链)(Takara公司)(15)人CD8α引导链的正向引物AF(Takara公司)(16)CD8α铰链区(CD8αhinge)的正向引物CF和反向引物CR(Takara公司)(17)CD28的正向引物DF和反向引物DR(Takara公司)(18)ICOS的正向引物GF和反向引物GR(Takara公司)(19)CD3ζ的正向引物EF和反向引物ER(Takara公司)(20)chA21scFv的正向引物BF和反向引物BR(Takara公司)(21)pMD.G质粒、pMDLg/p质粒、Rev表达质粒(Qiagen公司)(22)FITC标记的山羊抗鼠F(ab’)2抗体(JacksonImmunoResearch公司)(23)APCCY7标记的抗人-CD3,PE标记的抗人-CD45,FITC抗人-CD4,PE抗人-CD4,APC抗人-CD8,PE抗人CD45RO,APC抗人CD62L抗体(Biolegend公司)(24)IFN-γELISA试剂盒(Biolegend公司)(25)IL-2ELISA试剂盒(Biolegend公司)(26)HER2-Fc嵌合蛋白(R&DSystems公司)(27)CD19-Fc嵌合蛋白(SPEEDBioSystems公司)(28)铬酸钠(Na251CrO4)(DuPontNEN公司)(29)FITC兔抗人HER2抗体(Clone24D2,Biolegend公司)(30)脂质体2000(Invitrogen公司)(31)凝聚胺(Sigma公司)4、引物序列表表一二、本实施例的技术方案(一)、外周血单核细胞的分离与激活1、人外周血单核细胞(peripheralbloodmononuclearcell,PBMC)的分离(1)抗凝血管抽取健康志愿者的外周血15ml;(2)向该抗凝血管中加入等体积的PBS,轻轻吹打成细胞悬液30ml;(3)另取两支50ml离心管,向一离心管加入15ml的LTS1077淋巴细胞分层液;然后,用吸管吸取15ml的细胞悬液,在距离LTS1077淋巴细胞分层液上方1cm处将细胞悬液小心而缓慢的加入,使细胞悬液重叠于LTS1077淋巴细胞分层液上,2000rpm离心20min;(4)取出离心后的离心管,移液管吸去最上层的血浆,移液枪吸取血浆层下的单个核细胞置入另一离心管中;然后,加入l5ml的PBS洗涤,轻轻吹打均匀后再次离心,1500rpm,l0min,去掉上清;共洗涤3次;(5)向去掉上清后的离心管内加入含10%灭活胎牛血清、100U/ml青一链霉素、100U/mlIL-2的RPMI-1640培养基,放置于37℃,5%CO2的细胞培养箱中培养,而分离获得PBMC细胞制剂。2、人外周血单核细胞的激活(1)取步骤1获得的PBMC细胞制剂,于24孔板中种植1x106个PBMC细胞(1×106/ml);(2)按照免疫磁珠分选试剂盒的说明书的方法,用PBS将包被抗CD3/CD28的磁珠洗3遍;(3)将磁珠按3:1(磁珠:细胞)比例加入PBMC细胞中,放置37℃、5%CO2培养箱中培养过夜;(4)细胞激活12~24小时后,离心,收取被激活的人外周血单核细胞,用作提mRNA并反转录为cDNA。(二)、提取激活的外周血单核细胞的mRNA并反转录为cDNA1、外周血单核细胞的mRNA的提取(1)取出被激活后的人外周血单核细胞1.5×106个,用PBS冲洗2遍;(2)去掉上清后,向细胞沉淀中加入1.5ml的Trizol,吹打成均匀细胞悬浮液;(3)采用1ml注射器来回抽吸细胞悬浮液,以剪切基因组DNA,然后用注射器直接将样品转移到一新的1.5ml的EP管中;(4)向EP管中加入250μl的氯仿,剧烈震荡30sec,12000rpm离心5min;(5)将离心后产生的上清移至另一新的1.5ml的Ep管中,并加入等体积的异丙醇,室温放置5min;(6)12000rpm离心5min,吸走上清液;(7)向吸走上清液后的Ep管中加入70%的乙醇750μl,不需吹打,12000rpm离心2min;(8)尽可能彻底吸走离心后产生的上清,室温干燥使乙醇挥发,而形成沉淀;(9)向该沉淀加入60μl的DEPC(diethylpyrocarbonate,焦碳酸二乙酯)水,而溶解该沉淀,即溶解外周血单核细胞的mRNA;(10)取溶解的mRNA3μl,加至1ml的DEPC水中,采用紫外分光光度计测量260nm和280nm的吸光度值:OD260/280=1.9~2.0;按1OD=40μg的mRNA计算mRNA的产率,OD260/280在1.9~2.0视为提取的mRNA纯度很高;(11)用提取的RNA产物来进行下一步的RT反应。2、RT(ReverseTranscription,反转录)反应(1)将步骤1提取的mRNA与其他试剂构成如下的反应体系:试剂体积mRNA1.5μlOligodT-AdaptorPrimer(引物)1μldNTPMixture(各10nM)2μlAMVReverseTranscriptase1μl10×RTBuffer1.5μlRNaseFreedH2O3.75μlMgCl22μlRNaseInhibitor0.25μlTotal13μl(2)RT反应条件:室温,10min;42℃,1h;99℃,5min灭活AMVReverseTranscriptase;进而反转录获得PMBCs的cDNA(3)将反转录得到的PMBCs的cDNA置于-80℃冰箱保存,备用。(三)、靶向HER2的嵌合性抗原受体(CAR)载体的构建1、PCR扩增chA21scFv、CD8αhinge、CD28、ICOS和CD3ζ1.1、PCR扩增chA21scFva、提供chA21scFv的DNA模板及chA21scFv的引物:chA21scFv的DNA模板由中国科技大学提供的质粒PEE14-chA21获得;chA21scFv的正向引物BF和反向引物BR由Takara公司提供,其引物系列具体见上表一);b、按照如下的PCR反应体系和PCR反应条件获得PCR产物;PCR反应体系:PCR反应条件:c、电泳配制琼脂糖凝胶(20g/L):称取0.6g的琼脂糖凝胶粉,加入30ml的TAE电泳缓冲液,混匀后放入微波炉中加热45s,加入1ul的EB液,混匀后灌注,室温冷却;向电泳槽中加入适量TAE电泳缓冲液,用DL2000作为DNAMarker,向样本孔中加入5u1的上述PCR产物,调节电泳仪电压为90mV,电泳半小时;d、结果观察利用数码凝胶图像采集与分析系统进行扫描分析可知:上述PCR产物为chA21scFv基因片段;e、PCR产物回收(1)将电泳后余下的PCR产物转移至2ml的EP管中,加入300ul的PB缓冲液,充分混匀;(2)吸附:QIAquick柱子链接2ml的EP管,将含PCR产物的PB缓冲液缓慢加入QIAquick柱子,13000转/分离心30秒;(3)洗涤:弃去EP管中的液体,向QIAquick柱子中加入800ul的PE缓冲液,13000转/分离心30秒;(4)弃去EP管中的液体,13000转/分离心1分钟;(5)洗脱:将QIAquick柱子置于新的1.5ml的EP管中,向柱子中加入60ul的EB缓冲液,13000转/分离心1分钟,弃去EP管中的液体而回收PCR产物;(6)将回收后的PCR产物置于-20℃冰箱保存。1.2、PCR扩增CD8αhinge、CD28和CD3ζa、提供引物以及步骤(二)制得的PBMCs的cDNA:CD8αhinge的正向引物CF和反向引物CR由Takara公司提供,其引物系列见上表一;CD28的正向引物DF和反向引物DR由Takara公司提供,其引物系列见上表一;ICOS的正向引物DF和反向引物DR由Takara公司提供,其引物系列见上表一;CD3ζ的正向引物EF和反向引物ER由Takara公司提供,其引物系列见上表一;b、按照如下的PCR反应体系和PCR反应条件获得PCR产物;PCR反应体系:试剂体积PBMCs的cDNA1.5μl(50ng)10×PCRbuffer7.25μl10mMdNTP混合物1.5μl10um正向引物(CD8αhinge/CD28/ICOS/CD3ζ)3μl10um反向引物(CD8αhinge/CD28/ICOS/CD3ζ)3μl50mMMgSO43μlTaqDNA聚合酶1μl(5单位)加三蒸水至80μlPCR反应条件:与PCR扩增chA21scFv的PCR反应条件相同;c、PCR产物回收(与PCR扩增chA21scFv的PCR产物回收的步骤相同),进而获得CD8αhinge/CD28/ICOS/CD3ζ的PCR产物。2、重叠PCR而进行基因融合2.1、提供CD8αleader链(CD8α引导链),将CD8αleader链与PCR扩增后的chA21scFv进行基因融合,而形成CD8αleader-chA21scFv:a、第一步PCR反应,其反应体系和反应时间如下;第一步PCR反应体系:试剂体积CD8αleader链~50ng扩增后的chA21scFv~50ng10×PCRbuffer5μl10mMdNTP1μl50mMMgSO42μlTaqDNA聚合酶0.2μl加水至50μl第一步PCR反应条件:b、第二步PCR反应,其反应体系和反应时间如下;第二步PCR反应体系:向第一步PCR反应完成后的体系中加入CD8αleader链的正向引物AF(其引物系列如表一所示)以及chA21scFv的反向引物BR(其引物序列如表一所示)各2ul;第二步PCR反应条件:e、将第二步PCR反应的PCR产物进行电泳,数码凝胶图像采集与分析系统进行扫描分析,而证明第二步PCR反应的PCR产物为CD8αleader-chA21scFv;f、第二步PCR反应的PCR产物回收(与PCR扩增chA21scFv的PCR产物回收的步骤相同),而获得CD8αleader-chA21scFv;2.2、将扩增后的CD8αhinge与扩增后的CD28进行基因融合,获得CD8αhinge-CD28;将CD8αhinge-CD28与扩增后的ICOS进行基因融合,获得CD8αhinge-CD28-ICOS;将CD8αhinge-CD28-ICOS与扩增后的CD3ζ进行基因融合,获得CD8αhinge-CD28-ICOS-CD3ζ;将CD8αleader-chA21scFv与CD8αhinge-CD28-ICOS-CD3ζ进行基因融合,获得CD8αleader-chA21scFv-CD8αhinge-CD28-ICOS-CD3ζ,其基因结构如图1所示;具体方法同上,其中,CD8αhinge与CD28融合过程中所添加的引物为CF,DR;CD8αhinge-CD28与ICOS融合过程中所添加的引物为CF,GR;CD8αhinge-CD28-ICOS与CD3ζ融合过程中所添加的引物为CF,ER;CD8αleader-chA21scFv与CD8αhinge-CD28-ICOS-CD3ζ融合过程中所添加的引物为AF,ER(引物序列如表一所示)。将PCR产物进行电泳,数码凝胶图像采集与分析系统进行扫描分析,最终回收PCR产物CD8αleader-chA21scFv-CD8αhinge-CD28-ICOS-CD3ζ。3、将CD8αleader-chA21scFv-CD8αhinge-CD28-ICOS-CD3ζ交由美国剑桥加基因公司(Addgene,Cambridge,MA,USA)接入pSin(慢病毒)骨架形成pSin-chA21-28ζ质粒,即CAR表达载体。(四)包装CAR表达载体(包装pSin-chA21-28ζ慢病毒质粒),而制得感染混合物1、293T细胞传代培养及准备a、293T细胞复苏及培养(1)细胞培养基:配置含10%灭活胎牛血清、100U/ml青一链霉素的RPMI-1640培养基;(2)从液氮罐取出冻存的293T细胞,迅速放入37℃水浴锅,冻存的293T细胞融化后,在超净台内将细胞悬液移入离心管中,加入4ml的RPMI-1640培养基,放入离心机中,1000转/分离心3~4分钟;(3)弃去上清液,加入1ml配制的RPMI-1640培养基轻轻吹打成细胞悬液,移入75cm2细胞培养瓶中,加入RPMI-1640培养基至10ml,放入37℃,5%CO2的细胞培养箱中培养,24小时后给予换液;b、293T细胞传代培养皿中的细胞布满约80~90%时进行传代。将旧的培养基吸走,向培养皿中加入2~3ml的PBS冲洗1遍,吸走PBS,向培养皿中加入0.25%的胰蛋白酶2ml,消化3~5min,注意在倒置显微镜下观察细胞形态的变化,当见到细胞回缩,形态变圆,细胞间连接间隙增大时,向培养皿中加5ml的RPMI-1640培养基终止消化,吸管反复吹打使细胞脱落,制成细胞悬液后,按大约1:3比例传代培养;c、293T细胞冻存(1)生长状态良好的细胞,布满培养瓶约80~90%时可以冻存。细胞消化后吹打成细胞悬液,移入15ml离心管中,放入离心机中,1000转/分离心3~4分钟;(2)弃去上清液,加入含10%二甲基亚砜的灭活胎牛血清1ml,轻轻吹打成细胞悬液,移入细胞冻存管中,做好标记,置入冰上,并迅速投入液氮罐中保存。2、慢病毒质粒的包装(1)取出冻存的293T细胞,并置于75cm2的细胞培养瓶培养;选取融合度60~70%的293T细胞,换液后三小时后备用;(2)将3种包装质粒pMD.G、pMDLg/p、Rev及pSin-chA21-28z质粒按下表比例于1ml无血清无双抗的37℃预热的RPMI-1640中混合均匀,室温孵育5分钟,而获得质粒混合物;pMDLg/p5.5μgRev3μgpMD.G4.5μgpSin-chA21-28z13μg总计26μg(3)将26μg的上述质粒混合物与39μl脂质体2000(质粒与脂质体2000的比率为1μg:1.5μl)逐滴加入1ml无血清无抗生素的RPMI-1640中轻轻混合均匀,室温孵育5分钟,而获得混合液;(4)将最终的脂质体2000及质粒共混物的混合液逐滴加到293T细胞培养皿中,轻轻混合均匀,37℃、5%CO2培养箱中培养;(5)收集转染24小时和48小时的293T细胞上清液;(6)取收集的293T细胞上清液约35ml,收集于50ml离心管中,2000转,10分钟,去除293T细胞碎片,而获得去碎片后的上清液;(7)将步骤(6)获得的上清液置于冰上,用60ml注射器连接0.45μm针头滤器将离心后的上清液过滤于35ml超速离心管中,25000转,3小时;(8)将离心管轻轻取出,置于冰上;(9)在病毒专用超净台中,打开金属离心管,吸去部分离心后的病毒上清,用镊子取出超速离心管,吸去大部分上清,剩余约4ml;(10)用5ml移液管反复吹打剩余的4ml病毒上清约10次,0.75ml/管进行分装,放入-80℃冰箱中保存备用,而获得慢病毒颗粒,即感染混合物。(五)、转染外周血单核细胞1、人外周血单核细胞的分离与激活与步骤(一)相同。2、人外周血单核细胞的转染(1)人外周血单核细胞在24孔板中激活12~24小时后,离心24孔板,吸走800μl上清培养液,加入新的培养液,调整每孔细胞数目约0.5×106/200μl;(2)从人外周血单核细胞分选出T细胞并激活,取(7~9)×105激活的T细胞,用CD45RO,CD62L抗体染色,流式细胞仪检测转染前激活的人外周血单核细胞的分型(方法同上);(3)在室温下将冻存的慢病毒颗粒融化,轻轻混匀,将1ml的慢病毒颗粒加入T细胞中,向24孔板中加入凝聚胺,用RPMI1640培养基调整至终浓度为12μg/ml,将24孔板放入离心机离心,2500r/min,离心1.5小时;离心后将24孔板放于37℃、5%CO2培养箱中培养过夜;(4)离心过夜培养的24孔板,去掉大部分含慢病毒颗粒的上清培养液,加入新鲜的RPMI-1640培养液,扩增T细胞;(5)每2天计数T细胞,向RPMI-1640培养基中加入IL-250IU/ml,维持T细胞密度为(0.5~1)×106/ml;(6)2周后,使用抗人CD3,CD45,CD4,CD8,CD45RO,CD62L抗体以及FITC标记的羊抗鼠F(ab')2抗体,进行流式细胞仪分析(方法同上);(7)转染成功的chA21-28-ICOSζCAR-T细胞备用。(六)、表达抗HER2的CAR-T细胞体外功能的检测在检测前,先将实施例1制备的CAR-T细胞与表达HER2的肿瘤细胞株(实施例1所涉及的材料中的细胞系)按如下步骤进行共培养,而获得共培养液:(1)用0.25%胰酶消化肿瘤细胞后,加入RPMI1640培养基中和胰酶,离心后调整细胞密度为1x106/ml,取100μl(1x105)肿瘤细胞接种于U型96孔板中,设置3个复孔;(2)表达抗HER2的chA21-28-ICOSζCAR-T细胞体外培养扩增14天后,离心去掉抗CD3/CD28磁珠,在无IL-2的RPMI1640培养液中培养过夜,使T淋巴细胞静息;(3)收取静息的T淋巴细胞,离心去掉上清,将细胞重悬于RPMI1640培养液中,计数,调整细胞密度为1x106/ml,取100μl(1x105)T细胞接种于U型96孔板中已经接种肿瘤细胞的相应的孔中,将96孔板放置于37℃、5%CO2培养箱中培养过夜。只有T细胞的孔作为阴性对照孔。1、ELISA法检测共培养液中IFN-γ的含量(1)包被:按说明书指导,将Capture抗体稀释于1X包被缓冲液中,向试剂盒提供的微孔板中的各反应孔中各加0.1ml,塑料贴纸覆盖微孔板,放置4℃过夜;(2)封闭:将过夜后的微孔板用自动ELISA洗板机洗漆4次后,抛干,用IX分析缓冲液100μl封闭1小时;(3)加样:将微孔板再次洗漆4次后,抛干,向各反应孔加入待检测的T细胞与肿瘤细胞共培养的上清液100μl,相应稀释倍数的上清液及IFN-γ标准品(1000pg/ml,倍比稀释至15.6pg/ml),室温孵育2小时;(4)加检测抗体:微孔板洗涤4次后,抛干,按说明书指定将Detection抗体用1X分析缓冲液稀释,取100μl加入各反应孔中,室温孵育1小时;(5)加辣根过氧化物酶标记的二抗:微孔板洗漆4次后,抛干,将HRP标记的抗体用1X分析缓冲液稀释,向各反应孔中各加100μl,室温孵育0.5小时;(6)微孔板洗漆4次后,抛干,向各反应孔中加入新鲜配制的TMB底物溶液100μl,避光孵育15分钟;(7)向各反应孔中加入1M硫酸100μl终止反应;(8)结果判定:在ELISA检测仪上,以空白对照孔调零,检测各孔450nm吸光值(OD值),计算IFN-γ浓度值。检测结果如图2所示。根据图2可知,chA21-28-ICOSζCAR-T细胞可以特异性的识别所有HER2+的肿瘤细胞并大量分泌IFN-γ,针对乳腺癌细胞(SKBR3)分泌的IFN-γ高达19000pg/ml以上,但将chA21-28-ICOSζCAR-T细胞与HER2阴性的MDA-MB-468和TC-1细胞共培养时,细胞培养液上清中只能检测到非常低剂量的IFN-γ。而NT-T细胞与HER2阳性的肿瘤细胞共培养时,细胞培养液上清中检测不到IFN-γ。因此,结果表明:HER2-特异性的T细胞可以特异性的识别并杀伤HER2阳性的肿瘤细胞。2、ELISA法检测共培养液中IL-2的含量检测步骤与IFN-γ的步骤相同,检测结果如图3所示。根据图3可知,chA21-28-ICOSζCAR-T细胞可以特异性的识别所有HER2+的肿瘤细胞并大量分泌IL-2,针对乳腺癌细胞(SKBR3)分泌的IL-2高达2800pg/ml以上。但将chA21-28-ICOSζCAR-T细胞与HER2阴性的MDA-MB-468和TC-1细胞共培养时,细胞培养液上清中只能检测到非常低剂量的IL-2。而NT-T细胞与HER2阳性的肿瘤细胞共培养时,细胞培养液上清中检测不到IL-2。因此,结果表明:HER2-特异性的T细胞可以特异性的识别并杀伤HER2阳性的肿瘤细胞。3、CAR-T细胞的抗原特异性评价试验(1)包被:用200μl5μg/mlHER2-Fc嵌合蛋白或者CD19-Fc嵌合蛋白的包被96孔板,用塑料贴纸覆盖96孔板,4℃过夜;(2)加入活化的T细胞:次日,PBS洗涤3次后,抛干,向96孔板中加入1×105个chA21-28-ICOSζCAR-T细胞或NTT细胞,37℃培养过夜;(3)酶联免疫法检测IFN-γ的分泌,检测结果如图4所示。根据图4可知,NT-T细胞对HER2-FC嵌合蛋白和CD19-FC嵌合蛋白均无特殊反应,chA21-28-ICOSζCAR-T细胞对CD19-Fc嵌合蛋白也无特殊反应,但是在HER2-FC嵌合蛋白封闭的96孔板中,chA21-28-ICOSζCAR-T细胞释放了大量的INF-γ,且高达19000pg/ml以上。4、51Cr释放试验检测chA21-28-ICOSζCAR-T细胞杀伤乳腺癌细胞能力(1)收获处于对数生长期的乳腺癌细胞(SKBR3),调整细胞浓度为2×106/ml;(2)取1×106细胞(0.5ml),加Na251CrO4100uCi,37度孵育2~3h,每15min轻轻振摇一次;(3)用10%FCSRPMI1640洗涤3次,每次800rpm、5min。(4)重悬细胞浓度1×105/ml;(5)96孔U型培养板中,每孔加100μl(1x104细胞),设3个复孔;(6)按照效应T细胞与靶细胞为1:1,3:1和10:1的比例,每孔加入100μl不同细胞浓度的实施例1制备的CAR-T细胞;设置最大释放组,向乳腺癌细胞加100μl1%TritonX-100;设置自然释放组,向乳腺癌细胞中加100μlRPMI1640培养基;(7)200g离心1min,放入37℃、5%CO2孵箱培养4h。(8)200g离心1min,每孔取出100μ上清,用Wizard2gamma计数(PerkinElmer)检测;(9)计算:特异性杀伤率(%)=(实验组cpm-自然释放cpm)/(最大释放组-自然释放cpm),计算结果图5所示。根据图5可知,chA21-28-ICOSζCAR-T细胞特异性的裂解HER2-阳性的SKBR3肿瘤细胞,而NTT细胞对于HER2阳性或者阴性的SKBR3肿瘤细胞均未有裂解作用。同时,将NT-T细胞和chA21-28-ICOSζCAR-T细胞分别与表达HER2的SK0V3细胞共培养24小时后,可以看到NT-T细胞对SK0V3细胞的生长没有影响,而加入chA21-28-ICOSζCAR-T细胞的培养皿中可以看到T细胞集落的形成,且SKBR3肿瘤细胞明显减少。5、统计分析所有数据均为表示。利用GraphPadPrism5.0(GraphPadSoftware,Inc.,SanDiego,CaliforniaUSA)软件,T检验法分析细胞因子分泌的差异及特异性细胞裂解的差异。P<0.05认为有统计学意义。综上所述,本发明感染混合物感染T细胞后制得的CAR-T细胞对表达HER2的肿瘤细胞具有良好的杀伤效果,且CAR-T细胞与乳腺癌细胞(SKBR3)共培养时分泌的INF-γ高达19000pg/ml以上,IL-2高达2800pg/ml以上,远高于其他第三代CAR-T细胞分泌的INF-γ和IL-2。以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效变换,或直接/间接运用在其他相关的
技术领域:
均包括在本发明的专利保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1