富勒烯炔基衍生物及其制备方法与流程
本发明涉及一种富勒烯衍生物的合成领域,具体涉及一种富勒烯炔基衍生物及其制备方法。
背景技术:
炔基是有机合成中重要的官能团,也是合成甾体、类胡萝卜素、维生素B、烟碱等天然产物和具有生物活性的药物中间体的重要前体片段。其中,端基炔烃中的C-H键具有弱酸性,可以通过金属、有机小分子和无机碱等活化,使端炔具有很高的化学反应活性,它不仅是构筑C-C键的重要手段,也是一些串联反应及多组分反应的重要合成砌块。
共轭聚合物被广泛的用于电子器件、光学器件和非线性光学材料等众多领域。一直以来,多聚炔烃和聚二炔只是用作非芳香性的共轭聚合物的骨架(Schreiber,M.,Adv.Mater.1994,6,786-790)。随着富勒烯化学的发展,近年来人们期望将富勒烯与炔基单元结合起来,以构筑新型的,既具有富勒烯的氧化还原性质,又具有共轭炔烃性质的全碳材料(Nierengarten,J.-F.Helv.Chim.Acta 1997,8,293-316)。而富勒烯炔基化合物是构筑这种全碳材料的基本单元。因此,如何简单高效的制备富勒烯炔基化合物是人们面临的首要问题。
Komatsu等利用富勒烯的缺电性,尝试了富勒烯与(三甲硅基)乙炔锂的反应。由于炔基锂相对比较稳定,亲核性较差,在室温下,他们并没有得到预期的产物,而在回流的甲苯溶液中得到了富勒烯炔基衍生物(Komatsu,K.J.Org.Chem.1994,59,6101-6102;Murata,Y.,Tetrahedron 1996,52(14):5077-5090)。Anderson等也用同样的方法合成了一系列的富勒烯炔基化合物(Anderson,H.L.Angew.Chem.Int.Ed.Engl.1994,33,1366-1368)。但是,这些方法都是基于富勒烯与炔基锂的反应,但炔基锂制备条件较为苛刻,需要在无水无氧的条件下制备。因此,开发一种简单高效的富勒烯炔基衍生物的一锅合成法具有重要的意义。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种的富勒烯炔基衍生物及其制备方法,制备方法简单有效,操作方便,避免了使用危险的有机锂试剂,为开发新的富勒烯材料提供了条件。
一种富勒烯炔基衍生物,该化合物的结构为:
式中:R1为-H、-OCH3或-HCC;R2为-H或-CH2Ph。
所述的富勒烯炔基衍生物的制备方法,具有以下步骤:
(1)在惰性气体保护的无水溶剂中,加入C60、苯基乙炔与四丁基氢氧化铵的甲醇溶液,60-110℃下回流0.5-2h,得到中间体苯炔基富勒烯一价负离子R1PhCCC60–;
(2)向步骤(1)所得的反应溶液中加入3-7倍C60化学当量的三氟乙酸反应10-50min,或加入10-50倍C60化学当量的苄基溴反应1-2h;
(3)将步骤(2)所得的反应溶液冷却后,浓缩,过滤,得到粗产物;
(4)将步骤(3)所得的反应粗产物进行分离纯化,得到炔基富勒烯化合物。
C60、苯基乙炔与四丁基氢氧化铵的摩尔比为1:10-50:3-5。
苄基溴为亲电试剂,三氟乙酸为质子化溶剂。
步骤(1)中,四丁基氢氧化铵的甲醇溶液的浓度为1mol/L。
所述步骤(1)中惰性气体为N2气或Ar气,优先Ar气。
所述步骤(1)中无水溶剂为邻二氯苯或苯腈。
所述步骤(1)中所述的C60、苯基乙炔与四丁基氢氧化铵(溶解在甲醇溶液中)的摩尔比为1:20:3。
所述步骤(1)中反应温度为100℃,反应时间为1-1.5h。
所述步骤(2)中三氟乙酸与C60的摩尔比为5:1,反应时间为15-20min。
所述步骤(2)中苄基溴与C60的摩尔比为20:1,反应时间为1.5-2h。
所述的富勒烯炔基衍生物的制备方法,其特征在于,具有以下步骤:
(1)在惰性气体保护的无水溶剂中,加入C60、苯基乙炔与四丁基氢氧化铵(溶解在甲醇溶液中),三者的摩尔比为1:10-50:3-5,60-110℃下回流0.5-2h,得到中间体苯炔基富勒烯一价负离子R1PhCCC60–;
(2)向步骤(1)所得的反应溶液中加入3-7倍C60化学当量的三氟乙酸反应10-50min或加入10-50倍C60化学当量的苄基溴反应1-2h;
(3)将步骤(2)所得的反应溶液冷却后,旋蒸浓缩,甲醇超声冲洗过滤,得到粗产物;
(4)将步骤(3)所得的反应粗产物用Buckyprep硅胶柱为分离柱,甲苯为流动相,采用高效液相色谱法进行分离纯化,得到炔基富勒烯化合物。
本发明与现有技术相比,具有以下有益效果:
(1)本发明用四丁基氢氧化铵作为碱,与具有弱酸性的端炔反应,生成炔基负离子再与富勒烯发生亲核反应,避免了使用制备条件较为苛刻的炔基锂试剂。本方法更为简单有效。
(2)反应过程中生成炔基富勒烯负离子,可与亲电试剂反应,可通过变换亲电试剂的官能团制备其他功能性富勒烯化合物,为开发新的富勒烯材料提供了条件。
(3)本发明可以通过改变苯炔烃上的取代基团与使用不同的亲电试剂,制备不同取代基团的产物,适用范围广泛。
(4)本发明制备的炔基化合物,既保留了富勒烯优良的氧化还原性质,又引入了共轭苯炔基团,有望在光电器件与非线性光学领域有重要应用。
(5)本发明制备的富勒烯炔基氢化物,可进一步反应,是制备富勒烯炔基二聚体和多聚体的基本单元。
附图说明
图1为实施例1中制备的1,2-苯炔基富勒烯氢化物的紫外可见光谱图。
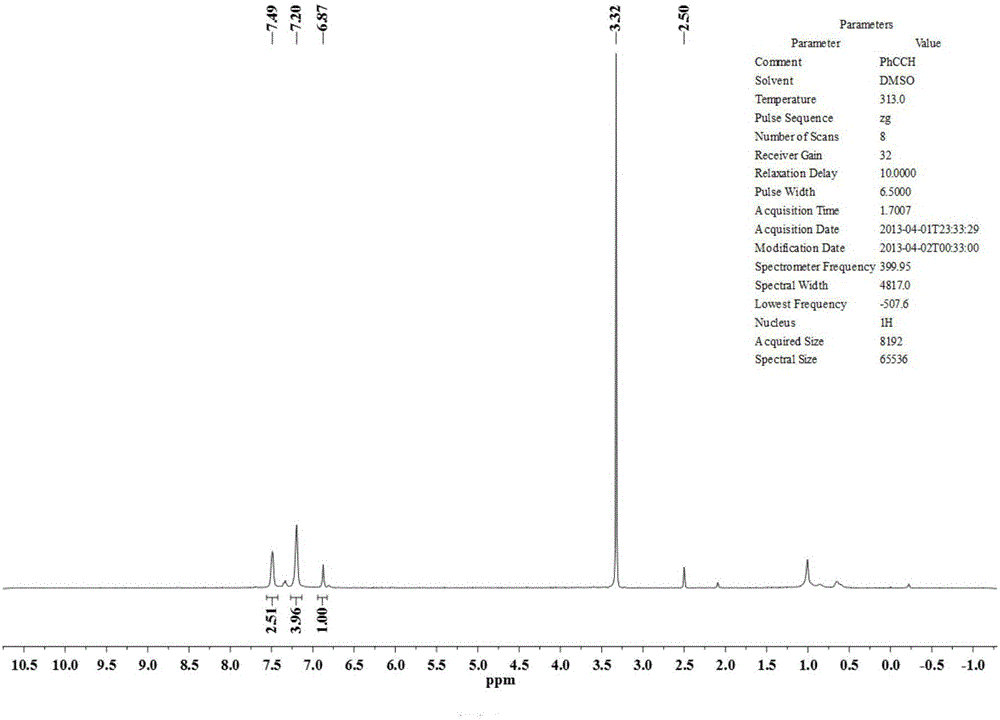
图2为实施例1中制备的1,2-苯炔基富勒烯氢化物的1H核磁图。
图3为实施例2中制备的1,2-(对甲氧基)苯炔基富勒烯氢化物的紫外可见光谱图。
图4为实施例2中制备的1,2-(对甲氧基)苯炔基富勒烯氢化物的1H核磁图。
图5为实施例3中制备的1,2-(对乙炔基)苯炔基富勒烯氢化物的紫外可见光谱图。
图6为实施例3中制备的1,2-(对乙炔基)苯炔基富勒烯氢化物的1H核磁图。
图7为实施例4中制备的1,2-苯炔基,苄基-富勒烯化合物的紫外可见光谱图。
图8为实施例4中制备的1,2-苯炔基,苄基-富勒烯化合物的1H核磁图。
具体实施方式
下面对结合具体实例,对本发明进行清楚、完整的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的其他实施例,都属于本发明保护的范围。
实施例1
1,2-苯炔基富勒烯氢化物的制备方法:
取36mg C60(0.05mmol)与20倍化学当量的苯乙炔(110μL)溶于20mL邻二氯苯溶液中,通氩气10min除去溶剂中的氧气,然后向溶液中加入3倍化学当量的1.0M TBAOH/CH3OH溶液(150μL),100℃下回流1h,再加入5倍化学当量的三氟乙酸反应20min后停止反应。减压蒸馏除去溶剂,用甲醇冲洗,洗去多余的反应试剂,得到反应粗产物。粗产物经过干燥后溶于甲苯,离心后除去不溶物,得到的清液通过高效液相色谱进行分离半制备(Buckyprep硅胶柱为分离柱,甲苯为洗脱剂),分离出1,2-苯炔基富勒烯氢化物。产物的结构经过通过HRMS、Uv-vis光谱、1H NMR和13C NMR得到确认。表征数据为:Positive ESI-ICR HRMS:calcd for[M]+(C68H6+)822.0464,found 842.0471;1H NMR(600MHz,CS2/d6-DMSO)δ7.47(m,2H),7.17(m,3H),6.85(s,1H);13C NMR(125MHz,CS2/d6-DMSO)δ151.26,151.05,147.45,147.19,146.52,146.26,146.09,145.65,145.59,145.48,145.41,145.30,145.23,144.57,144.40,143.11,142.50,142.47,142.00,141.94,141.92,141.77,141.60,141.52,140.29,140.27,136.43,136.01,135.03,132.07,128.82,128.49,122.52,92.35,84.03,61.76,54.98.UV-vis(toluene)λmax:326and 434nm。
图1为实施例1中制备的1,2-苯炔基富勒烯氢化物的紫外可见光谱图。
图2为实施例1中制备的1,2-苯炔基富勒烯氢化物的1H核磁图。
实施例2
1,2-(对甲氧基)苯炔基富勒烯氢化物的制备方法:
取36mg C60(0.05mmol)与20倍化学当量的对甲氧基苯乙炔(130μL)溶于20mL ODCB溶液中,通氩气10min除去溶剂中的氧气,然后向溶液中加入3倍化学当量的1.0M TBAOH/CH3OH溶液(150μL),100℃下回流1h,再加入5倍化学当量的三氟乙酸反应20min后停止反应。减压蒸馏除去溶剂,用甲醇冲洗,洗去多余的反应试剂,得到反应粗产物。粗产物经过干燥后溶于甲苯,离心后除去不溶物,得到的清液通过高效液相色谱进行分离半制备(Buckyprep硅胶柱为分离柱,甲苯为洗脱剂),分离出1,2-(对甲氧基)苯炔基富勒烯氢化物。产物的结构经过通过Uv-vis光谱、1H NMR和13C NMR得到确认。表征数据为:1H NMR(500MHz,CS2/d6-DMSO)δ7.39(d,J=8.5Hz,2H),6.85(s,1H),6.68(d,J=8.5Hz,2H),3.64(s,3H);13C NMR(150MHz,CS2/d6-DMSO)δ159.70,151.18,151.14,147.23,146.97,146.32,146.04,145.86,145.44,145.39,145.33,145.30,145.24,145.18,145.06,145.00,144.35,144.20,142.88,142.26,141.79,141.76,141.72,141.69,141.64,141.60,141.38,141.33,141.29,140.07,140.01,135.84,134.72,133.26,114.29,113.90,90.84,83.97,61.77,54.84,54.55;UV-vis(toluene)λmax:327and 434nm。
图3为实施例2中制备的1,2-(对甲氧基)苯炔基富勒烯氢化物的紫外可见光谱图。
图4为实施例2中制备的1,2-(对甲氧基)苯炔基富勒烯氢化物的1H核磁图。
实施例3
1,2-(对乙炔基)苯炔基富勒烯氢化物的制备方法:
取36mg C60(0.05mmol)与20倍化学当量的1,4-二乙炔基苯(126mg)溶于20mL ODCB溶液中,通氩气10min除去溶剂中的氧气,然后向溶液中加入3倍化学当量的1.0M TBAOH/CH3OH溶液(150μL),100℃下回流1h,再加入5倍化学当量的三氟乙酸反应20min后停止反应。减压蒸馏除去溶剂,用甲醇冲洗,洗去多余的反应试剂,得到反应粗产物。粗产物经过干燥后溶于甲苯,离心后除去不溶物,得到的清液通过高效液相色谱进行分离半制备(Buckyprep硅胶柱为分离柱,甲苯为洗脱剂),分离出1,2-(对乙炔基)苯炔基富勒烯氢化物。产物的结构经过通过HRMS、Uv-vis光谱、1H NMR和13C NMR得到确认。表征数据为:Positive ESI-ICR HRMS:calcd for[M]+(C70H6+)846.0464,found846.0456;1H NMR(500MHz,CS2/d6-DMSO)δ7.39(d,J=8.5Hz,2H),6.85(s,1H),6.67(d,J=8.5Hz,2H),3.64(s,3H);13C NMR(125MHz,CS2/d6-DMSO)δ151.11,150.74,147.47,147.20,146.49,146.30,146.27,146.12,146.10,145.63,145.62,145.42,145.41,145.32,145.24,144.57,144.39,143.12,142.53,142.49,141.99,141.95,141.92,141.74,141.61,141.54,140.31,135.96,135.08,132.24,131.85,123.04,122.72,94.21,83.43,83.33,61.79,54.98;UV-vis(toluene)λmax:327and 434nm。
图5为实施例3中制备的1,2-(对乙炔基)苯炔基富勒烯氢化物的紫外可见光谱图。
图6为实施例3中制备的1,2-(对乙炔基)苯炔基富勒烯氢化物的1H核磁图。
实施例4
1,2-苯炔基,苄基-富勒烯化合物的制备方法:
取36mg C60(0.05mmol)与20倍化学当量的对苯乙炔(110μL)溶于20mL ODCB溶液中,通氩气10min除去溶剂中的氧气,然后向溶液中加入3倍化学当量的1.0M TBAOH/CH3OH溶液(150μL),100℃下回流1h,再加入20倍化学当量的苄基溴2h后停止反应。减压蒸馏除去溶剂,用甲醇冲洗,洗去多余的反应试剂,得到反应粗产物。粗产物经过干燥后溶于甲苯,离心后除去不溶物,得到的清液通过高效液相色谱进行分离半制备(Buckyprep硅胶柱为分离柱,甲苯为洗脱剂),分离出1,2-苯炔基,苄基-富勒烯化合物。产物的结构经过通过HRMS、Uv-vis光谱、1H NMR、13C NMR和单晶X射线衍射得到确认。表征数据为:Positive ESI-ICR MS:calcd for[M]+(C75H12+)912.0933,found 912.0950;1H NMR(600MHz,CS2/d6-DMSO)δ7.47(m,2H),7.21-7.16(m,3H),4.97(s,1H);13C NMR(150MHz,CS2/d6-DMSO)δ153.18,152.84,147.09,146.96,145.83,145.79,145.68,145.63,145.52,145.22,144.88,144.74,144.71,144.38,143.98,143.95,142.46,142.00,141.95,141.58,141.49,141.34,141.16,141.11,140.62,139.66,138.20,136.14,134.02,133.58,131.47,131.25,128.28,128.00,127.60,126.65,122.10,87.79,86.47,65.79,60.03,49.92.;X-ray Crystal data for 11:Empirical formula:C75H12;Formula weight:912.85;Crystal system,space group:Monoclinic,P2(1)/c;Unit cell dimensions:α=90.00°,β=115.3050°,γ=90.00°;Volume:Calculated density:1.632Mg m–3;Crystal size:0.32x 0.18x 0.13mm;Reflections collected:23317;Max.and min.transmission:0.9879and 0.9706;Final R indices[I>2σ(I)]:R1=0.0516,wR2=0.0843;R indices(all data):R1=0.1342,wR2=0.1083。
图7为实施例4中制备的1,2-苯炔基,苄基-富勒烯化合物的紫外可见光谱图。
图8为实施例4中制备的1,2-苯炔基,苄基-富勒烯化合物的1H核磁图。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。
对本领域普通技术人员来说,可以根据上述说明或本发明的原理加以改进或变换。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽范围。
- 还没有人留言评论。精彩留言会获得点赞!