一种精确定量检测诺如病毒Ⅰ型的试剂盒及检测方法与流程
本发明属于分子生物学领域,具体涉及一种用于检测诺如病毒Ⅰ型的试剂盒和寡核苷酸,更确切的说,是一种检测诺如病毒Ⅰ型的反转录—微滴式数字聚合酶链式反应(droplet digital reverse transcriptional polymerase chain reaction,RT-ddPCR))快速定量检测试剂盒。
背景技术:
诺如病毒(Norovirus)属于杯状病毒科,为无包膜单股正链RNA病毒,基因组全长为7.5-7.7kp,包括3个开放阅读框(Open Reading Frame,ORF),其中ORF1编码核苷酸三磷酸酶、蛋白酶和RNA依赖的RNA多聚酶(RNA-dependent RNA polymerase,RdRp)等非结构蛋白,ORF2编码主要结构蛋白VP1,ORF3编码次要结构蛋白。基于RdRP和VP1基因序列信息的不同,诺如病毒可被分为5种基因型GⅠ-GⅤ。其中GⅠ和GⅡ最为常见,为感染人的主要病毒基因型。
诺如病毒是全世界范围内引起非细菌性胃肠炎暴发的主要食源性病毒,可感染各年龄组人群,尤其是儿童,引起患者恶心、呕吐、腹痛,甚至低热、头痛、肌痛、乏力及食欲减退等症状。其传播途径为:传染源→粪便→水体(食品)→人体传播,污染的水和食物尤其贝类是传播的主要载体。诺如病毒对环境具有较强的耐受性,在酸性(pH 2.7)条件下、加热(60℃)条件及自来水中游离氯(3.75~6.25mg/L)浓度条件下,仍具感染性,预防手段十分有限。因此,对环境和食品中诺如病毒进行检测和分析,有利于水体环境及贝类海产品诺如病毒污染风险评估的开展,进而对食源性病毒病的暴发进行有效的预警,保护人类健康,保障食品贸易正常进行。
虽然诺如病毒Ⅰ型是严格的细胞内寄生物,在食品中不能繁殖,但是其感染性强,甚至少于102拷贝数/mL的病毒颗粒都能导致感染。而可能存在诺如病毒Ⅰ型污染的食品样品中,其病毒滴度通常处于比较低的水平。因此需要一种针对诺如病毒Ⅰ型的精确定量检测方法,实现对诺如病毒Ⅰ型的有效监控。目前,诺如病毒Ⅰ型的定量检测方法主要包括以聚合酶链式反应(Polymerase Chain Reaction,PCR)基础的实时荧光定量PCR(Real-time Fluorescent Quantitative PCR,RT-qPCR)和反转录-环介导恒温核酸扩增(Realtime reverse transcription lood-mediated isothermal amplification,RT-LAMP)法。这两种方法需要经过仔细校准的标准曲线和稳定的诺如病毒Ⅰ型标准物质,而且每次检测都需建立标准曲线,因此,结果分析中潜在主观因素的存在,造成了多次检测间结果的差异和不同实验室间结果的多样性,影响诺如病毒Ⅰ型定量检测的标准化和规范化。
近年来发展起来的数字PCR(Digital PCR,dPCR)技术是一种全新的核酸定量检测方法。目前,数字PCR包括:微反应室/孔板数字PCR(Chamber Digital PCR,cdPCR)、微流体数字PCR(Microfluidic Digital PCR,mdPCR)(大规模集成微流控芯片)和微滴式数字PCR(Droplet Digital PCR,ddPCR)三种dPCR系统。目前,国内外均未见利用RT-ddPCR进行诺如病毒Ⅰ型定量检测的相关报道。
技术实现要素:
本发明的目的是提供一组特异性强、灵敏度高的用于检测诺如病毒Ⅰ型的RT-ddPCR引物和探针。
本发明的另一个目的是提供一种操作简单、结果准确的诺如病毒Ⅰ型RT-ddPCR快速定量检测试剂盒。
为实现上述目的,本发明采用以下技术方案:
本发明通过分析诺如病毒Ⅰ型的基因组构成,选取其分型基因片段RdRp-VP1,设计出特异性引物和探针,所述用于检测诺如病毒Ⅰ型的引物和探针的序列见表1,其中,探针5’标记FAM,3’标记BHQ。
表1 RT-ddPCR引物和探针序列
本发明还提供一种精确定量检测诺如病毒Ⅰ型的试剂盒,该试剂盒包括上述用于检测诺如病毒Ⅰ型的引物和探针。进一步地,该试剂盒还包括完成RT-ddPCR反应所需材料和试剂,例如诺如病毒Ⅰ型阳性对照RNA、one-step RT-ddPCR supermix、醋酸镁、微滴生成油、微滴生成卡、96孔板和铝箔热封膜等,上述材料和试剂优选为单独包装。
本发明还提供了一种诺如病毒Ⅰ型精准定量的检测方法,即RT-ddPCR方法,其包括以下内容:
1.提取待测样品RNA,可以使用传统Trizol法提取方法或商业化试剂盒进行提取;
2.配制RT-ddPCR反应体系,其中,所述反应体系包括序列表中SEQ ID NO.1至SEQ ID NO.3所示的引物和探针。在本发明的一个具体实施方案中,RT-ddPCR反应体系如表2所示;
表2诺如病毒Ⅰ型ddPCR反应体系
3.将步骤2.配制的RT-ddPCR反应体系和微滴生成油加入微滴生成卡中,置于微滴生成仪中生成微滴;
4.进行扩增反应,反应条件见表3;
表3诺如病毒Ⅰ型RT-ddPCR反应条件
注:升降温速度应≤2.5℃/s
5.结果判定。
将扩增后的96孔板置于微滴读取仪(QX200,Bio-Rad,Pleasanton,CA)中,利用QuantaSoft软件进行结果读取和分析。含有扩增产物的阳性微滴与不含扩增产物的阴性微滴会呈现出荧光信号强度的差异,以阴性微滴簇荧光幅度的最高点为界来设定阈值线。按照泊松分布原理计算获得RT-ddPCR反应体系内诺如病毒Ⅰ型目的片段含量,进而通过RNA模板加样量(2μL)和提取的RNA模板体积数,按以下公式计算获得样品中诺如病毒Ⅰ型的精准定量。
本发明的优点是:1)对核酸分子的绝对定量避免了由PCR扩增效率差异所导致的偏差;2)无需依赖有证标准物质或其他标准品;3)具有更高的精确度、灵敏性和重复性,易于标准化;4)更适合低拷贝数的核酸检测;5)由于RT-ddPCR是终点检测,对抑制剂的耐受度更高,因此可降低由基质类型所导致的检测偏差。
下面结合说明书附图和具体实施方式对本发明作进一步说明,凡依照本发明公开内容所做的任何本领域的等同替换,均属于本发明的保护范围。
附图说明
图1不同退火温度条件下诺如病毒Ⅰ型目的片段RT-ddPCR检测结果。
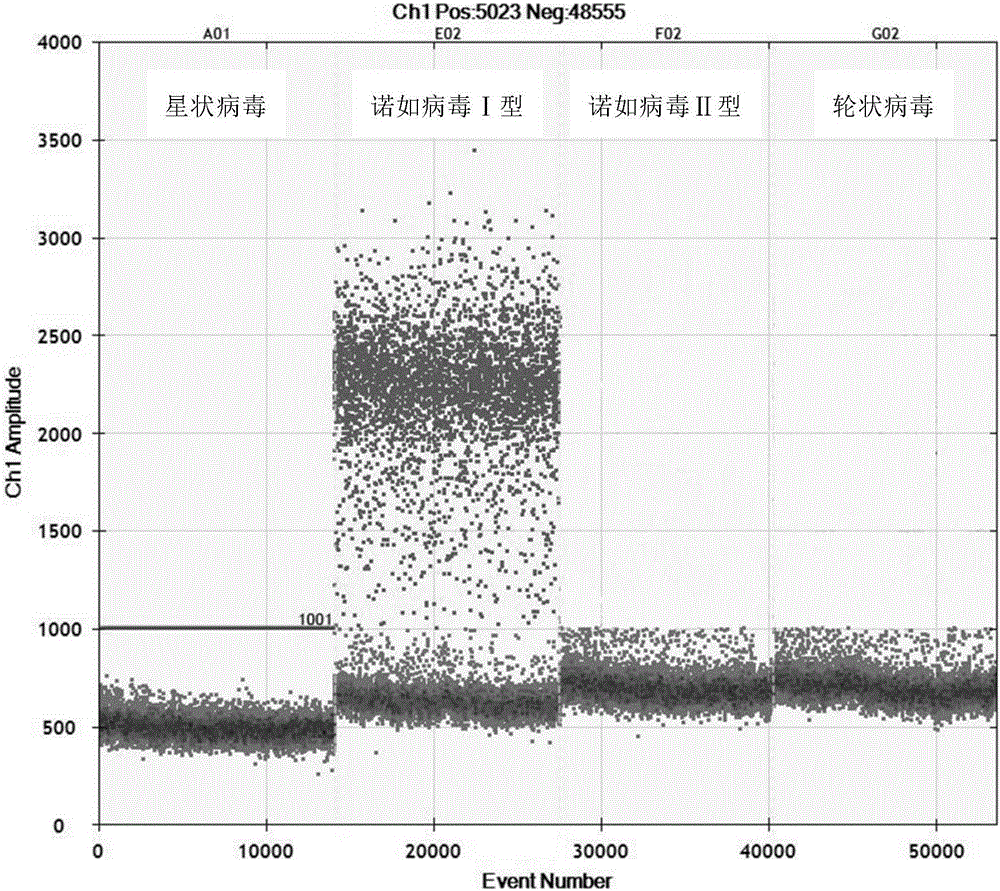
图2 RT-ddPCR试剂盒检测诺如病毒Ⅰ型特异性分析结果。
图3 RT-ddPCR试剂盒检测诺如病毒Ⅰ型灵敏度分析结果。
图4 RT-ddPCR试剂盒检测诺如病毒Ⅰ型重复性分析结果。
具体实施方式
实施例1 RT-ddPCR引物、探针设计
为实现对诺如病毒Ⅰ型的特异性检测和绝对定量分析,我们选取诺如病毒分型基因片段RdRp-VP1,通过NCBI在线工具进行序列分析和比对,利用Prime Express软件V4.0(ABI,Foster City,CA,USA)设计出10余对引物和探针组合,经过筛选最终获得特异性强、适用于RT-ddPCR引物/探针组合各1套,序列见表1。其中探针5’端标记FAM,3’端标记BHQ。引物/探针均由北京六合通经贸有限公司合成。
实施例2检测方法的建立
(1)RNA提取:利用商业化试剂盒进行提取;或者利用传统Trizol法提取RNA,具体操作如下:①在100μL样品中加入1mL Trizol,震荡30s后,室温放置5min;②加入250μL氯仿,剧烈震荡30s,室温放置5min;4℃,12000g,离心5min;③将上清液转入新离心管中,加入500μL的异丙醇剧烈震荡混匀30s,室温放置5min;④4℃,5000g,离心5min;⑤小心移去上清,沉淀用1mL 70%乙醇清洗后12000g,4℃,离心5min(尽可能吸走上清,离心管置于超净台上将沉淀吹干);⑥加入50μL无RNase水溶解RNA(为了使病毒RNA更好的溶解,置60℃加热10min)。提取的RNA于-80℃保存备用。
(2)按照表2配制20μL的RT-ddPCR反应体系
(3)微滴生成
将20μL的ddPCR反应体系和65μL微滴生成油分别加入到8孔微滴生成卡中,置于微滴生成仪(QX200,Bio-Rad,Pleasanton,CA)中生成微滴。
(4)扩增反应
将生成的油包水的微滴(40μL)缓慢转移至96孔板中,封膜后置于PCR仪(Veriti Thermal cycler,Applied BioSystems,Foster City,CA)上进行扩增反应,扩增条件如表3所示。
(5)结果判定
将扩增后的96孔板置于微滴读取仪(QX200,Bio-Rad,Pleasanton,CA)中,利用QuantaSoft软件进行结果读取和分析。含有扩增产物的阳性微滴与不含扩增产物的阴性微滴会呈现出荧光信号强度的差异,可以阴性微滴簇荧光幅度的最高点为界来设定阈值线。按照泊松分布原理计算获得RT-ddPCR反应体系内诺如病毒Ⅰ型目的片段含量,进而通过RNA模板加样量(2μL)和提取的RNA模板体积数,按以下公式计算获得样品中诺如病毒Ⅰ型的精准定量。
本发明还对RT-ddPCR检测条件进行了优化,例如退火温度,取提取的诺如病毒Ⅰ型RNA作为模板,分别在50℃、55℃、60℃、65℃和70℃的退火温度下进行扩增反应,比较不同条件下RT-ddPCR的检测结果。由图1可见,50℃条件下诺如病毒Ⅰ型目的基因片段的扩增效率偏低,阳性微滴和阴性微滴分界不明显;55℃和60℃条件下目的基因片段扩增效率较高,可出现比较明显的阳性微滴簇,且55℃条件下扩增的荧光信号略高于60℃,因此,将55℃作为最佳退火温度。
实施例3试剂盒组成
1.试剂盒的组成(保存于-20℃)
(1)实施例1设计的用于检测诺如病毒Ⅰ型的引物和探针SEQ ID No.1-3,由北京六合通经贸有限公司合成;
(2)one-step RT-ddPCR supermix、25mM醋酸镁:购自美国BioRad公司,货号186-3021;
(3)微滴生成油:购自美国BioRad公司,货号186-3030;
(4)微滴生成卡:购自美国BioRad公司,货号186-4007;
(5)铝箔热封膜:购自美国BioRad公司,货号181-4000;
(6)Twin Tec Semi-Skirted 96孔板:购自德国Eppendorf公司,货号0030128605;
(7)阴性对照:DEPC水;购自上海生工,货号:D1005;
(8)阳性对照:诺如病毒Ⅰ型RNA标准物质;
(9)DEPC水:购自上海生工,货号:D1005。
2.诺如病毒Ⅰ型RNA标准物质制备
以诺如病毒Ⅰ型RNA为模板,利用引物SEQ ID No.1-2,扩增出约68bp的特异性片断,称之为GⅠ(包含RT-ddPCR扩增靶基因);构建重组质粒pcDNAⅡ-GⅠ(pcDNAⅡ载体购自Invitrogen公司),于上海生工公司进行序列测定,并将测序结果与GenBank中诺如病毒Ⅰ型的基因序列进行同源性分析,其同源性达100%。提取并纯化质粒DNA,用Promega公司的Ribo MAXTM Large Scale RNA Production system-T7试剂盒(货号:P1300)进行体外转录(按试剂盒操作说明书进行),体外转录产物用DNase消化,去除其中的DNA。利用RNeasy MiniElute Cleanup kit(购自QIAGEN公司,货号74204)进一步纯化cRNA。纯化的cRNA于上海生工公司进行序列测定,并将测序结果与GenBank中诺如病毒Ⅰ型的基因序列进行同源性分析,其同源性达100%。将cRNA分装,保存于-80℃。对制备的诺如病毒Ⅰ型RNA标准物质进行均匀性、稳定性检验,均符合相关要求;采用多家实验室定值方法对制备的标准物质进行定值研究,最终制备的诺如病毒Ⅰ型RNA标准物质浓度为:5.43×107copies/μl。-80℃保存,作为试剂盒的阳性对照
实施例4检测方法特异性和灵敏度评价
1.检测特异性分析
(1)材料:轮状病毒、星状病毒、诺如病毒Ⅰ型和诺如病毒Ⅱ型RNA均由中国疾病预防控制中心病毒病所提供。
(2)方法:使用本发明所述试剂盒,对常见的腹泻病毒包括轮状病毒、星状病毒、诺如病毒Ⅰ型和诺如病毒Ⅱ型RNA进行RT-ddPCR扩增检测,观察该试剂盒有无非特异性反应的发生。
(3)结果:轮状病毒、星状病毒、诺如病毒Ⅰ型和诺如病毒Ⅱ型RNA经PCR仪(Veriti Thermal cycler,Applied BioSystems,Foster City,CA)扩增后,采用微滴读取仪(QX200,Bio-Rad,Pleasanton,CA)检测,利用QuantaSoft软件进行结果读取和分析。结果表明,只有诺如病毒Ⅰ型出现阳性微滴,其余病毒均为阴性微滴,证明该方法具有良好的特异性。结果见图2。
2.检测灵敏度分析
(1)材料:前面制备的诺如病毒Ⅰ型RNA标准物质进行10倍梯度稀释至5.43拷贝/μL。
(2)方法:各稀释梯度取2μL,利用实施例3所述的试剂盒进行RT-ddPCR检测,通过分析本发明所述试剂盒所能检测到的最低限,反应体系见表2。
(3)结果:发现利用本发明所述试剂盒,可检测到5.43拷贝/μL诺如病毒Ⅰ型RNA标准物质。结果见图3。可见本试剂盒检测诺如病毒Ⅰ型可达到5.43拷贝/μL,大大提高了诺如病毒Ⅰ型相关检测方法的灵敏度,不依赖标准品,可实现绝对定量,结果直观可靠。
实施例5检测方法准确性和重复性评价
1.检测准确性分析
准确性(truness)是指一组测试结果的平均值与可接受的参考值之间的一致性程度。按照欧盟与Codex的标准,准确度的判定标准是在整个检测动态范围内,测定值应在参考值±25%范围内。
(1)材料:前面制备的诺如病毒Ⅰ型检测RNA阳性对照(5.43×107copies/μl)分别稀释至5.43×103copies/μl、5.43×102copies/μl、5.43×101copies/μl和5.43copies/μl,表示为样品U1-U4(表4)。
(2)方法:各样品分别进行RT-ddPCR检测,每个样品设7个重复,同时设置1个空白对照(以去DEPC水代替模板RNA)。
(3)结果:诺如病毒Ⅰ型RNA的RT-ddPCR测定值均同预计值接近,其标准偏差均<15%(表4),小于25%的判定标准,说明该方法具有非常好的准确性。
表4诺如病毒Ⅰ型RT-ddPCR检测的准确性
2.检测重复性分析
(1)方法:利用前面制备的诺如病毒Ⅰ型RNA阳性对照(5.43×107copies/μl)稀释至5.43×103copies/μl,进行RT-ddPCR检测,设8个重复,同时设置1个空白对照(以去DEPC水代替模板RNA)。
(2)结果:由图4可见,对特定浓度的诺如病毒Ⅰ型RNA阳性对照的测定变异系数CV小于25%,证明该方法用于诺如病毒Ⅰ型定量检测时具有良好的重复性。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无法对所有的实施方式予以穷举。凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!