本发明属于基因工程技术领域,涉及一种小麦基因,特别是涉及一种小麦叶片叶绿素降解过程的关键酶基因。本发明还涉及所述基因的克隆及其编码蛋白。
背景技术:
小麦是我国主要的粮食作物。小麦籽粒产量的2/3来源于花后合成的同化产物,小麦旗叶的衰老与籽粒形成和灌浆成熟同步进行,旗叶过早衰老将严重影响小麦的产量,推迟旗叶衰老的发生、延缓其衰老进程,则可以显著提高小麦产量并改善籽粒品质。据理论推算,在作物成熟期,延长功能叶片寿命一天,产量可增加2%左右。因此,延缓灌浆期小麦叶片衰老(持绿)是提高小麦产量、改善籽粒品质的重要途径之一。叶绿素降解是叶片衰老的主要标志,是在一系列酶的催化下完成的。通过基因工程手段调控叶绿素降解过程关键酶基因的表达,对于揭示小麦衰老机制和延缓衰老进程都具有十分重要的意义。
植物叶绿素a (Chlorophyll a,Chl a)的降解存在两条途径:一是Chl a在叶绿素酶(Chlase,CLH)的催化下先脱植基,生成脱植基叶绿素a (Chlorophyllide,Chlide a),再在脱镁螯合物(Metal cheating substance,MCS)作用下去除镁离子,生成脱镁叶绿酸a (Pheophorbide a,Pheide a);二是Chl a先在MCS作用下脱除镁离子生成脱镁叶绿素a (Pheophytin a,Phein a),再在脱镁叶绿酸水解酶(PPH)作用下脱植基,生成Pheide a。
目前对于植物叶绿素的降解究竟是先脱植基还是先脱镁离子仍然存在争议。具体表现为:1、CLH依旧参与乙烯诱导的果实成熟时叶绿素降解(Shemer T. A, et al. 2008)。2、自然成熟的柑桔中CLH1的表达与品种有关。Jacob-Wilk等发现,柑桔(Citrus sinensiscv.Valencia)在自然成熟时CLH1为低水平组成型表达,而Distefano等发现,卡莱门汀柑桔“Comune”的CLH1表达在桔皮变黄时瞬时增加,随后降低,但“Tardivo”CLH1则始终为低水平表达,因此有必要验证这2种柑桔成熟过程中PPH的作用。3、在有些植物品种中依旧不能排除CLH的功能,如在西葫芦和烟草叶片中异源过表达CLH,可以促进这些叶片中叶绿素的降解(Harpaz-Saad S., et al. 2007)。4、即使是同一植物品种,不同研究者的结论也不一致。如Büchert等在评价青花菜衰老组织中CLH和PPH的作用时发现,CLH的表达与典型的衰老相关基因表达没有关联,两个叶绿素酶同功酶BoCLH1和BoCLH2中的一个在衰老时表达水平下降,激素处理对BoCLH基因表达的影响与观察到的叶绿素含量不相匹配;而PPH的表达与之相反,在诱导衰老的前3天增加,此后保持低水平;采后保绿处理大多抑制了PPH的表达,延迟了叶绿素的降解。这些结果支持了叶绿素降解过程中的脱植基反应由PPH负责。与Büchert的结论相反,Chen等在含有反义叶绿素酶基因BoCLH1的转基因青花菜中发现采后叶绿素的降解被延迟,说明BoCLH在采后叶绿素降解中起关键作用。5、叶绿素降解的2条途径(即由脱镁叶绿素到脱镁叶绿酸和由脱植基叶绿素到脱镁叶绿酸)都存在,如Cabbage(Heaton J.W., et al, 1996)、柑橘和荷兰芹(Amir-Shapira D., et al, 1987)。尽管存在上述争议,现有证据表明至少在水稻和拟南芥叶片衰老时,CLH可能是不活跃的。欧洲油菜的叶绿素降解也被认为是从脱镁开始的(Langmeier M., et al, 1993)。
小麦叶片叶绿素降解会导致其光合能力下降,进而影响小麦植株的生长和发育,最终导致产量下降。因此,研究小麦叶片衰老过程中叶绿素降解机制,对于利用基因工程手段选育持绿性小麦品种具有重要意义。鉴于此,从小麦叶片中克隆脱镁叶绿素脱镁叶绿酸水解酶基因(Pheophytin Pheophorbide Hydrolase,TaPPH),并进行功能研究,将有助于揭示小麦叶片衰老过程中叶绿素的降解机制,为利用生物工程手段选育持绿性小麦品种提供基础。
技术实现要素:
本发明的目的是提供一种小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH,以及由所述基因编码的蛋白TaPPH。
本发明所述的小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH,其cDNA的核苷酸序列如SEQ ID No.2所示,基因cDNA全长2490bp,包括1032bp的开放阅读框(open reading frame,ORF),698bp的5’非翻译区(untranslated region,UTR)和760bp的3’UTR。
进一步地,本发明所述小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH编码的蛋白TaPPH,其氨基酸序列如SEQ ID No.3所示,所述蛋白由343个氨基酸组成,分子量约为38.65kDa。TaPPH具有PPH蛋白拥有的保守结构域:酯酶-脂肪酶超家族结构域和α/β水解酶催化结构域。
本发明中,编码所述蛋白TaPPH的基因,其核苷酸序列包括但不限于SEQ ID No.2所示的序列,还可以是经过密码子优化的编码蛋白TaPPH的其他核苷酸序列。
本发明提供的小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH是通过电子克隆结合常规PCR方法获得的。根据NCBI上公布的拟南芥AtPPH基因序列(GenBank注册号:NM_121383)作为查询序列,检索小麦EST数据库,将所有匹配片段进行组装,挑选含有较长ORFs的contig作为候选目的片段。以此候选片段为模板,利用Primer Premier 5.0软件设计数对引物,分别对反转录得到的小麦叶片cDNA模板进行PCR扩增,琼脂糖凝胶电泳检测扩增片段。根据上述分离得到的TaPPH基因中间片段设计特异性引物进行RACE PCR反应,扩增出一些条带,分别切胶回收。将回收得到的DNA纯化后连接pEasy-T5 Zero克隆载体,转化Trans1-T1 Phage Resistant化学感受态细胞,筛选阳性克隆,分别测序。将测序得到的序列与中间片段进行序列比对,初步确定目的基因的5’端及3’端片段。将所获得的中间片段、5’端片段和3’端片段通过软件ContigExpress拼接,最终获得了核苷酸序列如SEQ ID No.2所示的小麦TaPPH基因的全长cDNA序列。
本发明所述小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH能够应用在小麦品种的改良中。
进一步地,本发明所述的小麦脱镁叶绿素脱镁叶绿酸水解酶基因TaPPH能够应用于培育持绿性小麦中,用于延缓小麦的衰老。
更近一步地,本发明所述的基因TaPPH能够在研究水稻、拟南芥等植物的持绿性中应用。
本发明提供了一种小麦脱镁叶绿素脱镁叶绿酸水解酶基因(TaPPH)及其编码的蛋白TaPPH。该基因在小麦叶片中表达量最高,并在黑暗诱导离体叶片和小麦叶片自然衰老过程中表现为升高-下降-升高的表达趋势,表明基因TaPPH受黑暗诱导表达。外源施加脱落酸(Abscisic acid,ABA)和乙烯利(Ethephon,Eth)处理小麦后,基因TaPPH的表达量增加;但外源施加6-苄氨基嘌呤(6-Benzylaminopurine, 6-BA)处理后,TaPPH基因的表达水平在4~24小时降低,表明TaPPH受ABA和乙烯的诱导表达上调,受细胞分裂素诱导表达下调;也说明TaPPH基因确实与小麦叶片衰老有关。
将本发明提供的小麦脱镁叶绿素脱镁叶绿酸水解酶基因(TaPPH)以反义形式转入小麦、水稻、拟南芥等植物中,可以延缓其衰老。为进一步揭示植物叶片衰老过程中的叶绿素降解机制,以利用生物工程手段选育持绿性品种提供了基础。
附图说明
图1是由保守序列设计特异性引物扩增得到的TaPPH中间片段。
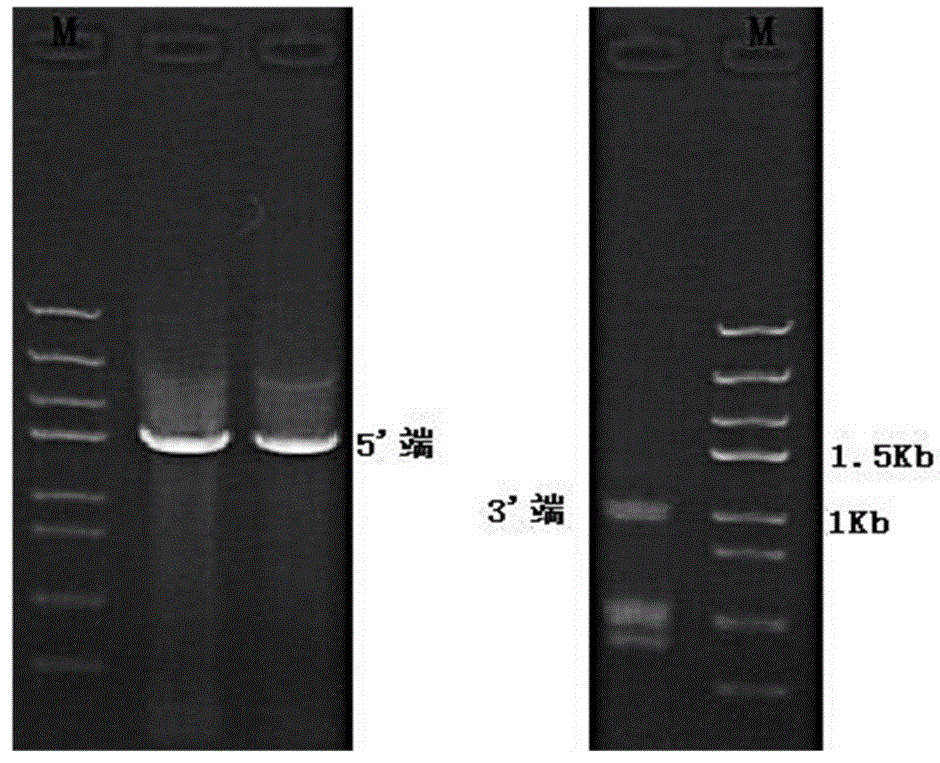
图2是由RACE-PCR反应获得的TaPPH的5’端片段及3’端片段。
图3是根据TaPPH拼接序列设计特异性引物扩增的产物。
图4是黑暗处理后小麦幼苗叶片中TaPPH的表达特性。
图5是ABA和乙烯利处理后小麦幼苗叶片中TaPPH的表达特性。
图6是6-BA处理后小麦幼苗叶片中TaPPH的表达特性。
具体实施方式
下述实施例仅为本发明的优选技术方案,并不用于对本发明进行任何限制。对于本领域技术人员而言,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
若未特别指明,实施例中所采用的技术手段均为本领域技术人员所熟知的常规手段。
实施例1:TaPPH的分子克隆。
选取籽粒饱满的长4738小麦种子,置于培养皿中,加去离子水,萌发后种植在花盆中,置于人工气候箱培养,光周期为12h光照,12h黑暗,湿度80%,温度25℃。三叶期时取小麦叶片,经液氮速冻后,于-80℃超低温冰箱保存备用。
利用Omega公司提供的Plant RNA Kit,提取得到小麦幼苗叶片的总RNA。
以质量良好的小麦叶片总RNA做模板,利用Trans Script® All-in-One SuperMix for PCR反转录合成cDNA,将产物置于-20℃保存备用。
将已知的拟南芥AtPPH基因序列(GenBank注册号:NM_121383)作为查询序列,使用blastn程序检索NCBI的Expressed sequence tags(EST)数据库,限定物种为Triticum aestivum (taxid:4565)。将所有匹配结果下载,导入软件ContigExpress进行片段组装,挑选含有较长ORFs的contig作为候选目的片段。以此片段设计如下TaPPH基因编码区引物:
正向引物(Forward, F1):5’-AAGAATGTGGAGTCTGAGGGTT-3’;
反向引物(Reverse, R1):5’-CACGACGGATGTTTGACG-3’。
使用上述引物,对反转录得到的小麦叶片cDNA模板进行PCR扩增,具体的扩增反应体系为:10×TransTaq® HiFi PCR buffer II 3.0μl,2.5mM dNTPs 1.5μl,5mM Primers(F1/R1) 0.6/0.6μl,cDNA 1μl,ddH2O 8μl,TransTaq® HiFi DNA Polymerase 0.3μl,共15μl。PCR反应程序:94℃预变性5min;94℃变性30s,58℃复性30s,72℃延伸1:30min,35个扩增循环;72℃延伸15min,4℃保存。
1.2%琼脂糖凝胶电泳检测扩增片段,获得了图1所示的单一清晰条带,片段大小为389 bp。切胶,用Gel Extraction Kit回收目的片段。
将回收产物与pEasy-T5 Zero克隆载体连接,转化Trans1-T1 Phage Resistant化学感受态细胞,在LB/Amp+固体培养基上37℃过夜培养(16~24h)。之后挑取白色单克隆进行菌落PCR鉴定阳性克隆:挑取阳性克隆接种于4mL LB/Amp+液体培养基中,37℃、240rpm条件下摇菌8~12h,之后提取质粒,双酶切(SpeI/NotI)鉴定,能够得到与PCR产物大小相匹配的目的条带的为阳性质粒。将阳性质粒送华大基因科技服务有限公司测序(测序引物为通用引物M13 F/R),得到中间片段的核苷酸序列如SEQ ID NO.1所示。
与其他植物的同源序列(PPH)进行序列比对,发现该片段与其他已知的PPH基因序列具有很高的相似性,初步判断得到的这个片段为小麦TaPPH基因的中间片段。
根据上述分离得到的SEQ ID NO.1所示核苷酸序列的TaPPH基因中间片段设计如下特异性引物:
GSP1:5’-CCTTATGTTGGAGGCATGCCGCTTC-3’,
NGSP1:5’-GAGGCATGCCGCTTCAAGAATGAG-3’,
GSP2:5’-TGAGGGTTCAGTTGACCTCCCATTTC-3’。
以小麦叶片cDNA为模板,分别配制体系进行5’和3’-RACE PCR反应,扩增出一些条带(如图2所示),分别切胶回收。将回收产物分别与pEasy-T5 Zero克隆载体连接,转化Trans1-T1 Phage Resistant化学感受态细胞,菌落PCR筛选阳性克隆,挑菌并接种于4mL LB/Amp+液体培养基中,37℃、240rpm下摇菌8~12h,之后提取质粒,分别测序(送华大基因科技服务有限公司,测序引物为通用引物M13 F/R)。将测序得到的序列与中间片段进行序列比对,发现图2中5’端一条约1.5kb的序列及3’端一条约900bp的序列与中间片段有重叠区域,初步确定为目的基因的5’端及3’端片段。
将所获得的中间片段、5’端片段和3’端片段通过软件ContigExpress拼接,获得序列长度2490bp的小麦TaPPH基因的全长cDNA序列。ORF Finder检测其包含一个698bp的5’非翻译区、1032bp的翻译区和一个760bp的3’非翻译区。该全长cDNA的核苷酸序列如SEQ ID No.2所示。
根据拼接获得的TaPPH全长cDNA序列,设计1对扩增包含该基因全长ORF的特异性引物:
正向引物(Forward, F2):5’- GGCACCAAGAATAGCAAGGC-3’,
反向引物(Reverse, R2):5’- AACGAACTACGGACGAATCATC-3’。
以此引物(F2/R2)对反转录得到的小麦叶片cDNA进行PCR扩增,反应体系:5×TransTaq® FastPfu Buffer 3.0μl,2.5mM dNTPs 1.5μl,Primers(F2/R2) 0.6/0.6μl,cDNA 1μl,ddH2O 8 μl,TransTaq® FastPfu DNA Ploymerase 0.3μl,共l5μl。PCR反应程序:95℃预变性5min;95℃变性30s,56℃复性30s,72℃延伸1:30min,35个扩增循环;72℃延伸15min。1.2%琼脂糖凝胶电泳检测扩增片段,获得了图3所示的单一清晰条带,切胶,用Gel Extraction Kit回收目的片段,送华大基因科技服务有限公司测序(测序引物为扩增引物F2/R2),测序结果显示,该片段大小为1127bp,其中包含有长度为1032bp的OFR。
实施例2:TaPPH基因的序列信息和特性分析。
TaPPH基因cDNA全长2490bp,包括1032bp的开放阅读框(open reading frame,ORF),698bp的5’非翻译区(untranslated region,UTR)和760bp的3’UTR。该基因编码由343个氨基酸组成的蛋白质TaPPH,预测其分子量大约为38.65kDa。TaPPH具有PPH蛋白拥有的保守结构域:酯酶-脂肪酶超家族结构域和α/β水解酶催化结构域。蛋白质序列比对发现,TaPPH与其它植物的PPH蛋白具有较高的相似性,其中与水稻的OsPPH相似性最高,达到91%。
实施例3:TaPPH基因的表达研究。
利用实时定量PCR(quantitative real-time PCR,qPCR)方法分析小麦不同组织、黑暗诱导和施加外源激素处理后小麦叶片TaPPH基因的表达情况。
试验结果显示,小麦不同器官中,TaPPH基因在叶片中的表达量最高。黑暗诱导小麦离体叶片后,如图4所示,TaPPH基因的表达表现为升高-下降-升高的趋势,表明TaPPH基因受黑暗诱导表达。外源施加脱落酸(abscisic acid,ABA)和乙烯利(Ethephon,Eth)处理小麦,TaPPH基因表达量增加(图5);但外源施加6-苄氨基嘌呤(6-Benzylaminopurine,6-BA)处理后,TaPPH基因的表达水平在4~24h降低(图6);表明TaPPH受ABA和乙烯的诱导表达上调,受细胞分裂素诱导表达下调,也说明TaPPH基因确实与小麦叶片的衰老有关。