一种人TRAILI型受体激动性抗原表位多肽及其抗体和应用的制作方法
本发明涉及一种抗原表位多肽、还涉及针对该抗原表位多肽的抗体及其用途,特别的,本发明涉及一种新发现的人肿瘤坏死因子相关凋亡诱导配体(TRAIL)I型受体激动性抗原表位多肽,还涉及由该抗原表位多肽刺激Balb/c鼠所产生的肿瘤坏死因子相关凋亡诱导配体I型受体特异性抗体,还涉及该抗体在提高肿瘤坏死因子相关凋亡诱导配体的杀伤肿瘤细胞的作用中的用途。本发明属于分子生物学和免疫学技术。
背景技术:
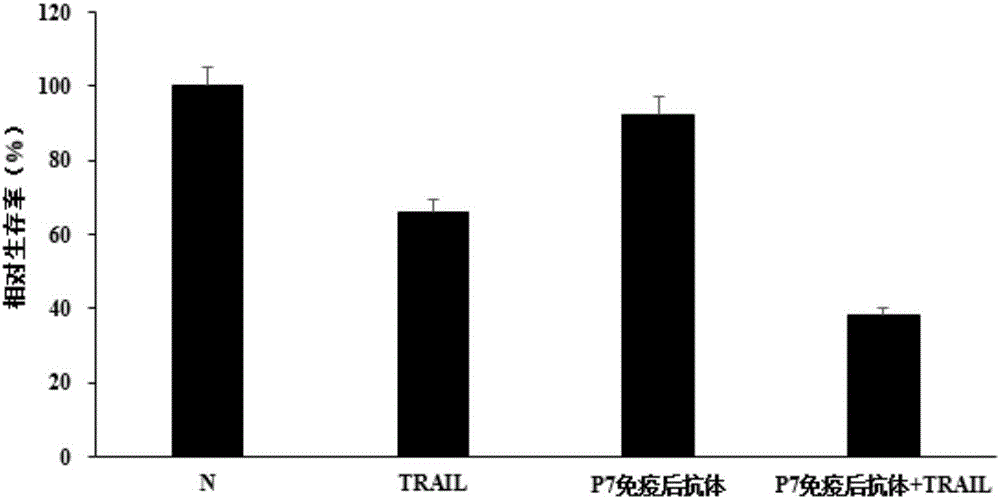
:恶性肿瘤已成为当今严重威胁人类健康并致死亡的主要疾病。近年,肿瘤生物治疗取得了较大进展,尤其是抗肿瘤单克隆抗体药物成功应用于临床,取得显著效果。TRAIL是肿瘤坏死因子超家族新成员。区别于其他超家族成员,如TNF-α和FasL对正常细胞有毒性作用限制了作为抗肿瘤药物在临床中应用,TRAIL表现为选择性诱导表达TRAIL特异受体的肿瘤细胞发生凋亡而无系统性细胞毒作用,使之成为肿瘤治疗研究热点。大量研究表明TRAIL具有很强的杀伤肿瘤能力,是最有应用前景的抗肿瘤治疗的候补药物之一,现已进入Ⅱ期临床试验研究。但由于对TRAIL耐受或敏感性低的肿瘤类型的存在,因而阻滞TRAIL作为抗肿瘤药物在临床推广应用。TRAIL可与它的五个受体(死亡受体DR4或DR5以及诱骗受体DcR1、DcR2和OPG)结合。在一些肿瘤细胞中,诱骗受体DcR1、DcR2或OPG可能与死亡受体竞争结合TRAIL而导致肿瘤细胞对TRAIL的耐药。因此,研究者研制针对选择性死亡受体DR4或DR5特异性单抗,试图代替TRAIL发挥杀肿瘤效果。单抗仅结合其相应的唯一受体,具有高度的特异性。死亡受体的单抗对特异杀伤肿瘤细胞效应显示出巨大潜力。临床前试验表明单抗与其他药物联合应用具有协同效应,可以提高肿瘤治疗的效果。目前,多种针对TRAIL激动性受体的抗体已处在临床实验阶段,它们有的可以直接代替TRAIL与激动性受体结合杀伤肿瘤细胞,有的自身不能杀伤肿瘤细胞,但是可以提高TRAIL杀伤肿瘤细胞,如AMG655。2012年,MarieP.Piechocki应用DR5DNA疫苗免疫小鼠,成功从免疫后小鼠血清中分离出抗DR5的抗体,这些抗体可以在体内、体外杀伤肿瘤细胞,但是经同种疫苗免疫后的不同小鼠产生的抗体所具有的杀伤活性不尽相同,这极有可能是因为针对DR5的DNA疫苗产生了多种抗体,从而影响了其活性。因此筛选激动性DR4或DR5抗原表位以代替或提高TRAIL杀伤活性为研制疫苗提供有力支持。技术实现要素:本发明的目的在于提供一种新发现的人TRAILI型受体激动性抗原表位多肽,该抗原表位多肽具有免疫原性,由该抗原表位多肽刺激Balb/c鼠所产生的肿瘤坏死因子相关凋亡诱导配体I型受体特异性抗体具有提高肿瘤坏死因子相关凋亡诱导配体杀伤肿瘤细胞作用的用途。为了达到上述目的,本发明采用了以下技术手段:本发明的一种人TRAILI型受体激动性抗原表位多肽,其特征在于所述的抗原表位多肽的氨基酸序列如SEQIDNO.1所示。编码所述的人TRAILI型受体激动性抗原表位多肽的核苷酸序列也在本发明的保护范围之内。进一步的,本发明还提出了抗本发明所述的人TRAILI型受体激动性抗原表位多肽的抗体。在本发明中,优选的,所述的抗体是通过以下方法制备得到:将经权利要求1所述的人TRAILI型受体激动性抗原表位多肽免疫的Balb/c鼠的外周血以8000rpm离心5min以去除包括红细胞在内的杂质,而后采用ProteinA/GSepharose进行纯化,获得人TRAILI型受体激动性抗原表位多肽的抗体。抗体活性检测试验表明,单独加入本发明所述的抗体不能有效的诱导HeLa细胞凋亡,而抗体+TRAIL能够有效地的诱导HeLa细胞凋亡,且起作用强于单独使用TRAIL,由此说明P7抗原所产生的抗体可以有效的提高TRAIL杀伤HeLa细胞的能力因此,更进一步的,本发明还提出了所述的抗体在制备辅助TRAIL抗肿瘤的药物中的用途。以及所述的抗原表位多肽在制备广谱抗肿瘤疫苗中的用途。附图说明图1为抗体特异性检测结果;图2为抗体活性检测结果。具体实施方式下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例一、人TRAILI型受体胞外区结构域划分与合成1、人TRAILI型受体胞外肽段的划分将人TRAILI型受体胞外区以20个氨基酸为一组,分成11组,表1所示,以进行多肽的筛选。表1:TRAILI型受体胞外区肽段的划分肽段名称氨基酸序列P1ASGTEAAAATPSKVWGSSAGP2RIEPRGGGRGALPTSMGQHGP3PSARARAGRAPGPRPAREASP4PRLRVHKTFKFVVVGVLLQVP5VPSSAATIKLHDQSIGTQQWP6EHSPLGELCPPGSHRSEHPGP7ACNRCTEGVGYTNASNNLFAP8CLPCTACKSDEEERSPCTTTP9RNTACQCKPGTFRNDNSAEMP10CRKCSRGCPRGMVKVKDCTPP11WSDIECVHKESGNGHN2、抗原肽的合成及偶联11组TRAILI型受体抗原肽由强耀生物科技有限公司进行合成,并分别与KLH(血蓝蛋白)和BSA(牛血清白蛋白)进行偶联。实施例二、抗人TRAILI型受体激动性表位的筛选1、动物免疫:使用实施例一合成的与KLH偶联的多肽为免疫原(KLH为阴性对照),与弗氏完全佐剂乳化后免疫Balb/c鼠,2周后用实施例一的多肽与弗氏不完全佐剂进行第二次免疫,三次免疫后,取小鼠血清进行效价检测,效价达到16000以上的小鼠,直接腹腔注射上述多肽加强免疫,3天后将小鼠处死,分离外周血。结果显示P7组抗原肽刺激的小鼠产生了特异性抗体。2、抗体的纯化:将P7抗原肽(ACNRCTEGVGYTNASNNLFA,SEQIDNO.1所示)刺激后的小鼠外周血以8000rpm离心5min以去除红细胞等杂质,而后采用ProteinA/GSepharose纯化抗体。3、抗体特异性的检测:1×105HeLa细胞经0.25%胰酶消化,PBS洗涤,加入稀释的免疫血清,并以KLH免疫的小鼠血清为阴性对照,冰上孵育30min,PBS洗涤后,加入FITC标记的羊抗鼠IgG,PBS洗涤后,流式检测与细胞表面受体结合情况。结果表明经P7抗原肽刺激产生的抗体可以与HeLa细胞表面的TRAIL受体I结合,且与阳性对照抗体无明显差异,结果如图1。4抗体活性的检测:将HeLa细胞以5×103个/孔接种96孔板,分别设置阴性对照组、TRAIL组、抗体组、抗体+TRAIL组,TRAIL浓度为1μg/ml,抗体浓度为1:10稀释度,24小时候MTT法检测细胞凋亡。结果显示单独加入抗体组不能有效的诱导HeLa细胞凋亡,而抗体+TRAIL组能够有效地的诱导HeLa细胞凋亡,且起作用强于TRAIL组,由此说明P7抗原所产生的抗体可以有效的提高TRAIL杀伤Hela细胞的能力,结果如图2。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种全人源化EGFRvIII嵌合抗原受体T细胞及其制备方法与制造工艺
- 嵌合抗原受体及制备方法与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- CD20特异性嵌合抗原受体及其应用的制造方法与工艺
- 一种用于辣根过氧化物酶染色的染色剂及其制备方法、染色组合、应用及标记酶染色试剂盒与制造工艺
- 对SSEA4抗原具有特异性的嵌合抗原受体的制造方法与工艺
- 具有针对CD79和CD22的特异性的分子的制造方法与工艺
- 具有针对CD45和CD79的特异性的分子的制造方法与工艺
- 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与制造工艺