本发明涉及生命健康
技术领域:
,尤其涉及一种用于检测非小细胞肺癌的甲基化抑癌基因标志物及其检测方法。
背景技术:
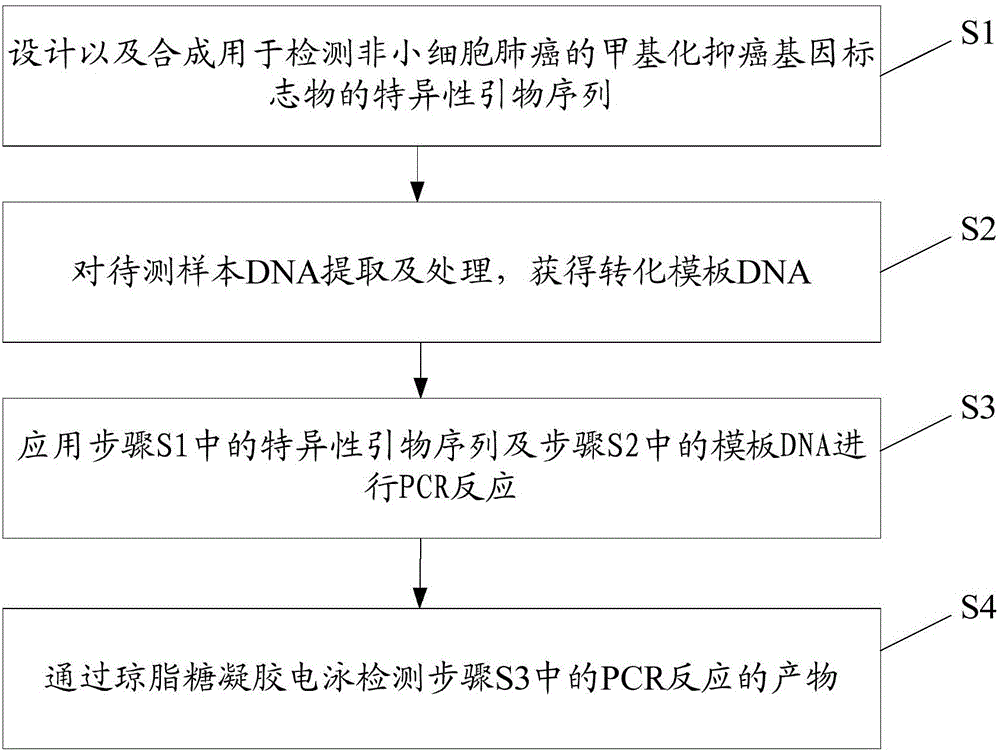
:据GLOBOCAN报告,由于人口的增长和老龄化的到来,癌症的发生率不断增加,2012年全球约有1.41千万新发癌症病例,其中肺癌发病率为180万,占癌症发病率的13%,是癌症中诊断率最高的病种,也是全球男性、发达国家女性癌症死亡率最高的病种。肺癌分为小细胞肺癌、非小细胞肺癌。非小细胞肺癌占肺癌总量的80%左右,主要包括腺癌、腺鳞癌、鳞状细胞癌和大细胞癌,非小细胞肺癌大多为腺癌或鳞状细胞癌。随着对表观遗传学研究的深入,DNA甲基化涉及基因和微RNA的表达调节、变异基因的剪切的等,其被认为在癌症早期检测中发挥重要的作用。据文献报道,在早期非小细胞肺癌中,已经发现数百个DNA甲基化位点。其中抑癌基因表达下调跟该类基因的甲基化有密切的关系。根据最新的研究进展,基因启动子区CG岛的甲基化可能是肿瘤发生的一个重要的机制。采用甲基化抑癌基因鉴定肿瘤是目前比较热门的研究方向近年来新的检测位点不断被发现并证实为肿瘤的抑制基因并不同程度的出现甲基化,如FUS1,NPRL2/G21、RASSF1A、CMTM7、DUTT1、H37、PCDH10、RASGRF2、RUNX3、RASSF2、BLU等。但已报道鉴定方法中由于采用的样本来源不同、样本数量的差别,使得标志物的组合的异质性很大,广谱适用性未知。基于此,有必要设计一种用于检测非小细胞肺癌的甲基化抑癌基因标志物组合及其检测方法,从而通过甲基化抑癌基因标志物检测,提高检测的灵敏度和特异性,为辅助诊断非小细胞肺癌提供帮助。技术实现要素:本发明的目的在于提供一种用于检测非小细胞肺癌的甲基化抑癌基因标志物及其检测方法,所述用于检测非小细胞肺癌的甲基化抑癌基因标志物及其检测方法能够通过7个甲基化抑癌基因标志物组合检测,提高了检测的灵敏度和特异性,为辅助诊断非小细胞肺癌提供帮助。为实现上述目的,本发明提供一种用于检测非小细胞肺癌的甲基化抑癌基因标志物,所述用于检测非小细胞肺癌的甲基化抑癌基因标志物包括HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1。此外,本发明还提供了一种用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法,所述用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法包括如下步骤:S1:设计以及合成如权利要求1所述的用于检测非小细胞肺癌的甲基化抑癌基因标志物的特异性引物序列;S2:对待测样本DNA提取及处理,获得转化模板DNA;S3:应用步骤S1中的特异性引物序列及步骤S2中的模板DNA进行PCR反应;S4:通过琼脂糖凝胶电泳检测步骤S3中的PCR反应的产物。优选地,所述步骤S1包括如下步骤:S11:人工合成一对扩增HOXA9启动子甲基化区的特异性引物序列;S12:人工合成一对扩增TBX5启动子甲基化区的特异性引物序列;S13:人工合成一对扩增PITX2启动子甲基化区的特异性引物序列;S14:人工合成一对扩增MFY6启动子甲基化区的特异性引物序列;S15:人工合成一对扩增ZMYND10启动子甲基化区的特异性引物序列;S16:人工合成一对扩增TAC1启动子甲基化区的特异性引物序列;S17:人工合成一对扩增CDO1启动子甲基化区的特异性引物序列。优选地,所述步骤S2包括如下步骤:S21:取预设量的待测组织或者细胞,用手术剪剪碎转移至1.5ml的离心管中,获得待测样品A;S22:取预设量的待测样品A通过DNA提取试剂盒,获得待测样品B。优选地,所述步骤S2还包括如下步骤:S23:将待测样品B经过硫化氢盐或者亚硫酸氢盐转化,获得模板DNA。优选地,所述步骤S3中的PCR反应的扩增条件为:94℃5min,1个循环;94℃1min,58℃30s,70℃40s,5个循环;94℃1min,55℃30s,70℃40s,30个循环;70℃10min,1个循环。本发明提供的用于检测非小细胞肺癌的甲基化抑癌基因标志物及其检测方法通过7个甲基化抑癌基因标志物组合检测,提高了检测的灵敏度和特异性,为辅助诊断非小细胞肺癌提供帮助。附图说明图1为本发明用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法的流程示意图;图2为本发明用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法的步骤S1的流程示意图;图3为本发明用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法的步骤S2的流程示意图;图4为本发明7个标志物的ROC曲线下面积示意图。具体实施方式下面结合具体实施例对本发明做进一步的详细说明,以下实施例是对本发明的解释,本发明并不局限于以下实施例。本发明提供一种用于检测非小细胞肺癌的甲基化抑癌基因标志物,所述用于检测非小细胞肺癌的甲基化抑癌基因标志物包括HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1。采用甲基化抑癌基因标志物进行联合检测具有快速、高通量、灵敏和特异性好等特点,检测方法不仅适用于肺癌早期的检测,为辅助诊断非小细胞肺癌提供帮助。此外,本发明还提供了一种用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法。在本实施例中,本发明主要适用于检测人肺癌的甲基化水平的应用,DNA提取试剂盒为,QIAmpDNAMiniKit(QIAGEN);其他试剂为国产分析纯试剂。本发明所采用的生物材料均来自与申请人合作的医院。在本实施例中,待测DNA样本为生物样本:包括50例肺癌患者的肿瘤组织及配对正常组织。在实施例中,如图1所示,图1为本发明用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法的流程示意图。所述用于非小细胞肺癌的甲基化抑癌基因标志物的检测方法包括如下步骤:S1:设计以及合成上述用于检测非小细胞肺癌的甲基化抑癌基因标志物的特异性引物序列;具体地,上述用于检测非小细胞肺癌的甲基化抑癌基因标志物包括HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1。S2:对待测样本DNA的提取及处理,获得转化模板DNA;S3:应用步骤S1中的特异性引物序列及步骤S2中的模板DNA进行PCR反应;S4:通过琼脂糖凝胶电泳检测步骤S3中的PCR反应的产物。具体地来说,步骤S1包括:S11:人工合成一对扩增HOXA9启动子甲基化区的特异性引物序列;S12:人工合成一对扩增TBX5启动子甲基化区的特异性引物序列;S13:人工合成一对扩增PITX2启动子甲基化区的特异性引物序列;S14:人工合成一对扩增MFY6启动子甲基化区的特异性引物序列;S15:人工合成一对扩增ZMYND10启动子甲基化区的特异性引物序列;S16:人工合成一对扩增TAC1启动子甲基化区的特异性引物序列;S17:人工合成一对扩增CDO1启动子甲基化区的特异性引物序列。步骤S11、S12、S13、S14、S15、S16、S17中的特异性引物序列均是根据NCBI(美国国立生物技术信息中心)公开的人类全基因组序列,使用methprimer在线软件设计甲基化特异引物,由华大基因有限公司合成。HOXA9、TBX5PITX2、MFY6、ZMYND10、TAC1、CDO1均为抑癌基因,当这些基因启动子区域甲基化时,会减弱或降低这些基因的转录、翻译以及表达。因此,对于正常人群来说,HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1等基因的表达量会较高,对于患病人群来说,HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1等基因的表达量会较低甚至沉默表达,因此根据需要,故分别设计特异性的甲基化检测的引物,所述S11包括正反一对引物HOXA9-f、HOXA9-r,其中正向引物也称为上游引物为HOXA9-f,反向引物也称为下游引物为HOXA9-r,HOXA9的上游引物和下游引物均如表1所示。同样的,S12也包括正反一对引物TBX5-f、TBX5-r,其中正向引物也称为上游引物为TBX5-f,反向引物也称为下游引物为TBX5-r,TBX5的上游引物和下游引物均如表1所示;S16也包括正反一对引物TAC1-f、TAC1-r,其中正向引物也称为上游引物为TAC1-f,反向引物也称为下游引物为TAC1-r,同样的对于检测PITX2基因、MFY6基因、ZMYND10基因、CDO1基因启动子甲基化区的上游引物和下游引物如表1所示。表1为HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1以及CDO1的引物序列表HOXA9-f5-GGTTAATGGGGGCGCGGGCGTC-3HOXA9-r5-TCATATAACAACTTAATAACACCG-3TBX5-f5-GGGACGCGTAAAATTTAGAATC-3TBX5-r5-AACACAAAACCGAAAAACGTC-3PITX2-f5-CGTTATTAGTTGAAGGTAAGGTCG-3PITX2-r5-AACACCGAAAAATACAATCCG-3MFY6-f5-GGAAATGCGTATTCGGTTC-3MFY6-r5-CGAACCCCCTAAAATAATCG-3ZMYND10-f5-GGGTGGGGATGTTGTTATATT-3ZMYND10-r5-AACTATCCTATCCCAAACTTTAACAC-3TAC1-f5-GGTATTGAGTAGGCGAAAGAGC-3TAC1-r5-CTCTAATTCCTCCGAACGCACG-3CDO1-f5-CGAGTGGGTAATGTACGTTAAG-3CDO1-r5-CGCGACCCGAACTTCCCGAACC-3具体地来说,所述步骤S2包括如下步骤:S21:取预设量的待测组织或者细胞,用手术剪剪碎转移至1.5ml的离心管,获得待测样品A;S22:取预设量的待测样品A通过DNA提取试剂盒,获得待测样品B。此外,所述步骤S2还包括将待测样品B经过硫化氢盐或者亚硫酸氢盐转化,获得模板DNA。S23:将待测样品B经过硫化氢盐或者亚硫酸氢盐转化,获得模板DNA。在步骤S2中,取大约25mg肺癌组织或细胞,对照组选择同一患者健康部位的组织或细胞;用高压灭菌消毒后的手术剪剪碎加入到1.5ml的离心管中,获得待测样品A;再使用DNA提取试剂盒提取待测样品A,获得待测样品B,待测样品B可以是纯化后的双链DNA。然后将待测样品B用硫化氢盐或者亚硫酸氢盐转化,获得模板DNA,因为通过用亚硫酸氢盐处理基因组DNA,所有未发生甲基化的胞嘧啶被转化为尿嘧啶,而甲基化的胞嘧啶不变;随后设计针对甲基化和非甲基化序列的引物进行PCR。甲基化特异引物中相应位点设计为C,使特异性甲基化序列扩增。非甲基化特异引物,在相应位点设计为T,使未甲基化序列扩增。根据不同引物扩增的PCR产物的有无判断CpG二核苷酸中的胞嘧啶是否发生变化。电泳检测MSP扩增产物,如果用针对处理后甲基化DNA链的引物能得到扩增片段,则说明该位点存在甲基化;反之,说明被检测的位点不存在甲基化,在此步骤中,也可以将待测样品B通过转化试剂盒进行转化。具体地来说,所述步骤S3中,应用步骤S1中的特异性引物序列及步骤S2中模板DNA进行PCR反应。然后统计组合设置为16组,包括单一基因扩增水平统计组合及多种基因扩增水平统计组合,第一组是HOXA9;第二组是TBX5;第三组是PITX2;第四组是MFY6;第五组是ZMYND10;第六组是TAC1;第七组是CDO1;第八组是HOXA9、TBX5、PITX2;第九组是HOXA9、TBX5、ZMYND10;第十组是HOXA9、TBX5、TAC1;第十一组是HOXA9、TBX5、PITX2、TAC1;第十二组是HOXA9、TBX5、PITX2、ZMYND10;第十三组是HOXA9、TBX5、PITX2、ZMYND10、TAC1;第十四组是HOXA9、TBX5、PITX2、ZMYND10、TAC1、CDO1;第十五组是HOXA9、TBX5、PITX2、ZMYND10、TAC1、MFY6;第十六组是HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1。由于不同的引物之间碱基的不同或者碱基数量的不同,往往导致退火温度的不一致,然而在PCR的反应过程,退火温度对于整个PCR的产物甚至PCR的结果至关重要,若退火温度过高,引物无法与模板结合,无法使单链DNA变成双链DNA;然而若退火温度过低,往往会造成PCR的产物中杂带过多,影响实验结果。基于此,在步骤S30中,PCR反应的扩增条件优选为:94℃5min,1个循环;94℃1min,58℃30s,70℃40s,5个循环;94℃1min,55℃30s,70℃40s,30个循环;70℃10min,1个循环。从而满足7对不同的引物在同一PCR小管里面即同一PCR体系中进行不同目标片段的扩增,从而实现多个基因标志物的联合检测。在本实施例中,使用的PCR仪器为罗氏LightCycler480,Master罗氏的试剂,反应体系为20ul;2PCR反应体系配制如下表2所示:表2PCR反应体系的配制组分体积ul2×PCRMasterMix10ul硫酸氢盐转化DNA4ulprimer1ul灭菌双蒸水10ul合计25ulS4:通过琼脂糖凝胶电泳检测步骤S3中的PCR反应的产物。在步骤S4中进行对上述步骤S3得到的PCR产物的验证,可以选择通过琼脂糖凝胶电泳来检测,在TEA或者TBA缓冲液中跑胶,通过凝胶成像系统进行显影。为统计分析上述得到的PCR产物,即采用甲基化抑癌基因标志物的灵敏度和特异性指标,我们采取以下实例对本发明进行解释,本发明并不局限于以下实施例。实例1:分别随机选择50名非小细胞肺癌的病人,生物样本为非小细胞肺癌的病人的肿瘤组织,对照组为正常组织,分别利用步骤S1中的引物组,再分别以非小细胞肺癌的病人的肿瘤组织和正常组织为处理后的模板进行PCR反应,灵敏度和特异性如下表3所示。表3不同基因组合分别对肿瘤组织甲基化、正常组织甲基化、灵敏性和特异性的影响构建ROC曲线比较7个甲基化标志物区分肺癌病人的肿瘤组织与正常组织的诊断能力。在本实施例中,AUC是曲线下面积的简称。如附图4所示,附图4包括附图4a,4b,4c,4d,4e,4f,4g,4h,4i,4j,4k,4l,4m,4n,40,4p。其中,附图4a为HOXA9曲线下面积示意图;附图4b为TBX5曲线下面积示意图;附图4c为PITX2曲线下面积示意图;附图4d为MFY6曲线下面积示意图;附图4e为ZMYND10曲线下面积示意图;附图4f为TAC1曲线下面积示意图;附图4g为CDO1曲线下面积示意图;附图4h为HOXA9、TBX5、PITX2曲线下面积示意图;附图4i为HOXA9、TBX5、ZMYND10曲线下面积示意图;附图4j为HOXA9、TBX5、TAC1曲线下面积示意图;附图4k为HOXA9、TBX5、PITX2、TAC1曲线下面积示意图;附图4l为HOXA9、TBX5、PITX2、ZMYND10曲线下面积示意图;附图4m为HOXA9、TBX5、PITX2、ZMYND10、TAC1曲线下面积示意图;附图4n为HOXA9、TBX5、PITX2、ZMYND10、TAC1、CDO1曲线下面积示意图;附图4o为HOXA9、TBX5、PITX2、ZMYND10、TAC1、MFY6曲线下面积示意图;附图4p为HOXA9、TBX5、PITX2、MFY6、ZMYND10、TAC1、CDO1曲线下面积示意图。针对7个标志物的ROC曲线下面积分析如下:HOXA9,0.990;TBX5,0.925;PITX2,0.883;MFY6,0.793;ZMYND10,0.853;TAC1,0.961;CDO1,0.845。在最佳的cutoff值下,基因的敏感性和特异性如下:HOXA9,82.1%和100%;TBX5,78.6%和87.5%;PITX2,60.7%和96.4%;MFY6,58.9%和94.6%;ZMYND10,66.1%和94.6%;TAC1,89.3%和98.2%;CDO1,64.3%和98.2%。这7个标志物不同组合联合起来检测的AUC范围在0.872-0.91,平均为0.89,相应的敏感度范围为在80.4-98.2%,平均89.1%,特异度范围80.4-91%,平均为86.6%(见表3)。这些结果表明,甲基化标志物组合中4种以上(包括4种)联合检测肺癌具有比较高的灵敏度和特异性。本发明提供的用于检测非小细胞肺癌的甲基化抑癌基因标志物及其检测方法通过7个甲基化抑癌基因标志物的联合检测,提高了检测的灵敏度和特异性,为辅助诊断非小细胞肺癌提供帮助。以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页1 2 3