本发明涉及基因重组技术领域,特别涉及一种鸡β干扰素优化基因及重组鸡β干扰素的生产工艺。
背景技术:
近年来我国养禽业发展迅速,规模不断扩大。但是,禽流感、新城疫,鸡传染性支气管炎等病毒类疾病的流行制约了养禽业发展的重要因素。目前我国仍然采用疫苗免疫、化学药物及抗生素治疗等方法来防制禽类疾病。但由于病原的血清型复杂、变异速度快,常常导致疫苗的免疫效果不佳,同时抗生素和化学药物的使用又因为病原的耐药性与药物残留问题而限制了其使用的范围。因此迫切需要广谱抗病毒生物制剂来治疗和加强免疫效果。
干扰素(Interferon,IFN)是一类重要的细胞因子,由生物体细胞受到病毒或其他诱生剂的作用而产生的分泌性蛋白,具有抗病毒、抗细胞增殖、免疫调节等多种生物学活性。对于兽用抗病毒生物制品来说,与传统的化学药物和疫苗相比,重组动物干扰素具有广谱高效的抗病毒活性而且不会产生耐药性与药物残留安全性问题。
在临床应用上,干扰素有着抗生素无法替代的作用,研究表明禽干扰素具有抗病毒较强、抗病毒谱广等优点,细胞接触干扰素在短时间内就能产生抗病毒作用,可适用于不同品种的鸡,对生产性能影响小。但目前市面上禽类重组干扰素的制品较少,制作成本相对较高,不利于禽类重组干扰素的推广。因此,通过较低的成本,更简易的步骤获得抗病毒活性更强的鸡干扰素是目前的研究重点以及难点。
技术实现要素:
本发明要解决的技术问题是克服鸡β干扰素表达量低、变复性蛋白损耗大,抗病毒活性低的现有技术缺陷,提供一种优化的重组鸡β干扰素的生产工艺。
为了解决上述技术问题,本发明提供了如下的技术方案:
本发明一种鸡β干扰素优化基因及重组鸡β干扰素的生产工艺,其包括以下步骤:
S1、参照NCBI中已发表的鸡β干扰素基因序列,根据大肠杆菌密码子的偏好性对去除信号肽基因序列的干扰素基因进行密码子的优化,人工合成该鸡β干扰素基因;
S2、设计引物:根据密码子优化后的干扰素基因,设计1对引物:
ChIFN-β-F:5-AGCCATATG ATGTGTAATCACCTGCGTCA -3(NdeI)
ChIFN-β-R:5-AAGGAATTC TTATTGGGTATTCAGACGTT -3(EcoRI);
S3、重组表达质粒的构建:
以合成的ChIFN-β干扰素基因为模板,采用带NdeI的ChIFN-β-F ,带EcoRI的ChIFN-β-R为引物,对ChIFN-β进行PCR扩增;
pET-28b载体、PCR产物经NdeI、EcoRI双酶切回收,连接,转化至大肠杆菌DH5β感受态细胞;
S4、重组表达质粒的转化和鉴定:
将测序正确的ChIFN-β重组子转化BL21(DE3)感受态细胞,卡那霉素抗性筛选经PCR检测,确认插入片段为目的基因;
S5、重组表达质粒在大肠杆菌中的诱导表达:
将鉴定正确的表达菌株接种于液体LB培养基,37℃震荡培养,OD值为0.5-0.6时加IPTG至终浓度为1mM诱导表达;诱导培养4h后,离心收集菌体,进行SDS-PAGE分析,然后将SDS-PAGE凝胶上的蛋白转印至硝酸纤维素膜(NC),Western-blot检测目的蛋白。由于目的蛋白含有His标签,所以用His 标签抗体( 1∶2 000) 作为一抗,用辣根过氧化物酶标记的羊抗鼠( 1∶ 10 000) 作二抗。
进一步地,还包括以下步骤:
S6、表达产物的提取与蛋白复性纯化
S61、包涵体的提取与处理:
将1L 诱导表达的重组菌E.coli/pET-28b-ChIFN-β 以10000 r/min离心收集菌体,按1:5的菌体超声缓冲液重悬菌体,所述缓冲液为50mM Tris,0.5mM EDTA,50mM NaCl,pH7.0;并在冰浴的条件下,充分超声破碎,然后于4℃10000 r/min 离心15 min 收集沉淀得到粗制包涵体;离心收集的包涵体用洗涤缓冲液1充分悬浮,磁力搅拌30min后,以10000 r/min,4℃,20min进行离心;然后依次用洗涤缓冲液2、洗涤缓冲液3对包涵体进行洗涤;所述的洗涤缓冲液1为50mM Tris-HCl,0.5% TritonX-100,0.5M NaCl,pH8.0;所述的洗涤缓冲液2为50mM Tris-HCl,2M Uera,1%巯基乙醇,2mM EDTA,0.15M Nacl,pH8.0;所述的洗涤缓冲液3为50mM Tris- HCl,4M Uera,5mM DTT,0.5M NaCl,pH8.0;
S62、包涵体变性:
使用含8M 尿素的变性液按1:5的包涵体变性液比例将洗涤后的包涵体溶解于变性液中,室温磁力搅拌6h,然后以10000 r/min,4℃,20min离心,收集变性液上清,4℃保存;其中,所述的变性液成分为50mM Tris-HCl,8M Uera,5mM DTT,pH8.0;
S63、变性液复性:
采取梯度稀释法进行蛋白复性,把收集的变性液上清按1:20的变性液复性液比例加入到预冷的复性液中,复性时采用滴管悬滴,完成后磁力搅拌5min,转入4℃冰箱,静置复性24h;所述的复性液成分为50mM Tris-HCl,0.15M NaCl,0.4M L-Arg,1mM GSSG,5mM GSH,10%甘油,pH7.0;
S64、镍柱亲和纯化:
复性完成后,对复性液进行透析除去L-Arg,参照QIAGEN公司镍柱纯化说明书对带有His标签的目的蛋白进行纯化。
一种鸡β干扰素优化基因,其序列如SEQ ID NO:1所示。
一种权利要求3所述的鸡β干扰素优化基因翻译的氨基酸,其序列如SEQ ID NO:2所示。
本发明所达到的有益效果是:
本发明根据大肠杆菌密码子的偏好性对Genebank中发表的鸡β干扰素基因序列进行了密码子优化,人工合成该鸡β干扰素序列。构建原核表达载体,诱导表达后对包涵体进行变性、复性和镍柱亲和纯化, SDS-PAGE结果显示本研究实现了鸡β干扰素的高效表达与纯化,镍柱亲和纯化后的重组鸡β干扰素蛋白浓度经Broadford法测定,浓度约为0.242mg/ml。通过细胞病变抑制法测定出此重组鸡β干扰素蛋白的抗病毒效价达2.73×106UI/mg。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
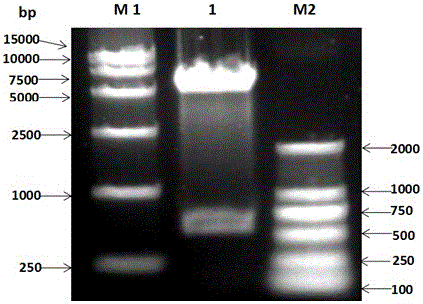
图1为pET-28b-ChIFN-β重组质粒双酶切鉴定,初步证明了pET-28b-ChIFN-β构建正确;
其中,M1:DNA标准DL15000;1:pET-28b-ChIFN-β双酶切鉴定;M2: DNA标准DL2000;;
图2 为蛋白表达的SDS-PAGE检测结果,初步证明了目的蛋白得到了正确表达;
其中,M:相对分子质量低的蛋白Marker;1,2:诱导表达后菌体和包涵体SDS-PAGE结果;
图3为蛋白表达的Western-Blot检测结果,证明了目的蛋白表达正确;
其中,M:相对分子质量低的蛋白Marker;1:包涵体
图4表达产物镍柱纯化的SDS-PAGE检测结果,目的条带单一证明了经镍柱纯化后的目的蛋白的纯度较高;
其中,M:相对分子质量低的蛋白Marker;1,2:两个批次的蛋白纯化样品;
图5为细胞病变抑制法测定重组ChIFN-β抵抗水泡口炎病毒繁殖的活性,证明了目的蛋白作用于细胞后可以有效的抑制水泡口炎病毒的繁殖。
具体实施方式
以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
如图1至图3所示,本发明一种鸡β干扰素优化基因及重组鸡β干扰素的生产工艺,其包括以下步骤:
S1、参照NCBI中已发表的鸡β干扰素基因序列,根据大肠杆菌密码子的偏好性对去除信号肽基因序列的干扰素基因进行密码子的优化,人工合成该鸡β干扰素基因;优化后的片段由英潍捷基(上海)贸易有限公司测序合成。
S2、设计引物:根据密码子优化后的干扰素基因,设计1对引物:
ChIFN-β-F:5-AGCCATATG ATGTGTAATCACCTGCGTCA -3(NdeI)
ChIFN-β-R:5-AAGGAATTC TTATTGGGTATTCAGACGTT -3(EcoRI);
S3、重组表达质粒的构建:
以合成的ChIFN-β干扰素基因为模板,采用带NdeI的ChIFN-β-F ,带EcoRI的ChIFN-β-R为引物,对ChIFN-β进行PCR扩增;
pET-28b载体、PCR产物经NdeI、EcoRI双酶切回收,连接,转化至大肠杆菌DH5β感受态细胞;将通过卡那霉素抗性筛选, PCR及NdeI、EcoRI双酶切鉴定正确的重组质粒送英潍捷基(上海)贸易有限公司测序鉴定。
S4、重组表达质粒的转化和鉴定:
将测序正确的ChIFN-β重组子转化BL21(DE3)感受态细胞,氨苄青霉素抗性筛选经PCR检测,确认插入片段为目的基因;
S5、重组表达质粒在大肠杆菌中的诱导表达:
将鉴定正确的表达菌株接种于液体LB培养基,37℃震荡培养,OD值为0.5-0.6时加IPTG至终浓度为1mM诱导表达;诱导培养4h后,离心收集菌体,进行SDS-PAGE分析,然后将SDS-PAGE凝胶上的蛋白转印至硝酸纤维素膜(NC),Western-blot检测目的蛋白。由于目的蛋白含有His标签,所以用His 标签抗体( 1∶2 000) 作为一抗,用辣根过氧化物酶标记的羊抗鼠( 1∶ 10 000) 作二抗,
进一步地,还包括以下步骤:
S6、表达产物的提取与蛋白复性纯化
S61、包涵体的提取与处理:
将1L 诱导表达的重组菌E.coli/pET-28b-ChIFN-β 以10000 r/min离心收集菌体,按1:5的菌体超声缓冲液重悬菌体,所述缓冲液为50mM Tris,0.5mM EDTA,50mM NaCl,pH7.0;并在冰浴的条件下,充分超声破碎,然后于4℃10000 r/min 离心15 min 收集沉淀得到粗制包涵体;离心收集的包涵体用洗涤缓冲液1充分悬浮,磁力搅拌30min后,以10000 r/min,4℃,20min进行离心;然后依次用洗涤缓冲液2、洗涤缓冲液3对包涵体进行洗涤;所述的洗涤缓冲液1为50mM Tris-HCl,0.5% TritonX-100,0.5M NaCl,pH8.0;所述的洗涤缓冲液2为50mM Tris-HCl,2M Uera,1%巯基乙醇,2mM EDTA,0.15M Nacl,pH8.0;所述的洗涤缓冲液3为50mM Tris- HCl,4M Uera,5mM DTT,0.5M NaCl,pH8.0;
S62、包涵体变性:
使用含8M 尿素的变性液按1:5的包涵体变性液比例将洗涤后的包涵体溶解于变性液中,室温磁力搅拌6h,然后以10000 r/min,4℃,20min离心,收集变性液上清,4℃保存;其中,所述的变性液成分为50mM Tris-HCl,8M Uera,5mM DTT,pH8.0;
S63、变性液复性:
采取梯度稀释法进行蛋白复性,把收集的变性液上清按1:20的变性液复性液比例加入到预冷的复性液中,复性时采用滴管悬滴,完成后磁力搅拌5min,转入4℃冰箱,静置复性24h;所述的复性液成分为50mM Tris-HCl,0.15M NaCl,0.4M L-Arg,1mM GSSG,5mM GSH,10%甘油,pH7.0;
S64、镍柱亲和纯化:
复性完成后,对复性液进行透析除去L-Arg,参照QIAGEN公司镍柱纯化说明书对带有His标签的目的蛋白进行纯化。
一种鸡β干扰素优化基因,其序列如SEQ ID NO:1所示。
一种权利要求3所述的鸡β干扰素优化基因翻译的氨基酸,其序列如SEQ ID NO:2所示。
其中,E.coli/DH5α、BL21(DE3)、水泡口炎病毒(VSV)由本实验室保存;
pET-28b为华南农业大学兽医学院动物传染病实验室保存;限制酶EcoRI、NdeI及T4DNA连接酶等为TaKaRa公司产品;DNA片段快速回收试剂盒购于天根生化科技有限公司。
重组ChIFN-β抗病毒活性的测定:
通过细胞病变抑制法测定重组干扰素的活性:将DF-1细胞接种于96孔细胞培养板,在37℃,5% CO2的饱和二氧化碳水汽培养箱中培养到细胞长成单层。每列加入4倍系列稀释的重组干扰素每孔100μL,同时设病毒对照(阳性对照)和细胞对照(阴性对照),培养12h后,每孔加入1000TCID50的水泡口炎病毒,该水泡口炎病毒在DF-1上的TCID50为7.32。同时设定不加病毒的细胞对照。培养至24h后开始观察细胞病变,待阳性出现明显病变时进行结晶紫染色。弃细胞培养液,用无菌PBS洗1遍,于每孔中加入结晶紫染色液100μL,室温放置30min;弃染料,双蒸水冲洗没着色染料,然后每孔中加入脱色液100μL,室温放置10min脱色;运用酶标仪测定OD570值并记录;数据处理:以能抑制50%细胞病变的干扰素含量定义为一个活性单位,运用Reed-Muench法计算干扰素效价,计算重组干扰素的活性单位为2.73×106UI/mg。
如图5所示,图5为细胞病变抑制法测定重组ChIFN-β抗水泡口炎病毒活性的细胞状态图片,1阴性对照组(不加干扰素,不感染病毒)2阳性对照组(不加干扰素,感染病毒)3,4,5分别为47,48,49倍稀释的鸡干扰素作用于细胞后,对细胞的抗病毒效果图。由图片观察可知1阴性对照组成立(不发生细胞病变);2阳性对照组成立(发生细胞病变);3,4细胞不发生细胞病变,说明抗病毒效果显著;5出现明显细胞病变,说明在49倍这个稀释度的干扰素对细胞抵抗病毒作用不明显。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
<110>华南农业大学 北京利昂盛生物技术有限公司
<120>一种鸡β干扰素优化基因及重组鸡β干扰素的生产工艺
<160>4
<210>1
<211>534
<212>DNA
<213>人工序列
<400>1
ATGTGTAATC ACCTGCGTCA CCAAGACGCC AACTTCAGCT GGAAAAGCCT GCAACTGCTG 60
CAAAACACTG CTCCGCCACC GCCGCAGCCG TGTCCGCAGC AAGATGTTAC GTTCCCGTTC 120
CCGGAAACCC TGCTGAAATC CAAAGACAAA AAGCAGGCAG CAATTACCAC CCTGCGTATT 180
CTGCAGCACC TGTTCAACAT GCTGAGCTCC CCGCACACTC CGAAGCACTG GATTGACCGT 240
ACCCGTCACT CTCTGCTGAA CCAGATTCAA CACTACATCC ACCATCTGGA GCAGTGCTTC 300
GTCAACCAGG GTACCCGTTC TCAGCGTCGT GGCCCGCGTA ACGCACACCT GTCTATCAAC 360
AAATACTTCC GCTCCATTCA TAACTTCCTG CAGCACAACA ACTATTCTGC CTGCACTTGG 420
GACCATGTCC GTCTGCAGGC TCGTGATTGC TTCCGCCATG TTGACACCCT GATCCAATGG 480
ATGAAGTCCC GCGCCCCGCT GACGGCGTCT TCTAAACGTC TGAATACCCA ATAA 534
<210>2
<211>176
<212> PRT
<213>鸡β干扰素优化基因翻译的氨基酸序列
<400>2
Cys Asn His Leu Arg His Gln Asp Ala Asn Phe Ser Trp Lys Ser 15
Leu Gln Leu Leu Gln Asn Thr Ala Pro Pro Pro Pro Gln Pro Cys 30
Pro Gln Gln Asp Val Thr Phe Pro Phe Pro Glu Thr Leu Leu Lys 45
Ser Lys Asp Lys Lys Gln Ala Ala Ile Thr Thr Leu Arg Ile Leu 60
Gln His Leu Phe Asn Met Leu Ser Ser Pro His Thr Pro Lys His 75
Trp Ile Asp Arg Thr Arg His Ser Leu Leu Asn Gln Ile Gln His 90
Tyr Ile His His Leu Glu Gln Cys Phe Val Asn Gln Gly Thr Arg 105
Ser Gln Arg Arg Gly Pro Arg Asn Ala His Leu Ser Ile Asn Lys 120
Tyr Phe Arg Ser Ile His Asn Phe Leu Gln His Asn Asn Tyr Ser 135
Ala Cys Thr Trp Asp His Val Arg Leu Gln Ala Arg Asp Cys Phe 150
Arg His Val Asp Thr Leu Ile Gln Trp Met Lys Ser Arg Ala Pro 165
Leu Thr Ala Ser Ser Lys Arg Leu Asn Thr Gln 176
<210>3
<211>29
<212>DNA
<213> ChIFN-β-F
<400>3
AGCCATATGA TGTGTAATCA CCTGCGTCA 29
<210>4
<211>29
<212>DNA
<213> ChIFN-β-R
<400>4
AAGGAATTCT TATTGGGTAT TCAGACGTT 29