检测基因P53的比率电化学DNA传感器修饰电极及其制备方法与流程
本发明涉及电化学检测技术领域,具体涉及一种用于检测肿瘤抑制基因P53的比率电化学DNA传感器修饰电极及其制备方法。
背景技术:
肿瘤抑制基因P53是一种被称为“基因组的守护者”的抑癌基因,是一系列同工型蛋白质(P53蛋白)的同源基因。由该基因编码的一系列蛋白质具有调控细胞分裂、修复和凋亡的作用。当细胞受损时,P53蛋白会监测细胞基因的受损程度。在基因受损程度较小时,P53蛋白会促使细胞进行自我修复;而在受损基因不可修复时,P53蛋白则会诱导细胞凋亡。因此,当P53基因突变时,细胞的修复凋亡过程会受到干扰,从而使一部分受损细胞在不正常的条件下继续分裂生长,从而导致肿瘤的产生。
国际癌症基因组协会已经证明,P53基因是在人类癌症有关的基因中突变最为频繁的基因。在人类已知的所有恶性肿瘤组织中,该基因出现突变的概率在50%以上,是迄今为止人类发现的与癌症相关性最高的基因。
现有的对于P53基因的检测主要有毛细管电泳、变性高效液相色谱、变性梯度凝胶电泳以及酵母中分离的等位基因功能分析技术等方法,这些方法虽然有高的灵敏度,但是存在操作复杂,成本高等诸多缺点;同时仪器投入费用高和耗材贵,也限制了这些方法的临床应用。
技术实现要素:
针对上述现有技术,本发明的目的之一是提供一种用于检测P53基因的探针,目的之二是提供一种用于检测P53基因的探针在制备检测P53基因的修饰电极中的应用,目的之三是提供一种用于检测P53基因的修饰电极的制备方法,目的之四是提供一种用于检测P53基因的修饰电极,目的之五是提供一种修饰电极在制备用于检测P53基因的电化学传感器中的应用,目的之六是提供一种基于双发夹结构的用于检测P53基因的比率电化学DNA传感器的应用方法。
为了实现上述目的,本发明采用如下技术方案:
本发明一方面,提供一种用于检测P53基因的探针,由一条单链DNA辅助探针S1和一条单链DNA捕获探针S2组成,所述S1的DNA链序列为:5’-Fc-CTC TCA GTG ATT TTT TTA GTG AGA GAG-(CH2)6-SH-3’,所述S2的DNA链序列为:5’-MB-TCA CTG AGT CTT CCA GTG TGA TGA TCA CT-3’。
本发明第二方面,提供一种利用上述检测P53基因的探针在制备检测P53基因的修饰电极中的应用。
本发明第三方面,提供一种用于检测P53基因的修饰电极的制备方法,步骤如下:
(1)辅助探针S1在含有三(2-羧乙基)膦的Tris-HCl缓冲液中加热,退火获得单链辅助探针S1的Tris-HCl缓冲液;
(2)将打磨、清洗干燥后的金电极浸在步骤(1)得到的辅助探针S1的Tris-HCl缓冲液中,通过自组装的方式将辅助探针S1修饰到金电极表面,得到S1/GE修饰电极;
(3)将步骤(2)所得电极浸在捕获探针S2的Tris-HCl缓冲液中,水浴加热,使捕获探针S2与辅助探针S1结合,在金电极表面形成双发夹结构,得到S2/S1/GE修饰电极;
优选:所述步骤(2)中打磨、清洗干燥的具体步骤为:将金电极用氧化铝粉末打磨抛光成镜面,再分别经乙醇、二次蒸馏水超声清洗20-60s,氮气干燥,得到清洁金电极。
优选:所述步骤(1)中90℃水浴加热4-6分钟。
优选:所述步骤(1)中含有三(2-羧乙基)膦的Tris-HCl缓冲液的为含有浓度为110-150mM的三羟甲基氨基甲烷(Tris),100-120mM的NaCl,1-10mM的MgCl2,9-11mM的三(2-羧乙基)膦的混合液,pH为7.4-7.8。
优选:所述步骤(2)、(3)中Tris-HCl缓冲液为含有浓度为110-150mM的三羟甲基氨基甲烷(Tris),100-120mM的NaCl,1-10mM的MgCl2,pH为7.4-7.8。
优选:所述步骤(2)中将辅助探针S1修饰到金电极表面的条件为:反应温度为22-25℃反应时间为10-24小时,辅助探针S1缓冲液的浓度为40-50mM(即:缓冲液中辅助探针S1的浓度)。
优选:所述步骤(3)中加热操作具体为:水浴35-37℃加热1-3小时,所述捕获探针的浓度为35-50mM。
本发明第四方面,提供一种利用上述制备方法制备得到的修饰电极以及所述修饰电极在制备用于检测P53基因的电化学传感器中的应用。
本发明第五方面,提供一种检测肿瘤抑制基因P53的方法,步骤如下:
(1)将上述S2/S1/GE修饰电极在Tris-HCl缓冲液中水浴加热后,与甘汞参比电极和铂丝对电极构成三电极系统,在Tris-HCl缓冲液中进行DPV检测,得到亚甲基蓝的峰电流I0(MB),二茂铁的峰电流为I0(Fc);
(2)将上述S2/S1/GE修饰电极与不同浓度的P53基因缓冲液在加热的条件下进行识别后用Tris-HCl缓冲液冲洗,之后与甘汞参比电极和铂丝对比电极构成三电极系统,在Tris-HCl缓冲液中进行DPV检测,以得到的二茂铁峰电流比亚甲基蓝的峰电流的值:I=IFc/IMB;以I对P53基因浓度的对数做线性回归方程,得工作曲线;
(3)在对实际样品进行检测时,采用同样方法对待测样品中的P53基因进行DPV检测,求得二茂铁峰电流对亚甲基蓝峰电流的比值,后代入线性回归方程即得样品中P53基因的浓度。
优选:所述步骤(1)、(2)中,Tris-HCl缓冲液为含有110-150mM的三羟甲基氨基甲烷(Tris),100-120mM的NaCl,1-10mM的MgCl2的混合液,其pH为7.4-7.8。
优选:步骤(1)中,加热时间为15-30分钟。
优选:所述步骤(2)中,P53基因缓冲液为含有110-150mM的三羟甲基氨基甲烷(Tris),100-120mM的NaCl,1-10mM的MgCl2以及10-8-10-12M的P53基因的混合液,其pH为7.4-7.8。
优选:所述步骤(2)中,加热是水浴加热,反应温度为35-37℃,反应时间为15-30分钟。
本发明的有益效果:
(1)本发明所提供的检测P53基因的方法简单,操控方便,使用成本低,与毛细管电泳、变性高效液相色谱、变性梯度凝胶电泳以及酵母中分离的等位基因功能分析技术等方法相比较,本发明的方法具有样品无需前处理,易操控,反应条件简单、成本低等优点。
(2)目前由于以下的技术难题,限制了基于双发夹结构的比率电化学分析法应用到P53基因的检测:第一在电极表面不易构建双发夹结构。首先,若辅助探针只是修饰到电极表面而未形成茎环结构,则辅助探针的电活性物质(二茂铁)与电极表面相距过远,从而导致电子转移在电极表面无法发生,无法检测到电信号。其次要通过一定的实验条件和一定浓度的试剂诱导捕获探针和辅助探针相结合,否则无法形成双发夹结构,也就无法进行比率的测定。第二无法构建足够的双发夹结构。在电极表面,双发夹结构最理想的状态是与电极表面垂直。如果双发夹结构平铺在电极表面,单个双发夹结构所占的面积就会增大,电极表面修饰的双发夹结构就会减少,从而影响检测结果。本发明克服了上述技术难题,首次将基于双发夹结构的比率电化学分析法应用到P53基因的检测中来,在实现高灵敏度检测(检测限达到2.4×10-12M)的同时还具有操作简便,成本低,快速高效等优点。
(3)本发明利用捕获探针与P53基因的特异性结合,基于碱基互补配对原理(具体原理:捕获探针与P53基因结合后,由于P53基因与捕获探针存在19对互补碱基,而辅助探针与捕获探针只存在10对互补碱基,导致P53基因与捕获探针之间的结合力远大于辅助探针与捕获探针之间的结合力。因此在P53基因存在的条件下,捕获探针会与P53基因结合并被拉离电极表面从而导致MB的电信号减弱),具有好的选择性和灵敏度,能够直接对实际样品中的P53基因进行准确测定。
(4)本发明具有良好的再生能力,将使用后的传感器(具体指:利用本发明的修饰电极制备的检测P53基因的电化学传感器)或修饰电极在S2的缓冲溶液中浸泡过夜后,对于P53基因仍具有较好的检测能力。
(5)目前还没有关于基于双发夹结构的比率电化学传感器的介绍,本发明的修饰电极用于传感器的优点主要有两个:
第一、一般的电化学传感器难以克服电化学方法本身的缺陷,即电化学信号不稳定,收外界影响大,重复性差等。但是由于利用本发明修饰电极的比率(即二茂铁的电信号值比亚甲基蓝的电信号值)电化学生物传感器检测的是两个信号,因此当传感器受到干扰时,两个信号所受到的干扰相互抵消,从而保证检测结果的准确性。
第二、以DNA双发夹结构来实现比率电化学传感器,使得所制备的传感器具有良好的再生性。这是普通的比率电化学传感器所不具备的优点。如果将使用后的修饰电极重新浸泡在S2的缓冲溶液中,电极表面又会重新构建起双发夹结构,仍然可用于P53基因的检测。
附图说明
图1为实施例1的原理图;
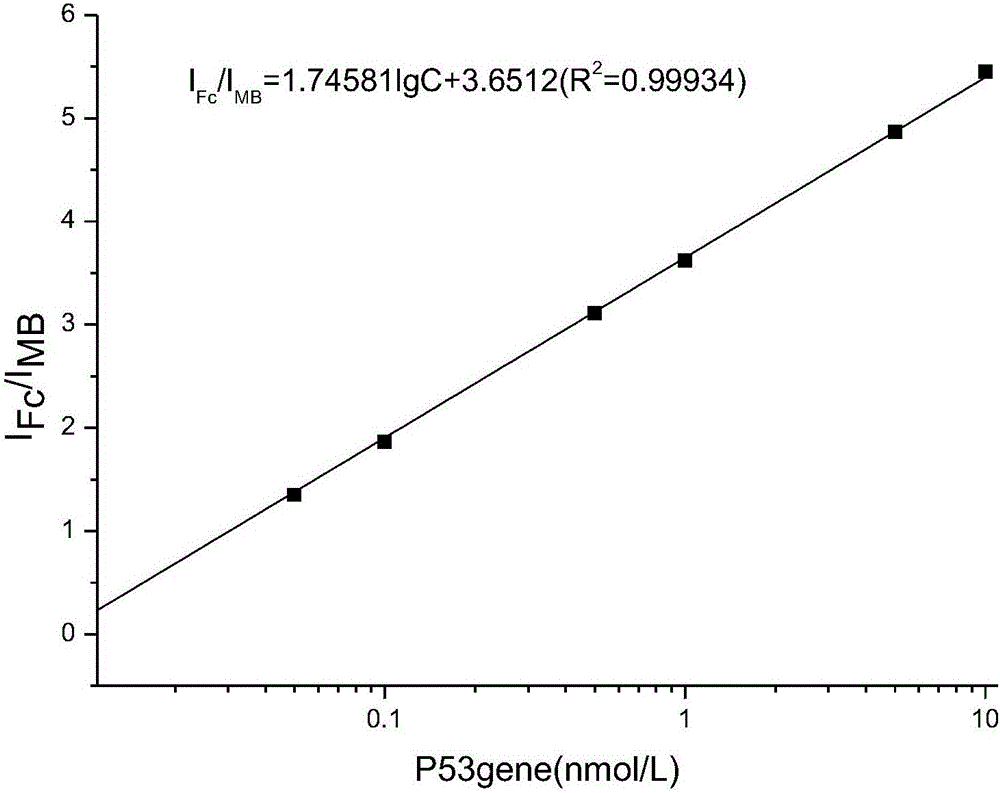
图2是实施例3检测P53基因的线性关系图。
具体实施方式
下面结合附图与实施例对本发明作进一步说明。
实验中所使用的仪器及试剂为:(1)仪器:CHI650电化学工作站(上海辰华仪器有限公司);采用饱和甘汞电极(SCE)为参比电极,铂丝电极为对电极;(2)试剂:辅助探针、捕获探针和P53基因(上海生工生物工程股份有限公司),其他试剂均为分析纯,实验用水为二次蒸馏水。
实施例1
一种用于基于双发夹结构的P53基因的修饰电极的制备方法,如图1所示,包括以下步骤:
(1)设计一条单链DNA辅助探针S1,该DNA链两端碱基可以与捕获探针链S2两端碱基互补配对并且自身有10个碱基长度的互补配对序列,能够在固定在金电极表面后形成发夹结构;S1链的5’端修饰有二茂铁标记物,该标记物可以产生电化学信号;S1链的53’端硫醇化,使得S1可以通过金-硫键修饰到金电极表面;辅助探针S1的DNA链序列为:5’-Fc-CTC TCA GTG ATT TTT TTA GTG AGA GAG-(CH2)6-SH-3’;
(2)设计一条单链DNA捕获探针S2,该DNA链中间部分碱基可以与P53基因互补配对;同时两端碱基可与辅助探针S1两端互补配对,能够在与辅助探针S1结合后形成双发夹结构;S2链的5’端修饰有亚甲基蓝标记物,该标记物可以产生电化学信号;辅助探针S2的DNA链序列为:5’-MB-TCA CTG AGT CTT CCA GTG TGA TGA TCA CT-3’;
(3)将金电极用氧化铝粉末打磨抛光成镜面,再分别经乙醇、二次蒸馏水超声清洗,氮气干燥,得到清洁金电极;
(4)辅助探针S1在含有三(2-羧乙基)膦的Tris-HCl缓冲液中打开二硫键,后将其水浴90℃加热6分钟,以退火获得单链辅助探针S1缓冲液;所述三(2-羧乙基)膦的Tris-HCl缓冲液为含有110-150mM Tris-HCl,100-120mM NaCl,1-10mMMgCl,9~11mM三(2-羧乙基)膦的混合液,其pH为7.4。
(5)将步骤(2)处理好的金电极浸在步骤(3)得到辅助探针S1缓冲液中,所述辅助探针S1缓冲液的浓度为40mM,反应温度为22℃反应时间为24小时,将辅助探针S1修饰到金电极表面,得到S1/GE修饰电极。
(6)将步骤(5)所得电极浸在捕获探针S2缓冲液中,所述捕获探针S2的浓度为50mM,水浴加热,反应温度为37℃,反应时间为1小时,使捕获探针S2与辅助探针S1结合,在金电极表面形成双发架结构,得到S2/S1/GE修饰电极;
实施例2
一种用于基于双发夹结构的P53基因的修饰电极的制备方法,如图1所示,包括以下步骤:
(1)设计一条单链DNA辅助探针S1,该DNA链两端碱基可以与捕获探针链S2两端碱基互补配对并且自身有10个碱基长度的互补配对序列,能够在固定在金电极表面后形成发夹结构;S1链的5’端修饰有二茂铁标记物,该标记物可以产生电化学信号;S1链的53’端硫醇化,使得S1通过金-硫键修饰到金电极表面;其中,辅助探针S1的DNA链序列为:5’-Fc-CTC TCA GTG ATT TTT TTA GTG AGA GAG-(CH2)6-SH-3’;
(2)设计一条单链DNA捕获探针S2,该DNA链中间部分碱基可以与P53基因互补配对;同时两端碱基可与辅助探针S1两端互补配对,能够在与辅助探针S1结合后形成双发夹结构;S2链的5’端修饰有亚甲基蓝标记物,该标记物可以产生电化学信号;辅助探针S2的DNA链序列为:5’-MB-TCA CTG AGT CTT CCA GTG TGA TGA TCA CT-3’;
(3)将金电极用氧化铝粉末打磨抛光成镜面,再分别经乙醇、二次蒸馏水超声清洗60s,氮气干燥,得到清洁金电极;
(4)辅助探针S1在含有三(2-羧乙基)膦的Tris-HCl缓冲液中打开二硫键,后将其水浴90℃加热4分钟,以退火获得单链辅助探针S1缓冲液;所述三(2-羧乙基)膦的Tris-HCl缓冲液为含有110-150mM Tris-HCl,100-120mM NaCl,1-10mMMgCl,9~11mM三(2-羧乙基)膦的混合液,其pH为7.8。
(5)将步骤(2)处理好的金电极浸在步骤(3)得到辅助探针S1缓冲液中,所述辅助探针S1缓冲液的浓度为50mM,反应温度为25℃反应时间为22小时,将辅助探针S1修饰到金电极表面,
(6)将步骤(4)所得电极浸在捕获探针S2缓冲液中,所述捕获探针S2的浓度为35mM,水浴加热,反应温度为35℃,反应时间为3小时,使捕获探针S2与辅助探针S1结合,在金电极表面形成双发夹结构,得到S2/S1/GE修饰电极。
实施例3
实施例1制备的修饰电极在检测P53基因中的应用,步骤如下:
将实施例1的修饰电极浸泡在Tris-HCl缓冲液中,所述Tris-HCl缓冲液为含有110-150mM Tris-HCl,100-120mM NaCl,1-10mMMgCl的混合液,其pH为7.4,水浴加热15分钟。然后与甘汞参比电极和铂丝对比电极构成三电极系统,在Tris-HCl缓冲液进行DPV检测,得到亚甲基蓝的峰电流I0(MB),二茂铁的峰电流为I0(Fc),重复多次取平均值。
配置一系列p53基因缓冲溶液,其中缓冲溶液的浓度和pH值保持不变,p53基因的浓度分别调节为10-8,5×10-9,10-9,5×10-10,10-10,5×10-11,10-11,10-12M,然后将所得的电极浸泡在p53的缓冲溶液中,水浴35℃加热15分钟,以三电极法测定每个样品的电化学信号,并对测定的p53基因进行线性拟合(即IFc/IMB与p53基因浓度的对数的线性关系)。
使用所构建的三电极系统采用同样方法对实际样品中的P53基因进行DPV检测,求的二茂铁氧化电流对亚甲基蓝氧化电流的比值,代入线性回归方程确定样品中P53基因的浓度,以检验本发明在生物样品或复杂体系中的实际分析能力,参见图2(图中六个点的的浓度为1×10-8,5×10-9,1×10-9,5×10-10,1×10-10,5×10-11,1×10-11M)。
对P53基因的检测结果显示,对不同浓度P53基因峰电流曲线均变化明显,P53基因在浓度为0.01~100nM内成良好的线性关系,本申请的电化学生物传感器对溶菌酶的检测限度可低至2.4×10-12M,仪器成本低,灵敏度高,快速高效。
实施例4
实施例1制备的修饰电极在检测P53基因中的应用,步骤如下:
将实施例1修饰电极浸泡在Tris-HCl缓冲液中,所述Tris-HCl缓冲液为含有110-150mM Tris-HCl,100-120mM NaCl,1-10mMMgCl的混合液,其pH为7.8,水浴加热30分钟。然后与甘汞参比电极和铂丝对比电极构成三电极系统,在Tris-HCl缓冲液进行DPV检测,得到亚甲基蓝的峰电流I0(MB),二茂铁的峰电流为I0(Fc),重复多次取平均值。
配置一系列p53基因缓冲溶液,其中缓冲溶液的浓度和pH值保持不变,p53基因的浓度分别调节为10-8,5×10-9,10-9,5×10-10,10-10,5×10-11,10-11,10-12M,然后将所得的电极浸泡在p53的缓冲溶液中,水浴35℃加热30分钟,以三电极法测定每个样品的电化学信号,并对测定的p53基因进行线性拟合(即IFc/IMB与p53基因浓度的对数的线性关系)。
使用所构建的三电极系统采用同样方法对实际样品中的P53基因进行DPV检测,求的二茂铁氧化电流对亚甲基蓝氧化电流的比值,代入线性回归方程确定样品中P53基因的浓度,以检验本发明在生物样品或复杂体系中的实际分析能力。
对P53基因的检测结果显示,对不同浓度P53基因峰电流曲线均变化明显,P53基因在浓度为0.01~100nM内成良好的线性关系,本申请的电化学生物传感器对溶菌酶的检测限度可低至2.4×10-12M,仪器成本低,灵敏度高,快速高效。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 还没有人留言评论。精彩留言会获得点赞!