用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制作方法
所述申请号为201310612970.2的中国专利申请是申请日为2010年1月15日、申请号为201080009980.1、发明名称为“用于PHOLED的具有氮杂-二苯并噻吩或氮杂-二苯并呋喃核的新材料”的中国专利申请(PCT/US2010/021111)的分案申请。本申请要求2009年1月16日提交的美国临时申请No.61/145,370的优先权,其公开内容通过引用全部明确地纳入本文中。本申请涉及2008年9月12日提交的美国申请No.12/209,928和2006年5月31日提交的美国申请No.11/443,586。要求保护的发明由联合的大学-公司研究协议的一个或多个下列参与方做出,代表其做出,和/或与其相关地做出:密歇根大学董事会、普林斯顿大学、南加利福尼亚大学和通用显示公司。该协议在要求保护的发明的做出之日和其之前有效,并且要求保护的发明作为在该协议范围内进行的活动的结果而做出。
技术领域:
本发明涉及含有氮杂-二苯并噻吩或氮杂-二苯并呋喃的新的有机络合物。该材料可以用于有机发光器件(OLEDs)中。
背景技术:
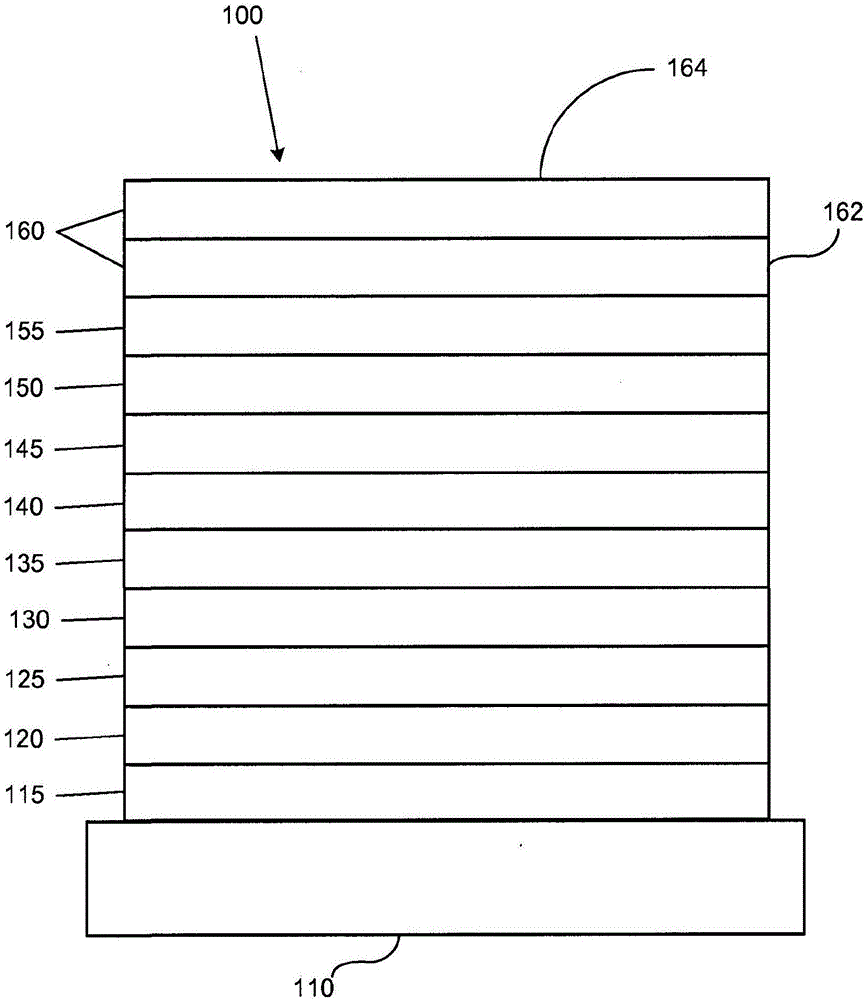
:由于很多原因,利用有机材料的光电器件变得越来越受欢迎。用于制备这样的器件的很多材料比较廉价,因此有机光电器件在相对于无机器件的成本优势方面具有潜力。此外,有机材料的固有特性,例如它们的柔性,可以使得它们良好地适用于特定应用,例如在柔性基片上制造。有机光电器件的实例包括有机发光器件(OLEDs)、有机光电晶体管、有机光伏电池和有机光电探测器。对于OLEDs,有机材料可以具有优于常规材料的性能。例如,有机发光层发射的波长通常可以容易地用合适的掺杂剂进行调整。OLEDs利用当跨器件施加电压时发光的有机薄膜。OLEDs正在成为在诸如平板显示、照明和背光的应用中越来越有利的技术。多种OLED材料和构造记载于美国专利No.5,844,363、6,303,238和5,707,745中,它们全部通过引用纳入本文。发磷光分子的一种应用是全色显示器。这样的显示器的工业标准要求适于发射称为“饱和”色彩的特定色彩的像素。特别是,这些标准要求饱和的红、绿和蓝色像素。色彩可以使用CIE坐标度量,它是现有技术中公知的。发绿光分子的一个实例是三(2-苯基吡啶)铱,它记为Ir(ppy)3,具有以下结构:在本文的该图以及后面的图中,我们将从氮到金属(此处为Ir)的配位键表示为直线。本文中使用的术语“有机”包括可以用于制备有机光电器件的聚合物材料和小分子有机材料。“小分子”指的是非聚合物的任何有机材料,并且“小分子”实际上可以相当大。在某些情况下小分子可以包含重复单元。例如,使用长链烷基作为取代基并不会将该分子排除在“小分子”类别之外。小分子也可以纳入聚合物中,例如作为聚合物主链的侧挂基团或者作为主链的一部分。小分子也可以充当树枝状化合物的核心结构部分,该化合物包括一系列构建在核心结构部分上的化学壳。树枝状化合物的核心结构部分可以是荧光或磷光小分子发光体。树枝状化合物可以是“小分子”,并且据信目前在OLEDs领域使用的所有树枝状化合物都是小分子。本文中使用的“顶部”指的是离基片最远,而“底部”指的是离基片最近。在将第一层描述为“位于第二层上”的情况下,第一层距离基片更远。在第一层和第二层之间可以存在其它层,除非明确指出第一层与第二层“接触”。例如,可以将阴极描述为“位于阳极上”,即使其间存在多种有机层。本文中使用的“可溶液处理”指的是能够以溶液或悬浮液形式在液体介质中溶解、分散或输送和/或从液体介质中沉积。当认为配体直接有助于发光材料的光活性性质时,可以将该配体称为“光活性”的。当认为配体不有助于发光材料的光活性性质时,可以将该配体称为“辅助”的,尽管辅助配体可以改变光活性配体的性质。如本文中所使用,并且如本领域技术人员通常所理解,第一“最高已占分子轨道”(HOMO)或“最低未占分子轨道”(LUMO)能级“大于”或“高于”第二HOMO或LUMO能级,如果该第一能级更接近于真空能级。由于电离势(IP)作为相对于真空能级的负能量进行测量,因此更高的HOMO能级对应于具有更小的绝对值的IP(负性较低的IP)。类似地,更高的LUMO能级对应于具有更小的绝对值的电子亲和性(EA)(负性较低的EA)。在常规的能级图上,真空能级位于顶部,材料的LUMO能级高于相同材料的HOMO能级。与“较低”的HOMO或LUMO能级相比,“较高”的HOMO或LUMO能级显得更接近该图的顶部。如本文中所使用,并且如本领域技术人员通常所理解,第一功函数“大于”或“高于”第二功函数,如果该第一功函数具有更高的绝对值。因为功函数通常作为相对于真空能级的负数进行测量,这意味着“更高”的功函数更负。在常规的能级图上,真空能级位于顶部,“较高”的功函数表示为沿向下的方向更远离真空能级。因而,HOMO和LUMO能级的定义采用与功函数不同的惯例。关于OLEDs以及上述定义的更多细节,可以见美国专利No.7,279,704,其全部公开内容通过引用纳入本文。技术实现要素:提供了用于制备氮杂-二苯并噻吩化合物或氮杂-二苯并呋喃化合物的方法。该方法包括用tBuONO处理具有式的氨基-芳基硫代吡啶中间体的乙酸溶液,其中X1和X2之一为氮并且X1和X2中的另一个为碳并且其中Y为S或O,以产生具有式的氮杂络合物(complex)。R1和R2可以表示单取代、二取代、三取代或四取代。R1选自氢、烷基、芳基、杂芳基和卤素(halide)。优选地,R1为卤素。R2选自氢、烷基、芳基和卤素。优选地,X1和X2之一可以为碳并且另一个可以为氮。更优选地,X1为氮并且X2为碳或者X1为碳并且X2为氮。优选地,Y为S。或者,Y可以优选地为O。R2可以包括至少一个卤素,并且R2可以仅包括卤素取代基。该方法可以用于制备其中R2不是卤素的化合物,并且在用tBuONO处理之前将氨基-芳基硫代吡啶中间体用H2SO4处理。的产率可以大于50%。提供了新的一类氮杂-二苯并噻吩和氮杂-二苯并呋喃化合物。这些化合物具有下式:X1、X2、X3、X4、X5、X6、X7和X8独立地选自碳原子和氮原子,并且X1、X2、X3、X4、X5、X6、X7和X8的至少之一为氮原子。Y为S或O。R1和R2可以表示单取代、二取代、三取代或四取代。R1和R2独立地选自氢、烷基、芳基和卤素,并且R1和R2的至少之一选自R’1、R’2、R’3和R’4可以表示单取代、二取代、三取代、四取代或五取代,并且R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,m和n为0、1、2、3或4;并且其中m+n等于或大于2,并且m+n等于或小于6。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。此外,提供了新的一类氮杂-二苯并噻吩和氮杂-二苯并呋喃化合物。这些化合物具有下式:X1、X2、X3、X4、X5、X6、X7和X8独立地选自碳原子和氮原子,并且X1、X2、X3、X4、X5、X6、X7和X8的至少之一为氮原子。Y为S或O。R1和R2可以表示单取代、二取代、三取代或四取代。R1和R2独立地选自氢、烷基、芳基和卤素,并且R1和R2的至少之一选自R’1、R’2、R’3和R’4可以表示单取代、二取代、三取代、四取代或五取代,并且R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,m和n为0、1、2、3或4;并且其中m+n等于或大于2,并且m+n等于或小于6。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。还提供了这样的化合物:其中R1和R2之一为氢并且R1和R2中的另一个选自:或者此外,提供了这样的化合物:其中R1和R2两者均选自本文中提供的基团。此外,提供了这样的化合物:其中R1选自本文中提供的基团。提供了包括化合物1-93的氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物的具体实例。提供了包括化合物1-79的氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物的具体实例。提供了包含有机发光器件的第一器件。该器件进一步包含阳极、阴极以及位于阳极和阴极之间的有机层。该有机层包含具有式I的化合物。特别是,该器件的有机层可以包含选自化合物1-93的化合物。一方面,该第一器件为消费产品。还提供了有机发光器件。该器件包含阳极、阴极以及位于阳极和阴极之间的有机层。该有机层包含具有式I的化合物。特别是,该器件的该有机层可以包含选自化合物1-79的化合物。优选地,该有机层为发光层并且具有式I的化合物为主体。该发光层可以进一步包含发光掺杂剂。优选地,该发光掺杂剂具有式其中R1和R2各自独立地选自氢、烷基和芳基。此外,还提供了消费产品。该产品含有器件,该器件具有阳极、阴极以及位于阳极和阴极之间的有机层,其中该有机层包含具有式I的化合物。附图说明图1示出有机发光器件。图2示出不具有独立电子传输层的倒置的有机发光器件。图3示出氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物。图4示出合成路径中的反应。具体实施方式通常,OLED包括位于阳极和阴极之间并且与阳极和阴极电连接的至少一个有机层。当施加电流时,阳极向有机层中注入空穴,阴极向有机层中注入电子。注入的空穴和电子各自向带相反电荷的电极迁移。当电子和空穴局限于同一分子中时,形成“激子”,它是具有激发能态的局域化的电子-空穴对。当激子通过发光机理弛豫时,发射出光。在一些情况下,激子可以局域化在激发体或激发复合体上。也可以发生非辐射机理,例如热弛豫,但是通常将其视为不合需要的。最初的OLEDs使用从其单线态发光(“荧光”)的发光分子,例如美国专利No.4,769,292中所公开,其全部内容通过引用纳入本文中。荧光发射通常发生在小于10纳秒的时间范围内。最近,已展示了具有从三线态发光(“磷光”)的发光材料的OLEDs。见Baldo等人的“HighlyEfficientPhosphorescentEmissionFromOrganicElectroluminescentDevices”(有机电致发光器件的高效磷光发射),Nature,第395卷,151-154,1998;(“Baldo-I”)和Baldo等人的“Veryhigh-efficiencygreenorganiclight-emittingdevicesbasedonelectrophosphorescence”(基于电磷光的极高效绿色有机发光器件),Appl.Phys.Lett,第75卷,第3期,4-6(1999)(“Baldo-II”),它们全部通过引用纳入本文。磷光更详细地记载于美国专利No.7,279,704的第5-6栏,其通过引用纳入本文。图1显示了有机发光器件100。这些图不一定按比例绘制。器件100可以包括基片110、阳极115、空穴注入层120、空穴传输层125、电子阻挡层130、发光层135、空穴阻挡层140、电子传输层145、电子注入层150、保护层155和阴极160。阴极160是具有第一导电层162和第二导电层164的复合阴极。器件100可以通过将上述层按顺序沉积而制备。这些不同的层的性质和功能以及材料实例更具体地记载于US7,279,704的第6-10栏中,其通过引用纳入本文。可以获得这些层中的每种的更多实例。例如,柔性且透明的基片-阳极组合公开于美国专利No.5,844,363中,其全部内容通过引用纳入本文。p型掺杂的空穴传输层的一个实例是以50:1的摩尔比用F4-TCNQ掺杂的m-MTDATA,公开于美国专利申请公布No.2003/0230980中,其全部内容通过引用纳入本文。发光材料和主体材料的实例公开于Thompson等人的美国专利No.6,303,238中,其全部内容通过引用纳入本文。n型掺杂的电子传输层的一个实例是以1:1的摩尔比用Li掺杂的BPhen,公开于美国专利申请公布No.2003/0230980中,其全部内容通过引用纳入本文。美国专利No.5,703,436和5,707,745(其全部内容通过引用纳入本文)公开了包括复合阴极的阴极的实例,其具有金属如Mg:Ag的薄层,具有覆盖的透明导电溅射沉积ITO层。阻挡层的理论和用途更详细地记载于美国专利No.6,097,147和美国专利申请公布No.2003/0230980中,其全部内容通过引用纳入本文中。注入层的实例提供于美国专利申请公布No.2004/0174116中,其全部内容通过引用纳入本文。关于保护层的说明可以见于美国专利申请公布No.2004/0174116中,其全部内容通过引用纳入本文。图2显示了倒置OLED200。该器件包括基片210、阴极215、发光层220、空穴传输层225和阳极230。器件200可以通过按顺序沉积所述层而制备。因为大多数常规OLED构造具有位于阳极上的阴极,而器件200具有位于阳极230下的阴极215,因此可以将器件200称为“倒置”OLED。与针对器件100所说明的类似的材料可以用于器件200的相应的层中。图2提供了可以如何将某些层从器件100的结构中省略的实例。图1和2所示的简单分层结构以非限制性实例的方式提供,并且应当理解,本发明的实施方案可以与很多种其它结构结合使用。所述的具体材料和结构是示例性的,并且可以使用其它材料和结构。基于设计、性能和成本因素,可以通过以不同方式将上述多种层相结合或者将层完全省略而获得功能性OLEDs。也可以包括未明确说明的其它层。可以使用明确说明的材料以外的材料。尽管本文中提供的很多实例将很多层描述成包含单一的材料,但是应当理解,可以使用材料的组合,例如主体与掺杂剂的混合物或者更一般的混合物。另外,层可以具有多个亚层。本文中给予各种层的名称并不打算具有严格的限制性。例如在器件200中,空穴传输层225传输空穴并向发光层220中注入空穴,并且可以描述为空穴传输层或空穴注入层。在一种实施方案中,OLED可以被描述为具有位于阴极和阳极之间的“有机层”。该有机层可以包含单一的层,或者可以进一步包含如针对图1和2中所述的不同有机材料的多个层。也可以使用未明确说明的结构和材料,例如包括聚合物材料的OLEDs(PLEDs),例如Friend等人的美国专利No.5,247,190中所公开的,其全部内容通过引用纳入本文中。作为进一步的实例,可以使用具有单个有机层的OLEDs。OLEDs可以叠置,例如如Forrest等人的美国专利No.5,707,745中所述,其全部内容通过引用纳入本文中。OLED结构可以偏离图1和2中所示的简单的层状结构。例如,基片可以包括成角的反射表面以改善外耦合(out-coupling),例如Forrest等人的美国专利No.6,091,195中所记载的平台(mesa)结构和/或Bulovic等人的美国专利No.5,834,893中所记载的陷阱(pit)结构,其全部内容通过引用纳入本文中。除非另外说明,各种实施方案的任何层可以通过任何合适的方法沉积。对于有机层,优选方法包括热蒸发、喷墨,例如如美国专利No.6,013,982和6,087,196中所记载,其全部内容通过引用纳入本文中;有机气相沉积(OVPD),例如如Forrest等人的美国专利No.6,337,102中所记载,其全部内容通过引用纳入本文中;以及通过有机气相喷涂(OVJP)的沉积,例如如美国专利申请No.10/233,470中所记载,其全部内容通过引用纳入本文中。其它合适的沉积方法包括旋涂和其它基于溶液的方法。基于溶液的方法优选在氮气或惰性气氛中进行。对于其它层,优选方法包括热蒸发。优选的成图案方法包括通过掩模沉积、冷焊,例如如美国专利No.6,294,398和6,468,819中所记载,其全部内容通过引用纳入本文中;以及与某些沉积方法如喷墨和OVJD相关的成图案方法。也可以使用其它方法。可以对待沉积的材料进行改性以使它们与具体的沉积方法相容。例如,可以在小分子中使用取代基例如支化或非支化的并优选含有至少3个碳的烷基和芳基,以增强它们进行溶液处理的能力。可以使用具有20个或更多个碳的取代基,3至20个碳是优选范围。具有非对称结构的材料可以比具有对称结构的材料具有更好的可溶液处理性,因为非对称材料可以具有较低的重结晶倾向。树枝状化合物取代基可以用于提高小分子进行溶液处理的能力。根据本发明的实施方案制备的器件可以纳入很多种消费产品中,包括平板显示器、计算机监视器、电视、广告牌、室内或室外照明灯和/或信号灯、危险警告显示器、全透明显示器、柔性显示器、激光打印机、电话、移动电话、个人数字助理(PDAs)、笔记本电脑、数码相机、可携式摄像机、取景器、微型显示器、交通工具、大面积墙、剧场或体育场屏幕或标志。多种控制机制可以用于控制根据本发明制备的器件,包括无源矩阵和有源矩阵。很多器件拟用于对人体而言舒适的温度范围内,例如18℃至30℃,更优选室温(20至25℃)。本文中记载的材料和结构可以应用于除OLEDs以外的器件中。例如,其它光电器件如有机太阳能电池和有机光电探测器可以使用这些材料和结构。更一般地说,有机器件例如有机晶体管可以使用这些材料和结构。术语卤、卤素、烷基、环烷基、烯基、炔基、芳烷基(arylkyl)、杂环基团、芳基、芳香基团和杂芳基是本领域已知的,并且定义于US7,279,704的第31-32栏中,该专利通过引用纳入本文中。提供了含有氮杂-二苯并噻吩或氮杂-二苯并呋喃核的新的一类化合物(示于图3中)。特别是,提供了进一步被三亚苯和/或含氮取代基取代的氮杂-二苯并噻吩化合物或氮杂-二苯并呋喃化合物。这些化合物可以有利地用于磷光有机发光器件中。优选地,这些化合物可以在发光层中用作主体材料或者用作增强层中的材料。尽管存在现有的用于氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物的合成方法,这些合成路线可能具有有限的实用性。例如,氮杂-二苯并噻吩和氮杂-二苯并呋喃的底物首先通过公知的Pschorr环化方法合成,该方法包括形成重氮盐,然后在使用或不使用催化剂例如Cu、CuCl的情况下在含水介质中环化。然而,Pschorr环化方法的一般产率不一致并且可以低于10%。因此,非常需要提供用于以改善的产率制备氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物的方法。本文中提供了用于制备氮杂-二苯并噻吩化合物的新方法(示于图4中)。本发明中所述的方法与现有合成方法的不同至少在于使用乙酸、不使用含水介质以及不使用任何金属催化剂。优选地,乙酸为纯乙酸(或冰乙酸)。本文中提供的方法可以提供高于50%的产率或者高于70%的产率。含二苯并噻吩的材料和含二苯并呋喃的材料通常为具有相对较高的三线态能量的空穴传输材料。由于二苯并噻吩和二苯并呋喃的有利性能,这些化合物已用于OLED领域中,并且这些化合物中的一些已获得良好的器件性能。参见Lin等人,Dibenzothiophene-containingMaterialsinPhosphorescentLightEmittingDiodes(磷光发光二极管中的含二苯并噻吩的材料),2008,美国申请No.12/208,907和Ma等人的Benzo-fusedThiophene/TriphenyleneHybridMaterials(苯并稠合噻吩/三亚苯杂化材料),2008,PCT/US2008/072499。不受制于理论,认为阴离子注入和阴离子稳定性可以在器件稳定性中扮演重要角色。为了得到针对向发光层中的阴离子注入的较低能障(energybarrier)和高的阴离子稳定性,需要具有较低的LUMO能级的化合物。特别是,含有二苯并噻吩和二苯并呋喃、具有较低LUMO值的化合物(即更容易还原的化合物)会是有利的。本文中提供的化合物含有氮杂-二苯并噻吩或氮杂-二苯并呋喃核,该核被具有期望性能的特定化学基团进一步取代。具体地说,这些氮杂型化合物被三亚苯基团和/或含氮基团(例如咔唑)取代,以保持高的三线态能量并提供改善的电荷传输性能。因此,这些取代的氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物可以提供具有改善的稳定性、改善的效率和更长的寿命的器件。此外,已表明这些氮杂型化合物比它们的二苯并噻吩或二苯并呋喃对应物更容易还原,因此可以提供具有低操作电压的器件。三亚苯是具有高的三线态能量的多环芳烃,它也具有高的π共轭以及第一单线态和第一三线态能级之间的相对较小的能量差。这将表明,与具有类似的三线态能量的其它芳族化合物(例如联苯)相比,三亚苯具有相对容易达到的HOMO和LUMO能级。三亚苯的这些特征使得它成为OLED主体中的良好的分子构建模块以使电荷(空穴或电子)稳定。使用三亚苯及其衍生物作为主体的一个优点是它可以容纳红色、绿色甚至蓝色磷光掺杂剂,以在没有能量猝灭的情况下得到高效率。可以使用三亚苯主体以提供高效率和稳定性PHOLEDs。参见Kwong和Alleyene,TriphenyleneHostsinPhosphorescentLightEmittingDiodes(磷光发光二极管中的三亚苯主体),2006,60pp,US2006/0280965A1。含有氮杂-二苯并噻吩或氮杂-二苯并呋喃核以及三亚苯结构部分的化合物作为PHOLEDs中的主体可以是有利的。更具体地说,该化合物的两部分的三线态能量相对较高,从而保持总体的高三线态能量。此外,这两个基团在一个化合物中的组合也可以提供改善的电荷平衡,从而改善器件效率和寿命。可以作为这样的化合物的三亚苯结构部分的三亚苯基团非限制性实例可以包括含氮基团也可以用作氮杂-二苯并噻吩化合物和氮杂-二苯并呋喃化合物的取代基。这样的含氮基团可以包括咔唑、低聚咔唑、吲哚并咔唑和二苯基胺。咔唑是具有高的三线态能量的含氮杂芳族化合物,并具有空穴传输和电子传输性能。使用含咔唑化合物(即咔唑、低聚咔唑和吲哚并咔唑)作为主体材料的一个优点是它们同时具有足够大的三线态能量和载流子传输性能。例如,吲哚并咔唑和3-(9-咔唑基)咔唑具有相对较低的电化学氧化电势。这样,这些化合物更容易氧化和将氧化逆转,这改善总的主体稳定性。另一个优点是这些咔唑构建模块可以充当给体,而与在此作为受体的氮杂-二苯并噻吩或氮杂-二苯并呋喃的偶合形成给体-受体型分子。据信,具有给体-受体分子构造的这些分子至少部分地有助于器件中的低电压特性。本文中提供的化合物可以充当蓝色、绿色和红色PHOLEDs中的主体材料。特别是,被三亚苯取代的氮杂-二苯并噻吩或氮杂-二苯并呋喃化合物可以用于蓝色、绿色和红色器件中,因为这些化合物可以容纳蓝色、绿色和红色发光掺杂剂。优选地,这些化合物可以用于蓝色器件中。本文中提供的氮杂型化合物也可以被三亚苯和含氮取代基两者取代。被三亚苯和含氮基团两者取代的这些化合物可以用于绿色和红色器件中,因为这些化合物可以容纳绿色和红色发光掺杂剂。优选地,这些化合物可以用于绿色器件中。本文中所述的杂芳族化合物(即氮杂-二苯并噻吩和氮杂-二苯并呋喃)比它们的二苯并噻吩或二苯并呋喃对应物更容易还原,特别是相差0.2V至0.5V。结果,这些氮杂型化合物可以提供具有低操作电压和长寿命的器件。不受制于理论,认为更容易还原的化合物可以提供更高的阴离子稳定性和器件中从电子传输层(ETL)向发光层(EML)的更容易的阴离子注入。本文中所述的化合物具有下式:X1、X2、X3、X4、X5、X6、X7和X8独立地选自碳原子和氮原子,并且X1、X2、X3、X4、X5、X6、X7和X8的至少之一为氮原子。Y为S或O。R1和R2可以表示单取代、二取代、三取代或四取代。R1和R2独立地选自氢、烷基、芳基和卤素。R1和R2的至少之一选自R’1、R’2、R’3和R’4可以表示单取代、二取代、三取代、四取代或五取代;并且R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。本文中所述的化合物具有下式:其中X1、X2、X3、X4、X5、X6、X7和X8独立地选自碳原子和氮原子,并且X1、X2、X3、X4、X5、X6、X7和X8的至少之一为氮原子。Y为S或O;其中R1和R2可以表示单取代、二取代、三取代或四取代。R1和R2独立地选自氢、烷基、芳基和卤素,并且R1和R2的至少之一选自R’1、R’2、R’3和R’4可以表示单取代、二取代、三取代、四取代或五取代;并且R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。优选地,m和n为0、1、2、3或4,并且m+n等于或大于2并且m+n等于或小于6。不受制于理论,认为至少2通过提供优选量的电子传输结构部分而提供更好的电子传输性能。此外,认为大于6可以导致升华温度的提高,使得使用这样的化合物的器件制造变得不实用。一方面,R1和R2的至少之一选自:R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。提供了这些化合物的具体实例,这些具体实例包括选自以下的化合物:提供了这些化合物的具体实例,这些具体实例包括选自以下的化合物:另一方面,R1和R2的至少之一选自:R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:另一方面,R1和R2各自独立地选自氢和R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:一方面,R1和R2的至少之一选自:R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:另一方面,R1和R2各自独立地选自氢和R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:一方面,R1和R2各自独立地选自氢和R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:另一方面,R1选自:R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。R2为氢。优选地,R’1、R’2、R’3和R’4各自独立地为氢或甲基。这样的化合物的具体实例包括选自以下的化合物:还提供了包含有机发光器件的第一器件。该器件进一步包含阳极、阴极以及位于阳极和阴极之间的有机层。该有机层进一步包含具有下式的化合物:X1、X2、X3、X4、X5、X6、X7和X8独立地选自碳原子和氮原子。X1、X2、X3、X4、X5、X6、X7和X8的至少之一为氮原子。Y为S或O。R1和R2可以表示单取代、二取代、三取代或四取代。R1和R2独立地选自氢、烷基、芳基和卤素。R1和R2的至少之一选自:R’1、R’2、R’3和R’4可以表示单取代、二取代、三取代、四取代或五取代。R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。一方面,该第一器件为消费产品。此外,还提供有机发光器件。该器件包含阳极、阴极以及位于阳极和阴极之间的有机发光层,其中该有机层进一步包含具有式I的化合物。优选地,m和n为0、1、2、3或4;并且m+n等于或大于2并且m+n等于或小于6。一方面,R1和R2的至少之一选自:R’1、R’2、R’3和R’4独立地选自氢、烷基、杂烷基、芳基和杂芳基。另一方面,R1和R2各自独立地选自氢和一方面,提供含有选自化合物1-93的化合物的器件。特别是,提供其中化合物选自化合物1-79的器件。一方面,有机层是发光层,并且具有式I的氮杂-二苯并噻吩和氮杂-二苯并呋喃是有机层中的主体。该有机层可以进一步包含发光掺杂剂。优选地,该发光掺杂剂具有下式:其中R1和R2独立地选自氢、烷基和芳基。如上所讨论,具有式I的氮杂-二苯并噻吩和氮杂-二苯并呋喃化合物可以有利地用作发光层中的主体材料。然而,这些化合物也可以用作增强层中的材料。特别是,本文中所述的化合物可以用作阻挡层中的材料。还提供了消费器件,其中该器件进一步包含阳极、阴极和有机层。该有机层进一步包含具有式I的氮杂-二苯噻吩或氮杂-二苯并呋喃化合物。此外,提供了用于制备氮杂-二苯并噻吩化合物或氮杂-二苯并呋喃化合物的方法(表示在图4中,上部)。该方法包括用tBuONO处理具有式的氨基-芳基硫代吡啶中间体的乙酸溶液,以产生具有式的氮杂络合物。Y为S或O。X1或X2为氮。R1和R2可以为单取代、二取代、三取代或四取代。R1选自氢、烷基、芳基和杂芳基;并且R2选自氢、烷基、芳基和卤素。例如,可以用1-2当量的tBuONO在室温下处理在吡啶环上具有卤素取代基的中间体3-氨基-4-芳基硫代吡啶的乙酸溶液或者在吡啶环上具有卤素取代基的中间体3-芳基硫代-4-氨基吡啶的乙酸溶液,直到不产生气体,通常约1-3小时。该方法的具体实例包括其中Y为S的中间体和氮杂络合物(即二苯并噻吩中间体和氮杂-二苯并噻吩络合物)。或者,该方法可以优选地包括其中Y为O的中间体和氮杂络合物(即二苯并呋喃中间体和氮杂-二苯并呋喃络合物)。本文中提供的方法可以产出大于50%或者大于70%的氮杂-络合物。特别是,的产率可以大于50%。制备氮杂-二苯并噻吩或氮杂-二苯并呋喃化合物的方法的实例包括其中X1和X2之一为碳且另一个为氮的中间体。在该方法的一个具体实例中,X1为氮且X2为碳。在另一个具体实例中,X1为碳且X2为氮。制备氮杂-二苯并噻吩或氮杂-二苯并呋喃化合物的方法的实例包括下述的化合物:其中R2包括至少一个卤素。在该方法的一种具体实例中,R2仅包括卤素取代基。此外,R1优选为卤素。卤素取代基可以包括但不限于溴、氯、氟和碘。该方法也可以用于制备其中R2不是卤素的氮杂-二苯并噻吩或氮杂-二苯并呋喃化合物(即在吡啶环上不存在进一步的取代基)。对于在吡啶环上不存在卤素取代基的这些氮杂化合物,将氨基-芳基硫代吡啶中间体在用tBuONO处理之前用H2SO4处理(表示在图4中,下部)。例如,可以用1-5当量的H2SO4然后用1-2当量的tBuONO处理中间体3-氨基-4-芳基硫代吡啶的乙酸溶液或者中间体3-芳基硫代-4-氨基吡啶的乙酸溶液,直到不产生气体,通常约1-5小时。本文中所述的可以用于有机发光器件中的特定层的材料可以与器件中存在的多种其它材料组合使用。例如,本文中公开的发光掺杂剂可以与多种主体、传输层、阻挡层、注入层、电极和可以存在的其它层组合使用。所述的或下述的材料是可以与本文中公开的化合物组合使用的材料的非限制性实例,本领域技术人员可以容易地查阅文献来确定可以组合使用的其它材料。除了本文中公开的材料,和/或与本文中公开的材料相组合,可以在OLED中使用很多空穴注入材料、空穴传输材料、主体材料、掺杂剂材料、激子/空穴阻挡层材料、电子传输和电子注入材料。可以在OLED中与本文中公开的材料组合使用的材料的非限制性实例列于下表1中。表1列举了非限制性的材料类别、每一类化合物的非限制性实例和公开这些材料的文献。表1实验化合物实施例实施例1.化合物1的合成化合物1步骤1.向500mL圆底烧瓶中加入2-氯-3-碘-4-氨基吡啶(10g,39mmol)、4-溴苯硫酚(7.0g,34mmol)、CuI(0.4g,2.0mmol)、乙二醇(4.9g,78mmol)、碳酸钾(10.8g,74mmol)和200mL异丙醇。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。2-氯-3-(4-溴苯基硫)-4-氨基吡啶的产量为7.4g。步骤2.向500mL圆底烧瓶中加入2-氯-3-(4-溴苯基硫)-4-氨基吡啶(7.0g,22mmol)和400mLAcOH。向该清澈溶液中逐滴加入ButONO(2.3g,22mmol)。在室温下搅拌1小时后,再加入10mmolButONO。将该混合物继续搅拌另外2小时。将反应用水骤停,并将产物用硅胶柱纯化。1-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶的产量为6.5g。步骤3.向500mL圆底烧瓶中加入1-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶(3.6g,12mmol)、咔唑(6.0g,36mmol)、Pd2(dba)3(1.1g,1.2mmol)、2-二环己基膦基-2’,6’-二甲氧基联苯(S-Phos,2.0g,4.8mmol)、叔丁醇钠(6.9g,72mmol)和250mL二甲苯。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。产量为4.0g。将产物通过真空升华进一步纯化。1HNMR结果证实了目标化合物。实施例2.化合物2的合成化合物2步骤1.向500mL圆底烧瓶中加入2-氯-4-氨基-5-碘吡啶(11.5g,45mmol)、4-溴苯硫酚(8.1g,42.8mmol)、CuI(0.4g,2.3mmol)、乙二醇(5.6g,90.4mmol)、碳酸钾(12.4g,90.4mmol)和200mL异丙醇。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。2-氯-5-(4-溴苯基硫)-4-氨基吡啶的产量为9.2g。步骤2.向500mL圆底烧瓶中加入2-氯-5-(4-溴苯基硫)-4-氨基吡啶(11g,35mmol)和600mLAcOH。向该清澈溶液中逐滴加入ButONO(3.6g,35mmol)。在室温下搅拌1小时后,再加入15mmolButONO。将该混合物继续搅拌另外2小时。将反应用水骤停,并将产物用硅胶柱纯化。3-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶的产量为10g。步骤3.向500mL圆底烧瓶中加入3-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶(3.0g,10mmol)、咔唑(4.2g,25mmol)、Pd(OAc)2(0.1g,0.5mmol)、P(But)3(1M于甲苯中,1.5mL,1.5mmol)、叔丁醇钠(6.3g,66mmol)和250mL二甲苯。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。产量为4.2g。将产物通过真空升华进一步纯化。1HNMR结果证实了目标化合物。实施例3.化合物3的合成化合物3步骤1.向500mL圆底烧瓶中加入2,6-二氯-3-碘-4-氨基吡啶(7.0g,28.8mmol)、苯硫酚(3.2g,34.8mmol)、CuI(0.2g,1.2mmol)、乙二醇(3.0g,57.6mmol)、碳酸钾(6.6g,57.6mmol)和200mL异丙醇。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。2,6-二氯-3-苯基硫-4-氨基吡啶的产量为4.0g。步骤2.向500mL圆底烧瓶中加入2,6-二氯-3-苯基硫-4-氨基吡啶(4.0g,14.7mmol)和200mLAcOH。向该清澈溶液中逐滴加入ButONO(1.5g,15mmol)。在室温下搅拌1小时后,再加入8mmolButONO。将该混合物继续搅拌另外2小时。将反应用水骤停,并将产物用硅胶柱纯化。1,3-二氯-[1]苯并噻吩并[2,3-c]吡啶的产量为3.2g。步骤3.向500mL圆底烧瓶中加入1,3-二氯-[1]苯并噻吩并[2,3-c]吡啶(2.5g,10mmol)、咔唑(4.2g,25mmol)、Pd2(dba)3(0.9g,1.0mmol)、2-二环己基膦基-2’,6’-二甲氧基联苯(S-Phos,1.6g,4.0mmol)、叔丁醇钠(4.8g,50mmol)和200mL二甲苯。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。产量为4.2g。将产物通过真空升华进一步纯化。1HNMR结果证实了目标化合物。实施例4.化合物4的合成化合物4步骤1.向500mL圆底烧瓶中加入1-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶(5.0g,16.7mmol)、咔唑(2.8g,16.7mmol)、Pd(OAc)2(0.1g,0.4mmol)、PBut3(甲苯中的1.0M溶液,1.2mL,1.2mmol)、叔丁醇钠(4.8g,50.1mmol)和400mL二甲苯。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。1-氯-6-(9-咔唑)-[1]苯并噻吩并[2,3-c]吡啶的产量为1.9g。步骤2.向500mL圆底烧瓶中加入1-氯-6-(9-咔唑)-[1]苯并噻吩并[2,3-c]吡啶(1.3g,3.4mmol)、二苯基胺(0.7g,4.0mmol)、Pd2(dba)3(0.09g,0.1mmol)、2-二环己基膦基-2’,4’,6’-三异丙基联苯(0.2g,0.4mmol)、叔丁醇钠(0.8g,8.0mmol)和100mL甲苯。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。化合物4的产量为1.1g。实施例5.化合物21的合成化合物21步骤1.将2-氨基-5-氯吡啶(10.0g,77.8mmol)、乙酸钾(7.63g,77.8mmol)在100mL乙酸中的溶液加热至85℃,并滴加50mL乙酸中的ClI(12.6g,77.8mmol)。将反应混合物在该温度下保持2小时,用1L水稀释,用NaOH1N溶液中和至pH7,并用乙酸乙酯萃取(4×75mL)。将有机级份合并,用NaHCO3洗涤,通过C盐(celite)过滤并蒸发。使残余物进行硅胶柱色谱分离(洗脱剂-己烷/乙酸乙酯1/1),得到黄色固体形式的5-氯-3-碘吡啶-2-胺(11.9g,60%)。步骤2.将5-氯-2-甲氧基苯基硼酸(5.0g,26.8mmol)、5-氯-3-碘吡啶-2-胺(6.83g,26.8mmol)、碳酸钠(8.53g,80.5mmol,于50mL水中)、Pd(PPh3)4(621mg,2mol.%)和100mL甲苯的混合物在N2下回流过夜。将反应混合物冷却至室温,将有机层分离并在真空中浓缩。将残余物以己烷/乙酸乙酯梯度混合物作为洗脱剂进行硅胶柱色谱分离,得到3.3g(46%产率)5-氯-3-(5-氯-2-甲氧基苯基)吡啶-2-胺。步骤3.将5-氯-3-(5-氯-2-甲氧基苯基)吡啶-2-胺(5.2g,19.3mmol)在50mL冰乙酸和20mLTHF中的溶液冷却至-10℃,并滴加亚硝酸叔丁酯(4.6mL)。将反应混合物在0℃搅拌过夜,升温至室温,用100mL水稀释。将固体物料过滤并干燥,得到2.9g纯的3,6-二氯苯并呋喃并[2,3-b]吡啶。步骤4.将3,6-二氯苯并呋喃并[2,3-b]吡啶(2.86g,12.01mmol)、咔唑(5.02g,30.003mmol)、叔丁醇钠(4.62g,48.05mmol)、2-二环己基-膦基-2’,6’-二甲氧基联苯(S-Phos,430mg)、Pd2(dba)3(910mg)在150mL干燥二甲苯中的混合物在N2下回流48小时。然后将反应混合物冷却至室温,用100mLH2O稀释,并用乙酸乙酯萃取(4×50mL)。将有机级份合并,用无水Na2SO4干燥,过滤并蒸发。将残余物通过硅胶柱色谱纯化(洗脱剂-己烷-二氯甲烷梯度混合物),然后用己烷/二氯甲烷混合物结晶,得到白色细针状的目标产物。通过升华的额外纯化(288℃,10-5mmHg)得到1.86g纯的目标化合物。实施例6.化合物39的合成化合物39步骤1.制备3-氯-6-溴-[1]苯并噻吩并[2,3-c]吡啶(1.7g,5.8mmol)、三亚苯-2-基硼酸(1.6g,5.8mmol)、磷酸三钾(3.7g,17mmol)、200mL甲苯和10mL水的混合物,并用氮气鼓泡二十分钟。然后加入三(二亚苄基丙酮)二钯(53mg,0.060mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(96mg,0.23mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应混合物冷却至室温并通过硅胶短柱过滤,并用二氯甲烷洗涤。将前几个级份丢弃,因为它们仅含有杂质。将合并的滤液浓缩,得到粗产物,将粗产物用热的二氯甲烷和己烷重结晶,得到1.8g黄色固体形式的3-氯-6-(2-三亚苯基)-[1]苯并噻吩并[2,3-c]吡啶(4.0mmol,70%产率)。步骤2.制备3-氯-6-(2-三亚苯基)-[1]苯并噻吩并[2,3-c]吡啶(1.6g,3.6mmol)、咔唑(0.72g,4.3mmol)、Pd(OAc)2(20mg,0.090mmol)、叔丁醇钠(1.0g,11mmol)和300mL二甲苯的混合物,并用氮气鼓泡15分钟。然后加入PBut3(甲苯中的1.0M溶液,0.27mL,0.27mmol),并将混合物再用氮气鼓泡15分钟。在回流过夜后,将反应混合物冷却至室温并通过硅胶短柱过滤,然后用二氯甲烷洗涤。将二甲苯级份丢弃。将合并的二氯甲烷滤液浓缩,并将粗产物在己烷中20%二氯甲烷的混合物100mL中搅拌过夜。通过过滤收集残余物,得到1.7g浅黄色固体(2.9mmol,80%产率)。实施例7.化合物59的合成化合物59步骤1.制备1-氯-6-(9-咔唑)-[1]苯并噻吩并[2,3-c]吡啶(1.0g,1.6mmol)、三亚苯-2-基硼酸(0.85g,3.1mmol)、磷酸三钾(1.7g,7.8mmol)、100mL甲苯和5mL水的混合物,并用氮气鼓泡二十分钟。然后加入三(二亚苄基丙酮)二钯(24mg,0.030mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(43mg,0.10mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应冷却至室温并浓缩。将获得的固体溶解于800mL回流的甲苯中并通过薄的C盐短柱过滤。将收集的滤液浓缩至约100mL,然后在氮气下回流一小时。在缓慢冷却至室温后,通过过滤收集沉淀。将残余物在甲醇中20%二氯甲烷的热混合物100mL中搅拌,并在其冷却至室温后搅拌过夜。将残余物通过过滤收集并在真空下干燥,产生1.2g白色固体(2.1mmol,81%产率)。实施例8.化合物66的合成化合物66步骤1.向250mL圆底烧瓶中加入2-氯-3-碘-4-氨基吡啶(5.0g,19.6mmol)、苯硫酚(2.16g,19.6mmol)、CuI(0.187g,0.98mmol)、乙二醇(2.5g,39mmol)、碳酸钾(5.4g,39mmol)和150mL异丙醇。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。2-氯-3-苯基硫-4-氨基吡啶的产量为4.2g(91%)。步骤2.向250mL圆底烧瓶中加入2-氯-3-苯基硫-4-氨基吡啶(2.7g,11.4mmol)和60mL冰AcOH。向该清澈溶液中逐滴加入ButONO(1.36g,11.45mmol)。在室温下搅拌1小时后,再加入(1.36g,11.45mmol)ButONO。将该混合物在室温下继续搅拌18小时。将反应用水骤停,并将产物用硅胶柱纯化。1-氯-苯并噻吩并[2,3-c]吡啶的产量为2.2g(88%)。步骤3.制备1-氯-苯并噻吩并[2,3-c]吡啶(1.5g,6.8mmol)、根据美国临时申请No.60/963,944合成的3-(三亚苯-2-基)苯基硼酸(2.5g,7.2mmol)、磷酸三钾(4.4g,20.4mmol)、100mL甲苯和10mL水的混合物,并用氮气鼓泡十五分钟。然后加入三(二亚苄基丙酮)二钯(63mg,0.068mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(116mg,0.28mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应混合物冷却至室温。将产物通过硅胶色谱柱纯化。获得约2.7g(81%)化合物66。实施例9.化合物70的合成化合物70步骤1.制备1-氯-苯并噻吩并[2,3-c]吡啶(1.0g,4.5mmol)、根据美国临时申请No.60/963,944合成的2-三亚苯-硼酸(1.25g,4.5mmol)、磷酸三钾(3.0g,18.0mmol)、100mL甲苯和10mL水的混合物,并用氮气鼓泡十五分钟。然后加入三(二亚苄基丙酮)二钯(42mg,0.045mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(77mg,0.18mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应混合物冷却至室温。将产物通过硅胶色谱柱纯化。获得约1.5g(84%)化合物70。实施例10.化合物71的合成化合物71步骤1.将2-氨基-5-氯吡啶(10.0g,77.8mmol)、乙酸钾(7.63g,77.8mmol)在100mL乙酸中的溶液加热至85℃,并滴加50mL乙酸中的ClI(12.6g,77.8mmol)。将反应混合物在该温度下保持2小时,用1L水稀释,用NaOH1N溶液中和至pH7,并用乙酸乙酯萃取(4×75mL)。将有机级份合并,用NaHCO3洗涤,通过C盐过滤并蒸发。使残余物进行硅胶柱色谱分离(洗脱剂-己烷/乙酸乙酯1/1),得到黄色固体形式的5-氯-3-碘吡啶-2-胺(11.9g,60%)。步骤2.将2-(甲基硫)苯基硼酸(5.0g,29.8mmol)、5-氯-3-碘吡啶-2-胺(7.56g,29.8mmol)、碳酸钠(9.0g,于50mL水中)、Pd(PPh3)4(621mg)和100mL甲苯的混合物在N2下回流过夜。将反应混合物冷却至室温,将有机层分离并在真空中浓缩。将残余物以己烷/乙酸乙酯梯度混合物作为洗脱剂进行硅胶柱色谱分离,得到3.5g5-氯-3-(2-(甲基硫)苯基)吡啶-2-胺。步骤3.将5-氯-3-(2-(甲基硫)苯基)吡啶-2-胺(5.2g,19.3mmol)在50mL冰乙酸和20mLTHF中的溶液冷却至-10℃,并滴加亚硝酸叔丁酯(4.6mL)。将反应混合物在0℃搅拌过夜,升温至室温,用100mL水稀释。将固体物料过滤并干燥,得到2.5g纯的3-氯苯并噻吩并[2,3-b]吡啶。步骤4.制备3-氯-[1]苯并噻吩并[2,3-b]吡啶(1.3g,5.9mmol)、4,4,5,5-四甲基-2-(3-(三亚苯-2-基)苯基)-1,3,2-二氧杂戊硼烷(3.1g,7.1mmol)、磷酸三钾(3.8g,18mmol)、100mL甲苯和10mL水的混合物,并用氮气鼓泡十五分钟。然后加入三(二亚苄基丙酮)二钯(54mg,0.060mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(97mg,0.24mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应混合物冷却至室温并过滤以收集沉淀。将残余物用甲醇洗涤,然后溶解于热的甲苯中。将溶液通过硫酸镁短柱过滤,用二氯甲烷洗涤。将合并的滤液浓缩以得到700mg白色固体(1.4mmol,24%产率)。实施例11.化合物79的合成化合物79步骤1.向250mL圆底烧瓶中加入2-氯-5-碘-4-氨基吡啶(5.0g,19.6mmol)、苯硫酚(2.16g,19.6mmol)、CuI(0.187g,0.98mmol)、乙二醇(2.5g,39mmol)、碳酸钾(5.4g,39mmol)和150mL异丙醇。将反应加热至回流并在氮气气氛下搅拌24小时。冷却后,将混合物通过硅胶柱纯化。2-氯-3-苯基硫-4-氨基吡啶的产量为4.5g(97%)。步骤2.向250mL圆底烧瓶中加入2-氯-3-苯基硫-4-氨基吡啶(3.7g,16.8mmol)和60mL冰AcOH。向该清澈溶液中逐滴加入ButONO(1.8g,16.8mmol)。在室温下搅拌1小时后,再加入(1.8g,16.8mmol)ButONO。将该混合物在室温下继续搅拌18小时。将反应用水骤停,并将产物用硅胶柱纯化。3-氯-苯并噻吩并[2,3-c]吡啶的产量为1.2g(33%)。步骤3.制备3-氯-苯并噻吩并[2,3-c]吡啶(1.0g,4.5mmol)、根据美国临时申请No.60/963,944合成的3-(三亚苯-2-基)苯基硼酸(2.1g,4.8mmol)、磷酸三钾(2.9g,13.5mmol)、100mL甲苯和10mL水的混合物,并用氮气鼓泡十五分钟。然后加入三(二亚苄基丙酮)二钯(63mg,0.068mmol)和2-二环己基膦基-2’,6’-二甲氧基联苯(116mg,0.28mmol)。将混合物用氮气再鼓泡二十分钟。在氮气下回流过夜后,将反应混合物冷却至室温。将产物通过硅胶色谱柱纯化。获得约1.2g(55%)化合物79。实施例12.化合物80的合成化合物80步骤1.将咔唑(7.3g,43.7mmol)、3-溴碘苯(25g,87.3mmol)和叔丁醇钠(8.4g,87.3mmol)在氮气气氛下悬浮于150mL干燥的二甲苯中。单批加入三(二亚苄基丙酮)二钯(200mg)和1,1’-双(二苯基膦基)二茂铁(400mg),并将反应加热至回流,并在氮气气氛下搅拌24小时。冷却后,将二甲苯蒸发,并使残余物进行硅胶柱色谱分离,得到3-溴苯基咔唑(9.5g,黄色固化油)。步骤2.将3-溴苯基咔唑(9.5g,29.5mmol)、双(频那醇合)二硼(11.2g,44.2mmol)、乙酸钾(8.7g)、三(二亚苄基丙酮)二钯(200mg)和1,1’-双(二苯基膦基)二茂铁(400mg)悬浮于200mL二氧六环中,并在氮气气氛下加热回流过夜。在冷却和蒸发后,将残余物进行硅胶柱色谱分离,得到9-(3-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)苯基)-9H-咔唑b(6.0g,无色晶体)。步骤3.将1,3-二溴苯(16g,64.9mmol)、9-(3-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)苯基)-9H-咔唑b(6.0g,11.6mmol)、乙酸钾(6.6g在水中的饱和溶液)和四(三苯基膦)钯(0)(380mg)在氮气气氛下在150mL甲苯中加热回流过夜。在冷却、蒸发和柱色谱后获得9-(3’-溴-[1,1’-联苯]-3-基)-9H-咔唑(5.8g)。步骤4.在与步骤2相同的条件下,用乙酸钾作为碱、用三(二亚苄基丙酮)二钯和1,1’-双(二苯基膦基)二茂铁催化的双(频那醇合)二硼与9-(3’-溴-[1,1’-联苯]-3-基)-9H-咔唑在二氧六环中的反应得到9-(3’-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)-[1,1’-联苯]-3-基)-9H-咔唑,将其通过硅胶柱色谱纯化。步骤5.将1-氯苯并[4,5]噻吩并[2,3-c]吡啶(记载为化合物66,步骤2)和9-(3’-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)-[1,1’-联苯]-3-基)-9H-咔唑溶解于甲苯(150mL)中。单批加入催化剂(三(二亚苄基丙酮)二钯,400mg,和2-二环己基膦基-2’,6’-二甲氧基联苯,200mg)和碱(磷酸三钾),并在氮气气氛下将反应加热回流过夜。将产物通过硅胶柱纯化,得到化合物80。器件实施例所有的实例器件通过高真空(<10-7Torr)热蒸发进行制作。阳极为的氧化铟锡(ITO)。阴极由的LiF以及随后的的Al组成。所有的器件在制作后立即在氮气手套箱(<1ppm的H2O和O2)中用环氧树脂密封的玻璃盖进行封装,并在包装中加入吸湿剂。提供了具体器件,其中P1是发光掺杂剂,且本发明化合物化合物1、化合物2或化合物3为主体。器件实施例1-3的有机叠层从ITO表面起依次由作为空穴注入层(HIL)的P1、作为空穴传输层(HTL)的4,4’-双[N-(1-萘基)-N-苯基氨基]联苯(α-NPD)、作为发光层(EML)的用15%的P1(一种Ir磷光化合物)掺杂的本发明化合物、作为ETL2的本发明化合物以及作为ETL1的Alq3(三-8-羟基喹啉铝)组成。对比实施例1以与器件实施例类似的方式制作,不同之处在于EML包含用10%的P1掺杂的CBP作为主体,并且将P2用作阻挡层材料。如本文中所使用,下列化合物具有下列结构:提供了用于OLED中的特定材料,它们可以得到具有特别好的性能的器件。这些材料可以用作发光层的主体或者作为增强层中的材料。器件实施例1-3的发光层材料和阻挡层材料示于表2中。测试了器件并将测得的结果提供于表3中。Cmpd是“化合物”的缩写。具有使用化合物1-3的发光层和阻挡层的器件表现出高的器件效率、长的寿命和降低的操作电压。表2器件实施例Cmpd掺杂剂%BL11P115%122P115%233P115%3对比1CBPP110%P2表3从器件实施例1-3可以看出,本发明化合物作为绿色磷光OLEDs中的主体得到高的器件效率(即在1000cd/m2条件下LE>60cd/A),表明氮杂二苯并噻吩作为发色体具有对于有效的绿色电致磷光而言足够高的三线态能量。还可注意到的是包含化合物1和2作为主体的器件的高稳定性。对于化合物1和2,寿命T80%(定义为在40mA/cm2的恒定电流密度下在室温下初始亮度L0衰减到其值的80%所需要的时间)分别为113小时和85小时,具有比对比实施例1更高的L0。这反映为器件稳定性的1.5倍的改善。因而,本发明化合物可以良好地充当增强层。另一个显著的特征是化合物1和2与CBP相比均得到较低的器件电压,化合物1和2分别为在1000cd/m2下5V和在1000cd/m2下5.2V,CBP在1000cd/m2下具有5.8V的器件电压。这些数据表明,氮杂-二苯并噻吩可以作为用于磷光OLEDs的出色的主体和增强层材料,提供比常规使用的主体CBP更高的效率、更低的电压和器件稳定性方面的很多倍的改善。应当理解,本文中所述的多种实施方案仅仅作为示例,不用于限制本发明的范围。例如,在不偏离本发明的精神的情况下,本文中所述的很多材料和结构可以用其它材料和结构替代。因此,要求保护的本发明可以包括对于本领域技术人员而言显而易见的具体实施例和优选实施方案的变化形式。应当理解,关于为什么本发明能够成立的多种理论是非限制性的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于二溴1,4?二丙基?1,4?二氮杂二环[2.2.2]辛烷的二价锰荧光材料及其制备方法 ...的制作方法
- 一种苯并二氮杂卓类化合物作为农用杀虫剂的新用图
- 一种苯并二氮杂卓类化合物作为杀菌剂的用图
- 一种(1s,4s)?2,5?二氮杂二环[2.2.2]辛烷及其衍生物的合成方法
- 包含噻吩并三唑并二氮杂卓化合物的药物制剂的制作方法
- 一种苯并内酯类化合物、其制备方法和在制备抗癌药物中的应用
- 二氮杂-苯并荧蒽并烯类化合物的制作方法
- 制备(2s,5r)-1,6-二氮杂-二环[3.2.1]辛烷-2-腈-7-氧代-6-(磺氧基)-单钠盐的方法
- 利用含有噻吩并三唑并二氮杂*化合物的药物制剂治疗白血病的方法
- 一种注射用短效苯并二氮杂卓盐药物组合物及其制备方法
- 一种制备(1s,4s)?2,5?二氮杂二环[2.2.1]庚烷或[2.2.2]辛烷衍生物的方法
- 一种基于二溴1,4?二丙基?1,4?二氮杂二环[2.2.2]辛烷的二价锰荧光材料及其制备方法 ...的制作方法
- 一种苯并二氮杂卓类化合物作为农用杀虫剂的新用图
- 一种苯并二氮杂卓类化合物作为杀菌剂的用图
- 一种(1s,4s)?2,5?二氮杂二环[2.2.2]辛烷及其衍生物的合成方法
- 包含噻吩并三唑并二氮杂卓化合物的药物制剂的制作方法
- 一种苯并内酯类化合物、其制备方法和在制备抗癌药物中的应用
- 二氮杂-苯并荧蒽并烯类化合物的制作方法
- 制备(2s,5r)-1,6-二氮杂-二环[3.2.1]辛烷-2-腈-7-氧代-6-(磺氧基)-单钠盐的方法
- 利用含有噻吩并三唑并二氮杂*化合物的药物制剂治疗白血病的方法
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 一种噻吩并[3,2‑d]嘧啶类HIV‑1逆转录酶抑制剂及其制备方法和应用与流程
- 一类噻吩稠合苯并噁二唑衍生物及其合成方法与流程
- 一种可溶性苯并噻吩衍生物及其制备和应用的制作方法与工艺
- 含噻吩磺酰胺结构的苯并喹唑啉类酪氨酸激酶抑制剂、制备方法及用途与流程
- 一种含噻吩磺酰胺结构的乙氧苯并喹唑啉类酪氨酸激酶抑制剂、制备方法及用途与流程
- 一类含噻吩磺酰胺结构的苯并喹唑啉类酪氨酸激酶抑制剂及其用途的制作方法与工艺
- 一种含噻吩磺酰胺结构的乙氧苯并喹唑啉类酪氨酸激酶抑制剂及用途的制作方法与工艺
- 一种基于S,S‑二氧二苯并噻吩衍生物的给受体型交替共轭聚合物发光材料及其制备方法与应用与流程
- 一种三苯基硅基相连苯并噻吩衍生物及使用该衍生物的有机发光器件的制作方法与工艺
- 苯深度脱噻吩的镍基吸附剂及其制备方法和应用与流程