一种三维生物打印的脑肿瘤体外模型及其构建方法与流程
本发明涉及医学基础研究技术领域,具体涉及一种三维生物打印的脑肿瘤体外模型及其构建方法。
背景技术:
人脑胶质瘤是一种高度恶性和高复发性的脑肿瘤,即使手术、放疗和化疗综合治疗手段也未能有效提高患者生存期。报告显示,新发胶质瘤患者平均生存期只有15个月,而且一般术后5~7个月复发。因此,针对胶质瘤的治疗仍然面临巨大挑战。对胶质瘤发生发展机制和治疗方法的新探索将为胶质瘤的治疗提供新的希望。
几十年来,对于肿瘤的研究仍然停留在二维细胞培养和动物模型上。众所周知,肿瘤在体内生长是三维空间微环境结构,该三维空间微环境结构不仅包含肿瘤细胞,还包含肿瘤间质细胞和细胞外基质以及各种分泌因子。简单的二维细胞培养不仅改变了肿瘤生长的原始方式,更改变了肿瘤细胞与细胞外基质的相互作用关系。已经有文献指出体内肿瘤细胞经体外二维细胞培养后会很快失去肿瘤细胞的固有特征和功能。而动物模型作为受体的肿瘤研究方式也存在种属交叉的局限性,这给人源肿瘤特征的描述和研究结果带来非常复杂和无法辨别的干扰数据。对于胶质瘤干细胞而言,因其体外生长特性而呈现为悬浮球形生长,这是一种自发的3D细胞培养方法,但是对于胶质瘤干细胞球体内部往往出现细胞因缺氧和缺养而出现坏死和分化,不能很好维持胶质瘤干细胞的固有特征和比例。因此,仍需要开发能够更加模拟体内微环境的新的脑肿瘤模型用于脑肿瘤发生发展机制和抗癌药物筛选的研究。
近年来,三维培养方法已经逐渐受到脑肿瘤研究者的重视。目前大多研究者都是以高分子聚合物作为支架材料,把脑肿瘤细胞种植到支架表面获得三维培养的目的。Zhang报道了壳聚糖-透明质酸支架培养胶质母细胞瘤细胞U118,发现其胶质瘤干细胞样特性增强,侵袭能力也增强,而且更加耐药。Wan报道了胶质瘤细胞U251在包被了层粘连蛋白的静电纺丝聚苯乙烯支架培养,通过细胞外基质信号引起胶质瘤细胞多能性的表达。三维培养胶质瘤细胞的方法相比于二维细胞培养的方法,细胞能够获得更加接近体内微环境的特征,如增殖、侵袭和耐药特性。但是现有技术中的三维支架培养方式也存在问题,因为细胞只能沿着支架/纤维表面或者支架内部预制孔径内生长,无法模拟体内脑肿瘤侵袭迁移路径和脑肿瘤-基质相互作用关系。而且,对于较大体积的支架内部,脑肿瘤仍然会因缺乏营养物质而大片坏死,达不到预期目的。现有的将胶质瘤细胞直接混合水凝胶的或者种植胶质瘤细胞在水凝胶表面的三维培养方法也存在明显缺陷:细胞在水凝胶表面生长时,细胞只是在水凝胶表面团聚成球,三维空间有限;细胞混合在水凝胶内则会对水凝胶体积和厚度有限制,因为超过渗透极限的话,培养液等营养成分无法通过渗透的方式供给细胞生存,细胞仍然会因缺少营养而发生凋亡。
因此,仍需建立能够模拟体内胶质瘤生长空间环境和体外三维空间结构的脑肿瘤体外模型以及建立所述脑肿瘤体外模型的构建方法。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种三维生物打印的脑肿瘤体外模型,本发明提供的脑肿瘤体外模型可以有效地解决现有技术中较大体积水凝胶内部的细胞营养供给不足以及现有脑肿瘤模型在体外培养时脑肿瘤细胞生物学特征和功能丧失的问题。
本发明的另一目的在于提供上述脑肿瘤体外模型的构建方法。
为实现上述目的,本发明采用如下技术方案:
一种三维生物打印的脑肿瘤体外模型,所述脑肿瘤体外模型由含脑肿瘤细胞的水凝胶体系经3D生物打印机制备水凝胶纤维并构建得到,所述水凝胶纤维的直径为0.16mm~0.75mm,所述水凝胶纤维在所述脑肿瘤体外模型的体积填充度为40~90%;所述含脑肿瘤细胞的水凝胶体系的制备原料包括透明质酸、海藻酸钠、明胶谷氨酰胺转氨酶和脑肿瘤细胞。
明胶和海藻酸钠能够为肿瘤细胞的生长提供支撑和空间结构,以其作为原料构建得到的肿瘤细胞模型还具有较好的模型强度和韧性。但是,不同类型的肿瘤细胞的营养物质需求不同。本发明是针对脑肿瘤细胞建立体外模型,因此在满足3D打印效果和模型强度、韧性的同时,还需要为脑肿瘤细胞提供类似其组织来源的生长环境,故本发明还在水凝胶的制备原料中加入了有利于神经系统细胞生长、存活和繁殖的透明质酸。本发明以透明质酸、海藻酸钠、明胶为水凝胶的主要原料,通过生物3D打印构建脑肿瘤体外模型具有较好的强度,并且特别适宜于脑肿瘤细胞的生长,还具有较好的3D打印效果。
在本发明中,发明人发现3D生物打印机制备的水凝胶纤维的直径和水凝胶纤维在体外模型中的体积填充度对脑肿瘤体外模型的构建和生物性能尤为重要,如果水凝胶纤维的直径大于0.75mm会出现细胞营养和氧气不足而坏死,如果水凝胶纤维的直径小于0.16mm则造成水凝胶纤维的力学强度较弱,难以支撑构建得到的体外模型。水凝胶纤维的填充度过大,3D打印得到的脑肿瘤体外模型不适宜细胞生存,细胞因缺氧和缺养而发生凋亡坏死;水凝胶纤维的填充度过小则会影响构建得到的模型的强度。
由于脑肿瘤模型的力学性能对其后期的使用具有重要影响,因此构建的脑肿瘤模型需要具有良好的强度和韧性,以保证在培养期间内脑肿瘤模型能较好地保持其三维结构。通常含有海藻酸钠的肿瘤细胞模型需要浸没在氯化钙溶液中使氯化钙和海藻酸钠交联形成海藻酸钠凝胶,从而增强肿瘤模型的强度。但是发明人发现,仅选用氯化钙作为交联剂提供的模型强度较差,交联后的肿瘤模型并不足以满足后期的模型培养使用。经过众多尝试之后发明人发现,当在脑肿瘤细胞液中添加适量的谷氨酰胺转氨酶,在将脑肿瘤细胞液与水凝胶混合之后,谷氨酰胺转氨酶能够与水凝胶中的明胶进行交联,显著增强了脑肿瘤模型的强度,而且谷氨酰胺转氨酶交联明胶所带来的力学强度足以满足后期脑肿瘤体外模型的细胞培养的需要且不会影响到细胞的活性。
本发明提供的脑肿瘤体外模型可以为任意复杂形状的多级孔径的体外模型,该脑肿瘤体外模型能够模拟脑肿瘤生长空间环境和体外三维空间结构,可以有效地解决现有技术中较大体积水凝胶内部的细胞营养供给不足以及现有脑肿瘤模型在体外培养时肿瘤细胞生物学特征和功能丧失的问题,并为脑肿瘤的发生、发展机制,脑肿瘤干细胞研究和体外药物研发提供更加适宜的平台工具。
在本发明中,所述水凝胶纤维在所述脑肿瘤体外模型中的体积填充度是指脑肿瘤体外模型除去孔隙所占据的空间,水凝胶纤维在脑肿瘤体外模型中实际所占据的空间比例。
优选地,所述水凝胶纤维的直径为0.20mm~0.35mm,所述水凝胶纤维在所述脑肿瘤体外模型的体积填充度为50~80%。
为了使本发明提供的水凝胶更适合3D打印,具有更好的打印效果,同时更好地满足脑肿瘤模型的力学强度和适合脑肿瘤细胞的生长,优选地,在所述含脑肿瘤细胞的水凝胶体系中,透明质酸与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为0.2~2%(wt/v),海藻酸钠与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为1~2%(wt/v),明胶与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为7~16%(wt/v)。
优选地,在所述含脑肿瘤细胞的水凝胶体系中,谷氨酰胺转氨酶与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为0.15~3%(wt/v),更优选为0.4~2%(wt/v)。
本发明针对脑肿瘤细胞的生长环境和营养需求,在培养体系中加入了脑肿瘤干细胞培养所需的细胞因子;优选地,所述细胞因子为bFGF、EGF和B27;更为优选地,所述bFGF和EGF的终浓度各为20 ng/ml,所述B27的终浓度为2%(v/v)。
优选地,所述水凝胶的制备原料还包括纤维蛋白原和/或胶原;胶原和纤维蛋白原均可以促进脑肿瘤细胞的粘附和生长。
优选地,所述脑肿瘤细胞为脑肿瘤干/祖细胞和/或临床肿瘤患者手术离体脑肿瘤组织。对于临床标本,离体胶质瘤组织先经过清洗、剪碎、胰酶体系消化、过滤和离心处理后获取单细胞悬液,尽可能的保留胶质瘤体内状态的固有特征,然后混合在水凝胶体系内。
在本发明中,所述水凝胶纤维在所述模型中均匀填充;优选地,所述水凝胶纤维以直线网格状、多边形、蜂窝形的形式填充所述脑肿瘤体外模型。
上述三维生物打印的脑肿瘤体外模型的构建方法,所述构建方法包括如下步骤:
(1)水凝胶的准备:
将水凝胶的制备原料混合均匀,形成水凝胶;
(2)脑肿瘤细胞悬液的准备:
将脑肿瘤细胞配制成合适的浓度,加入谷氨酰胺转氨酶形成脑肿瘤细胞悬液;
(3)肿瘤模型设计:
利用软件设计肿瘤模型;
(4)含脑肿瘤细胞的水凝胶体系的制备:
将所述脑肿瘤细胞悬液与所述水凝胶混合,得到含脑肿瘤细胞的水凝胶体系;
(5)3D生物打印:
以所述含脑肿瘤细胞的水凝胶体系为材料,以所设计的肿瘤模型为模型,通过3D生物打印机制备含脑肿瘤细胞的水凝胶纤维并构建得到脑肿瘤模型;
(6)后处理:
将所述3D生物打印得到的脑肿瘤模型浸入氯化钙溶液中使海藻酸钠交联即得三维生物打印的脑肿瘤体外模型。
本发明提供的三维生物打印的脑肿瘤体外模型构建方法借助水凝胶体系以海藻酸钠和明胶作为细胞外基质和支撑,通过利用3D生物打印机制造含脑肿瘤细胞的水凝胶纤维,通过参数调整精确控制纤维的直径和实体尺寸,通过层层叠加的生物打印方式,最终得到具有网孔通道结构和适合脑肿瘤细胞生存微环境的脑肿瘤模型。在本发明中,水凝胶、脑肿瘤细胞悬液的准备以及肿瘤模型的设计,这三个步骤不分先后顺序,可根据实际需要同时进行或先后进行。
优选地,在所述含脑肿瘤细胞的水凝胶体系中,透明质酸与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为0.2~2%(wt/v),海藻酸钠与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为1~2%(wt/v),明胶与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为7~16%(wt/v);所述谷氨酰胺转氨酶与所述含脑肿瘤细胞的水凝胶体系的质量体积百分比为0.15~3%(wt/v)。
优选地,所述水凝胶的准备中,将水凝胶的制备原料分别配制成一定浓度的溶液后,按照一定比例混合均匀,形成水凝胶。更优选地,分别配制质量分数为1~4%的透明质酸溶液、质量分数为1~6%的海藻酸钠溶液和质量分数为10~30%的明胶溶液,然后将其按照一定比例混合。
优选地,所述脑肿瘤细胞悬液的准备中,谷氨酰胺转氨酶在所述脑肿瘤细胞悬液中的质量体积百分数为1~6%(wt/v)。
优选地,所述脑肿瘤细胞悬液的细胞浓度为1×105~1×107个/mL。
优选地,所述肿瘤模型设计中,根据临床患者CT扫描数据重建、复原原始肿瘤体积和形状设计肿瘤模型,或将肿瘤模型设计为正方体、长方体、圆柱体或多边体形。
优选地,所述含脑肿瘤细胞的水凝胶体系的制备中,所述水凝胶与所述脑肿瘤细胞悬液的体积比为1:1~5:1。
优选地,所述含脑肿瘤细胞的水凝胶体系的制备原料包括纤维蛋白原和/或胶原;更优选地,在脑肿瘤细胞悬液的准备中,向配制好的脑肿瘤细胞悬液中添加纤维蛋白原和/或胶原;所述纤维蛋白原在所述脑肿瘤细胞悬液中的质量分数为0.5~3.0%(wt/v);所述胶原在所述脑肿瘤细胞悬液中的质量分数为0.1~1.0%(wt/v)。
当所述含脑肿瘤细胞的水凝胶体系中含有纤维蛋白原时,所述后处理还包括将脑肿瘤模型浸入凝血酶溶液中的操作。优选地,所述后处理包括将脑肿瘤模型浸入CaCl2溶液中进行交联之后,再浸入凝血酶(Thrombin)溶液中,交联纤维蛋白原。
优选地,所述凝血酶的酶活为5~20U/mL。
优选地,所述氯化钙溶液的质量分数为0.5~5%。
优选地,在后处理中,所述3D生物打印得到的脑肿瘤模型在氯化钙溶液中的浸泡时间为1~5分钟,使得海藻酸钠交联,增强水凝胶体系强度以获得稳定空间结构和网孔结构的脑肿瘤模型;在凝血酶(Thrombin)溶液中的浸泡时间为1~3分钟,通过凝血酶交联纤维蛋白原。
在本发明中,进行3D生物打印时,具体是将预混合好的含细胞水凝胶体系吸入打印注射器,连接特定内径的打印喷头,喷头内径可以为0.21mm、0.26mm、0.34mm或者其他内径针头;将上述注射器和打印喷头置于4~8℃冰箱内预冷10~15分钟,安装到生物打印机,开始打印。打印注射器夹具可以调节温度,范围在25~37℃为宜。打印成型室也需要控制温度,维持2~10℃为宜,低温环境利于明胶凝固和整体肿瘤模型的成型。
本发明提供的方法构建得到的脑肿瘤体外模型的培养与使用方法如下:
将制造完成的脑肿瘤体外模型放入含10%胎牛血清的DMEM/F12培养基中培养或者继续干细胞培养基培养。根据需要可以使用静态培养、灌流培养、生物反应器培养等不同培养方式;根据需要可以在培养基中加入其他诱导培养的细胞因子;比如VEGF,IL6和IL1等因子,研究胶质瘤干细胞转分化内皮细胞的研究以及胶质瘤微环境炎性因子在肿瘤进展中的作用,还可以加入抗胶质瘤的化疗药物替莫唑胺、顺铂和阿霉素等进行药物敏感性实验。
本发明还提供了所述脑肿瘤体外模型的检测与鉴定方法,具体如下:
可通过病理和免疫染色进行检测,具体是在培养不同天数取材,然后固定、包埋石蜡、石蜡切片、HE染色;同时对胶质瘤干细胞标记物Nestin和分化标记物GFAP和β-tubulinⅢ进行鉴定。
与现有技术相比,本发明具有如下有益效果:
本发明通过3D生物打印的精确控制和定位的方法制备含脑肿瘤细胞的水凝胶纤维,这可以避免脑肿瘤体积较大而无法获得足够营养而坏死的情况发生;通过不同材料的配比和细胞因子的加入,调配适合神经系统肿瘤生长,能够模拟和复制体内脑肿瘤微环境以及脑肿瘤细胞特征和潜在功能的材料体系。
本发明提供的三维生物打印脑肿瘤体外模型的构建方法使得包括临床胶质瘤标本在内的胶质瘤组织或细胞系可以实现脑肿瘤的体外三维制造,本发明制备得到的脑肿瘤体外模型既能保持肿瘤体内生长的三维空间环境,又能实现体内肿瘤特征的完全保留。本发明提供的方法构建得到的脑肿瘤体外模型更加接近体内空间微环境,该模型可以特异性地用于脑肿瘤发生机制研究、胶质瘤干细胞生物学研究、胶质瘤血管化研究和脑肿瘤化疗药物的开发和临床前研究。
附图说明
图1为体外3D生物打印重建胶质瘤模型的流程示意图;
图2为实施例1三维生物打印的脑肿瘤体外模型的示意图;
图3为实施例1和对比例1的脑肿瘤体外模型的力学性能比较;
图4为实施例1和对比例2的脑肿瘤体外模型的细胞增殖曲线;
图5为实施例1的脑肿瘤体外模型的病理切片;
图6为实施例1的脑肿瘤体外模型的免疫组化照片。
具体实施方式
下面结合实施例对本发明做进一步的描述。这些实施例仅是对本发明的典型描述,但本发明不限于此。下述实施例中所用的试验方法如无特殊说明,均为常规方法,所使用的原料、试剂等,如无特殊说明,均为可从常规市购等商业途径得到的原料和试剂。
实施例1 人脑胶质瘤组织体外3D生物打印重建
本实施例提供了一种三维生物打印的脑肿瘤体外模型的构建方法,图1为体外3D生物打印重建胶质瘤模型的流程示意图,具体的工艺步骤如下:
(1)水凝胶准备
以透明质酸/海藻酸钠/明胶作为重建的细胞外基质和主要支撑材料,加入纤维蛋白原促进细胞活性和生长。
首先将称重后的透明质酸、海藻酸钠、明胶和纤维蛋白原分别包装,用γ射线辐照灭菌。超净台内称重,配制4%透明质酸、6%海藻酸钠和30%明胶溶液各20ml装入60ml离心管,密封。同时配制3%浓度的纤维蛋白原溶液,备用。海藻酸钠溶液比较难溶解,放入60℃超声水浴处理24小时促进溶解完全,明胶溶液37℃溶解过夜。然后将透明质酸、海藻酸钠溶液和明胶溶液按照1:1:1体积混合,在超净台内无菌条件下37℃水浴搅拌2小时,充分混匀。分装到无菌EP管,冻存-20℃备用。
分别配制3%氯化钙溶液,6%谷氨酰胺转氨酶溶液和20U/ml的凝血酶溶液作为交联剂,0.22μm孔径的针式滤器过滤备用。
(2)脑肿瘤细胞悬液的准备
以胶质瘤干细胞SU3为例,胶质瘤干细胞悬浮培养在不含胎牛血清(FBS)的DMEM/F12干细胞培养基中,其中包含20 ng/ml碱性成纤维细胞细胞因子(bFGF)、20 ng/ml 表皮细胞因子(EGF)、B27(50 X)、左旋谷氨酰胺(100 X)、维生素溶液(100 X)、丙酮酸钠溶液(100 X)(Gibco)。干细胞球悬液收集并经1200转/分离心4分钟,然后干细胞球沉淀经细胞离散试剂盒(Cell Dissociation Reagent, Gibco)消化成单细胞悬液,离心后用400μl 新鲜培养基重悬,加入6% TGase(Ruibio)100μl和3%纤维蛋白原溶液100μl。用移液器轻轻吹打混合均匀,得到600μl含1%TGase和0.5%纤维蛋白原的细胞悬液。
(3)肿瘤模型设计
以mimics软件和3-matic软件绘制长度20mm,宽20mm和高10mm的立方体作为肿瘤模型文件STL;用slic3r软件设计内部填充为直线网格状,填充密度为70%,输出为G代码;再转换成为3D生物打印机(TissformⅢ,清华大学)能够识别的.cli文件。
(4)含脑肿瘤细胞的水凝胶体系的制备
将按上述方法配制好的水凝胶从-20℃取出,37℃孵育30分钟使其恢复流动性。用移液器取600μl水凝胶加入已经制备好的200μl细胞悬液,用移液器轻轻充分混匀,得到含脑肿瘤细胞的水凝胶体系。
(5)3D生物打印
用1ml规格注射器吸取含脑肿瘤细胞的水凝胶体系,连接0.26mm内径的打印喷头,放置在4℃环境预冷10分钟。然后,安装到3D生物打印机Z轴上的保温夹具内,夹具内部保温温度设置为30℃。通过控制软件下降Z轴,调整Z轴喷头距离下方成型室内XY平台约3mm,成型室温度控制在4~8℃范围内。设置打印参数:喷射速度为37500/(4000mm),扫描速度为3mm/s,层厚为0.37mm。调入肿瘤模型.cli格式文件,开始打印。
(6)后处理
打印完成后,喷雾3%CaCl2交联30秒,然后用无菌平头镊取出浸入3% CaCl2继续交联3分钟,然后浸入无菌蒸馏水洗去多余的Ca2+。浸入20U/ml凝血酶溶液3分钟,交联纤维蛋白原。最后得到脑肿瘤体外模型Ⅰ,如图2所示。
也可以将脑肿瘤模型设计为其他形状,按照与上述相同的构建方法,得到其他形状的脑肿瘤体外模型。
对比例1
本对照例的脑肿瘤体外模型的构建方法同实施例1,不同之处在于,本对照例在步骤(2)脑肿瘤细胞悬液的准备中,不添加谷氨酰胺转氨酶,本对照例构建得到脑肿瘤体外模型Ⅱ。
为了比较实施例1的脑肿瘤体外模型Ⅰ和对比例1的脑肿瘤体外模型Ⅱ的力学性能,分别将脑肿瘤体外模型Ⅰ和脑肿瘤体外模型Ⅱ浸泡在PBS缓冲溶液中,置于37℃,5%CO2培养箱中孵育2周,观察支架结构的保持情况。
对比例2
本对照例的脑肿瘤体外模型的构建方法同实施例1,不同之处在于,本对照例在步骤(3)肿瘤模型设计中将脑肿瘤模型的填充度设计为100%,最后得到填充度为100%的脑肿瘤体外模型Ⅲ。
试验例1 脑肿瘤体外模型的力学性能比较
图3是实施例1的脑肿瘤体外模型Ⅰ和对比例1的脑肿瘤体外模型Ⅱ在PBS缓冲溶液中浸泡2周后的形态图片,其中上面一行是实施例1构建得到的脑肿瘤体外模型Ⅰ,下面一行是对比例1构建得到的脑肿瘤体外模型Ⅱ。
从图3中可以看到,实施例1中的脑肿瘤体外模型Ⅰ在PBS缓冲溶液中浸泡2周后还维持着完整的三维空间结构和孔隙结构,而对比例1中的脑肿瘤体外模型Ⅱ已经发生坍塌和损坏,无法维持原有的三维形态。这表明本发明中添加谷氨酰胺转氨酶可以有效增加脑肿瘤体外模型的力学强度和韧性,对于后续脑肿瘤体外模型的培养与使用具有重要意义。
试验例2 脑肿瘤体外模型的培养与鉴定
1. 脑肿瘤体外模型的培养方法
将制得的脑肿瘤体外模型更换为新鲜完全培养基(DMEM/F12+10%FBS+1%双抗)继续培养。
2. 脑肿瘤体外模型的检验与鉴定
(1)细胞增殖曲线
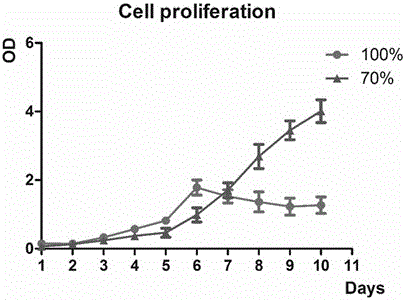
测定实施例1和对比例2在相同培养时间(1~10天)的吸光度值,得到细胞增殖曲线,细胞增殖曲线具体见图4。
从图4可见,在培养的前6天内,对比例2的脑肿瘤模型的增殖速度大于实施例1,但是培养6天以后,对比例2的脑肿瘤模型的增殖活性逐渐下降,而实施例1的肿瘤模型增殖活性一直稳定增加,增殖能力逐渐加快,明显超越对比例2的增殖速度。由此可见,100%填充度打印的含细胞水凝胶支架不适宜细胞生存,细胞因缺养和缺氧而会发生凋亡坏死,而70%填充度的支架能够保持较高细胞活性。
(2)病理切片和免疫组化
为了验证本发明的脑肿瘤模型在体外培养时的细胞增殖结果及其生物学特征,对实施例1的3D生物打印重建的脑肿瘤体外模型,在体外培养第7天和21天时分别取材,经4%多聚甲醛固定过夜、梯度酒精逐级脱水、二甲苯透明、透蜡和浸蜡包埋得到石蜡块。制作3μm厚度石蜡切片,按照常规步骤进行HE染色,进行病理切片观察。另外,在体外培养第21天时,按照常规免疫组化染色步骤经脱蜡、抗原修复、抗原封闭、一抗孵育、二抗孵育、DAB显色、苏木素染核、脱水透明、封片等步骤完成抗原-抗体反应染色,镜下观察拍照。
图5为3D生物打印胶质瘤模型病理染色结果,标尺为:A,D为200μm;B, E为50μm;C, F为20μm。其中A~C为3D生物打印制造胶质瘤模型体外培养7天的结果,可见细胞呈单个细胞散在分布与水凝胶体系内,细胞增殖不明显;D~F为3D生物打印制造胶质瘤模型体外培养21天的结果,可见细胞增殖较快,细胞呈团球状,挤压占据水凝胶支架的主要结构。表明3D生物打印胶质瘤细胞在水凝胶体系里经历短暂适应之后,细胞活性较高,增殖能力逐渐增强。
图6为3D生物打印胶质瘤模型体外培养21天时的免疫组化结果,标尺:50μm。从图6可见,胶质瘤干细胞SU3在3D打印完成后浸入含10%FBS的DMEM/F12培养基培养21天,仍然表达胶质瘤干/祖细胞标记物Nestin,而且表达分化细胞星型胶质细胞标记物GFAP和神经元细胞标记物β-tubulinⅢ。证明3D生物打印胶质瘤干细胞不仅能保存胶质瘤细胞固有特征,还能诱导其分化潜能。本发明制备得到的脑肿瘤体外模型既能保持肿瘤细胞的增殖,还能实现体内肿瘤特征的保留。
- 还没有人留言评论。精彩留言会获得点赞!