一种含钼、锌、镍的食气厌氧菌发酵产醇的培养体系和培养方法与流程
本发明涉及微生物发酵技术领域,尤其涉及一种含钼、锌、镍的食气厌氧菌发酵产醇的培养体系和培养方法。
背景技术:
合成气是一种主要包含CO、H2以及少量CO2等其他组分的混合气体,合成气的来源较为广泛,如煤、石油、天然气、工业废气(如焦炉煤气、炼厂气)、城市固体废弃物以及生物质等。目前,化石能源的过度使用以及城市垃圾、秸秆等的燃烧造成大气中CO、CO2、CH4等气体含量的不断攀升,损害人体健康,造成了全球范围内的温室效应,加剧了厄尔尼诺现象,导致气候异常、海平面上升、农作物产量下降等诸多严重的社会环境和经济问题。上述合成气的处理一般采用吸收或燃烧等方法,处理效率低,能耗高。
现有技术研究发现,自然界中存在一类厌氧食气微生物,能以合成气(CO、CO2以及H2)作为唯一的碳源和能量源进行生长,并且将其转化为多种有机酸和醇类物质,包括乙酸、丁酸、2,3-丁二醇等高附加值化学品以及乙醇、丁醇、正己醇等生物燃料。因此,将合成气作为碳源和能源应用到微生物的工业发酵过程中,不仅可以形成一条可持续发展的能源和化学品开发的绿色通道,节省企业的运行成本,提高经济效益,还可以减少含碳气体排放,加速地球碳循环,减轻温室效应,创造社会和环境效益。
然而目前,虽然文献中有报道Co2+,Cu2+,Fe2+,Mn2+,Mo6+,Ni2+,Zn2+,SeO4-以及WO4-这几种金属离子的单独的浓度变化对Clostridium ragsdalei合成气发酵产乙醇的影响,通过调节培养基中上述金属离子的浓度可以改变发酵产乙醇的产量,但是食气厌氧菌在发酵过程中产物合成能力较弱,醇类物质的产量低下,尤其是正丁醇、正己醇等高级醇的产量,限制了微生物发酵技术在工业生产实际中的应用。
技术实现要素:
有鉴于此,本发明的目的在于提供一种含钼、锌、镍的食气厌氧菌发酵产醇能力的培养体系和培养方法,来解决现有技术中利用合成气发酵过程中产物合成能力较弱,醇类产量低下的问题。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种食气厌氧菌利用合成气发酵的培养体系,其特征在于,包括以下组分:微量元素、关键金属元素和培养基;
所述的微量元素包括以下元素:镁元素、铁元素、钴元素、硒元素和钨元素;所述的微量元素的体积为培养基体积的0.3~0.4%;
所述的关键金属离子包括钼元素、锌元素和镍元素;
所述钼元素在培养体系中的浓度≤0.42μM;
所述锌元素在培养体系中的浓度为≥70μM;
所述镍元素在培养体系中的浓度≥0.84μM;
所述的培养基包括以下体积分数的组分:1~5%的大量元素溶液,0.2~0.8%的还原剂溶液,余量的营养水溶液。
优选的,所述的钼元素在培养体系中的浓度为0~0.20μM。
优选的,所述的锌元素在培养体系中的浓度为70~300μM。
优选的,所述的镍元素在培养体系中的浓度为1~20μM。
优选的,所述的钼元素在培养体系中的浓度为0~0.10μM,所述的锌元素在培养体系中的浓度为100~150μM,所述的镍元素在培养体系中的浓度为8~18μM。
优选的,所述的大量元素溶液包括以下含量的组分:6~10wt%氯化钠,8~12wt%氯化铵,0.5~1.5wt%氯化钾,0.5~1.5wt%磷酸二氢钾,1~3wt%硫酸镁,0.2~0.6wt%氯化钙和余量的水。
优选的,所述的还原剂溶液包括以下含量的组分:0.8~1.0wt%的氢氧化钠,2~6wt%的L-半胱氨酸盐酸盐和2~6wt%的九水硫化钠,余量的水。
优选的,所述营养水溶液中包括质量分数为0.05~0.15%的酵母提取物和质量分数为1.0~4.0%的吗啉乙磺酸。
本发明还提供了一种食气厌氧菌利用合成气发酵产醇的方法,包括以下步骤:
1)向所述培养体系中接入发酵菌种,得到有菌培养体系;
2)向所述步骤1)得到的有菌培养体系中通入合成气后密封,振荡培养,得到包括乙醇、正丁醇和正己醇的发酵产物。
优选的,步骤2)中所述合成气包括以下体积含量的组份:45~55%的CO、30~40%的CO2和10~20%的H2;所述通入合成气的速度为1.5~2.5L/min。
本发明的有益效果:本发明通过构建包括微量元素、关键金属元素和培养基的培养体系,并利用所述培养体系对食气厌氧菌进行发酵,尤其是培养体系中钼元素、锌元素和镍元素浓度的协调调整,提高了食气厌氧菌发酵的菌体最高浓度和发酵产醇类的能力,以Clostridium carboxidivorans P7为例,菌株的细胞浓度最大可达OD600nm~1.8Abs,最高乙醇产量为4.9g/L,正丁醇产量最高为1.98g/L,正己醇含量为0.42g/L。
附图说明
图1为对比例1中菌株发酵的OD600值、乙醇、丁醇和正己醇的产量;
图2为实施例1中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图3为实施例2中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图4为实施例3中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图5为实施例4中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图6为实施例5中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图7为实施例6中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量;
图8为实施例7中菌株发酵乙醇的OD600值、乙醇、丁醇和正己醇的产量。
具体实施方式
本发明提供了一种食气厌氧菌利用合成气发酵的培养体系,包括以下组分:微量元素、关键金属元素和培养基;所述的微量元素包括以下元素:镁元素,铁元素,钴元素,硒元素和钨元素;所述的微量元素的体积为培养基体积的0.3~0.4%;关键金属离子包括钼元素、锌元素、镍元素;所述钼元素在培养体系中的浓度≤0.42μM;所述锌元素在培养体系中的浓度为≥70μM;所述镍元素在培养体系中的浓度≥0.84μM;所述的培养基包括以下体积分数的组分:1~5%的大量元素溶液,0.2~0.8%的还原剂溶液,余量的营养水溶液。
在本发明中,所述的微量元素包括以下元素:镁元素,铁元素,钴元素,硒元素和钨元素,优选还包括氮元素。本发明对所述的微量元素的来源没有限定,只要是能够提供所述种类的微量元素的物质即可,具体的本发明实施例中提供所述微量元素的物质可为氨三乙酸,硫酸镁,硫酸亚铁铵,硒酸钠/亚硒酸钠,氯化钴和钨酸钠;本发明中提供所述微量元素的物质为市售分析纯。本发明中,所述微量元素的添加体积优选为培养基体积的0.1~0.5%,更优选的为0.2~0.4,最优选的为0.33%。
在本发明中,所述的关键金属元素包括钼元素、锌元素和镍元素;所述钼元素在培养体系中的浓度≤0.42μM,优选的为0~0.20μM,更优选的为0~0.1μM,最优选的为0μM,本发明对所述的钼离子的来源没有限定,只要是能提供钼离子的物质即可,具体的在本发明实施例中优选的为钼酸钠,所述的钼酸钠为市售分析纯。
本发明中所述的锌元素在培养体系中的浓度≥70μM,优选的为70~300μM,更优选的为100~150μM;本发明对所述锌元素的来源没有特殊要求,只要溶解状态下能解离出锌元素即可,具体的在本发明实施例中锌离子来源于锌盐,例如硫酸锌或者氯化锌,优选的为硫酸锌。
本发明中所述镍离子在培养体系中的浓度≥0.84μM,优选的为1~20μM,更优选的为8~18μM,本发明对所述镍元素的来源没有特殊要求,只要溶解状态下能解离出镍元素即可,具体的在本发明实施例中镍元素来源于镍盐,例如氯化镍、硫酸镍或硝酸镍,优选的为氯化镍。
本发明中所述的关键金属元素中钼元素、锌元素和镍元素各自在培养体系中的浓度,以及上述三者在培养体系中的浓度比例,对于食气厌氧菌利用合成气发酵所能达到的OD600值,乙醇,正丁醇和正己醇的产量均有较为关键的影响。
本发明提供的培养体系还包括培养基,所述的培养基包括以下体积分数的组分:1~5%的大量元素溶液,0.2~0.8%的还原剂溶液,余量的营养水溶液。
在本发明中,所述培养基优选包括体积分数为1~5%的大量元素溶液,更优选的为2~4%,最优选的为3%。在本发明中,所述大量元素优选包括钠元素、氮元素、钾元素、磷元素、硫元素、镁元素、氯元素和钙元素。本发明对所述大量元素的来源没有特殊限定,只要能够提供上述大量元素即可,具体的在本发明实施例中,所述大量元素溶液优选包括以下质量含量的组分:6~10wt%氯化钠,8~12wt%氯化铵,0.5~1.5wt%氯化钾,0.5~1.5wt%磷酸二氢钾,1~3wt%硫酸镁,0.2~0.6wt%氯化钙和余量的水。
在本发明中,所述氯化钠的含量优选的为6~10wt%,更优选的为7~9%,最优选的为8%;所述氯化铵的含量优选的为8~12wt%,更优选的为9~11%,最优选的为10%;所述氯化钾的含量优选的为0.5~1.5wt%,更优选的为0.8~1.2%,最优选的为1.0%;所述磷酸二氢钾的含量优选的为0.5~1.5wt%,更优选的为0.8~1.2%,最优选的为1.0%;所述硫酸镁的含量优选的为1~3wt%,更优选的为1.5~2.5%,最优选的为2%;所述氯化钙的含量优选的为0.2~0.6wt%,更优选的为0.3~0.5%,最优选的为0.4%;本发明大量元素溶液中还包括余量的水,本发明对大量元素母液中的水没有特殊限定,采用本领域常规的水即可,具体的在本发明实施例中可为无菌水、纯净水、蒸馏水或双蒸水,本发明大量元素母液中的水作为溶剂,溶解上述各个组份;本发明中上述大量元素母液中除水以外的组分均为市售分析纯。
在本发明中,所述的培养基包括还原剂溶液,所述还原剂溶液在所述培养基中的体积分数优选的为0.2~0.8%,更优选的为0.4~0.6%,最优选的为0.5%。在本发明中,所述的还原剂包括氢氧化钠,L-半胱氨酸盐酸盐和九水硫化钠;在所述还原剂溶液中,所述的氢氧化钠的含量优选的为0.8~1.0wt%,更优选的为0.9wt%;所述L-半胱氨酸盐酸盐的含量优选的为2~6wt%,更优选的为3~5wt%,最优选的为4wt%;所述九水硫化钠的含量优选的为2~6wt%,更优选的为3~5wt%,最优选的为4wt%;本发明所述还原剂中还包括余量的水,本发明对还原剂中的水没有特殊限定,采用本领域常规的水即可,具体的在本发明实施例中可为无菌水、纯净水、蒸馏水或双蒸水,本发明大量元素母液中的水作为溶剂,溶解上述各个组份;本发明中上述还原剂中除水以外的组分均为市售分析纯。
本发明所述的培养基中还包括剩余体积的营养水溶液,所述的营养水溶液中包括酵母提取物和吗啉乙磺酸,本发明以营养水溶液的质量为基准,所述酵母提取物的质量含量优选的为0.05~0.15%,更优选的为0.08~0.12,最优选的为0.1%;所述吗啉乙磺酸的质量含量优选的为1.0~4.0%,更优选的为2.0~3.0%,最优选的为2.5%。本发明对所述酵母提取物和吗啉乙磺酸的来源没有特殊的限定,采用本领域技术人员熟知的酵母提取物和吗啉乙磺酸的市售产品即可。
本发明中所述的培养体系通过将微量元素、关键金属元素和灭菌除氧后的培养基混合后得到。
本发明对所述培养基进行除氧和灭菌,得到灭菌和除氧后的培养基。为了便于培养基的除氧,本发明优选对上述技术方案所述培养基进行密封,本发明对所述的密封手段和方法没有特殊的限定,只要能够保证密封效果即可,在本发明的具体实施例中优选的将培养基置于血清瓶中,使用橡胶塞进行密封得到密封培养基,所述血清瓶优选的容积为100ml,所述血清瓶中培养基的体积优选的为20~30ml。
本发明优选向所述密封的培养基中充入氮气对培养基进行除氧,得到无氧培养基。本发明优选的使用连接有针头的氮气瓶提供氮气源,在充氮气的过程中排出培养基中的空气,所述的充入氮气的速度优选的为1.5~2.5L/min,更优选的为2.0L/min,所述氮气的纯度为99.999%。
本发明中将得到的无氧培养基进行灭菌后得到灭菌除氧后的培养基,本发明优选采用本技术领域常规的高温湿热灭菌法,所述灭菌的温度优选的为115~125℃,更优选的为118~123℃,最优选的为121℃;所述灭菌的时间优选的为15~40min,更优选的为20min。
本发明在得到灭菌除氧后的培养基,将所述灭菌除氧后的培养基与微量元素、钼酸根离子和锌离子混合,得到培养体系。本发明优选的在得到无菌无氧培养基后使其自然冷却至40℃以下,更优选为40℃~10℃,然后将冷却后灭菌除氧的培养基与微量元素、锌离子和钼酸根离子混合。
本发明提供了一种利用合成气低温发酵生产己醇的方法,包括以下步骤:
1)向上述技术方案所述培养体系中接入发酵菌种得到有菌培养体系;
2)向所述步骤1)得到的有菌培养体系中通入合成气后密封,振荡培养,得到包括乙醇、正丁醇和正己醇的发酵产物。
本发明在得到培养体系后,向所述培养体系中接入发酵菌种,得到有菌培养体系。本发明优选在无菌无氧条件下向所述培养体系中接入发酵菌种,在本发明实施例中,优选的所述接种在无菌厌氧操作箱中进行。在本发明中,所述发酵菌种的接种体积优选的为培养体系体积的8~12%,更优选的为10%。
在本发明中,所述接种用发酵菌种的OD600的吸光值优选的为0.6~1.5,更优选的为0.8~1.2,最优选的为1.0。本发明中所述接种用发酵菌种为处于对数生长期的细胞。本发明中所述的发酵菌种为食气厌氧菌,优选的为Clostridium carboxidivorans P7,所述的Clostridium carboxidivorans P7购买自德国布伦瑞克的莱布尼兹研究所的德国微生物与细胞培养物保藏中心,编号为DSM15243。
本发明在得到有菌培养体系后,向所述有菌培养体系中通入合成气后密封,振荡培养,得到含有乙醇、正丁醇和正己醇的产物。在本发明中,所述的合成气优选的包括以下体积含量的组份:45~55%的CO、30~40%的CO2和10~20%的H2,更优选的包括50%的CO、35%的CO2和15%的H2;本发明对所述合成气的来源没有特殊的限定,具体的在本发明实施例中采用市售的合成气。
在本发明中,所述合成气的通入速度优选的为1.5~2.5L/min,更优选的为1.8~2.2L/min,最优选的为2.0L/min;本发明中所述通入合成气的压力优选的为0.15~0.25MPa,更优选的为0.20MPa,本发明在通入合成气后控制有菌培养体系的压力在0.15~0.25MPa;本发明在完成通入合成气后再次密封有菌培养体系。
本发明在向有菌培养体系通入合成气密封后,对所述有菌培养体系进行振荡培养。本发明中对所述密封的方法没有特殊限定,采用本领域常规的密封手段实现密封即可,具体的在本发明实施例中所述的密封采用橡胶塞进行;
在本发明中,所述振荡培养的温度优选的为25~35℃,更优选为28~38℃,最优选的为30~37℃;所述振荡培养的转速优选的为100~250rpm,更优选的为150~200rpm,最优选的为180rpm;所述振荡培养的时间优选的为1~9天,更优选的为3~6天,最优选的为4~5天。
本发明在有菌培养体系培养过程中,优选的定时取样进行微生物生长情况和微生物发酵产物的检测,以更好的确定发酵结束的时间;在本发明中所述的发酵产物包括乙醇、正丁醇和正己醇。所述微生物发酵产物的检测方法为本领域常规的气相色谱法。
下面结合实施例对本发明提供的提高食气厌氧菌利用合成气发酵产醇能力的方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
对比例1
将20ml的大量元素母液,477.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至40℃,再加入0.1ml的微量元素,不添加钼元素、锌元素和镍元素,完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液5ml,(OD600nm吸光值为0.8,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。
结果如图1所示,在培养的第四天,菌株的细胞浓度OD600nm最大可达0.2Abs,最高乙醇产量为1.67g/L,检测不到正丁醇和正己醇的产量。
实施例1
将15ml的大量元素母液,482.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为30mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2.5L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至35℃,再加入0.1ml的微量元素、终浓度为0μM的钼元素、终浓度为7μM的锌元素和终浓度为0.84μM的镍元素完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,亚硒酸钠和钨酸钠的溶液的溶液。
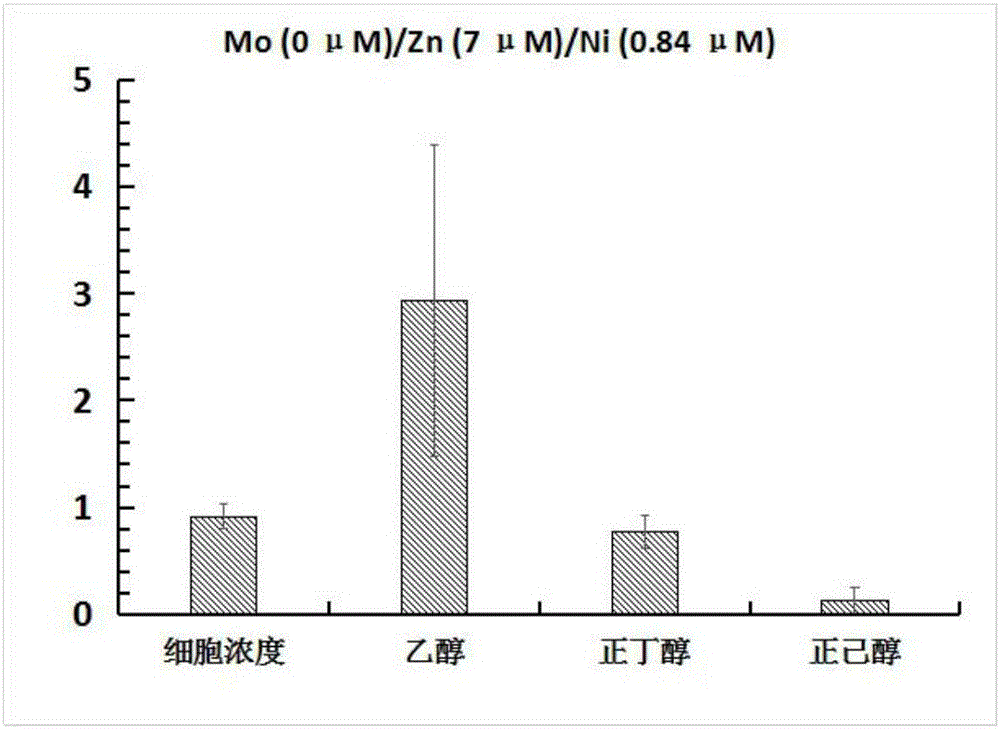
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液4ml,(OD600nm吸光值为1.1,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,190rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图2所示,在培养的第四天,菌株的细胞浓度OD600nm最大可达0.915Abs,检测到的乙醇产量2.93g/L,正丁醇产量0.77g/L,正己醇的产量0.13g/L。
实施例2
将10ml的大量元素母液,487.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为30mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2.5L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌30min。灭菌后,冷却至45℃,再加入0.15ml的微量元素、终浓度为0μM的钼元素、终浓度为70μM的锌元素和终浓度为8.4μM的镍元素,完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,亚硒酸钠和钨酸钠的溶液的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液2ml,(OD600nm吸光值为1.5,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,170rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图3所示,在培养的第四天,菌株的细胞浓度OD600nm最大可达1.8Abs,最高乙醇产量为4.9g/L,正丁醇产量最高为0.916g/L,正己醇的产量为0.42g/L。
实施例3
将15ml的大量元素母液,484ml营养水溶液和1.0ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2.0L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至35℃,再加入0.1ml的微量元素、终浓度为0μM的钼元素、终浓度为140μM的锌元素和终浓度为16.8μM的镍元素,完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液4ml,(OD600nm吸光值为1.0,再以3L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。结果如图4所示,在培养的第四天,菌株的细胞浓度OD600nm最大可达1.05Abs,最高乙醇产量为4.46g/L,正丁醇产量最高为1.98g/L,正己醇最高产量为0.26g/L,。
实施例4
将20ml的大量元素母液,477.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至40℃,再加入0.1ml的微量元素、终浓度为0.42μM的钼元素、终浓度为70μM的锌元素和终浓度为16.8μM的镍元素完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液5ml,(OD600nm吸光值为0.7,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图5所示,在培养的第四天,菌株的细胞浓度OD600nm最大可达0.908Abs,最高乙醇产量为2.82g/L,正丁醇产量最高为0.68g/L,正己醇含量为0.04g/L。
实施例5
将20ml的大量元素母液,477.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至40℃,再加入0.1ml的微量元素、终浓度为0.42μM的钼元素、终浓度为140μM的锌元素和终浓度为8.4μM的镍元素完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液5ml,(OD600nm吸光值为0.7,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图6所示,培养的第四天的样品进行检测,菌株的细胞浓度OD600nm最大可达0.843Abs,最高乙醇产量为2.78g/L,正丁醇产量最高为0.54g/L,正己醇含量为0.02g/L。
实施例6
将20ml的大量元素母液,477.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至35℃,再加入0.1ml的微量元素、终浓度为0.83μM的钼元素、终浓度为0μM的锌元素和终浓度为8.4μM的镍元素完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液5ml,(OD600nm吸光值为0.7,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图7所示,培养的第四天的样品进行检测,菌株的细胞浓度OD600nm最大可达0.872Abs,最高乙醇产量为2.76g/L,正丁醇产量最高为0.56g/L,正己醇含量为0.01g/L。
实施例7
将20ml的大量元素母液,477.5ml营养水溶液和2.5ml的还原剂配制成500ml培养基,其中大量元素母液包括以下质量含量的组分:8%氯化钠,10%氯化铵,1%氯化钾,1%的磷酸二氢钾,2%的硫酸镁、0.4%的氯化钙和余量的水;营养水溶液包括以下质量的组分:0.5g的酵母提取物,2.5g的吗啉乙磺酸和余量的水;还原剂包括以下质量含量的组分:0.9%的氢氧化钠,4%的L-半胱氨酸盐酸盐、4%的九水硫化钠和余量的水。
将配制好的培养基分装到100mL容量的血清瓶中,装液量为20mL。用橡胶塞将瓶口密封,使用接有针头的氮气瓶以2L/min的速度向血清瓶中充入99.999%的氮气用以去除血清瓶中残留的氧气,充气时长达到5min后结束充气,在121℃高温灭菌20min。灭菌后,冷却至40℃,再加入0.1ml的微量元素、终浓度为0.83μM的钼元素、终浓度为7μM的锌元素和终浓度为16.8μM的镍元素完成培养体系构建,微量元素为包括氨三乙酸,硫酸镁,硫酸亚铁铵,氯化钴,硒酸钠和钨酸钠的溶液。
接入培养至对数生长期的Clostridium carboxidivorans菌株P7培养液5ml,(OD600nm吸光值为0.7,再以2L/min流速,0.2MPa压力持续通入模拟合成气5min(合成气的组成:50%CO、35%CO2、15%H2)用以清除血清瓶中的氮气,使细菌完全处于合成气的气体环境下进行发酵,最后将合成气加压至0.2MPa密封。在37℃温度条件下,180rpm下振荡培养4天,每隔24h取样检测细胞浓度和发酵产物产量。如图8所示,培养的第四天的样品进行检测,菌株的细胞浓度OD600nm最大可达0.832Abs,最高乙醇产量为3.12g/L,正丁醇产量最高为0.55g/L,正己醇含量为0.04g/L。
由以上实施例可知,本发明通过构建包括培养基、微量元素和关键金属元素的培养体系,并利用所述培养体系对食气厌氧菌进行发酵,尤其是对培养体系中钼元素、锌元素和镍元素的浓度协调调整,提高了食气厌氧菌发酵产醇类的能力,以Clostridium carboxidivorans P7为例,在本发明所述的发酵系统中,不仅微生物的生长状况较好,OD600nm最大达到1.8,显著高于Clostridium carboxidivorans P7的普通培养体系,同时乙醇、正丁醇和正己醇的产量也有明显提升。本发明所述的培养体系和培养方法使得细胞浓度与醇类物质合成能力均得到大幅度提升,而且,这三种元素的浓度比例十分关键,在钼离子浓度低于0.42μM、锌离子浓度不低于70μM和镍离子浓度不低于0.84μM的情况下,乙醇产量可达4.9g/L、正丁醇产量可达1.98g/L、正己醇产量可达0.42g/L,其中乙醇和正丁醇产量要远远高于钼离子浓度高于0.42μM、锌离子浓度低于70μM和镍离子浓度低于0.84μM的情况。由此可见,本发明培养体系中钼元素、锌元素和镍元素的浓度调整,有利于提高食气厌氧菌的生产醇类物质的能力,提高发酵产物中乙醇和正丁醇的产量,并且丰富了发酵产物中醇类物质的种类,使得食气厌氧菌能够生产正己醇。综上所述,本发明提供的方法提高了食气厌氧菌利用合成气产醇类物质的能力。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!