利用多肽和小分子调控水稻或小麦中蛋白质表达水平的制作方法
本发明涉及生物
技术领域:
,尤其涉及一种利用多肽和小分子调控水稻或小麦中蛋白质表达水平。
背景技术:
:植物基因表达的化学诱导系统经过多年研究已开发出多种形式,如细菌来源的四环素诱导系统、哺乳动物来源的糖皮质激素可诱导系统、酵母来源的铜离子诱导系统、以及乙醇诱导的基因表达调控系统等。由于化学诱导系统可控性强,因此,在植物生物学研究中得到了广泛应用。令人遗憾的是,上述化学调控系统中用作诱导物的甲基脱氢皮质醇、雌二醇、四环素和重金属都对生态环境有害,不宜用于生产实践。此外,化学诱导系统还存在其它诸多问题,譬如表达泄漏、大田中可控性差(如乙醇诱导的调控系统)等。因此,转基因时空表达调控的化学诱导系统虽已被广泛应用于植物生物学研究,但在植物生物
技术领域:
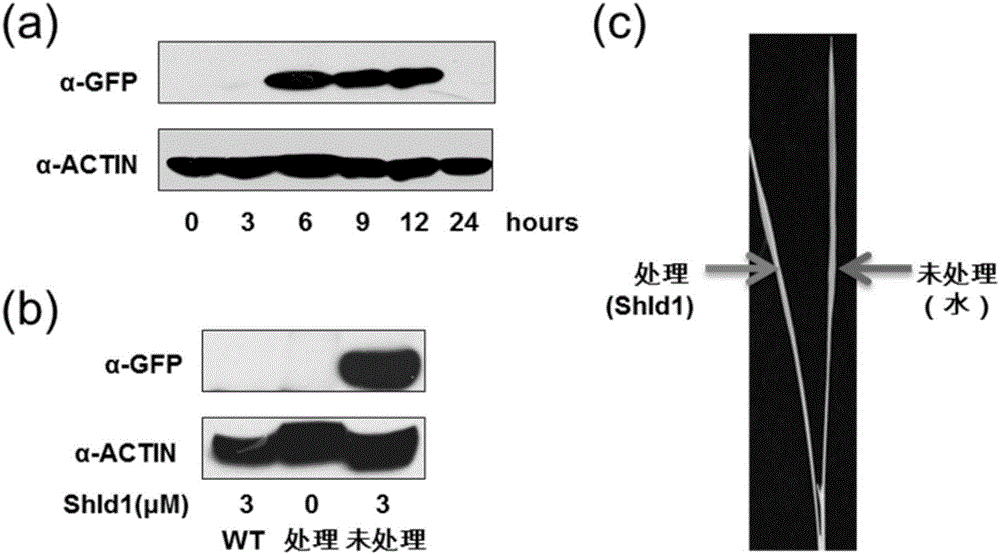
的使用却非常有限,特别是目前适合于大田应用的化学诱导系统少之又少。因此,迫切需要发展和建立新型的转基因时空表达调控化学诱导系统,为农业生物技术的发展及转基因分子育种提供重要的工具。绝大多数基因需要通过其编码的蛋白完成其生物学功能。目前植物基因表达的化学诱导系统还集中在从转录水平上控制基因的表达以调控其蛋白产物的功能。这些方法的主要局限性是它们对蛋白的控制是间接的,需要相对长的时间去起作用而引发相应的表型;此外,蛋白质本身的稳定性以及翻译后修饰也会影响这些方法的实际效果。因此,植物生物学家迫切需要直接调控蛋白质水平的化学诱导系统。随着化学生物学和化学遗传学的兴起,小分子化合物在蛋白质功能的研究中得到了广泛的应用。小分子对于蛋白质的作用几乎是实时的、通常也是可逆的和剂量依赖的,使得调控效果更加精确,调节方式也更加灵活。已有通过小分子控制蛋白质共定位,蛋白质激酶活性,以及蛋白质稳定性等的成功的报道。但是这些小分子通常是使用靶蛋白对小分子库进行大规模筛选得到的,其作用效果只针对特异的靶蛋白,不适用于其他蛋白质,而且不同蛋白质功能差异巨大,很难通过一种机制调节。与直接调控蛋白质活性相比,一种适用性更广泛的策略是通过小分子调控蛋白质的稳定性,从而控制靶蛋白质在细胞内的积累水平。最近,在哺乳动物中建立了一个利用小分子Shield1精细调控目的蛋白质积累水平的高效技术体系。Shield1是FK506的衍生物,具有更好的细胞通透性并且自身不具有任何生理活性。Shield1可以和一种稳定性改变的FKBP12突变形式DD(DestabilizedDomain)高效结合。DD在没有Shield1时是不稳定的,在细胞中的本底积累水平很低;而DD与Shield1结合后趋于稳定,得以在细胞内积累。重要的是,可以通过改变Shield1的浓度来快速、可逆地精细控制DD的累积水平。目前,这一系统已经在哺乳动物,果蝇,酵母,以及原生动物等多个物种中得到应用。目前已有改进的Shield1-RDDK系统在双子叶模式植物拟南芥中进行了验证(图1),这是第一种在植物中利用小分子直接调控蛋白质累积水平的方法,但在重要粮食作物水稻、小麦等中还没有相关的研究报道。EGFP是一种被广泛应用的报告蛋白,可在特定波长的光激发下发出荧光。GUS基因来自于大肠杆菌,编码β-葡萄糖醛酸糖苷酶,可催化多种β-葡萄糖苷酯类底物分解,产生深蓝色不溶性沉淀,是植物分子生物学研究中常用的报告基因之一。Bar基因来自于绿色产色链霉菌(Streptomycesviridochromogenes),编码草铵膦乙酰转移酶(PhosphinothricinN-acetyltransferase,PAT),可将草铵膦乙酰化而失活草铵膦。Pid3基因是从水稻籼稻品种地谷中克隆的稻瘟菌抗性基因,编码一个CC-NB-LRR蛋白。技术实现要素:本发明一个目的是提供多肽相关生物材料和shield1的用途。本发明提供了多肽相关生物材料和shield1在培育具有功能转基因农作物中的应用:所述多肽相关生物材料为如下任一种:多肽RDDK或RDDKHA、多肽RDDK编码基因或多肽RDDKHA编码基因、含有所述多肽RDDK编码基因的表达载体或含有所述多肽RDDKHA编码基因的表达载体、由所述多肽RDDK编码基因或所述多肽RDDKHA编码基因与功能蛋白基因融合得到的融合蛋白和融合蛋白编码基因;所述多肽RDDK的氨基酸序列为序列表中的序列2自N末端第77-185位氨基酸。所述RDDKHA多肽的氨基酸序列为序列表中的序列2自N末端第77-217位氨基酸。上述应用中,RDDK多肽的编码基因RDDK为序列表中的序列1自5’末端第229-555位核苷酸,UbRDDK多肽的编码基因UbRDDK的核苷酸序列为序列表中的序列1自5’末端第1-555位核苷酸。其中1-228为泛素编码基因Ub。RDDKHA多肽的编码基因RDDKHA为序列表中的序列1自5’末端第229-651位核苷酸,UbRDDKHA多肽的编码基因UbRDDKHA的核苷酸序列为序列表中的序列1。上述应用中,所述具有功能转基因农作物的功能是通过shield1诱导所述融合蛋白表达得到的;或所述农作物为小麦或水稻。上述应用中,所述功能蛋白基因为抗病基因或报告基因;或所述功能蛋白基因为Bar蛋白编码基因或抗稻瘟菌基因Pid3或GUS基因或EGFP基因。上述应用中,所述融合蛋白由多肽RDDK和EGFP蛋白融合组成RDDK-EGFP,其对应的具有功能转基因农作物为具有由EGFP表达带来的荧光信号功能的转基因农作物;或所述融合蛋白由多肽RDDKHA和Bar蛋白融合组成RDDKHA-Bar,其对应的具有功能转基因农作物为具有由Bar表达带来抗草甘膦功能转基因农作物;或所述融合蛋白由多肽RDDKHA和Pid3蛋白融合组成RDDKHA-Pid3,其对应的具有功能转基因农作物为具有由Pid3表达带来抗稻瘟菌功能转基因农作物;或所述融合蛋白由多肽RDDKHA和GUS蛋白融合组成RDDKHA-GUS,其对应的具有功能转基因农作物为具有由GUS表达带来报告功能转基因农作物。本发明另一个目的是提供一种培育具有功能转基因农作物的方法。本发明提供的方法,包括如下步骤:1)将上述融合蛋白编码基因导入农作物中,得到表达所述融合蛋白的转基因农作物;2)shield1或shield1水溶液诱导所述转基因农作物,得到shield1诱导后转基因农作物,即为具有功能转基因农作物;所述shield1或shield1水溶液诱导后转基因农作物的功能蛋白的表达量大于所述诱导前的转基因农作物。上述方法中,所述具有功能转基因农作物的功能是通过shield1诱导所述融合蛋白表达得到的;或所述农作物为小麦或水稻。上述方法中,所述shield1水溶液的浓度为3-10μM。上述方法中,所述融合蛋白由多肽RDDK和EGFP蛋白融合组成RDDK-EGFP,其对应的具有功能转基因农作物为具有由EGFP表达带来的荧光信号功能的转基因农作物,其对应的功能蛋白为EGFP;或所述融合蛋白由多肽RDDKHA和Bar蛋白融合组成RDDKHA-Bar,其对应的具有功能转基因农作物为具有由Bar表达带来抗草甘膦功能转基因农作物,其对应的功能蛋白为Bar;或所述融合蛋白由多肽RDDKHA和Pid3蛋白融合组成RDDKHA-Pid3,其对应的具有功能转基因农作物为具有由Pid3表达带来抗稻瘟菌功能转基因农作物,其对应的功能蛋白为Pid3;或所述融合蛋白由多肽RDDKHA和GUS蛋白融合组成RDDKHA-GUS,其对应的具有功能转基因农作物为具有由GUS表达带来报告功能转基因农作物,其对应的功能蛋白为GUS。本发明另一个目的是提供一种用于培育具有功能转基因农作物的体系。本发明提供的体系,包括上述多肽相关生物材料和shield1。本发明的实验证明,本发明首次在水稻、小麦中建立转基因蛋白表达水平的时空高效控制的化学诱导系统,最终为作物功能基因的挖掘和转基因分子育种提供有力的技术支撑。附图说明图1为shield1在水稻中直接调控RDDK融合蛋白的积累。图2为shield1对RDDK融合蛋白的诱导积累是时空特异的。图3为shield1诱导的转基因水稻除草剂抗性。图4为shield1诱导RDDK-Pid3转基因水稻稻瘟菌抗性。图5为shield1直接操控转基因小麦中目的蛋白水平。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、用于培育功能性转基因农作物的体系用于培育抗性农作物的体系包括多肽相关生物材料和小分子shield1。多肽及相关生物材料为如下:多肽RDDK或RDDKHA、多肽UbRDDK或UbRDDKHA、多肽编码基因UbRDDK或UbRDDKHA、含有多肽编码基因的表达载体、由多肽编码基因和功能蛋白基因融合得到的融合蛋白和融合蛋白编码基因中任一种。RDDK多肽的氨基酸序列为序列表中的序列2自N末端第77-185位氨基酸,RDDK多肽的编码基因RDDK为序列表中的序列1自5’末端第229-555位核苷酸,UbRDDK多肽的氨基酸序列为序列表中的序列2自N末端第1-185位氨基酸,该多肽的编码基因UbRDDK的核苷酸序列为序列表中的序列1自5’末端第1-555位核苷酸。RDDKHA多肽的氨基酸序列为序列表中的序列2自N末端第77-217位氨基酸,RDDKHA多肽的编码基因RDDKHA为序列表中的序列1自5’末端第229-651位核苷酸,UbRDDKHA多肽的氨基酸序列为序列表中的序列2,该多肽的编码基因UbRDDKHA的核苷酸序列为序列表中的序列1。小分子shield1(Clontech,货号632189,MW748.91,(C42H56N2O10),其化学式如下式1所示:实施例2、用于培育功能性转基因农作物的应用一、多肽RDDKHA/RDDK融合功能性蛋白表达1、重组载体pCambia2300-Ubi载体为将序列3所示的玉米ubiquitin启动子插入经过EcoRI酶切的pCambia2300(来自http://www.cambia.org/daisy/cambia/585.html)载体中得到的重组载体,命名为pCambia2300-Ubi。pCambia2300Ubi-UbRDDK中间载体:将序列1第1-555位所示的UbRDDK基因片段替换pCambia2300-Ubi载体骨架SacI和KpnI双酶切位点间DNA片段,得到中间载体pCambia2300Ubi-UbRDDK。pCambia2300Ubi-UbRDDKHA中间载体:将序列1所示的UbRDDKHA基因片段替换pCambia2300-Ubi载体骨架SacI和KpnI双酶切位点间DNA片段,得到中间载体pCambia2300Ubi-UbRDDKHA。pCambia2300Ubi-UbRDDK-EGFP载体:为将序列4所示的EGFP编码基因替换pCambia2300Ubi-UbRDDK载体骨架BamHI和NotI双酶切位点间DNA片段,形成ubiquitin-RDDK-EGFP同框融合片段,得到重组载体pCambia2300Ubi-UbRDDK-EGFP,表达融合蛋白RDDK-EGFP(氨基酸序列由多肽RDDK氨基酸序列和EGFP蛋白氨基酸序列组成,多肽RDDK氨基酸序列的最后一位与EGFP蛋白氨基酸序列的第一位紧邻;其中,EGFP蛋白氨基酸序列为序列8;多肽RDDK氨基酸序列为序列2第77-185位)。在细胞内,UbRDDK-EGFP蛋白一旦产生,其Ub会首先被切掉,从而留下RDDK-EGFP,下面蛋白相同均剪切掉Ub。pCambia2300Ubi-UbRDDKHA-Bar载体:将序列5所示的Bar编码基因(见序列5)替换中间载体pCambia2300Ubi-UbRDDKHA骨架KpnI和BamHI双酶切位点间DNA片段,形成ubiquitin-RDDKHA-Bar同框融合片段,得到重组载体pCambia2300Ubi-UbRDDKHA-Bar,表达融合蛋白RDDKHA-Bar(氨基酸序列由多肽RDDKHA氨基酸序列和Bar蛋白氨基酸序列组成,多肽RDDKHA氨基酸序列的最后一位与Bar蛋白氨基酸序列的第一位紧邻;其中,Bar蛋白氨基酸序列为序列9;多肽RDDKHA氨基酸序列为序列2第77-217位)。pCambia2300Ubi-UbRDDKHA-Pid3载体:将序列6所示的水稻抗稻瘟菌基因Pid3替换中间载体pCambia2300Ubi-UbRDDKHA中的SpeI和KpnI双酶切位点间DNA片段,形成UbRDDKHA-Pid3同框融合片段,得到重组载体pCambia2300Ubi-UbRDDKHA-Pid3,表达融合蛋白RDDKHA-Pid3(氨基酸序列由多肽RDDKHA氨基酸序列和Pid3蛋白氨基酸序列组成,多肽RDDKHA氨基酸序列的最后一位与Pid3蛋白氨基酸序列的第一位紧邻;其中,Pid3蛋白氨基酸序列为序列10;多肽RDDKHA氨基酸序列为序列2第77-217位)。pJIT163Ubi载体:将序列3所示的玉米ubiquitin启动子替换pJIT163(相关参考文献Guerineau,F.,Lucy,A.&Mullineaux,P.Effectoftwoconsensussequencesprece-dingthetranslationinitiatorcodonongeneexpressioninplantprotoplasts.PlantMolecularBiology18,815-818<1992>,公众可从中国科学院微生物研究所获得)中的HindⅢ和kpnI双酶切位点间DNA片段,得到中间载体pJIT163-Ubi。pJIT163Ubi-UbRDDKHA中间载体:将序列1所示的UbRDDKHA基因片段替换pJIT163Ubi载体骨架SacI和KpnI双酶切位点间DNA片段,得到中间载体pJIT163Ubi-UbRDDKHA。pJIT163Ubi-UbRDDKHA-GUS重组载体为将序列7所示的GUS基因替换载体pJIT163Ubi-UbRDDKHA中的BamHI和NotI双酶切位点间DNA片段,形成ubiquitin-RDDKHA-GUS同框融合片段,得到pJIT163Ubi-UbRDDKHA-GUS载体,表达融合蛋白RDDKHA-GUS(氨基酸序列由多肽RDDKHA氨基酸序列和GUS蛋白氨基酸序列组成,多肽RDDKHA氨基酸序列的最后一位与GUS蛋白氨基酸序列的第一位紧邻;其中,GUS蛋白氨基酸序列为序列11;多肽RDDKHA氨基酸序列为序列2第77-217位)。pJIT163Ubi-UbRDDKHA-Bar重组载体为将序列5所示的bar片段替换载体pJIT163Ubi-UbRDDKHA中的BamHI和EcoRI双酶切位点间DNA片段,形成ubiquitin-RDDKHA-Bar同框融合片段,得到pJIT163Ubi-UbRDDKHA-Bar载体,表达融合蛋白RDDKHA-Bar(氨基酸序列由多肽RDDKHA氨基酸序列和Bar蛋白氨基酸序列组成,多肽RDDKHA氨基酸序列的最后一位与Bar蛋白氨基酸序列的第一位紧邻;其中,Bar蛋白氨基酸序列为序列9;多肽RDDKHA氨基酸序列为序列2第77-217位)。2、转功能性基因植物的制备A、转基因水稻1)功能性基因转化获得转基因水稻将上述1制备的重组载体pCambia2300Ubi-UbRDDK-EGFP和pCambia2300Ubi-UbRDDKHA-Bar通过农杆菌侵染分别转化至水稻中花11(OryzasativaL.subsp.japonicacv.ZhonghuaNo.11,参考文献Ling-TaoPeng,Zheng-YingShi,LinLi(2007)EctopicexpressionofOsLFL1inricerepressesEhd1bybindingonitspromoter.BiochemicalandBiophysicalResearchCommunications360251–256)的成熟胚诱导的愈伤组织,得到T0代转EGFP水稻和T0代转Bar水稻;农杆菌转化的方法参考了HamidRashid,ShuujiYokoi,KinyaToriyamaPlantCellReports(1996)15:727-730TransgenicplantproductionmediatedbyAgrobacteriuminlndicarice所公开的方法。将上述1制备的重组载体pCambia2300-UbRDDKHA-Pid3通过农杆菌侵染转化至水稻日本晴(OryzasativaL.ssp.japonicacv.Nipponbare,记载在如下文献:StephenA.Goffetal.ADraftSequenceoftheRiceGenome(OryzasativaL.ssp.japonica).Science.2002,(296):92,公众可从中国科学院微生物研究所获得。)的成熟胚诱导的愈伤组织,得到T0代转Pid3水稻。2)鉴定转基因水稻(1)RT-PCR检测分别提取T0代转EGFP水稻、T0代转Bar水稻和T0代转Pid3水稻的幼苗的总RNA,反转录得到cDNA作为模板,分别用下面各自基因对应的引物进行RT-PCR:鉴定EGFP基因特异引物:DD-83-for:ACTTGTACAGCTCGTCCATGCCGAGEGFP-718-rev:CCGGGATGCTTGAAGATGGAAAGAAAGTC鉴定Bar基因特异引物:Bar-74-forGCACCATCGTCAACCACTACATCGAGBar-499-revCCAGCTGCCAGAAACCCACGTC鉴定Pid3基因特异引物:Pid3-FORATGGCGGAGGGTGTTGTGGGCTCPid3-REVTCCTCCCTCTTGAAGAGTACAGAGTCAG内参基因为actin,引物如下OsActin-for:GGGCGATCTAGGAAAGCTTCTCOsActin-rev:CAGTCCAAGAGGGGTATCTTGACPCR反应条件如下:94度变性3分钟;94度变性30秒,65度退火30秒,72度延伸60秒,循环30次;72度延伸5分钟。结果如下:T0代转EGFP水稻得到961bp为PCR鉴定阳性转基因植物;T0代转Bar水稻得到425bp为PCR鉴定阳性转基因植物;T0代转Pid3水稻得到515bp为PCR鉴定阳性转基因植物。(2)蛋白质免疫印迹将上述(1)PCR鉴定为阳性的T0代转EGFP水稻、T0代转Bar水稻和T0代转Pid3水稻幼苗分别提取总蛋白。提取液配方如下:50mMTris/HCl,pH7.5,100mMNaCl,2mMEDTA,0.5%SDS,5%甘油,2.5mMDTT,Complete蛋白酶抑制剂(Roche)。上述各株系总蛋白经SDS-PAGE分离后经半干法转印至PVDF膜,使用鼠源GFP抗体(Roche,1:2500稀释)检测GFP,使用鼠源HA抗体(Roche,1:2500稀释)检测HA,使用辣根过氧化物酶标记的抗鼠第二抗体(Sigma,1:20000稀释),使用Pro-lightHRP发光液显色(Tiangen)。结果得到目的蛋白的为阳性T0代转RDDK-EGFP水稻(目的蛋白RDDK-EGFP蛋白大小为44kd左右)、阳性T0代转Bar水稻(目的蛋白Bar大小为RDDKHA-Bar大小为40kd左右)。阳性T0代转Pid3水稻表达目的蛋白RDDKHA-Pid3,能看到荧光,且能检测到其发挥了生理功能。B、转基因小麦1)功能性基因转化得到转基因小麦将上述1制备的重组载体pJIT163Ubi-UbRDDKHA-GUS和pJIT163Ubi-UbRDDKHA-Bar基因枪法分别转入小麦科农199(基因枪转化方法参考了KangZhang,JinxingLiu,YiZhangJournalofGeneticsandGenomics42(2015)39-42BiolisticGeneticTransformationofaWideRangeofChineseEliteWheat(TriticumaestivumL.)Varieties所公开的方法。科农199是中国科学院遗传与发育生物学研究所育成的小麦新品种,审定编号:国审麦2006017),得到T0代转GUS小麦和T0代转Bar小麦。2)鉴定转基因小麦(1)RT-PCR检测分别提取T0代转GUS小麦和T0代转Bar小麦的幼苗的总RNA,反转录得到cDNA作为模板,分别用下面各自基因对应的引物进行RT-PCR:鉴定GUS基因特异引物:GUS-444-for:gattaccgacgaaaacggcaagGUS-867-rev:aggaactgttcgcccttcactg鉴定Bar基因特异引物:Bar-74-for:GCACCATCGTCAACCACTACATCGAGBar-499-rev:CCAGCTGCCAGAAACCCACGTC内参基因为actin,引物如下TaActin-for:GGGCGATCTAGGAAAGCTTCTCTaActin-rev:CAGTCCAAGAGGGGTATCTTGACPCR反应条件如下:94度变性3分钟;94度变性30秒,65度退火30秒,72度延伸60秒,循环30次;72度延伸5分钟。结果如下:T0代转GUS小麦得到422bp为PCR鉴定阳性转基因植物;T0代转Bar小麦得到425bp为PCR鉴定阳性转基因植物。(2)蛋白质免疫印迹将上述(1)PCR鉴定为阳性的T0代转GUS小麦和T0代转Bar小麦幼苗分别提取总蛋白。提取液配方如下:50mMTris/HCl,pH7.5,100mMNaCl,2mMEDTA,0.5%SDS,5%甘油,2.5mMDTT,Complete蛋白酶抑制剂(Roche)。上述各株系总蛋白经SDS-PAGE分离后经半干法转印至PVDF膜,使用鼠源GFP抗体(Roche,1:2500稀释)检测GFP,若多肽有HA,则使用鼠源HA抗体(Roche,1:2500稀释)检测HA;使用辣根过氧化物酶标记的抗鼠第二抗体(Sigma,1:20000稀释),使用Pro-lightHRP发光液显色(Tiangen)。结果得到目的蛋白的为阳性T0代转GUS小麦(目的蛋白RDDKHA-GUS大小为80Kd左右)、阳性T0代转Bar小麦(目的蛋白RDDKHA-Bar,大小为40Kd左右)。将上述阳性T0代小麦和阳性T0代水稻播种传代,得到T2代转GUS小麦、T2代转Bar小麦、T2代转EGFP水稻、T2代转Bar水稻和T2代转Pid3水稻。二、Shield1调控RDDKHA/RDDK融合功能蛋白的累积Shield1水溶液:将不同量的Shield1溶于水中,得到Shield1水溶液,使Shield1溶液的终浓度为0μM、0.3μM、1μM、3μM和10μM。Shield1处理(浸泡处理):将T2代转EGFP水稻、T2代转Bar水稻和T2代转Pid3水稻的无菌苗直接浸入不同浓度的Shield1水溶液中处理。实验重复三次,每个株系3株。1、shield1在水稻中直接调控RDDK-EGFP融合蛋白的积累1)RT-PCR采集0μM、3μMShield1水溶液处理8h后T2代转EGFP水稻进行RT-PCR检测RDDK-EGFP表达量,RT-PCR检测方法同上述一,以3μMShield1水溶液处理8h中花11野生型水稻为对照;结果如图1a所示,可以看出,从RNA水平上,与不加Shield1处理的T2代转EGFP水稻相比,加入3μMShield1处理的T2代转EGFP水稻的RDDK-EGFP的RNA水平并无明显差异;2)westernblot水平检测RDDK-EGFP融合蛋白的积累采集0μM、3μMShield1水溶液处理8h后T2代转EGFP水稻WB检测,WB检测方法同上述一,以3μMShield1水溶液处理8h中花11野生型水稻为对照;结果如图1b所示,可以看出,不加Shield1处理的T2代转EGFP水稻的RDDK-EGFP不表达,加入3μMShield1处理的T2代转EGFP水稻的RDDK-EGFP积累表达,表明,Shield1促进融合蛋白RDDK-EGFP的表达。3)RDDK-EGFP融合蛋白受诱导积累水平依赖于shield1的浓度采集0μM、0.3μM、1μM、3μM、10μMShield1水溶液处理8h后T2代转EGFP水稻WB检测,WB检测方法同上述一,以3μMShield1水溶液处理8h中花11野生型水稻为对照;结果如图1c所示,可以看出,随着Shield1浓度增加,T2代转EGFP水稻的RDDK-EGFP表达量增加,表明,目的蛋白RDDK-EGFP受诱导积累水平依赖于shield1的浓度。4)Shield1处理水稻叶鞘后内表皮细胞表达RDDK-EGFP融合蛋白的检测采集在0μM、1μM、3μM、10μMShield1水溶液浸泡8h后T2代转EGFP水稻,取水稻叶鞘内表皮细胞用共聚焦显微镜(由LeicaTCSSP8Ⅱ拍摄)进行检测,以3μMShield1水溶液处理8h中花11野生型水稻为对照;结果如图1d所示,可以看出,Shield1能够在水稻中诱导RDDK-EGFP融合蛋白的积累,且融合蛋白的功能不受影响,能被激发出荧光。5)Shield1处理水稻叶鞘后内表皮细胞表达RDDK-EGFP融合蛋白的定量检测采集在0μM、1μM、3μM、10μMShield1水溶液浸泡8h后T2代转EGFP水稻,取水稻叶鞘内表皮细胞用共聚焦显微镜(由LeicaTCSSP8Ⅱ拍摄)进行检测,激光共聚焦图像由LeicaTCSSP5Ⅱ拍摄。EGFP绿色荧光由488nm激发光激发,515/530nm波长处收集发射荧光。使用ImageJ软件(http://rsb.info.nih.gov/ij/)进行荧光强度测量。以10μMShield1水溶液处理8h中花11野生型水稻为对照;结果如图1e所示,可以看出,Shield1诱导的荧光强度随着其浓度升高而增强,说明RDDK-EGFP融合蛋白积累水平对Shield1具有剂量依赖效应。2、shield1对RDDK-EGFP融合蛋白的诱导积累是时空特异的1)shield1诱导融合蛋白积累水平随时间变化的关系3μMShield1水溶液处理T2代转EGFP水稻3h,在不同时间采样进行WB检测,WB检测方法同上述一,以3μMShield1水溶液处理3h中花11野生型水稻为对照;结果如图2a所示,可以看出,在shield1诱导3小时后,RDDK-EGPF融合蛋白有微弱地积累,6到12h积累达到顶峰,至24h时积累减弱至无法检测的水平,这说明RDDK-Shield1系统可以迅速调节目的蛋白的水平,并且这个调节是可逆的。2)shield1诱导地域性对同一株T2代转EGFP水稻的不同叶片分别用3μMShield1水溶液和水(mock)进行处理3h,采样进行WB检测,WB检测方法同上述一,以3μMShield1水溶液处理3h中花11野生型水稻为对照;结果如图2b和图2c所示,可以看出,只有经shield1处理的部位才有目的蛋白RDDK-EGFP的积累。3、shield1诱导的转Bar水稻除草剂抗性1)图3b为氯酚红试演原理示意图。除草剂草铵膦(PPT)能抑制植物中谷氨酰胺合成酶(GS)的活性,使植物中N代谢受到阻碍,致使细胞中游离氨含量升高,pH升高,杀死植物,并能使pH指示剂氯酚红变成红色;当抗除草剂基因Bar表达PAT蛋白(乙酰基转移酶),使PPT失活,则GS能够利用游离氨,使植物体内pH下降,从而使氯酚红成黄色。于是可以通过观察氯酚红颜色的变化就能判断植物是否具有除草剂抗性。2)westernblot水平检测RDDKHA-Bar融合蛋白的积累3μMShield1水溶液处理T2代转Bar水稻8h,采样进行WB检测,WB检测方法同上述一,抗体为α-HA抗体,以3μMShield1水溶液处理3h中花11野生型水稻为对照;结果如图3a所示,可以看出,Shield1处理后,融合蛋白UbRDDKHA-Bar有明显的表达。3)氯酚红试验3μMShield1水溶液处理T2代转Bar水稻8h,氯酚红法检验shield诱导的除草剂抗性。以3μMShield1水溶液处理3h中花11野生型水稻为对照。氯酚红培养基为向二分之一MS液体培养基中加入8g/l琼脂、8mg/l除草剂双丙氨膦和25mg/l氯酚红,ph调至6.0。所有的试剂都是同时加入培养基的,水稻叶片表面经过了简单的消毒处理(70%酒精擦拭))。多孔板放在光照培养箱中(24℃,16h光照/8h黑暗)。结果如图3c所示,T2代转Bar水稻叶片在8mg/l除草剂双丙氨膦作用下36h使培养基变为红色,而加有10μMshield1的培养基中未出现明显颜色变化。4)shield1处理过的转Bar水稻表现出除草剂抗性幼苗期T2代转Bar水稻用5μMShield1水溶液处理8h,之后用1g/L草铵膦水溶液喷施,10天后拍摄。以5μMShield1水溶液处理3h野生型水稻为对照.结果如图3d所示,可以看出,只有经shield1处理过的T2代转Bar水稻表现出除草剂抗性。5)转Bar水稻的shield1处理过的位置表现出除草剂抗性幼苗期T2代转Bar水稻的一片叶子用5μMShield1水溶液shield1诱导8h,另一片mock处理(水处理)8h,随后用1g/L除草剂草铵膦处理,10天后拍摄。以5μMShield1水溶液处理8h野生型水稻为对照。结果如图3e所示,可以看出,只有经shield1处理过的T2代转Bar水稻叶片表现出除草剂抗性。4、shield1诱导转Pid3水稻稻瘟菌抗性1)台盼蓝浸染接菌叶鞘将150μl到200μl之间接种处理液分别注射进入T2代转Pid3水稻和野生型日本晴水稻的叶鞘(将水稻叶鞘注满),接种培养48小时后用台盼蓝进行染色。接种处理液由2×105个/ml97-27-2稻瘟菌(QimingLv,XiaoXu,JunjunShang.(2007)FunctionalAnalysisofPid3-A4,anOrthologofRiceBlastResistanceGenePid3RevealedbyAlleleMininginCommonWildRice.Phytopathology,594-599(2013))孢子悬液、10μMshield1水溶液和水组成;以对照接种处理液为对照(mock)。对照接种处理液为不加shield1的接种处理液。结果如图4所示,可以看出,日本晴野生型水稻和未经Shield1处理的RDDK-Pid3转基因水稻叶鞘细胞被稻瘟菌97-27-2菌丝侵入,而经Shield1诱导的水稻并没有被菌丝侵入,而是引发了细胞死亡现象。统计稻瘟菌97-27-2接种不同水稻叶鞘时菌丝侵入的细胞数量和发生过敏性死亡的细胞数量,结果如表1所示,WT为野生型日本晴水稻,RDDK-Pid3为T2代转Pid3水稻,“+”表示接种处理液(10μMshield1),“-”表示对照接种处理液。可以看出,Shield1能够诱导RDDK-Pid3转基因水稻的稻瘟菌抗性,这说明Shield1能在转基因水稻中操控水稻内源性目的蛋白的积累,并发挥其生理功能。表1WT+RDDK-Pid3-RDDK-Pid3+侵入71(86.6%)73(78%)14(11.3%)细胞死亡11(13.4%)18(22%)110(88.7%)5、shield1直接操控转基因小麦中目的蛋白水平1)10μMshield1处理转GUS小麦采集10μMShield1水溶液处理8h后T2代转GUS小麦进行WB检测,WB检测方法同上述一,抗体用鼠源a-HA抗体(Roche,1:2500稀释)。以10μMShield1水溶液处理8h小麦科农199为对照;以不加入Shield1水溶液处理T2代转GUS小麦和以野生型小麦科农199为对照。结果如图5a所示,可以看出,加入10μMShield1处理的T2代转GUS小麦的RDDKHA-GUS积累表达,表明,Shield1促进融合蛋白RDDKHA-GUS的表达。2)对经shield1处理过的RDDKHA-GUS转基因小进行GUS染色;采集10μMShield1水溶液处理8h后T2代转GUS小麦叶片进行GUS染色,以10μMShield1水溶液处理8h以野生型小麦科农199得到的转空载体小麦为对照(WT);以不加入Shield1水溶液处理T2代转GUS小麦为对照。结果如图5b所示,可以看出,Shield1诱导了RDDK-HA-GUS融合蛋白的积累,并且GUS的功能并不受影响,叶片能被染色。3)shield1直接诱导RDDKHA-Bar外源抗除草剂蛋白的积累;采集10μMShield1水溶液处理8h后T2代转Bar小麦进行WB检测,WB检测方法同上述一,抗体用鼠源a-HA抗体(Roche,1:2500稀释)。以10μMShield1水溶液处理8h小麦科农199为对照;以不加入Shield1水溶液处理T2代转Bar小麦和野生型小麦为对照。结果如图5c所示,只有经Shield1诱导处理过的转基因小麦才检测到了RDDK-Bar融合蛋白的积累,可以看出,Shield1能在小麦中直接诱导RDDK-Bar蛋白的积累。4)shield1诱导RDDKHA-Bar转基因小麦除草剂抗性采集10μMShield1水溶液处理8h后T2代转Bar小麦进行WB检测,WB检测方法同上述一,抗体用鼠源a-HA抗体(Roche,1:2500稀释)。以10μMShield1水溶液处理8h野生型小麦科农199小麦为对照(WT);以不加入Shield1水溶液处理T2代转Bar小麦为对照。结果如图5d所示,可以看出,10μMShield1水溶液处理T2代转Bar小麦8h,氯酚红法检验shield诱导的除草剂抗性。以10μMShield1水溶液处理3h转空载小麦为对照。氯酚红培养基为向二分之一MS液体培养基中加入8g/l琼脂和25mg/l氯酚红,ph调至6.0。多孔板放在光照培养箱中(24℃,16h光照/8h黑暗)。结果如图2c所示,T2代转Bar小麦叶片在8mg/l除草剂双丙氨膦作用下36h使培养基变为红色,而加有10μMshield1的培养基中未出现明显颜色变化。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1