本发明涉及食品安全检测技术领域,具体地,涉及一种簇选择性赭曲霉毒素人工抗原及其广谱性多克隆抗体的制备方法。
背景技术:
赭曲霉毒素是真菌毒素中污染十分普遍的一种,主要是多种曲霉和青霉菌等真菌在恶劣环境条件下产生的有毒次级代谢产物。广泛存在于谷物及谷物产品、草料及饲料产品中,具有肾脏毒性、肝脏毒性和免疫毒性以及致癌、致畸和致突变作用等多种毒性,对动物和人体健康有很大的潜在危害。赭曲霉毒素(OT)主要为A、B、C三种,OTB是OTA的脱氯衍生物,OTC是OTA的乙基酯,毒性强弱顺序是:OTA>OTC>OTB,其中赭曲霉毒素A(OTA)产毒量最高、毒性最大、分布最广、对农作物污染最重、对人蓄影响最大。据报道在赭曲霉以及各种青霉菌种OTB/OTA生物合成比率约为1:5,产生的OTA和OTB具有很高的ppb浓度。另外有体外实验表明OTB和OTA具有相同的细胞毒性。赭曲霉毒素在食品中的残留对人体造成巨大威胁。但是,目前对赭曲霉毒素的检测方法研究不足,尤其是对OTB和OTC的检测方法研究较少,在食品加工、贮藏和销售等环节加强赭曲霉毒素一族的监控检测是十分必要的。
目前,赭曲霉毒素的检测方法主要有薄层色谱(Thin Layer chromatography,TLC)、高效液相色谱(High performance Liquid chromatography,HPLC)、气相色谱(Gas chromatography,GC)、质谱(Mass Sepectrum,MS)以及高效液相-质谱联用(High performance Liquid chromatography-Mass sepectrum,HPLC-MS)等方法。这些方法虽然准确度高,但其仪器设备昂贵、样品前处理复杂繁琐、检测成本高且需要专业人员操作。而免疫检测方法具备快速、灵敏、准确、操作简便等特点,且对样品纯度要求不高,特别适用于大批量样品的检测。
但是,目前检测赭曲霉毒素的免疫检测方法,均使用OTA偶联蛋白制备抗原、抗体。吴萌等使用OTA-BSA免疫得到鼠多抗,与OTB的交叉反应率仅为18%;李培武等人使用OTA-BSA免疫制备了鼠单抗,对OTA的IC50为0.052 μg/kg,检测限较灵敏,但与OTB的交叉反应率小于0.1%,仅可用于检测OTA。目前用于检测的酶联免疫试剂盒和免疫层析试纸条均只可以进行OTA的检测,对OTB和OTC的检测灵敏度低,且鲜见报道。使用OTA做免疫原获得的抗体大多都对OTB的识别均较低。由于赭曲霉毒素的危害性较大,迫切需要能够同时识别、检测多种赭曲霉毒素的免疫检测方法,而获得能够同时识别多种赭曲霉毒素的抗体则是关键。
技术实现要素:
本发明所要解决的技术问题是克服现有赭曲霉毒素免疫检测方法都不能同时检测多种赭曲霉毒素的缺陷和不足,提供一种赭曲霉毒素人工抗原及其广谱性多克隆抗体的制备方法。本发明首次获得了一种特殊的赭曲霉毒素B人工抗原结构,以该人工抗原制备出的多克隆抗体对赭曲霉毒素A、B、C均具有很好的识别性能,且灵敏度高,为建立赭曲霉毒素的广谱性免疫检测方法提供了核心材料,具有广阔的发展前景。
本发明的目的是提供一种赭曲霉毒素人工抗原。
本发明的另一目的是提供一种广谱性赭曲霉毒素多克隆抗体。
本发明的再一目的是提供一种赭曲霉毒素检测试剂盒。
本发明的上述目的是通过以下技术方案给予实现的。
一种赭曲霉毒素人工抗原,是将赭曲霉毒素B与载体蛋白偶联得到。
优选地,所述载体蛋白为钥孔血蓝蛋白(KLH)、牛血清蛋白(BSA)或鸡卵白蛋白(OVA)等。
优选地,将赭曲霉毒素B与载体蛋白偶联所用的方法为活泼酯法。
具体地,所述赭曲霉毒素人工抗原的制备方法如下:
S1.将赭曲霉毒素B、NHS和EDC溶解于二甲基甲酰胺(DMF)中,室温避光搅拌6~15h(搅拌过夜),得到赭曲霉毒素B溶液(OTB溶液);
S2.将钥孔血蓝蛋白(KLH)加入到PBS缓冲液中得到钥孔血蓝蛋白溶液(KLH溶液);
S3.将赭曲霉毒素B溶液(OTB溶液)缓慢逐滴入钥孔血蓝蛋白溶液(KLH溶液),室温避光搅拌6~10h;
S4.用PBS缓冲液透析后,得到赭曲霉毒素人工抗原。
其中,优选地,步骤S1所述赭曲霉毒素B、NHS和EDC的物质的量比为1:1~3:1~3。
更优选地,步骤S1所述赭曲霉毒素B、NHS和EDC的物质的量比为1:2:2。
优选地,所述赭曲霉毒素B和二甲基甲酰胺的质量体积比为1mg:60~90μL更优选地,步骤S1所述赭曲霉毒素B和二甲基甲酰胺的质量体积比为1mg:75μL。
优选地,步骤S1所述室温避光搅拌8~12。
优选地,步骤S3所述室温避光搅拌8 h。
优选地,步骤S2所述钥孔血蓝蛋白(KLH)加入到PBS缓冲液的质量体积比为1mg:20~40μL。
更优选地,步骤S2所述钥孔血蓝蛋白(KLH)加入到PBS缓冲液的质量体积比为1mg:30μL。
优选地,步骤S2所述PBS缓冲液的浓度为0.01 moL/L,pH=7.4。
优选地,步骤S4所述PBS缓冲液透析的时间为两天,每天4次。
优选地,所述PBS缓冲液的配方:Na2HPO4·12H2O 2.90g,NaCL 8.50g,KCL 0.20g,KH2PO4 0.20g,加蒸馏水定容至1000 mL。
一种广谱性赭曲霉毒素多克隆抗体,是由上述赭曲霉毒素人工抗原免疫兔得到。
具体是将上述赭曲霉毒素人工抗原乳化后免疫兔后,用辛酸-硫酸法纯化血清得到兔多克隆抗体。
更具体地,所述广谱性赭曲霉毒素多克隆抗体的制备方法为:将上述赭曲霉毒素人工抗原溶液与等量佐剂混合乳化,初次免疫与弗氏完全佐剂混合乳化后免疫,之后的加强免疫使用免疫原与弗氏不完全佐剂乳化后免疫,共免疫四次,每次间隔3周,每次免疫剂量为6mL/只;第四次免疫后第十天采血,采用辛酸-硫酸铵法纯化得到赭曲霉毒素多克隆抗体。
另外,一种包含有上述赭曲霉毒素广谱性多克隆抗体的赭曲霉毒素检测试剂盒也在本发明的保护范围之内。
本方面所获得的赭曲霉毒素多抗可用于广谱性检测赭曲霉毒素,所述赭曲霉毒素包括赭曲霉毒素A、B和/或C,可用于建立免疫学方法等,因此,本发明的广谱性赭曲霉毒素多克隆抗体及其试剂盒在广谱性检测赭曲霉毒素方面的应用,也在本发明的保护范围之内。
具体地,所述应用为广谱性赭曲霉毒素多克隆抗体及其试剂盒在赭曲霉毒素免疫检测方面的应用。
本发明与现有技术相比,具有以下有益效果:
本发明获得了一种赭曲霉毒素B人工抗原,所述人工抗原的制备方法简单,更重要的是以此所制备得到的赭曲霉毒素多克隆抗体灵敏度高,广谱性好,对赭曲霉毒素A、B、C均具有较好的识别能力。
(3)本发明制备得到的灵敏性度高且广谱性强的赭曲霉毒素多克隆抗体,为建立赭曲霉毒素的广谱性免疫检测方法提供了核心材料,具有广阔的发展前景。
附图说明
图1为赭曲霉毒素多克隆抗体制备流程图。
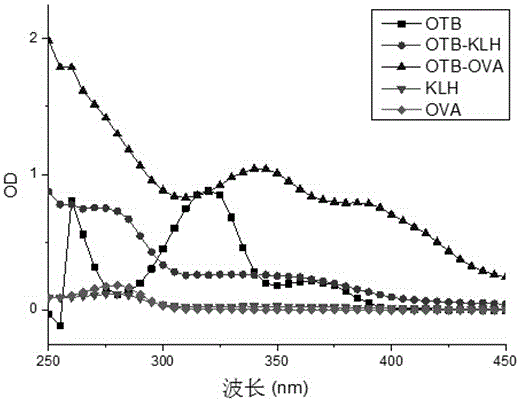
图2为赭曲霉毒素人工抗原紫外扫描鉴定曲线。
图3为赭曲霉毒素多克隆抗体对三种药物的间接竞争ELISA标准曲线。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
以下实施例包括赭曲霉毒素人工抗原的合成、广谱性赭曲霉毒素多克隆抗体的制备及其赭曲霉毒素A、B、C的检测,流程如图1所示。
实施例1 赭曲霉毒素人工抗原的合成与鉴定
1、人工抗原的合成方法
(1)准确称取2 mg OTB,1 mg NHS和2 mg EDC溶解于150 μL DMF中,室温下避光过夜搅拌,未见沉淀出现;
(2)10 mg钥孔血蓝蛋白(KLH)加入到300 μL的PBS缓冲液(0.01 moL/L,pH=7.4)中;
(3)将OTB溶液缓慢逐滴加入KLH溶液中,室温下避光搅拌8 h;
(4)用PBS缓冲液透析两天,每天4次,透析结束后得到赭曲霉毒素人工抗原。
其中,PBS缓冲液的配方:Na2HPO4·12H2O 2.90g,NaCL 8.50g,KCL 0.20g,KH2PO40.20g,加蒸馏水定容至1000 mL。
另外,将载体蛋白KLH替换为卵白蛋白(OVA)偶联方法同上。
2、人工抗原的鉴定:
取上述合成的赭曲霉毒素人工抗原,进行紫外扫描,结果如图2所示。
具体地,OVA、KLH、人工抗原分别进行紫外(250~450 nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现赭曲霉毒素人工抗原的吸收曲线与载体蛋白明显不同,KLH和OVA仅在280 nm处有特征峰,OTB在320nm和360 nm处有两个特征峰,而偶联反应后,OTB-KLH在310~375 nm之间有一个大的特征峰,而OTB-OVA在340 nm和390 nm处出现特征峰,且对比OTB的曲线可看出发生显著位移。由于在偶联后的透析过程已经将未反应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白与OTB的复合物,偶联成功。
实施例2 赭曲霉毒素多克隆抗体的制备
1、免疫:
用OTB-KLH分别免疫新西兰大白兔,分别将1 mg/mL的人工抗原溶液与等量佐剂混合乳化,初次免疫与弗氏完全佐剂混合乳化后免疫,之后的加强免疫使用免疫原与弗氏不完全佐剂乳化后免疫,共免疫四次,每次间隔3周,每次免疫剂量为6 mL/只,第四次免疫后第十天采血。
2、纯化(辛酸-硫酸铵法):
(1)取兔血清,在4℃条件下,12000r/min离心15min,去除沉淀;
(2)取1体积的兔血清与2体积的醋酸盐缓冲液混合(pH4.8),室温搅拌下,逐滴加入正辛酸,使用量为75 µL正辛酸/mL兔血清;
(3)室温搅拌混合30min,4℃静止2h使其充分沉淀;
(4)4℃条件下,12000r/min离心15min,去除沉淀;
(5)上清经砂芯漏斗或125um尼龙网过滤后,加入1/10体积的PBS缓冲液(0.1M,pH7.4),用2M的氢氧化钠调pH至7.4,计算总溶液体积;
(6)冰浴下于30min内加入0.277g/mL的硫酸铵,使其成为45%饱和溶液;
(7)4℃静止1h以上后,4℃条件下,12000r/min离心15min,弃上清;
(8)沉淀用PBS缓冲液(0.1M,pH7.4)透析三天。
实施例3 赭曲霉毒素多克隆抗体的ELISA检测
1、ELISA检测方法
(1)将赭曲霉毒素B人工抗原用包被液稀释至0.5 µg/mL的浓度,包被96孔酶标板,每孔加入100 µL,37℃温育过夜;
(2)弃去包被液,洗涤2次;
(3)每孔加入120 µL封闭液(5%脱脂奶粉),37℃封闭30 min;
(4)弃去封闭液,拍板,37℃烘干备用;
(5)用PBST 1:8000倍稀释赭曲霉毒素多克隆抗体,并将赭曲霉毒素稀释至1000,100,10,1,0.1,0.01,0.001 ng/mL;
(6)每行加50 µL赭曲霉毒素稀释液(三组平行),再加50 µL蛋黄提取物稀释液/孔,在37℃温育40 min,洗涤5次;
(7)加入羊抗兔二抗-HRP(4000倍稀释),37℃温育30 min,洗涤5次,拍板;
(8)加入显色液显色10 min;
(9)加入50 µL10% H2SO4终止反应,并在450 nm处读取OD值。
另外,将上述药物OTA换成OTB和OTC,并以同样的稀释倍数进行上述试验,测定该抗体对黄曲霉毒素其他结构类似物的交叉反应率。
2、结果
以由OTB-KLH免疫所得抗体为例进行结构的呈现,对OTA的识别性能良好,其IC50为0.85 ng/mL,LOD为0.03 ng/mL;对于OTB,IC50为3.53 ng/mL,LOD为0.15 ng/mL;对OTC,IC50为0.29 ng/mL,LOD为0.02 ng/mL。
本发明所得赭曲霉毒素多克隆抗体可以满足检测要求,可以广谱性识别赭曲霉毒素三种主要结构,且灵敏度均良好,是建立赭曲霉毒素广谱性免疫检测方法的必要材料。