一种角蛋白酶表达体系及其制备方法和应用与流程
本发明涉及基因工程技术领域,具体涉及一种角蛋白酶表达系统及其制备方法和应用。
背景技术:
角蛋白是一种不溶性的结构蛋白,是皮肤、毛发、羽毛、蹄、角、甲等的主要成分,也是重要的蛋白质资源。角蛋白含有高交联度的α-螺旋和β-折叠,具有极强抗性,难以直接利用。目前我国养殖业中每年产生的养殖废弃物数量惊人,随着我国养殖业的不断发展其数量还在持续增长,实现角蛋白资源的高值转化和利用势在必行。对羽毛等角蛋白的处理,传统的物理和化学加工方法(高温高压、酸碱处理等)不仅使营养成分流失,还消耗大量能源,引起严重的二次环境污染问题。因此,酶法降解角蛋白成为角蛋白资源转化利用的不二之选。角蛋白酶(keratinase,E.C 3.4.21/24/99.11)是一种金属或丝氨酸蛋白酶,主要由真菌、放线菌、细菌等微生物产生,可特异性降解角蛋白,产生可供机体利用的多种氨基酸和多肽,从而变废为宝,既能保护环境又能充分利用资源。
虽然角蛋白酶有巨大的研究和应用价值,但是野生菌株角蛋白酶产量低,活性不稳定,难以产业化生产应用。针对野生菌株产酶效率低的问题,通常是将角蛋白酶基因克隆到常用的表达载体中进行异源表达。然而目前最常用的基因工程表达系统尚存在许多问题未能解决,如大肠杆菌中表达的重组蛋白通常以没有生物活性的包涵体形式存在,酵母表达系统存在质粒不稳定和产物过度糖基化的现象,而哺乳动物细胞表达系统的表达水平很低。
昆虫细胞表达系统是一类真核生物表达系统,具有同大多数高等真核生物相似的蛋白翻译后修饰加工的能力,使重组蛋白在结构和功能上更接近天然蛋白;其表达量高达昆虫细胞蛋白总量的50%,可高效表达外源基因;昆虫杆状病毒表达载体容量大,可表达大片段的外源基因;具有外分泌功能,能将外源蛋白分泌到细胞外,便于后续蛋白分离纯化。
技术实现要素:
为了克服现有技术的不足,本发明的第一个目的在于提供一种角蛋白酶表达体系,该表达体系通过优化了地衣芽孢杆菌PWD-1角蛋白酶KerA氨基酸编码序列,使重组角蛋白酶能够高效、外分泌表达;该体系具有应用简单,生产的酶活力高的特点。
本发明的第二个目的是为了提供一种上述角蛋白酶表达体系的制备方法和应用。
实现本发明的目的可以通过采取如下技术方案达到:
一种角蛋白酶表达体系,包括含有OKer-His-Flag序列的重组杆状病毒。所述OKer-His-Flagr序列如SEQ ID NO.1所示,具体为:GGATCCGCCACCATGAAATTCTTAGTCAACGTTGCCCTTGTTTTTATGGTCGTGTACATTTCTTACATCTATGCGGCCCAGCCTGCCAAGAACGTTGAGAAGGACTACATCGTGGGATTCAAGTCCGGAG TCAAGACCGCCTCCGTTAAGAAGGACATCATCAAGGAGTCCGGTGGCAAGGTGGACAAGCAGTTCCGCATCATCAACGCCGCCAAGGCTAAGCTGGACAAGGAGGCTTTGAAGGAGGTGAAGAACGACCCCGACGTTGCTTACGTCGAGGAAGACCACGTGGCTCACGCTTTGGCTCAGACTGTCCCATACGGAATCCCATTGATCAAGGCCGACAAGGTGCAGGCTCAAGGTTTCAAGGGTGCTAACGTGAAGGTCGCTGTGCTGGACACTGGTATCCAGGCTTCCCACCCTGATTTGAACGTGGTGGGAGGTGCTAGTTTCGTGGCTGGAGAAGCCTACAACACTGACGGTAACGGTCACGGTACTCACGTTGCTGGAACCGTTGCTGCTCTGGATAACACCACCGGAGTTCTGGGAGTTGCTCCAAGTGTTTCCCTGTACGCTGTTAAAGTGCTCAACTCCTCCGGTAGCGGAAGCTACTCCGGAATCGTCTCCGGTATCGAATGGGCTACCACCAACGGAATGGACGTGATCAACATGAGCCTGGGCGGAGCTAGTGGTTCTACCGCTATGAAACAAGCCGTCGATAACGCCTACGCCAGAGGTGTCGTTGTGGTCGCTGCCGCCGGTAACAGCGGTTCAAGCGGCAATACAAACACAATCGGCTACCCTGCCAAATACGATAGCGTCATTGCCGTCGGCGCCGTTGATAGCAACAGCAACCGTGCCAGCTTCTCATCAGTGGGCGCCGAACTCGAAGTTATGGCCCCTGGCGCCGGCGTTTATTCAACATACCCCACAAATACATACGCCACACTGAACGGCACATCTATGGTCTCTCCCCACGTCGCCGGCGCCGCTGCTCTCATTCTCTCAAAACATCCCAATCTCTCTGCCTCACAAGTCAGGAATCGTCTCTCTTCTACTGCCACTTACCTGGGCTCATCTTTTTACTACGGCAAAGGCCTCATTAACGTGGAAGCCGCTGCTCAACACCATCACCATCACCACCACCACGACTACAAGGACGACGATGATAAATAGAAGCTT。
一种角蛋白酶表达体系的制备方法,包括如下步骤:
(1)目的序列的优化和克隆载体的构建;对地衣芽孢杆菌PWD-1角蛋白酶KerA氨基酸编码序列进行优化,并且将优化后的序列克隆至载体中,扩增,命名为pUC-OKer-His-Flag;地衣芽孢杆菌PWD-1角蛋白酶KerA氨基酸编码序列的GenBank登录号AAB34259.1;
(2)重组杆状病毒Bacmid DNA的制备;将步骤(1)所获的pUC-OKer-His-Flag载体进行双酶切获得OKer-His-Flag序列;将杆状病毒供体载体进行双酶切获得杆状病毒骨架载体;将所获得OKer-His-Flag序列与杆状病毒骨架载体进行连接获得重组供体载体,扩增所得重组供体载体,将重组供体载体命名为pFastBac1-OKer-His-Flag;将重组供体载体pFastBac1-OKer-His-Flag转化E.coli DH10Bac感受态细胞,鉴定阳性后,提取杆状病毒黏粒,即获得含有OKer-His-Flag基因序列的重组杆状病毒Bacmid DNA;
(3)重组杆状病毒的拯救;将重组杆状病毒Bacmid DNA转染至对数期昆虫细胞Sf9中,收获P1代重组杆状病毒;将P1代重组杆状病毒感染对数期昆虫细胞Sf9获得P2代重组杆状病毒,P2代重组杆状病毒感染对数期昆虫细胞Sf9获得P3代重组杆状病毒,命名为rAcNPV-OKer-His-Flag。
优选地,步骤(1)中所述的优化具体包括:在起始位点增加Kozak序列、以昆虫细胞蛋白信号肽取代KerA原序列中的信号肽、在终止密码子之前添加8His-Flag编码序列,与目的序列进行融合表达;所述Kozak序列为(如SEQ ID NO.2所示):GCCACC,所述昆虫细胞蛋白信号肽编码序列为(如SEQ ID NO.3所示);所述8His-Flag编码序列为(如SEQ ID NO.4所示)。具体的,所述Kozak序列为GCCACC,所述昆虫细胞蛋白信号肽编码序列为ATGAAATTCTTAGTCAACGTTGCCCTTGTTTTTATGGTCGTGTACATTTCTTACATCTATGCG;所述8His-Flag编码序列为CACCATCACCATCACCACCACCACGACTACAAGGACGACGATGATAAA。
优选地,步骤(1)中所述的载体为pUC57克隆载体。
优选地,步骤(2)中所述双酶切为限制性内切酶BamHⅠ和HindⅢ双酶切。
优选地,步骤(2)中所述杆状病毒供体载体为pFastBac1。
优选地,步骤(2)中所述扩增所得重组供体载体,具体操作为:将所获重组供体载体转化E.coli DH5α感受态细胞,挑取单克隆,进行酶切、测序鉴定;经鉴定阳性的克隆子命名为pFastBac1-OKer-His-Flag。
优选地,步骤(2)中所述对E.coli DH10Bac进行鉴定阳性所采用的方法为双向测序的方法,所述双向测序所用的引物如SEQ ID NO.8和SEQ ID NO.9所示。
优选地,步骤(3)的具体操作步骤为:依照Invitrogen公司生产的货号为No.10362100的 II Reagent试剂盒说明书的方法,将重组杆状病毒Bacmid DNA转染至对数期昆虫细胞Sf9中,72h后取上清,收获P1代重组杆状病毒;具体操作如下:
(3.1)在6孔板或35mm培养皿中接种Sf9昆虫细胞,27℃培养箱中培养至细胞汇合率大于80%;
(3.2)制备溶液A:将体积为5ul质量为1ug的Bacmid DNA加入100ul无血清、无双抗的SF900ⅡSFM培养基中,轻轻混匀;
(3.3)制备溶液B:将6ul Cellfection transfection reagent加入到100ul无血清、无双抗的SF900ⅡSFM培养基中,轻轻混匀;
(3.4)制备溶液C:将溶液A和溶液B混合,轻轻混匀,室温孵育15~45min;
(3.5)用无血清、无双抗的SF900ⅡSFM培养基清洗步骤(3.1)所获的细胞两次;
(3.6)将800ul无血清、无双抗的SF900ⅡSFM培养基加入到溶液C中,轻轻混匀,再将混合液加到步骤(3.5)所获的细胞中;置27℃培养箱培养5h;
(3.7)吸出培养液,加入含双抗和血清的SF900ⅡSFM培养基2ml;置27℃培养箱培养72h;
(8)收集细胞培养上清液,制得P1代重组杆状病毒;将P1代重组杆状病毒感染对数期昆虫细胞Sf9获得P2代重组杆状病毒,P2代重组杆状病毒感染对数期昆虫细胞Sf9获得P3代重组杆状病毒,命名为rAcNPV-OKer-His-Flag。
一种角蛋白酶表达体系的应用,其特征在于包括如下步骤:
(a)将重组杆状病毒rAcNPV-OKer-His-Flag感染对数期Sf9细胞,3~5d后收获细胞培养上清液;将细胞培养上清液在转速为12000rpm的条件下离心5min,取上清,用0.22um滤膜过滤,收集滤液;
(b)取1mlNi-NTA,用10倍柱床体积的Binding Buffer清洗、平衡柱子,流速为2ml/min;所述Binding Buffer包括如下各组分:50mM Tris、500Mm NaCl、质量比为0.1%Trion X-100、1mM DTT、质量比为5%的甘油;所述Binding Buffer的pH=8;
(c)将步骤(a)所获的滤液上柱,流速为1ml/min,反复上样2~4次;
(d)用10倍柱床体积的Wash Buffere清洗柱子,流速为2ml/min;所述Wash Buffere包括如下各组分:50mM Tris、500Mm NaCl、质量比为0.1%Trion X-100、1mM DTT、质量比为5%的甘油,20mM咪唑;所述Wash Buffere的pH=8;
(e)用Elution Buffer洗脱柱子,流速为1ml/min,收集洗脱液;所述Elution Buffer包括如下各组分:50mM Tris、300Mm NaCl、质量比10%的甘油、300mM咪唑;所述Elution Buffer的pH=8。
(f)透析步骤(e)收集的洗脱液,获得角蛋白酶。
相比现有技术,本发明的有益效果在于:
1、本发明提供了一种角蛋白酶表达体系,该表达体系通过优化了地衣芽孢杆菌PWD-1角蛋白酶KerA氨基酸编码序列,使重组角蛋白酶能够高效、外分泌表达;该体系具有应用简单,生产的酶活力高的特点。
2、本发明通过采用昆虫细胞作为角蛋白酶的表达载体,所表达的重组角蛋白酶在结构和功能上更接近天然的角蛋白酶;其表达量高达昆虫细胞蛋白总量的50%,能够高效表达;其次是采用昆虫信号肽替换了原有的信号肽,使角蛋白酶分泌到培养液中,便于纯化收集。
附图说明
图1为pUC-OKer-His-Flag载体结果图谱图2。
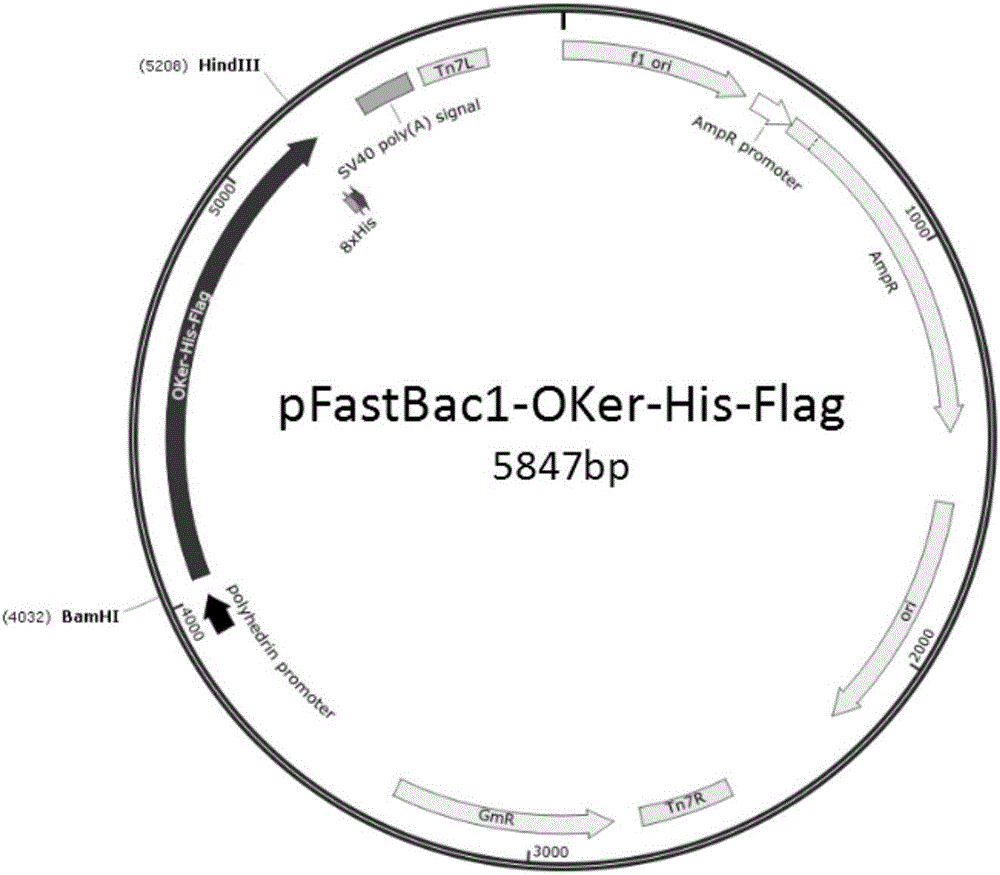
图2为pFastBac1-OKer-His-Flag载体结果图谱。
图3为重组杆状病毒Bacmid DNA结构图。
图4为Sf9细胞感染重组杆状病毒后变化(病变前)。
图5为Sf9细胞感染重组杆状病毒后变化(病变后)。
图6为感染后细胞上清SDS-PAGE检测。
图7为感染后细胞上清Western blot检测。
图8为纯化后重组蛋白SDS-PAGE检测。
图9为纯化后重组蛋白Western blot检测。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
实施例1:
一种角蛋白酶表达体系,包括含有OKer-His-Flag序列的重组杆状病毒。
所述的蛋白酶表达体系由如下步骤制备而成:
1、目的序列的优化和克隆载体的构建
根据昆虫细胞表达系统密码子偏好性和工艺需要,对地衣芽孢杆菌PWD-1角蛋白酶KerA氨基酸(GenBank登录号AAB34259.1)编码序列进行优化:通过在起始位点增加Kozak序列(GCCACC)、使用昆虫细胞表达系统常用密码子等来提高蛋白表达水平;以昆虫细胞蛋白信号肽取代KerA原序列中的信号肽,以引导重组蛋白分泌到细胞上清中;在终止密码子之前添加8His-Flag编码序列,与目的序列进行融合表达,以便于后续通过融合标签8His-Flag进行亲和纯化目的蛋白。利用化学法合成OKer全长cDNA序列,并克隆至pUC57克隆载体,命名为pUC-OKer-His-Flag(OKer表示优化后的Ker编码序列,见图1)。
优化后的全长cDNA序列为OKer-His-Flag,如SEQ ID NO.1所示,其中:酶切位点为BamHⅠ(如SEQ ID NO.5所示)和HindⅢ(如SEQ ID NO.6所示);Kozak序列如SEQ ID NO.2所示;昆虫细胞信号肽编码序列如SEQ ID NO.3所示;8His-Flag标签编码序列如SEQ ID NO.4所示:具体的,OKer-His-Flag的全长cDNA序列如下(其中:酶切位点为BamHⅠ(GGATCC)和HindⅢ(AAGCTT);为Kozak序列;____为昆虫细胞信号肽编码序列;为8His-Flag标签编码序列):
GGATCCATGAAATTCTTAGTCAACGTTGCCCTTGTTTTTATGGTCGTGTACATTTCTTACATCTATGCGGCCCAGCCTGCCAAGAACGTTGAGAAGGACTACATCGTGGGATTCAAGTCCGGAGTCAAGACCGCCTCCGTTAAGAAGGACATCATCAAGGAGTCCGGTGGCAAGGTGGACAAGCAGTTCCGCATCATCAACGCCGCCAAGGCTAAGCTGGACAAGGAGGCTTTGAAGGAGGTGAAGAACGACCCCGACGTTGCTTACGTCGAGGAAGACCACGTGGCTCACGCTTTGGCTCAGACTGTCCCATACGGAATCCCATTGATCAAGGCCGACAAGGTGCAGGCTCAAGGTTTCAAGGGTGCTAACGTGAAGGTCGCTGTGCTGGACACTGGTATCCAGGCTTCCCACCCTGATTTGAACGTGGTGGGAGGTGCTAGTTTCGTGGCTGGAGAAGCCTACAACACTGACGGTAACGGTCACGGTACTCACGTTGCTGGAACCGTTGCTGCTCTGGATAACACCACCGGAGTTCTGGGAGTTGCTCCAAGTGTTTCCCTGTACGCTGTTAAAGTGCTCAACTCCTCCGGTAGCGGAAGCTACTCCGGAATCGTCTCCGGTATCGAATGGGCTACCACCAACGGAATGGACGTGATCAACATGAGCCTGGGCGGAGCTAGTGGTTCTACCGCTATGAAACAAGCCGTCGATAACGCCTACGCCAGAGGTGTCGTTGTGGTCGCTGCCGCCGGTAACAGCGGTTCAAGCGGCAATACAAACACAATCGGCTACCCTGCCAAATACGATAGCGTCATTGCCGTCGGCGCCGTTGATAGCAACAGCAACCGTGCCAGCTTCTCATCAGTGGGCGCCGAACTCGAAGTTATGGCCCCTGGCGCCGGCGTTTATTCAACATACCCCACAAATACATACGCCACACTGAACGGCACATCTATGGTCTCTCCCCACGTCGCCGGCGCCGCTGCTCTCATTCTCTCAAAACATCCCAATCTCTCTGCCTCACAAGTCAGGAATCGTCTCTCTTCTACTGCCACTTACCTGGGCTCATCTTTTTACTACGGCAAAGGCCTCATTAACGTGGAAGCCGCTGCTCAATAGAAGCTT。
OKer-His-Flag序列对应的重组蛋白全长共387个氨基酸(如SEQ ID NO.7所示),预测分子量为40.19kDa;预测翻译后分泌过程去除信号肽后共366个氨基酸,分子量为37.72kDa。全长氨基酸序列如下(其中:____为昆虫细胞信号序列;为8His-Flag标签序列):
MKFLVNVALVFMVVYISYIYAAQPAKNVEKDYIVGFKSGVKTASVKKDIIKESGGKVDKQFRIINAAKAKLDKEALKEVKNDPDVAYVEEDHVAHALAQTVPYGIPLIKADKVQAQGFKGANVKVAVLDTGIQASHPDLNVVGGASFVAGEAYNTDGNGHGTHVAGTVAALDNTTGVLGVAPSVSLYAVKVLNSSGSGSYSGIVSGIEWATTNGMDVINMSLGGASGSTAMKQAVDNAYARGVVVVAAAGNSGSSGNTNTIGYPAKYDSVIAVGAVDSNSNRASFSSVGAELEVMAPGAGVYSTYPTNTYATLNGTSMVSPHVAGAAALILSKHPNLSASQVRNRLSSTATYLGSSFYYGKGLINVEAAAQ
2、重组杆状病毒Bacmid DNA的制备
克隆载体pUC-OKer-His-Flag和杆状病毒供体载体pFastBac1经限制性内切酶BamHⅠ和HindⅢ双酶切,胶回收基因片段OKer-His-Flag和杆状病毒骨架载体,连接,转化E.coli DH5α感受态细胞,挑取单克隆,进行酶切、测序鉴定。经鉴定阳性的克隆子命名为pFastBac1-OKer-His-Flag(图2);将重组供体载体pFastBac1-OKer-His-Flag转化E.coli DH10Bac感受态细胞,以M13引物对(见表1)进行双向测序,鉴定阳性后,提取杆状病毒黏粒,即获得含有OKer-His-Flag基因序列的重组杆状病毒Bacmid DNA(图3)。
表1重组杆状病毒Bacmid DNA鉴定引物
3、重组杆状病毒的拯救
依照Invitrogen公司生产的货号为No.10362100的 II Reagent试剂盒说明书的方法,将重组杆状病毒Bacmid DNA转染至对数期昆虫细胞Sf9中,72h后取上清,收获重组杆状病毒;具体操作如下:
(1)在6孔板或35mm培养皿中接种Sf9昆虫细胞,27℃培养箱中培养至细胞汇合率大于80%;
(2)制备溶液A:将体积为5ul质量为1ug的Bacmid DNA加入100ul无血清、无双抗的SF900ⅡSFM培养基中,轻轻混匀;
(3)制备溶液B:将6ul Cellfection transfection reagent加入到100ul无血清、无双抗的SF900ⅡSFM培养基中,轻轻混匀;
(4)制备溶液C:将溶液A和溶液B混合,轻轻混匀,室温孵育15~45min;
(5)用无血清、无双抗的SF900ⅡSFM培养基清洗步骤(1)所获的细胞两次;
(6)将800ul无血清、无双抗的SF900ⅡSFM培养基加入到溶液C中,轻轻混匀,再将混合液加到步骤(5)所获的细胞中;置27℃培养箱培养5h;
(7)吸出培养液,加入含双抗和血清的SF900ⅡSFM培养基2ml;置27℃培养箱培养72h;
(8)收集细胞培养上清液,收获P1代重组杆状病毒;将P1代重组杆状病毒感染对数期昆虫细胞Sf9,待细胞出现病变后(图4为病变前,图5为病变后)收获P2代重组杆状病毒,P2代重组杆状病毒感染对数期昆虫细胞Sf9获得P3代重组杆状病毒,命名为rAcNPV-OKer-His-Flag。
实施例2
一种角蛋白酶表达体系的应用方法,具体包括如下步骤:
(1)将实施例1所获的重组杆状病毒rAcNPV-OKer-His-Flag感染对数期Sf9细胞,3~5d后收获细胞培养上清液;将细胞培养上清液在转速为12000rpm的条件下离心5min,取上清,用0.22um滤膜过滤,收集滤液;
(2)取1mlNi-NTA,用10倍柱床体积的Binding Buffer清洗、平衡柱子,流速为2ml/min;所述Binding Buffer包括如下各组分:50mM Tris、500Mm NaCl、质量比为0.1%Trion X-100、1mM DTT、质量比为5%的甘油;所述Binding Buffer的pH=8;
(3)将步骤(1)所获的滤液上柱,流速为1ml/min,反复上样2~4次;
(4)用10倍柱床体积的Wash Buffere清洗柱子,流速为2ml/min;所述Wash Buffere包括如下各组分:50mM Tris、500Mm NaCl、质量比为0.1%Trion X-100、1mM DTT、质量比为5%的甘油,20mM咪唑;所述Wash Buffere的pH=8;
(5)用Elution Buffer洗脱柱子,流速为1ml/min,收集洗脱液;所述Elution Buffer包括如下各组分:50mM Tris、300Mm NaCl、质量比10%的甘油、300mM咪唑;所述Elution Buffer的pH=8。
(6)透析步骤(5)收集的洗脱液,获得角蛋白酶。
验证实施例1
取实施例2步骤2所获得的滤液,通过SDS-PAGE电泳检测表达情况。结果显示,滤液电泳条带中出现明显的目的条带,大小约38kDa,与预测(37.72kDa)相符(见图6)。滤液(细胞培养上清)的重组蛋白经SDS-PAGE电泳后,以小鼠单克隆抗体anti-Flag(Sigma Cat.No.F1804)作为一抗进行Western blot检测。结果显示,重组杆状病毒感染的昆虫细胞培养上清中出现大小约38kDa的特异性条带(见图7,其中泳道1为含Flag tag的阳性对照;泳道2和3为感染后细胞培养上清)。这些结果均说明重组蛋白在昆虫细胞中表达,并分泌到细胞培养上清中。
验证实施例2
将实施例2所获得的角蛋白酶通过SDS-PAGE和Western blot进行检测,结果表明纯化获得重组的角蛋白酶(见图8和图9,图9中泳道1为含Flag tag的阳性对照;泳道2、3、4为纯化后蛋白)。表明纯化后获得蛋白质为角蛋白酶。
纯化的重组蛋白采用BAC法测定蛋白浓度后,以偶氮酪蛋白作为底物测定角蛋白酶酶活,具体操作如下:
(1)取10g偶氮蛋白加入至1600mL pH=7.4的磷酸缓冲液中,混匀;
(2)用移液枪量取3.2mL上述磷酸缓冲液于试管中,37℃水浴中预热2min;
(3)加入纯化的重组角蛋白酶0.8mL,在37℃水浴中保温反应15min;
(4)加入质量分数10%的三氯乙酸0.8mL,终止酶反应;
(5)反应液于10000r/min下离心6min,并在450nm下测定吸光值;
(6)空白对照:在反应液中先添加10%三氯乙酸0.8mL,再加酶液0.8mL,其余操作与试验组相同。
经测定,纯化的重组角蛋白酶酶比活为635U/mg,具有酶比活力高的特点,可应用于角蛋白物质的降解和再利用。角蛋白酶酶活定义为:每毫升酶液在规定条件下反应15min后OD值增加0.01为1个酶活单位(1U)。
对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!