一种可检测活细胞线粒体的铜离子生物探针及其制备方法与流程
本发明涉及单光子光学材料领域,具体地说涉及一种可检测活细胞线粒体的铜离子生物探针及其制备方法。
背景技术:
利用活细胞成像工作站进行细胞和基因的功能研究,是生物医学研究的最新趋势。固定细胞观察仅能提供固定瞬间细胞的静态信息,无法反映细胞在正常生理生化条件下的状态活细胞观察,对处于正常生理状况下的细胞进行全程扫描和记录,获得其连续、全面、动态过程。由于其显示的正常细胞动态的活动过程,很容易发现和确定细胞间相互作用和信号传导的过程,以及在活细胞水平上的生物分子间的相互作用,不仅可以解决长期以来悬而未解的问题,更为未来的研究提出新的问题,指出新的方向。
化学荧光探针在对客体的识别过程中展现出较好的选择性,因而,在环境监测、分子催化和生物荧光成像等领域展具有潜在的应用价值,受到广泛关注。化学荧光探针主要利用测试过程中发生的荧光信号变化(增强、减弱或发射波长位移等)对客体进行检测,具有成本低廉、操作简单、检测限低、灵敏性和选择性高等优点。活细胞成像技术正是利用这些荧光探针,比如小分子有机染料或者量子点来特异性的标记感兴趣的分子。
铜是人体内第三大过渡金属元素,铜与蛋白质结合生成的酶,参与氧处理过程,也可以作为催化剂促进人体机能的正常运行。低浓度的铜离子是人体内一个重要的微量营养素,高浓度的铜离子对人体却是有毒的,如果在大脑和肝脏积累大量过剩的铜离子,则会导致老年痴呆症、帕金森、朊病毒、门克斯和威尔逊氏病。因此,在生物环境中检测低浓度的铜离子是非常重要的。
线粒体是细胞的能量工厂,参与众多的新陈代谢过程,许多病理学过程均与它相关,是一种重要的细胞器,一直以来都是研究的热点。因此,利用荧光探针对线粒体的动态形态进行实时成像,能够为我们诊断、治疗疾病提供了重要的手段。
因此如果能研究出一种可检测活细胞线粒体的,且能裸眼识别铜离子的可检测活细胞线粒体的铜离子生物探针,将会对疾病的诊断、治疗具有重大的意义。
技术实现要素:
本发明所要解决的技术问题是提供一种可检测活细胞线粒体的铜离子生物探针及其制备方法,该生物探针具备低毒性和良好的光学性能,能够在细胞线粒体部位成像,并且对铜离子有可逆的探测能力。
为了解决上述技术问题,本发明采用如下技术方案:一种可检测活细胞线粒体的铜离子生物探针,其结构式如下:
本发明还提供上述可检测活细胞线粒体的铜离子生物探针的制备方法,包括以下步骤:
A、中间体I的制备
冰浴条件下,向N,N-二甲基甲酰胺中依次加入三氯氧磷和三苯胺,然后升温至40~70℃进行反应,反应结束后,在弱碱性溶液中析出固体,之后经过滤、提纯,得到中间体I;
B、中间体II的制备
将中间体I溶于甲醇中,然后加入NaBH4进行反应,反应结束后,加入水析出固体,之后经过滤、洗涤、干燥,得到中间体II;
C、中间体III的制备
将KI、PPh3、HAc、CHCl3和Aliquat336加入到中间体II中,然后在60~100℃的条件下进行反应,反应结束后,经旋干、重结晶,得到中间体III;
D、中间体IV的制备
N2保护下,将3-羟基-4-硝基苯甲醛、K2CO3、N,N-二甲基乙酰胺和Aliquat336加入到中间体III中,然后在100~160℃的条件下进行反应,反应结束后,经水洗、萃取、提纯,得到中间体IV;
E、中间体V的制备
N2保护下,将中间体IV溶于乙醇中,再加入Pd/C和水合肼,然后在50~80℃的条件下进行反应,反应结束后,经过滤、重结晶,得到中间体V;
F、中间体VI的制备
将中间体V溶于甲醇中,再加入2-吡啶甲醛和冰乙酸,然后在60~90℃的条件下进行反应,反应结束后,冷却析出固体,之后经过滤,得到中间体VI;
G、目标产物L的制备
将中间体VI溶于甲醇中,再加入硼氢化钠,然后在10~40℃的条件下进行反应,反应结束后,经过滤、洗涤、干燥,得到目标产物L,即为所述可检测活细胞线粒体的铜离子生物探针。
进一步地,所述三苯胺是以与氯仿配制成溶液的形式加入的。这样设计可以保证反应充分进行。
进一步地,步骤A中,N,N-二甲基甲酰胺、三氯氧磷和三苯胺的摩尔比为1:1:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
进一步地,步骤B中,中间体I和NaBH4的摩尔用量比为1:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
进一步地,步骤C中,中间体II、KI和PPh3的摩尔用量比为1:1:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
进一步地,步骤D中,中间体III、3-羟基-4-硝基苯甲醛和K2CO3的摩尔用量比为2:1:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
进一步地,步骤F中,中间体V和2-吡啶甲醛的摩尔用量比为1:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
进一步地,步骤G中,硼氢化钠和中间体VI的摩尔用量比为2:1。采用此摩尔比,可保证反应目标产物具有较高的产率、纯度。
本发明的有益效果体现在:
1.本发明可检测活细胞线粒体的铜离子生物探针在450nm左右具有良好的单光子荧光性质,能够裸眼识别铜离子;HepG2细胞被探针染色后,可清晰地观察到有机材料对HepG2细胞细胞质中的线粒体具有高的成像能力,并能可逆地检测线粒体中的铜离子,本发明生物探针对于有机染料的设计、制备和生命科学研究具有重大的意义。
2.本发明可检测活细胞线粒体的铜离子生物探针是一类具有细胞质中线粒体成像功能的单光子光学材料。对细胞无损伤,可用于活体细胞检测,具有明显的应用价值。
3.本发明以具有较高反应活性和良好生物相容性的三苯胺基团作为主体,简洁高效地制备了三苯胺硝基衍生物,通过甲酰化反应、成烯反应、还原反应、缩合反应等,得到可检测活细胞线粒体的铜离子生物探针。
4.本发明制备方法原料易得,成本低,合成步骤简单,易于操作。
附图说明
图1为本发明的制备方法路线图。
图2a是本发明可检测活细胞线粒体的铜离子生物探针在乙腈中加入金属离子的可见紫外吸收光谱图。
图2b是本发明可检测活细胞线粒体的铜离子生物探针在乙腈中加入金属离子的单光子荧光发射光谱图。
图3a-3c是本发明可检测活细胞线粒体的铜离子生物探针对HepG2细胞荧光共聚焦显微成像图,其中图3a是目标产物着色的HepG2细胞的荧光共聚焦显微照片;图3b是明场作用图;图3c是叠合的照片。
图4a是本发明可检测活细胞线粒体的铜离子生物探针与线粒体的商品染色剂Mito-Tracker对HepG2细胞荧光共聚焦显微成像。
图4b是本发明可检测活细胞线粒体的铜离子生物探针与线粒体的商品染色剂Mito-TrackerL间的共定位轮廓图。
具体实施方式
下面结合实施例对本发明作进一步描述:
实施例1
一种可检测活细胞线粒体的铜离子生物探针的制备方法,包括以下步骤:
A、中间体I的制备
冰水浴条件下,向250mL烧瓶中加入0.1mol N,N-二甲基甲酰胺,随后逐滴加入0.1mol三氯氧磷,继续搅拌,15min后瓶中液体变得粘稠,最后得到白色略带红色固体冻盐,将100ml含有0.1mol三苯胺的氯仿溶液加入上述烧瓶中,升温度至50℃,约30min至冻盐全溶,65℃下回流反应16h,薄层色谱法判定反应完全,然后旋蒸完氯仿,剩余物倒入1000mL冷水中,以碳酸钾调节pH值至弱碱性,有大量黄绿色固体析出,之后抽滤,旋干溶剂,残余物经色谱柱(洗脱剂是纯石油醚)分离提纯,得到7.81g淡黄色固体状的产物,即中间体Ⅰ,产率71.5%。
中间体Ⅰ的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.89(d,J=8.80Hz,2H),7.23(q,6H),7.42(t,J=7.80Hz,4H),7.72(d,J=8.80Hz,2H),9.771(s,1H)。
B、中间体II的制备
向圆底烧瓶中加入1.00g(3.66×10-3mol)中间体Ⅰ,用20mL甲醇溶解,室温下边搅拌边分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入3.66×10-3mol NaBH4,反应3h,薄层色谱跟踪反应完全,加入60mL水,大量絮状白色固体在溶液中析出,之后抽滤,加入大量水抽滤,干燥,得0.78g白色固体状的产物,即中间体II,产率77.5%。
中间体II的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.64(s,2H),5.65(s,1H),6.54-6.67(m,6H),6.85(t,J=8.00Hz,2H),7.12(d,J=8.00Hz,2H),7.31(t,J=8.00Hz,4H)。
C、中间体III的制备
将1.06g(3.85×10-3mol)中间体II,3.85×10-3mol KI,3.85×10-3mol PPh3,0.1mL HAc,20mL CHCl3及5mL的水加入150mL的圆底烧瓶中,搅拌溶解,再加入50μL Aliquat336,70℃下剧烈搅拌,70℃下回流反应72h,薄层色谱跟踪反应完全,旋干,得黄色油状物,之后用20m苯回流重结晶,得2.22g白色产物,即中间体III,产率88.9%。
中间体III的1H NMR:(DMSO-d6,400Hz),δ(ppm):3.54(S,2H),6.76-6.86(d,J=8.00,4H),6.97(d,J=8.00Hz,4H),7.06(d,J=8.00Hz,2H),7.24-7.31(m,4H),7.67-7.78(m,12H),7.89-7.93(m,3H)。
D、中间体IV的制备
N2保护下,向50mL三口烧瓶中加入20g(3.10×10-2mol)中间体III,1.55×10-2mol 3-羟基-4-硝基苯甲醛,1.55×10-2mol K2CO3,20mL N,N-二甲基乙酰胺及50μL Aliquat336,120℃下反16h,薄层色谱跟踪反应完全,加入500mL水洗,乙酸乙酯萃取,无水硫酸镁干燥,柱色谱(石油醚和乙酸乙酯=100:1为洗脱剂)分离提纯,得1.28g红色固体状的产物,即中间体IV,产率52.5%。
中间体IV的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.95(d,J=8.00Hz,2H),7.05-7.15(m,7H),7.24-7.40(m,7H),7.56(d,J=8.00Hz,2H),7.94(d,J=8.00Hz,1H),10.90(s,1H)。
E、中间体V的制备
N2保护下,向100mL三口烧瓶中加入0.1g(2.45×10-3mol)中间体IV,用30mL乙醇溶解,再加入0.018g Pd/C,0.5mL水合肼,55℃下反应1.5h,薄层色谱跟踪反应完全,过滤,旋干,乙醇重结晶,抽滤,得0.05g灰白色的产物,即中间体V,产率53.8%。
中间体V的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.75(s,2H),6.56(d,J=8.00Hz,1H),6.72-7.06(m,11H),7.28-7.32(m,5H),7.43(d,J=8.80Hz,2H),9.07(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ147.62,146.10,144.39,137.51,133.06,129.98,129.87,128.66,127.34,124.19,123.63,123.38,119.61,114.50,112.29;MALDI-TOF m/z:计算值,378.17;实验值381.20。
F、中间体VI的制备
称取0.1372g(3.6×10-4mol)中间体V溶解在15mL乙醇中,加入3.6×10-4mol吡啶-2-甲醛和50μL冰乙酸,75℃下回流反应4.5h,薄层色谱跟踪反应完全,冷却析出固体,抽滤,得到0.1375g棕黄色粉末状的产物,即中间体VI,产率81.7%。
中间体VI的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.96(d,J=8.00Hz,2H),7.03-7.19(m,10H),7.30-7.38(m,5H),7.51-7.53(m,3H),7.94(t,J=8.00Hz,1H),8.45(d,J=8.00Hz,1H),8.70(d,J=4.00Hz,1H),8.78(s,1H),9.29(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ158.25,154.66,151.99,149.44,146.93,146.76,137.78,136.70,135.62,131.29,129.54,128.01,127.66,126.48,125.22,124.12,123.66,123.24,122.96,121.51,119.74,118.10,113.63;MS(APCI)m/z:计算值,467.20;实验值,468.20。
G、目标产物L的制备
称取1g(2.6×10-3mol)中间体VI溶解在20mL乙醇中,分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入5.2×10-3mol硼氢化钠,35℃下搅拌1h,薄层色谱跟踪反应完全,抽滤,加入50mL水,抽滤,干燥,得0.084g淡黄色固体状的产物,即目标产物L,也即为所述可检测活细胞线粒体的铜离子生物探针,产率68.8%。
目标产物L的1H NMR(400MHz,DMSO-d6),δ(ppm):9.50(s,1H),8.55(J=4,d,1H),7.74(J=8,d,2H),7.42(J=8,d,2H),7.25-7.36(m,6H),6.72-7.06(m,12H),6.36(J=8,d,1H),5.80(J=4,t,1H),4.42(J=4,d,2H).13C NMR(100MHz,DMSO-d6),δ(ppm):159.13,148.79,147.09,145.67,144.25,137.19,136.60,132.54,129.47,128.04,126.87,125.46,123.71,123.63,122.89,122.56,122.00,121.23,119.38,110.61,109.73,48.12.MS(APCI):理论值469.22;实验值470.58。
实施例2
一种可检测活细胞线粒体的铜离子生物探针的制备方法,包括以下步骤:
A、中间体I的制备
冰水浴条件下,向250mL烧瓶中加入0.1mol N,N-二甲基甲酰胺,随后逐滴加入0.1mol三氯氧磷,继续搅拌,15min后瓶中液体变得粘稠,最后得到白色略带红色固体冻盐;将100ml含有0.1mol三苯胺的氯仿溶液加入上述烧瓶中,升温度至50℃,约30min至冻盐全溶,40℃下回流反应18h,薄层色谱法判定反应完全,然后旋蒸完氯仿,剩余物倒入1000mL冷水中,以碳酸钾调节pH值至弱碱性,有大量黄绿色固体析出,之后抽滤,旋干溶剂,残余物经色谱柱(洗脱剂是纯石油醚)分离提纯,得到7.60g淡黄色固体状的产物,即中间体Ⅰ,产率69.6%。
中间体Ⅰ的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.89(d,J=8.80Hz,2H),7.23(q,6H),7.42(t,J=7.80Hz,4H),7.72(d,J=8.80Hz,2H),9.771(s,1H)。
B、中间体II的制备
向圆底烧瓶中加入1.00g(3.66×10-3mol)中间体Ⅰ,用20mL甲醇溶解,室温下边搅拌边分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入3.66×10-3mol NaBH4,反应2h,薄层色谱跟踪反应完全,加入50mL水,大量絮状白色固体在溶液中析出,之后抽滤,加入大量水抽滤,干燥,得0.82g白色固体状的产物,即中间体II,产率81.5%。
中间体II的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.64(s,2H),5.65(s,1H),6.54-6.67(m,6H),6.85(t,J=8.00Hz,2H),7.12(d,J=8.00Hz,2H),7.31(t,J=8.00Hz,4H)。
C、中间体III的制备
将1.06g(3.85×10-3mol)中间体II,3.85×10-3mol KI,3.85×10-3mol PPh3,0.1mL HAc,20mL CHCl3及5mL的水加入150mL的圆底烧瓶中,搅拌溶解,再加入50μL Aliquat336,90℃下剧烈搅拌,100℃下回流反应48h,薄层色谱跟踪反应完全,旋干,得黄色油状物,之后用20m苯回流重结晶,得2.46g白色产物,即中间体III。
中间体III的1H NMR:(DMSO-d6,400Hz),δ(ppm):3.54(S,2H),6.76-6.86(d,J=8.00,4H),6.97(d,J=8.00Hz,4H),7.06(d,J=8.00Hz,2H),7.24-7.31(m,4H),7.67-7.78(m,12H),7.89-7.93(m,3H)。
D、中间体IV的制备
N2保护下,向50mL三口烧瓶中加入20g(3.10×10-2mol)中间体III,1.55×10-2mol 3-羟基-4-硝基苯甲醛,1.55×10-2mol K2CO3,20mL N,N-二甲基乙酰胺及50μL Aliquat336,100℃下反36h,薄层色谱跟踪反应完全,加入600mL水洗,乙酸乙酯萃取,无水硫酸镁干燥,柱色谱(石油醚和乙酸乙酯=100:1为洗脱剂)分离提纯,得1.40g红色固体状的产物,即中间体IV,产率57.4%。
中间体IV的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.95(d,J=8.00Hz,2H),7.05-7.15(m,7H),7.24-7.40(m,7H),7.56(d,J=8.00Hz,2H),7.94(d,J=8.00Hz,1H),10.90(s,1H)。
E、中间体V的制备
N2保护下,向100mL三口烧瓶中加入0.1g(2.45×10-3mol)中间体IV,用30mL乙醇溶解,再加入0.018g Pd/C,0.5mL水合肼,50℃下反应3h,薄层色谱跟踪反应完全,过滤,旋干,乙醇重结晶,抽滤,得0.055g灰白色的产物,即中间体V,产率59.2%。
中间体V的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.75(s,2H),6.56(d,J=8.00Hz,1H),6.72-7.06(m,11H),7.28-7.32(m,5H),7.43(d,J=8.80Hz,2H),9.07(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ147.62,146.10,144.39,137.51,133.06,129.98,129.87,128.66,127.34,124.19,123.63,123.38,119.61,114.50,112.29;MALDI-TOF m/z:计算值,378.17;实验值381.20。
F、中间体VI的制备
称取0.1372g(3.6×10-4mol)中间体V溶解在15mL乙醇中,加入3.6×10-4mol吡啶-2-甲醛和50μL冰乙酸,90℃下回流反应4h,薄层色谱跟踪反应完全,冷却析出固体,抽滤,得到0.1402g棕黄色粉末状的产物,即中间体VI,产率83.3%。
中间体VI的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.96(d,J=8.00Hz,2H),7.03-7.19(m,10H),7.30-7.38(m,5H),7.51-7.53(m,3H),7.94(t,J=8.00Hz,1H),8.45(d,J=8.00Hz,1H),8.70(d,J=4.00Hz,1H),8.78(s,1H),9.29(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ158.25,154.66,151.99,149.44,146.93,146.76,137.78,136.70,135.62,131.29,129.54,128.01,127.66,126.48,125.22,124.12,123.66,123.24,122.96,121.51,119.74,118.10,113.63;MS(APCI)m/z:计算值,467.20;实验值,468.20。
G、目标产物L的制备
称取1g(2.6×10-3mol)中间体VI溶解在20mL乙醇中,分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入5.2×10-3mol硼氢化钠,10℃下搅拌2h,薄层色谱跟踪反应完全,抽滤,加入50mL水,抽滤,干燥,得0.090g淡黄色固体状的产物,即目标产物L,也即为所述可检测活细胞线粒体的铜离子生物探针,产率73.7%。
目标产物L的1H NMR(400MHz,DMSO-d6),δ(ppm):9.50(s,1H),8.55(J=4,d,1H),7.74(J=8,d,2H),7.42(J=8,d,2H),7.25-7.36(m,6H),6.72-7.06(m,12H),6.36(J=8,d,1H),5.80(J=4,t,1H),4.42(J=4,d,2H).13C NMR(100MHz,DMSO-d6),δ(ppm):159.13,148.79,147.09,145.67,144.25,137.19,136.60,132.54,129.47,128.04,126.87,125.46,123.71,123.63,122.89,122.56,122.00,121.23,119.38,110.61,109.73,48.12.MS(APCI):理论值469.22;实验值470.58。
实施例3
一种可检测活细胞线粒体的铜离子生物探针的制备方法,包括以下步骤:
A、中间体I的制备
冰水浴条件下,向250mL烧瓶中加入0.1mol N,N-二甲基甲酰胺,随后逐滴加入0.1mol三氯氧磷,继续搅拌,15min后瓶中液体变得粘稠,最后得到白色略带红色固体冻盐;将100ml含有0.1mol三苯胺的氯仿溶液加入上述烧瓶中,升温度至50℃,约30min至冻盐全溶,70℃下回流反应14h,薄层色谱法判定反应完全,然后旋蒸完氯仿,剩余物倒入1000mL冷水中,以碳酸钾调节pH值至弱碱性,有大量黄绿色固体析出,之后抽滤,旋干溶剂,残余物经色谱柱(洗脱剂是纯石油醚)分离提纯,得到7.70g淡黄色固体状的产物,即中间体Ⅰ,产率70.5%。
中间体Ⅰ的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.89(d,J=8.80Hz,2H),7.23(q,6H),7.42(t,J=7.80Hz,4H),7.72(d,J=8.80Hz,2H),9.771(s,1H)。
B、中间体II的制备
向圆底烧瓶中加入1.00g(3.66×10-3mol)中间体Ⅰ,用20mL甲醇溶解,室温下边搅拌边分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入3.66×10-3mol NaBH4,反应4h,薄层色谱跟踪反应完全,加入100mL水,大量絮状白色固体在溶液中析出,之后抽滤,加入大量水抽滤,干燥,得0.74g白色固体状的产物,即中间体II,产率73.5%。
中间体II的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.64(s,2H),5.65(s,1H),6.54-6.67(m,6H),6.85(t,J=8.00Hz,2H),7.12(d,J=8.00Hz,2H),7.31(t,J=8.00Hz,4H)。
C、中间体III的制备
将1.06g(3.85×10-3mol)中间体II,3.85×10-3mol KI,3.85×10-3mol PPh3,0.1mL HAc,20mL CHCl3及5mL的水加入150mL的圆底烧瓶中,搅拌溶解,再加入50μL Aliquat336,65℃下剧烈搅拌,60℃下回流反应78h,薄层色谱跟踪反应完全,旋干,得黄色油状物,之后用20m苯回流重结晶,得2.34g白色产物,即中间体III
中间体III的1H NMR:(DMSO-d6,400Hz),δ(ppm):3.54(S,2H),6.76-6.86(d,J=8.00,4H),6.97(d,J=8.00Hz,4H),7.06(d,J=8.00Hz,2H),7.24-7.31(m,4H),7.67-7.78(m,12H),7.89-7.93(m,3H)。
D、中间体IV的制备
N2保护下,向50mL三口烧瓶中加入20g(3.10×10-2mol)中间体III,1.55×10-2mol 3-羟基-4-硝基苯甲醛,1.55×10-2mol K2CO3,20mL N,N-二甲基乙酰胺及50μL Aliquat336,160℃下反12h,薄层色谱跟踪反应完全,加入700mL水洗,乙酸乙酯萃取,无水硫酸镁干燥,柱色谱(石油醚和乙酸乙酯=100:1为洗脱剂)分离提纯,得1.31g红色固体状的产物,即中间体IV,产率53.7%。
中间体IV的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.95(d,J=8.00Hz,2H),7.05-7.15(m,7H),7.24-7.40(m,7H),7.56(d,J=8.00Hz,2H),7.94(d,J=8.00Hz,1H),10.90(s,1H)。
E、中间体V的制备
N2保护下,向100mL三口烧瓶中加入0.1g(2.45×10-3mol)中间体IV,用30mL乙醇溶解,再加入0.018g Pd/C,0.5mL水合肼,80℃下反应1h,薄层色谱跟踪反应完全,过滤,旋干,乙醇重结晶,抽滤,得0.045g灰白色的产物,即中间体V,产率48.4%。
中间体V的1H NMR:(DMSO-d6,400Hz),δ(ppm):4.75(s,2H),6.56(d,J=8.00Hz,1H),6.72-7.06(m,11H),7.28-7.32(m,5H),7.43(d,J=8.80Hz,2H),9.07(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ147.62,146.10,144.39,137.51,133.06,129.98,129.87,128.66,127.34,124.19,123.63,123.38,119.61,114.50,112.29;MALDI-TOF m/z:计算值,378.17;实验值381.20。
F、中间体VI的制备
称取0.1372g(3.6×10-4mol)中间体V溶解在15mL乙醇中,加入3.6×10-4mol吡啶-2-甲醛和50μL冰乙酸,60℃下回流反应6h,薄层色谱跟踪反应完全,冷却析出固体,抽滤,得到0.1298g棕黄色粉末状的产物,即中间体VI,产率77.12%。
中间体VI的1H NMR:(DMSO-d6,400Hz),δ(ppm):6.96(d,J=8.00Hz,2H),7.03-7.19(m,10H),7.30-7.38(m,5H),7.51-7.53(m,3H),7.94(t,J=8.00Hz,1H),8.45(d,J=8.00Hz,1H),8.70(d,J=4.00Hz,1H),8.78(s,1H),9.29(s,1H);13C NMR(100MHz,DMSO-d6,TMS,ppm):δ158.25,154.66,151.99,149.44,146.93,146.76,137.78,136.70,135.62,131.29,129.54,128.01,127.66,126.48,125.22,124.12,123.66,123.24,122.96,121.51,119.74,118.10,113.63;MS(APCI)m/z:计算值,467.20;实验值,468.20。
G、目标产物L的制备
称取1g(2.6×10-3mol)中间体VI溶解在20mL乙醇中,分批(等量分四次加入,间隔时间10~30min,越靠后,间隔时间越长)加入5.2×10-3mol硼氢化钠,40℃下搅拌0.5h,薄层色谱跟踪反应完全,抽滤,加入50mL水,抽滤,干燥,得0.081g淡黄色固体状的产物,即目标产物L,也即为所述可检测活细胞线粒体的铜离子生物探针,产率66.3%。
目标产物L的1H NMR(400MHz,DMSO-d6),δ(ppm):9.50(s,1H),8.55(J=4,d,1H),7.74(J=8,d,2H),7.42(J=8,d,2H),7.25-7.36(m,6H),6.72-7.06(m,12H),6.36(J=8,d,1H),5.80(J=4,t,1H),4.42(J=4,d,2H).13C NMR(100MHz,DMSO-d6),δ(ppm):159.13,148.79,147.09,145.67,144.25,137.19,136.60,132.54,129.47,128.04,126.87,125.46,123.71,123.63,122.89,122.56,122.00,121.23,119.38,110.61,109.73,48.12.MS(APCI):理论值469.22;实验值470.58。
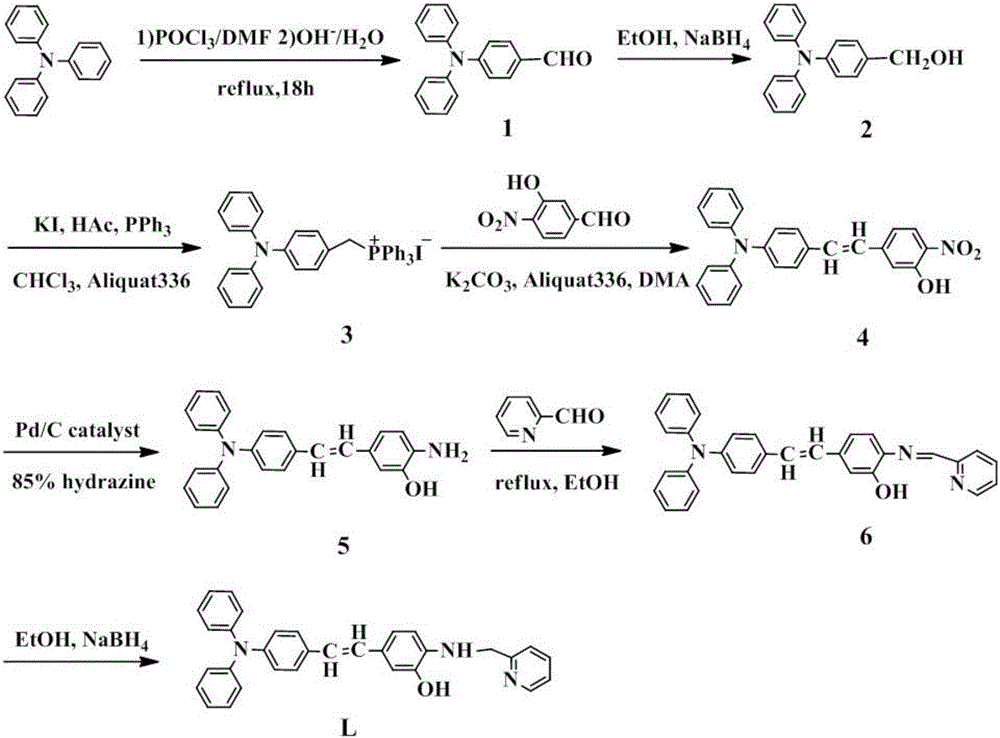
请参见图1,实施例1-3以三苯胺为母体通过Vilsmeier-Haack反应进行三苯胺甲酰化(中间体I),还原成醇(中间体II)、进而形成膦盐(中间体Ⅲ),再通过成烯反应制备出5-(4-(二苯胺)苯乙烯)-2-硝基苯酚(中间体Ⅳ),5-(4-(二苯胺)苯乙烯)-2-硝基苯酚在Pd/C,水合肼作用下还原得到的5-(4-(二苯胺)苯乙烯)-2-氨基苯酚(中间体Ⅴ),接着与2-吡啶甲醛通过简单的缩合反应得到席夫碱(中间体VI),席夫碱在硼氢化钠的作用下还原为乙烯基桥联三苯胺苯酚基胺类衍生物探针(目标产物L),也即可检测活细胞线粒体的铜离子生物探针。实施例4
目标产物L对铜离子的识别
选择性行为是荧光探针的最重要的特征之一。如图2a、图2b所示,当用370nm激发时,荧光强度是强的。当加入和目标产物L相等量的广泛的环境和生理上重要的金属离子,如:Cu2+,Hg2+,Zn2+,Ni2+,Mg2+,Pb2+,Ca2+,Cd2+,Ag+,Fe3+,Al3+,Mn2+,Co2+,Cr3+,Li+,K+,Na+,La+,Ba2+时,室温下,加入铜离子的目标产物L在溶液(四氢呋喃:水,1:1)中的荧光强度下降40倍,其他金属离子的加入没有引起明显的荧光强度改变。干扰试验显示,其它各种金属离子的存在不干扰目标产物L对铜离子识别。我们运用铜离子螯合剂半胱氨酸(L-Cysteine)检测了目标产物L在溶液(四氢呋喃:水,1:1)中识别Cu2+的可逆性,结果显示目标产物L具有良好的可循环的识别能力。
实施例5
目标产物L单光子细胞显影效果的测试
将清洗干净且灭菌的盖玻片放入6孔组织培养板中,肝癌组织细胞(HepG2细胞)5×105个/孔的密度接种在直径35mm的6孔板培养皿中,并用DMEM作为细胞培养基进行细胞培养,细胞培养基中含有胎牛血清(10%)、青霉素(100μg/mL)和链霉素(100ug/mL)。细胞培养皿置于含5%CO2和95%O2的培养箱中维持温度37℃进行细胞培养24h,用PBS(磷酸缓冲液,pH=7.4,Gibco试剂公司生产)洗涤HepG2细胞三次,洗去培养基。然后分别加入4μL目标化合物A或B的DMSO溶液(1mM),培养0.5h,用PBS缓冲溶液(pH=7.4)冲洗盖玻片6~7次,滴1mL 4%多聚甲醛/PBS溶液固定细胞10min,蒸馏水冲洗盖玻片6~7次。将盖玻片卡在洁净载玻片上,置于激光共聚焦显微镜(LSM-710,Zeiss,德国)下观察细胞形态及荧光摄取情况,结果见图3a-3c和图4a-4b。
从图3a-3c和图4a-4b可以清楚地看到,目标产物L均透过HepG2细胞的细胞膜,进入细胞质中的线粒体中,并对它完全均匀的着色,对目标产物的摄取率很高,说明目标产物对HepG2的线粒体具有很高的识别能力。这种有机材料的制备对于细胞显影材料的遴选、制备、对于生命科学、材料科学等方面都有着重要的意义。
应当理解本文所述的例子和实施方式仅为了说明,本领域技术人员可根据它做出各种修改或变化,在不脱离本发明精神实质的情况下,都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!