一种人尿液复合阳离子抗菌肽的制备方法与流程
本发明属于生物化学、生物技术、生物制品领域,具体涉及一种人尿液复合阳离子抗菌肽的制备方法。
背景技术:
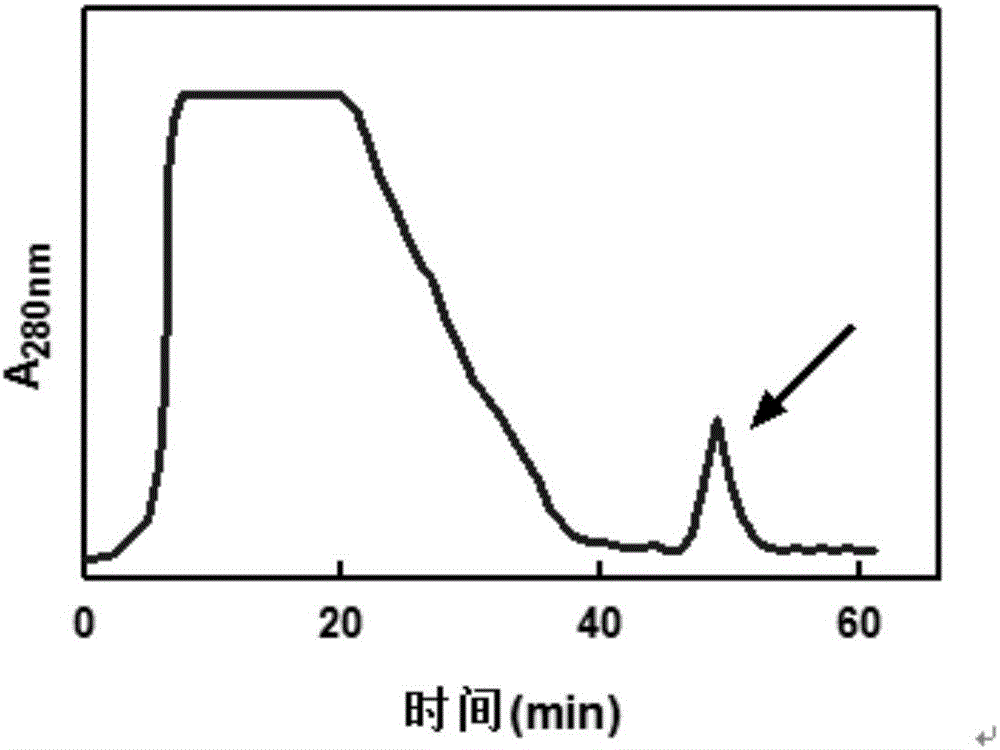
:抗菌肽或类似抗菌肽的小分子阳离子肽类广泛存在于生物界,包括细菌、动植物和人类。这种内源性的抗菌肽一般经诱导合成,在机体抵抗病原体的入侵方面起着重要的作用,更被认为是缺乏特异性免疫功能的低等生物的重要防御成分。抗菌肽一般由20-60个氨基酸残基组成,分子量在2000-7000Da左右,这类活性多肽多数具有强碱性、热稳定性以及广谱抗菌等特点。大多数对革兰氏阳性菌有较强的杀灭作用,有些则对革兰氏阴性菌和革兰氏阳性菌均起作用。抗菌肽还对某些真菌、原生动物,尤其对耐药性细菌有杀灭作用,并能选择杀伤肿瘤细胞,抑制病毒复制。因此,抗菌肽极具药用开发前景。迄今为止从不同生物体内分离得到的抗菌肽已不下200种,主要集中在昆虫方面的研究,仅从昆虫体内分离获得到的就多达170余种。异源抗菌肽具有免疫原性,限制了其在人体内的相关试验研究。相对于昆虫抗菌肽,人源抗菌肽的相关研究报道较少。健康成人尿液作为传统生化制药原料,已有很长的一段历史。包括尿激酶、尿胰蛋白酶抑制剂、尿激肽原酶等来源于人尿的供注射用的天然蛋白类药物已广泛应用于临床,其安全性及有效性已得到广泛证实。以往小分子肽类的常规分离手段主要是采用有机溶液、有机酸抽提或低浓度乙酸溶液浸提得到粗品,多种色谱方法组合(分子筛、离子交换、疏水层析等)进行分离,甚至采用反相高效液相色谱法进行精细纯化,整个分离纯化过程中需要进行抗菌活性跟踪测定。柱层析分离法制备抗菌肽,处理液体量有限,并不适合大规模放大。而且经多步层析分离,收率不高,低丰度的抗菌肽类往往丢失,最终一般仅能分离得到高丰度的抗菌肽。近年来,超滤法(又称切向流过滤)替代分子筛层析,在复合抗菌肽的分离中应用较多。相比分子筛层析,超滤法处理液体量大,工作效率大大提高,适合于放大生产。但单纯依靠超滤法进行分子量分级,最终制备的复合抗菌肽纯度不高,尤其是以一些昆虫体酶解液为原料时,仅凭超滤法纯化往往混杂有小分子无抗菌活性的水解肽类。技术实现要素:本发明的目的是提供一种人尿液复合阳离子抗菌肽的制备方法。本发明提供了一种制备抗菌物质的方法,包括如下步骤:(a1)取原料,采用1kDa截留分子量的超滤膜包依次进行浓缩和透析,收集截留液;所述原料为原料甲或原料乙;所述原料甲为人尿液;所述原料乙为将人尿液过滤收集的滤液;(a2)取步骤(a1)得到的截留液,采用nkDa截留分子量的超滤膜包依次进行浓缩和透析,收集透过液;n为30-50之间的数字;(a3)取步骤(a2)得到的透过液,进行弱阳离子交换层析,收集pH7.5条件下带正电的组分。本发明还保护一种制备抗菌物质的方法,包括如下步骤:(b1)取原料,采用1kDa截留分子量的超滤膜包依次进行浓缩和透析,收集截留液;所述原料为原料甲或原料乙;所述原料甲为人尿液;所述原料乙为将人尿液过滤收集的滤液;(b2)取步骤(b1)得到的截留液,采用nkDa截留分子量的超滤膜包依次进行浓缩和透析,收集透过液;n为30-50之间的数字;(b3)取步骤(b2)得到的透过液,进行弱阳离子交换层析,收集等电点为8.5以上的组分。以上任一所述方法中,n具体可为30或50。本发明还保护一种制备抗菌物质的方法,包括如下步骤:(c1)从人尿液中收集分子量为1kDa-50kDa的组分;(c2)从步骤(c1)得到的物质中收集等电点为8.5以上的组分。本发明还保护一种制备抗菌物质的方法,包括如下步骤:(d1)从人尿液中收集分子量为1kDa-50kDa的组分;(d2)从步骤(d1)得到的物质中收集pH7.5条件下带正电的组分。以上任一所述方法中,所述“从人尿液中收集分子量为1kDa-50kDa的组分”是通过步骤(e1)和(e2)实现的。所述步骤(e1)为:取原料,采用1kDa截留分子量的超滤膜包依次进行浓缩和透析,收集截留液;所述原料为原料甲或原料乙;所述原料甲为人尿液;所述原料乙为将人尿液过滤收集的滤液。所述步骤(e2)为:取步骤(e1)得到的截留液,采用50kDa截留分子量的超滤膜包依次进行浓缩和透析,收集透过液。所述“从步骤(c1)得到的物质中收集等电点为8.5以上的组分”或“从步骤(d1)得到的物质中收集pH7.5条件下带正电的组分”是通过步骤(e3)实现的。所述步骤(e3)为:将步骤(c1)或步骤(d1)收集的组分进行弱阳离子交换层析。以上任一所述方法中,所述过滤是采用孔径为100μm的滤纸或孔径为0.22μm的滤膜或孔径为0.45μm的滤膜。以上任一所述方法中,所述透析使用的透析液为pH7.5、10mmol/L的磷酸盐缓冲液。以上任一所述方法中,所述弱阳离子交换层析的洗脱液为乙酸体积百分含量为5%的乙酸水溶液。以上任一所述方法中,所述弱阳离子交换层析的填充介质为CMSepharoseFastFlow。以上任一所述方法中,所述弱阳离子交换层析的步骤为:将所述步骤(a2)得到的透过液或步骤(b2)得到的透过液或步骤(e2)得到的透过液上样,然后用磷酸盐缓冲液进行洗涤,然后采用乙酸体积百分含量为5%的乙酸水溶液洗脱,通过监测A280nm收集洗脱峰。所述磷酸盐缓冲液为10mmol/LpH7.5的磷酸盐缓冲液。所述洗涤采用5倍柱体积磷酸盐缓冲液。以上任一所述方法中,所述弱阳离子交换层析的步骤为:以10mL/min的流速上样所述步骤(a2)或步骤(b2)或步骤(e2)得到的透过液;上样结束后,用5倍柱体积的10mmol/LpH7.5磷酸盐缓冲液进行清洗,至流出液A280nm接近基线水平;然后采用乙酸体积百分含量为5%的乙酸水溶液洗脱,监测流出液A280nm,收集洗脱峰。所述弱阳离子交换层析的步骤具体为:先用10mmol/LpH7.5的磷酸盐缓冲液平衡柱子至pH稳定,然后以10mL/min的流速上样所述步骤(a2)或步骤(b2)或步骤(e2)得到的透过液;上样结束后,用5倍柱体积的10mmol/LpH7.5磷酸盐缓冲液进行清洗,至流出液A280nm接近基线水平;采用乙酸体积百分含量为5%的乙酸水溶液洗脱吸附组分,监测流出液A280nm,收集洗脱峰。所述洗脱峰对应的保留时间为40-60min。以上任一所述方法中,所述人尿液、所述截留液和所述透过液的体积比为50∶1∶10。以上任一所述方法中,所述步骤(a3)或步骤(b3)或步骤(c2)或步骤(d2)后还包括将收集的组分进行冷冻干燥,得到抗菌物质。本发明还保护利用以上任一所述的方法制备得到的产品。本发明还保护所述产品的应用,为如下(1)或(2):(1)作为抑菌产品;(2)制备抑菌产品。以上任一所述抗菌物质或抑菌产品针对的微生物为细菌。所述细菌具体可为大肠杆菌。人尿液有望成为人源抗菌肽的理想原料来源,主要是基于以下两方面原因。一方面,健康人群中尿路感染并不常见,正常成人尿液是无菌的,这与泌尿系统完善的固有免疫相关,其中就有尿路上皮细胞可分泌各类组成型和诱导型抗菌肽有关。另一方面,尿液蛋白质主要来源于人血浆蛋白质通过肾小球滤过。理论上,分子量小于5500Da的物质可自由通过肾小球滤过,随着分子量提高,滤过率降低,血红蛋白分子量为64500Da,滤过率仅有3%。研究表明,肾小球滤过膜除对分子大小具有选择性,对电荷同样有选择性,正电荷分子更易滤过。上述肾小球滤过分子的选择性均符合阳离子抗菌肽的生化特性,所以,人尿液集合了血浆和泌尿系统两种来源的抗菌肽类,有望成为人源抗菌肽的新来源。本发明提供的方法工艺简单、成本低廉、不涉及有害溶剂,采用超滤法将人尿蛋白进行分子量分级,大分子量尿蛋白组分是传统尿活性蛋白,如白蛋白、尿激酶、尿胰蛋白酶抑制剂等的理想原料来源,而抗菌肽存在于小分子组分中。利用抗菌肽富含碱性氨基酸,在中性偏碱的条件下带正电荷的这一生化特性,采用弱阳离子交换柱层析在上样环节即选择性吸附阳离子抗菌肽,达到纯化的目的。制备工艺针对抗菌肽的生化特性,采用两种不同原理的分离手段相结合,最终制备纯度较高的人源复合阳离子抗菌肽。本发明对于抗菌肽的研制具有重要意义。附图说明图1为实施例1中各步分离组分SDS-PAGE电泳图谱。图2为实施例1中弱阳离子交换层析图谱。图3为实施例1中各步分离组分HPLC检测图谱。图4为实施例2中各步分离组分抗菌检测结果。图5为实施例2中抗菌肽等电聚焦电泳图谱。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。大肠杆菌BL21(DE3):Novagen公司,产品目录号:69450。1kDa截留分子量的超滤膜包:Millipore公司,产品目录号:P2PLACC05。50kDa截留分子量的超滤膜包:Millipore公司,产品目录号:P2B050A01。30kDa截留分子量的超滤膜包:Millipore公司,产品目录号:P2B030A01。实施例1、抗菌肽的制备1、取50L尿液(收集自50位健康成年男性,均为8h内采集的新鲜尿液),采用布氏漏斗减压抽滤(滤纸孔径为100μm),收集滤液。2、取全部步骤1得到的滤液,采用1kDa截留分子量的超滤膜包依次进行50倍浓缩和透析(采用5LpH7.5、10mmol/L的磷酸盐缓冲液作为透析液;透析的目的是除去色素、尿素等杂质),收集截留液(理论上含有全尿蛋白),得到1L截留液。相关参数:MilliporePellicon超滤系统,0.5m21kDa截留分子量的超滤膜包,进口压力25-30Psi,循环口压力10-15Psi,压力差维持在15Psi以上。3、取全部步骤2得到的截留液,采用50kDa截留分子量的超滤膜包依次进行浓缩和透析(采用10LpH7.5、10mmol/L的磷酸盐缓冲液作为透析液),分别收集截留液(理论上含有分子量为50kDa以上的尿蛋白)和透过液(理论上含有分子量小于50kDa的尿蛋白),得到10L透过液。相关参数:MilliporePellicon超滤系统,0.1m250kDa截留分子量的超滤膜包,进口压力25-30Psi,循环口压力10-15Psi,压力差维持在15Psi以上。4、分别取步骤2得到的截留液、步骤3得到的截留液和步骤3得到的透过液,进行15%SDS-PAGE,结果如图1所示。图1中,泳道1为蛋白marker,泳道2为步骤2得到的截留液,蛋白条带较多且分子量分布很宽,泳道3为步骤3得到的截留液,泳道4为步骤3得到的透过液,蛋白分子量集中在20kDa以下(见箭头指示)。5、取全部步骤3得到的透过液,进行弱阳离子交换层析。弱阳离子交换层析的相关参数:填充介质为CMSepharoseFastFlow,柱子直径为2.6cm,柱床体积为50mL;监测A280nm值;第0min时,先用pH7.5、10mmol/L的磷酸盐缓冲液平衡柱子至pH稳定,然后以10mL/min的流速上样步骤3得到的透过液,然后用5倍柱体积的pH7.5、10mmol/L磷酸盐缓冲液洗涤直至A280nm接近基线水平,然后用5%(体积分数)乙酸水溶液洗脱,收集洗脱峰(洗脱峰对应的保留时间为40-60min)对应的过柱后溶液,弱阳离子交换层析谱图如图2所示。6、分别取步骤3得到的透过液和步骤5得到的洗脱峰对应的过柱后溶液,进行凝胶过滤HPLC检测。凝胶过滤HPLC检测的相关参数:色谱柱为TosohTSKG2000SWxl分析柱,规格为7.8mm(ID)×30cm(L);上样体积为20μL,检测波长为280nm;流动相为含300mmol/LNaCl和25mmol/LPBS的缓冲液(pH7.0),流速为0.5mL/min。检测结果如图3所示。图3中,图3A为步骤3得到的透过液组分,呈多峰分布,图3B为CMSepharoseFastFlow吸附组分,即5%(体积分数)乙酸水溶液洗脱组分,分子量很小且分布非常均一,呈单一峰,与抗菌肽特征相符;图3C为图3A和图3B两图的叠加。7、将步骤5得到的洗脱组分进行冷冻干燥,得到干粉203mg。干粉即为目的产物,抗菌物质I(又称为复合阳离子抗菌肽I)。8、取50L尿液(收集自50位健康成年男性,均为8h内采集的新鲜尿液),采用0.22μm的滤膜过滤,收集滤液。采用30kDa截留分子量的超滤膜包替代50kDa截留分子量的超滤膜包,将滤液按照步骤2-5的方法处理,得到抗菌物质II(又称为复合阳离子抗菌肽II)200mg。实施例2、抗菌肽的检测1、以大肠杆菌BL21(DE3)作为测定菌株,琼脂糖扩散法测定各步纯化组分的抗菌活性。1号样品:实施例1步骤2得到的截留液样品。2号样品:实施例1步骤3得到的透过液样品。3号样品:实施例1步骤3得到的截留液样品。4号样品:实施例1步骤7得到的抗菌肽样品。5号样品:实施例1步骤8得到的抗菌肽样品。具体步骤如下:(1)将大肠杆菌BL21(DE3)接种至LB液体培养基中,37℃、250rpm振荡培养12小时,得到菌浓度为2×109CFU/mL的菌液。(2)将LB固体培养基加热至融化,放置到瓶体不烫手(温度在45℃左右),取100μL步骤(1)得到的菌液接种至20mL的LB固体培养基中,室温放置至平板凝固,打孔。(3)将1-5号样本用1kDa透析袋进行透析(pH7.5、10mmol/L的磷酸盐缓冲液),完成溶液置换,收集透析液。(4)采用pH7.5、10mmol/L的磷酸盐缓冲液将步骤(3)收集的1-5号样本透析液稀释为各稀释液,各稀释液中的蛋白质浓度见表1。(5)向步骤(2)的平板中加入步骤(4)的各稀释液(每孔20μL)。(6)将步骤(5)的平板37℃培养12h,并测量抑菌圈直径,结果见表1和图4。表11-5号样品的稀释液浓度及抑菌圈直径测量结果样本编号稀释液中的蛋白质浓度抑菌圈直径1号300μg/ml2.5cm2号10μg/ml1.8cm3号260μg/ml0cm4号5μg/ml2.2cm5号5μg/ml2.2cm结果表明,全尿蛋白(1号样品)具有明显抗菌活性,经50kDa超滤按分子量范围对全尿蛋白进行分级分离后,抗菌活性主要集中在小分子尿蛋白组分(2号样品),而大分子尿蛋白组分(3号样品)并没有观察到抑菌圈。经弱阳离子交换层析捕获得到的阳离子肽类(4号样品和5号样品)则表现出了强抗菌活性。2、等电聚集电泳对实施例1步骤7得到的抗菌物质I和步骤8得到的抗菌物质II的等电点进行分析,采用两性电解质Ampholite3-10范围。结果如图5所示。图5为抗菌物质I的分析结果。结果表明,抗菌物质I的等电点按照两性电解质pH分布,由阴极至阳极pH值由10.0到3.0逐渐降低。与预期结果相符,尿来源抗菌肽基本是由碱性多肽组成,条带均位于碱性区域。抗菌物质II的等电点分析结果与抗菌物质I的分析结果相同。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1