一种醋酸菌液态浅层循环培养装置及高密度快培方法与流程
本发明涉及一种液态浅层循环的醋酸菌高密度快培装置及方法。
背景技术:
醋酸菌(Acetic acid bacteria)革兰氏阴性的严格需氧菌,主要生活在含糖、酸或醇的原料中,在显微镜下观察到醋酸菌细胞多为短杆棒状,单个,大部分成对无芽胞,大小为0.6~1.0μm×1.7~1.9μm。
醋酸菌作为食品工业中最常使用的微生物之一,它不仅在谷物醋的酿造过程中起关键作用,同时被运用于水果醋的酿造、多糖薄膜的制备、同聚纤维素产品的开发等等多种用途。传统醋酸菌培养工艺分为固态培养与液态培养,其中液态培养分为:表面静态培养、摇床振荡培养、发酵罐搅拌培养。固态培养的缺点是营养物质无法充分使用,醋酸菌仅仅利用了表面部分的营养物质,深层的营养物质最终将丢弃,造成浪费,并且在固态培养的过程中将投入大量的人力物力。液态培养中表面静态培养的缺点是醋酸菌容易形成醋膜,悬浮在液体表面,对氧气进入液体造成阻碍,使得仅有少量的醋酸菌悬浮在醋液表面的醋膜中,同时部分营养物质被用于形成醋膜而导致额外的浪费。现有工厂醋酸菌生产中,多以液态摇床振荡培养与液态发酵罐搅拌培养为主,主要因其技术要求低,并且人力使用低于传统固态培养与液态表面静置培养。但由于醋酸菌的生存与生长必须依靠氧气,并且其不耐强酸的特性导致在现有条件下难以大批量地生产。
技术实现要素:
本发明所要解决的技术问题在于克服传统醋酸菌培养存在的营养物质使用不充分与醋酸菌产量低下的问题,提供一种结构简单,能够大量、快速、自动化培养醋酸菌的醋酸菌液态浅层循环培养装置,以及采用该装置高密度快培醋酸菌的方法。
解决上述技术问题所采用的技术方案是:生长培养基储存罐通过管道经单向流加泵与培养槽的顶部相联通,所述的培养槽由至少4个上表面开口的矩形槽叠放而成,每个矩形槽的底部设置有出液管,相邻矩形槽上的出液管交错设置,培养槽底部的出液管通过管道与加热槽相联通,加热槽下部的一个出口通过管道经双向流加泵与菌悬液回收罐相连通、另一个出口通过管道经恒流泵与培养槽的顶部相连通,加热槽上部的入口通过管道经双向流加泵与补充培养基储存罐相连通。
上述矩形槽的长为60~160cm、宽为5~25cm、高为1~4cm,优选矩形槽的长为100cm、宽为15cm、高为1~4cm。
上述出液管1的直径优选为1.0~2.0cm、高度优选为3~6mm。
上述培养槽优选由4~12个上表面开口的矩形槽2叠放而成。
采用上述装置高密度快培醋酸菌的方法由下述步骤组成:
1、醋酸菌菌株的培养
将汉氏葡萄糖醋杆菌Gluconacetobacter hansenii活化培养后的菌株接种于驯化培养基中30±1℃驯化培养48小时,其中驯化培养基是向每100mL蒸馏水中加入2~6g葡萄糖、0.5~2g酵母提取物、0.5~2g大豆蛋白粉、0.1~0.5g丙氨酸、0.005~0.015g醋酸钠、0.001~0.01g辅酶Q10、0.001~0.01g叶酸,灭菌后加入1~5mL无水乙醇和0.5~3mL冰乙酸制成;再按上述方法重复驯化培养2~8次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加0.5~3mL,且驯化培养基中每100mL蒸馏水加入的冰乙酸总量不超过10mL;驯化培养完后分离出优势醋酸菌进行一级扩大培养和二级扩大培养。
2、装置消毒
在密闭条件下,将醋酸菌液态浅层循环培养装置用质量分数为95%的冰醋酸水溶液熏蒸24小时,同时使用55W紫外灭菌灯辐照2小时,每立方米密闭空间里质量分数为95%的冰醋酸水溶液的使用量为100~200mL。
3、醋酸菌液态浅层循环培养
在无菌条件下,将生长培养基储存罐内接有步骤1二级扩大培养后的菌悬液的浅层生长培养基通过单向流加泵泵入培养槽最上面一层矩形槽内,待培养液逐级向下充满矩形槽且从最底部矩形槽的出液管流入加热槽的培养液高于加热槽下部的两个出口后,关闭单向流加泵,开启加热槽加热培养液使其维持在30±2℃,并开启恒流泵使加热槽和培养槽内的培养液循环流动;培养42~54小时后,开启双向流加泵,向加热槽内泵入补充培养基储存罐中的补充培养基,培养66~78小时后,将双向流加泵的流速加倍;从加热槽泵出的菌悬液流入菌悬液回收罐内。
上述的浅层生长培养基是向每100mL蒸馏水中加入4~12g葡萄糖、1~4g酵母提取物、1~5g大豆蛋白粉、0.5~1g丙氨酸、0.001~0.01g辅酶Q10、0.005~0.02g醋酸钠、0.001~0.01g叶酸,灭菌后再加入1.0~5.5mL体积分数为95%的食用酒精和0.5~3mL冰乙酸制成;所述的补充培养基是向每100mL蒸馏水中加入1~5g葡萄糖、0.1~3.0g酵母提取物、0.1~3.0g大豆蛋白粉、1~7g无水碳酸钠,灭菌后再加入2.0~5.5mL体积分数为95%的食用酒精制成。
4、制备醋酸菌粉
培养90~102小时后,关闭加热槽、恒流泵、双向流加泵,将培养槽内的菌悬液倒入菌悬液回收罐内,然后将食品级脱脂奶粉与菌悬液回收罐内的菌悬液按质量-体积比为0.5~3g:10mL混合,经均质、预冷冻、真空冷冻干燥,得到醋酸菌粉成品。
上述步骤1中,优选驯化培养基是向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3g丙氨酸、0.01g醋酸钠、0.003g辅酶Q10、0.003g叶酸,灭菌后加入2mL无水乙醇和1mL冰乙酸制成;再重复驯化培养4次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加1mL。
上述步骤3中,优选浅层生长培养基是向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸、0.01g醋酸钠、0.005g辅酶Q10、0.005g叶酸,灭菌后再加入2.10mL体积分数为95%的食用酒精和1mL冰乙酸制成;优选补充培养基是向每100mL蒸馏水中加入2g葡萄糖、1g酵母提取物、1g大豆蛋白粉、5g无水碳酸钠,灭菌后再加入3.2mL体积分数为95%的食用酒精制成。
上述步骤3中,进一步优选补充培养基的泵入总体积为浅层生长培养基总体积的20%~40%,优选恒流泵的流速为60~120L/h、双向流加泵的流速为10~60mL/h。
本发明装置相对于现有工厂醋酸菌生产中使用的大型摇床与液态发酵罐,结构简单、成本低、能耗低,能够大量、快速、自动化培养醋酸菌。采用本发明装置培养醋酸菌,相比于固态培养,本发明在人力的投入量上实现了巨大的减少并可实现自动化培养;相对于固体培养时醋酸菌只能使用表面培养物质的情况,本发明使用循环培养方式,提高了培养物质的使用率。相比于液态表面静态培养,本发明大大增加了培养面积,保证了醋酸菌生长过程中所需的正常溶氧量以及菌体生长平面空间,提高了液体培养醋酸菌的浓度,最终实现短时高效节源的醋酸菌高密度液态培养,而且对醋酸菌进行高密度培养后可从醋酸菌细胞膜中提取乙醇脱氢酶、乙醛脱氢酶、辅酶Q10、辅酶Q9等多种功能性物质,并且能提高各物质的提取效率。相对于现有工厂醋酸菌生产中液态摇床振荡培养与液态发酵罐搅拌培养方法,本发明方法简单易行,可在现有工厂中轻易实现。
附图说明
图1是醋酸菌液态浅层循环培养装置的结构示意图。
图2是液态摇床振荡培养菌株醋酸菌N-9的扫描电子显微镜图。
图3是液态浅层循环培养醋酸菌菌株N-9的扫描电子显微镜图。
图4是液态发酵罐搅拌培养醋酸菌菌株N-9的扫描电子显微镜图。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
如图1所示,本实施例的醋酸菌液态浅层循环培养装置由出液管1、矩形槽2、生长培养基储存罐3、单向流加泵4、恒流泵5、加热槽6、双向流加泵7、菌悬液回收罐8、补充培养基储存罐9组成。
生长培养基储存罐3通过管道经单向流加泵4与培养槽的顶部相联通,所述的培养槽由4个上表面开口的矩形槽2叠放而成,矩形槽2的长为100cm、宽为15cm、高为4cm,材质为亚克力板。每个矩形槽2的底部加工有出液管1,且相邻矩形槽2上的出液管1交错排列。出液管1的直径为1.0cm、高度为4mm,通过出液管1的高度可控制液面厚度。培养槽底部的出液管1通过管道与加热槽6相联通,加热槽6下部的一个出口通过管道经双向流加泵7与菌悬液回收罐8相连通、另一个出口通过管道经恒流泵5与培养槽的顶部相连通,加热槽6上部的入口通过管道经双向流加泵7与补充培养基储存罐9相连通。
采用上述装置高密度快培醋酸菌的方法由下述步骤组成:
1、醋酸菌菌株的培养
将汉氏葡萄糖醋杆菌Gluconacetobacter hansenii(购于中国普通微生物菌种保藏管理中心,菌株编号为1.1811)接种于活化培养基中进行平皿固体活化培养,活化培养基是向每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、2.0g CaCO3、1.5g琼脂灭菌后制成,培养时间为48h,培养温度为30±1℃。将活化培养后的菌株接种于驯化培养基中,在30±1℃下驯化培养48h,其中驯化培养基是向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3g丙氨酸、0.01g醋酸钠、0.003g辅酶Q10、0.003g叶酸,灭菌后加入2mL无水乙醇和1mL冰乙酸制成。再按上述方法重复驯化培养4次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加1mL。驯化培养完后分离出优势醋酸菌,将所得优势醋酸菌菌株接种于含有80mL扩大培养基的250mL三角瓶,并置于摇床上在30±1℃下一级扩大培养24小时;再在无菌条件下,将一级扩大培养的菌悬液直接转入含有320mL扩大培养基的1000mL三角瓶,并置于摇床上在30±1℃下二级扩大培养24小时,其中一级和二级扩大培养基均是向每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、1g大豆蛋白粉并灭菌后得到。
2、装置消毒
在密闭条件下,将醋酸菌液态浅层循环培养装置用质量分数为95%的冰醋酸水溶液熏蒸24小时,同时使用55W紫外灭菌灯辐照2小时,每立方米密闭空间里质量分数为95%的冰醋酸水溶液的使用量为150mL。
3、醋酸菌液态浅层循环培养
在无菌条件下,将生长培养基储存罐3内接有步骤1二级扩大培养后的菌悬液的浅层生长培养基通过单向流加泵4泵入培养槽最上面一层矩形槽2内,其中浅层生长培养基是向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸、0.01g醋酸钠、0.005g辅酶Q10、0.005g叶酸,灭菌后再加入2.10mL体积分数为95%的食用酒精和1mL冰乙酸制成。待培养液逐级向下充满矩形槽2且从最底部矩形槽2的出液管1流入加热槽6的培养液高于加热槽6下部的两个出口后,关闭单向流加泵4,开启加热槽6加热培养液使其维持在30±1℃,并开启恒流泵5使加热槽6和培养槽内的培养液循环流动,所述恒流泵5的流速为80L/h。培养48小时后,开启双向流加泵7,向加热槽6内泵入补充培养基储存罐9中的补充培养基,其中双向流加泵7的流速为14mL/h,补充培养基是向每100mL蒸馏水中加入2g葡萄糖、1g酵母提取物、1g大豆蛋白粉、5g无水碳酸钠,灭菌后再加入3.2mL体积分数为95%的食用酒精制成,补充培养基的泵入总体积为浅层生长培养基总体积的37.5%。培养72小时后,将双向流加泵7的流速增加至28mL/h。开启双向流加泵7后,从加热槽6泵出的菌悬液均流入菌悬液回收罐8内。
4、制备醋酸菌粉
培养96小时后,关闭加热槽6、恒流泵5、双向流加泵7,将培养槽内的菌悬液倒入菌悬液回收罐8内,然后将食品级无菌脱脂奶粉与菌悬液回收罐8内的菌悬液按质量-体积比为1g:10mL混合,使用内切式高速分散器在转速为5000rpm下均质10分钟,将均质后的混合液在-20±1℃下预冷冻24小时,随后转入真空冷冻干燥机中在-40±1℃下使混合液干燥完全,最终得到每克成品中含有不低于0.35g醋酸菌的高密度的醋酸菌粉成品。
实施例2
本实施例中,培养槽由8个上表面开口的矩形槽2叠放而成,矩形槽2的长为60cm、宽为25cm、高为1cm,出液管1的直径为1.0cm、高度为2mm。其余零部件及零部件的连接关系与实施例1相同。
采用本实施例的装置高密度快培醋酸菌的方法,在步骤1中,使用的驯化培养基是向每100mL蒸馏水中加入3g葡萄糖、1g酵母提取物、0.5g大豆蛋白粉、0.1g丙氨酸、0.005g醋酸钠、0.001g辅酶Q10、0.001g叶酸,灭菌后加2mL无水乙醇和1mL冰乙酸制成。再重复驯化培养5次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加1.5mL;在步骤3中,使用的浅层生长培养基是向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.5g丙氨酸、0.005g醋酸钠、0.001g辅酶Q10、0.001g叶酸,灭菌后再加入1.0mL体积分数为95%的食用酒精和0.5mL冰乙酸制成,培养48小时后,开启双向流加泵7,向加热槽6内泵入补充培养基储存罐9中的补充培养基,使用的补充培养基是向每100mL蒸馏水中加入1g葡萄糖、0.1g酵母提取物、0.1g大豆蛋白粉、1g无水碳酸钠,灭菌后再加入2.0mL体积分数为95%的食用酒精制成,双向流加泵7的流速为11mL/h,补充培养基的泵入总体积为浅层生长培养基总体积的30%,培养72小时后,将双向流加泵7的流速增加至22mL/h,该步骤的其他步骤与实施例1相同。其他步骤与实施例1相同。
实施例3
本实施例中,培养槽由12个上表面开口的矩形槽2叠放而成,矩形槽2的长为160cm、宽为5cm、高为3cm,出液管1的直径为1.0cm、高度为3mm。其余零部件及零部件的连接关系与实施例1相同。
采用本实施例的装置高密度快培醋酸菌的方法,在步骤1中,使用的驯化培养基是每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸、0.01g醋酸钠、0.01g辅酶Q10、0.001g叶酸,灭菌后加2mL无水乙醇和1mL冰乙酸制成。再重复驯化培养2次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加3mL;在步骤3中,使用的浅层生长培养基是向每100mL蒸馏水中加入12g葡萄糖、4g酵母提取物、5g大豆蛋白粉、1g丙氨酸、0.02g醋酸钠、0.01g辅酶Q10、0.01g叶酸,灭菌后再加入5.5mL体积分数为95%的食用酒精和3mL冰乙酸制成,培养48小时后,开启双向流加泵7,向加热槽6内泵入补充培养基储存罐9中的补充培养基,使用的补充培养基是向每100mL蒸馏水中加入5g葡萄糖、3.0g酵母提取物、3.0g大豆蛋白粉、7g无水碳酸钠,灭菌后再加入5.5mL体积分数为95%的食用酒精制成,双向流加泵7的流速为21mL/h,补充培养基的泵入总体积为浅层生长培养基总体积的20%,培养72小时后,将双向流加泵7的流速增加至42mL/h,该步骤的其他步骤与实施例1相同。其他步骤与实施例1相同。
为了确定本发明的最佳工艺条件,发明人进行了大量的研究试验,具体试验情况如下:
1、醋酸菌菌株的筛选
在无菌条件下,分别将巴氏醋杆菌Acetobacter pasteurianus(购于中国普通微生物菌种保藏管理中心,菌株编号为1.41)、LB醋酸菌(购于鼎丰科技公司)、汉氏葡萄糖醋杆菌Gluconacetobacter hansenii(购于中国普通微生物菌种保藏管理中心,菌株编号为1.1811)接种于活化培养基中进行平皿固体活化培养,活化培养基是向每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、2.0g CaCO3、1.5g琼脂灭菌后制成,培养时间为48小时,培养温度为30±1℃。将活化培养后所得优势醋酸菌菌株接种于含有100mL扩大培养基的250mL三角瓶,并置于摇床上振荡培养,扩大培养基是向每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、1g大豆蛋白粉灭菌后制成,摇床转速为150rpm,培养时间为3天,培养温度为30±1℃。
采用气相色谱法(使用正丁醇(色谱纯)作为溶剂,将醋酸菌发酵液稀释100倍后进样测定,气相色谱仪器参数为:GC-2010PLUSAF 230V岛津气相色谱仪配FID检测器及Labsolutions工作站(日本岛津),色谱柱:HP-INNOWAX毛细管柱,色谱柱ID:327817H,长30.0m,内径0.32mm,膜厚0.25μm。试剂:冰乙酸(色谱纯),无水乙醇(色谱纯),正丁醇(色谱纯)。色谱条件:柱温:平衡温度60℃,平衡时间3min。起始温度60℃(保留1min),以10℃/min速率上升至120℃(保留1min)。检测器温度:210℃。气化温度:210℃。进样模式:分流。进样时间:1min。载气:高纯度氮气,压力77.4kPa,流量76.7mL/min,分流比28.0。流量程序:氢气流量:40mL/min。空气流量:400mL/min。尾吹:30mL/min。进样:1微升。测定方法:外标法)测定不同菌株产酸(乙酸)能力强弱,试验结果见表1。
表1 不同菌株产酸能力强弱比较
由表1可知,汉氏葡萄糖醋杆菌Gluconacetobacter hansenii为3种醋酸菌中产酸能力最强醋酸菌,而且试验结果表明该菌对碳酸钙有明显的消耗作用,形成清晰的透明圈,进一步说明该菌有较强的产酸能力。同时汉氏葡萄糖醋杆菌Gluconacetobacter hansenii的菌体经革兰氏染色后在显微镜下观察到为革兰氏阴性菌,并且菌体为接近椭圆形的短棒形结构。故本发明选取汉氏葡萄糖醋杆菌Gluconacetobacter hansenii作为初始菌株。
2.醋酸菌菌株的驯化
在无菌条件下,将汉氏葡萄糖醋杆菌Gluconacetobacter hansenii接种于活化培养基中进行平皿固体活化培养,培养时间为48h,培养温度为30±1℃。将活化培养后的菌株接种于驯化培养基中,在30±1℃下驯化培养48小时。将驯化后所得优势醋酸菌菌株接种于含有100mL扩大培养基的250mL三角瓶,并置于摇床上振荡培养,扩大培养基是向每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、1g大豆蛋白粉灭菌后制成,摇床转速为150rpm,培养时间为3天,培养温度为30±1℃。培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱。
(1)醋酸菌驯化培养基中碳源的筛选
向每100mL蒸馏水中加入2g酵母提取物、2g大豆蛋白粉,并分别加入4g葡萄糖、蔗糖、甘露醇、乳糖、4mL无水乙醇(灭菌后加入)、4.2mL 95%Vol食用酒精(灭菌后加入),灭菌后加1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表2。
表2 不同碳源的驯化培养基对醋酸菌产酸能力的影响
由表2可知,驯化培养基中使用葡萄糖与无水乙醇作为碳源时产酸效果较好,故本发明选取葡萄糖与无水乙醇作为驯化培养基中的混合碳源。
(2)醋酸菌驯化培养基中混合碳源葡萄糖添加量
向每100mL蒸馏水中加入2g酵母提取物、2g大豆蛋白粉,并加入葡萄糖与无水乙醇作为混合碳源,其中葡萄糖添加量分别为:2、4、6、8、10、12g,灭菌后加4mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表3。
表3 不同葡萄糖添加量的驯化培养基对醋酸菌产酸能力的影响
由表3可知,驯化培养基中使用葡萄糖与无水乙醇作为驯化培养基中的混合碳源时,葡萄糖添加量为4g产酸效果较好。
(3)醋酸菌驯化培养基中混合碳源无水乙醇添加量
向每100mL蒸馏水中加入2g酵母提取物、2g大豆蛋白粉,并加入葡萄糖与无水乙醇作为混合碳源,其中加入4g葡萄糖,灭菌后分别加入1、2、3、4、5、6mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表4。
表4 不同无水乙醇添加量的驯化培养基对醋酸菌产酸能力的影响
由表4可知,驯化培养基中使用葡萄糖与无水乙醇作为驯化培养基中的混合碳源时,无水乙醇添加量为2mL产酸效果较好。
(4)醋酸菌驯化培养基中氮源的筛选
向每100mL蒸馏水中加入4g葡萄糖,并分别加入4g酵母提取物、酵母浸出汁、牛肉膏、酵母粉、大豆蛋白粉、丙氨酸,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacterhansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表5。
表5 不同氮源的的驯化培养基对醋酸菌产酸能力的影响
由表5可知,驯化培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为驯化培养基中的氮源时产酸效果较好,故本发明选取酵母提取物、大豆蛋白粉与丙氨酸作为驯化培养基中的混合氮源。
(5)醋酸菌驯化培养基中混合氮源酵母提取物添加量
向每100mL蒸馏水中加入4g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中分别加入4g大豆蛋白粉、4g丙氨酸,酵母提取物的添加量分别为:0.1、0.5、1、2、3、4g,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表6。
表6 不同酵母提取物添加量的驯化培养基对醋酸菌产酸能力的影响
由表6可知,驯化培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为驯化培养基中的混合碳源时,酵母提取物添加量为1g产酸效果较好。
(6)醋酸菌驯化培养基中混合氮源大豆蛋白粉添加量
向每100mL蒸馏水中加入4g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中分别加入1g酵母提取物、4g丙氨酸,大豆蛋白粉的添加量分别为:0.1、0.5、1、2、3、4g,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表7。
表7 不同大豆蛋白粉添加量的驯化培养基对醋酸菌产酸能力的影响
由表7可知,驯化培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为驯化培养基中的混合碳源时,大豆蛋白粉添加量为1g产酸效果较好。
(7)醋酸菌驯化培养基中混合氮源丙氨酸添加量
向每100mL蒸馏水中加入4g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中分别加入1g酵母提取物、1g大豆蛋白粉,丙氨酸的添加量分别为:0.1、0.3、0.5、0.8、1.0、1.3g,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表8。
表8 不同丙氨酸添加量的驯化培养基对醋酸菌产酸能力的影响
由表8可知,驯化培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为驯化培养基中的混合碳源时,丙氨酸添加量为0.3g产酸效果较好。
(8)醋酸菌驯化培养基中无机盐及生长因子的筛选
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸,并分别加入0.01g辅酶Q10、醋酸钠、氯化钠、氯化钙、叶酸,灭菌后加入2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表9。
表9 不同无机盐及生长因子的驯化培养基对醋酸菌产酸能力的影响
由表9可知,驯化培养基中使用辅酶Q10、醋酸钠与叶酸作为驯化培养基中的无机盐及生长因子时产酸效果较好,故本发明选取辅酶Q10、醋酸钠与叶酸作为驯化培养基中的无机盐及生长因子。
(9)醋酸菌驯化培养基中无机盐醋酸钠添加量
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中分别加入0.01g辅酶Q10、0.01g叶酸,醋酸钠的添加量分别为:0.001、0.005、0.01、0.02、0.03、0.04g,灭菌后加入2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表10。
表10 不同醋酸钠添加量的驯化培养基对醋酸菌产酸能力的影响
由表10可知,驯化培养基中使用辅酶Q10、醋酸钠与叶酸作为驯化培养基中的无机盐及生长因子时,醋酸钠添加量为0.01g产酸效果较好。
(10)醋酸菌驯化培养基中生长因子辅酶Q10添加量
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中分别加入0.01g醋酸钠、0.01g叶酸,辅酶Q10的添加量分别为:0.001、0.003、0.005、0.010、0.015、0.020g,灭菌后加入2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表11。
表11 不同辅酶Q10添加量的驯化培养基对醋酸菌产酸能力的影响
由表11可知,驯化培养基中使用辅酶Q10、醋酸钠与叶酸作为驯化培养基中的无机盐及生长因子时,辅酶Q10添加量为0.003g产酸效果较好。
(11)醋酸菌驯化培养基中生长因子叶酸添加量
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中分别加入0.01g醋酸钠、0.003g辅酶Q10,叶酸的添加量分别为:0.001、0.003、0.005、0.008、0.010、0.013g,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表12。
表12 不同叶酸添加量的驯化培养基对醋酸菌产酸能力的影响
由表12可知,驯化培养基中使用辅酶Q10、醋酸钠与叶酸作为驯化培养基中的无机盐及生长因子时,叶酸添加量为0.003g产酸效果较好。
(12)醋酸菌驯化培养基中冰乙酸初始添加量
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸、0.01g醋酸钠、0.003g辅酶Q10、0.003g叶酸,灭菌后加2mL无水乙醇,并且冰乙酸初始添加量分别为:0.1、0.5、1、2、3、4mL,作为驯化培养基。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表13。
表13 不同冰乙酸初始添加量的驯化培养基对醋酸菌产酸能力的影响
由表13可知,驯化培养基中冰乙酸初始添加量为1mL产酸效果较好。
(13)醋酸菌驯化培养基中驯化次数
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸、0.01g醋酸钠、0.003g辅酶Q10、0.003g叶酸,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。再分别重复驯化培养次数为:2、4、6、8、10、12次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加1mL。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表14。
表14 不同重复驯化培养次数对醋酸菌产酸能力的影响
由表14可知,驯化培养基中冰乙酸初始添加量为1mL,重复驯化培养次数为4次时,产酸效果较好。并且试验表明当每100mL蒸馏水加入的冰乙酸总量超过10mL后,醋酸菌的生长会得到明显的抑制。故驯化培养基中每100mL蒸馏水加入的冰乙酸总量不超过10mL。
(14)醋酸菌驯化培养基中冰乙酸逐次梯度提高量
向每100mL蒸馏水中加入4g葡萄糖、1g酵母提取物、1g大豆蛋白粉、0.3丙氨酸、0.01g醋酸钠、0.003g辅酶Q10、0.003g叶酸,灭菌后加2mL无水乙醇和1mL冰乙酸作为驯化培养基。再重复驯化培养4次,并且驯化培养基中每100mL蒸馏水加入的冰乙酸逐次等量增加0.1、0.5、1、2、2.5mL。按照试验2的方法培养汉氏葡萄糖醋杆菌Gluconacetobacter hansenii,培养结束采用气相色谱法,测定不同菌株产酸(乙酸)能力强弱,试验结果见表15。
表15 不同冰乙酸逐次梯度提高量对醋酸菌产酸能力的影响
由表15可知,驯化培养基中冰乙酸初始添加量为1mL,重复驯化培养次数为4次,冰乙酸逐次梯度提高量为1mL时,产酸效果较好。
上述将汉氏葡萄糖醋杆菌Gluconacetobacter hansenii经过连续驯化培养所得优势醋酸菌菌株命名为N-9醋酸菌菌株,以下均使用该菌株进行试验。
3、醋酸菌液态浅层循环培养装置的构建与优化
考虑在培养过程中,不同的装置参数对培养效果的影响,设定不同单因素试验进行装置的优化处理。装置的规格参数表现在矩形槽2的长度、矩形槽2宽度、出液管1高度、恒流泵5流速、矩形槽2个数5个方面。其余零部件及零部件的连接关系与实施例1相同。在密闭条件下,将醋酸菌液态浅层循环培养装置用质量分数为95%的冰醋酸水溶液熏蒸24小时,同时使用55W紫外灭菌灯辐照2小时,每立方米密闭空间里质量分数为95%的冰醋酸水溶液的使用量为150mL。将二级扩大培养后的N-9醋酸菌菌悬液接入扩大培养基(每100mL蒸馏水中加入10g葡萄糖、1g酵母提取物、1g大豆蛋白粉灭菌后制成)中,并将其转入醋酸菌液态浅层循环培养装置的浅层生长培养基储存罐3中,再通过单向流加泵4泵入培养槽最上面一层矩形槽2内,待培养液逐级向下充满矩形槽2且从最底部矩形槽2的出液管1流入加热槽6的培养液高于加热槽6下部的两个出口后,关闭单向流加泵4,开启加热槽6加热培养液使其维持在30±1℃,并开启恒流泵5使加热槽6和培养槽内的培养液循环流动。培养96小时后通过OD660测定菌浓度,具体测定方法为:取4mL菌悬液置于高速离心机中,7000×g条件下离心6min取上清液作为空白对照组,使用紫外-可见分光光度计在波长660nm下测定菌悬液的OD660值以表示菌浓度的大小(一个单位的OD660值代表醋酸菌干重0.04g)。
(1)矩形槽2长度对醋酸菌菌浓度的影响
不同矩形槽2的长度及培养96小时后菌浓度测定结果如表16所示。
表16 矩形槽2长度对培养效果的影响
由表16可知,在矩形槽2的宽为10cm、矩形槽2的个数为4、出液管1的高度为3mm、恒流泵5流速为60L/h时,矩形槽2的长度为100cm培养效果较好。将所得到的菌悬液在无菌条件下接种于醋酸菌活化培养基,30±1℃下培养3d,观察发现产生明显透明圈且无杂菌生长,故该冰醋酸喷洒熏蒸结合紫外照射方法可实现在此密闭空间中的消毒作用。
(2)矩形槽2宽度对醋酸菌菌浓度的影响
不同矩形槽2的宽度及培养96小时后菌浓度测定结果见表17。
表17 矩形槽2宽度对培养效果的影响
由表17可知,在矩形槽2的长为100cm、矩形槽2的个数为4、出液管1的高度为3mm、恒流泵5流速为60L/h时,矩形槽2的宽度为15cm培养效果较好。
(3)出液管1高度对醋酸菌菌浓度的影响
不同出液管1高度及培养96小时后菌浓度测定结果见表18。
表18 出液管1高度对培养效果的影响
由表18可知,在矩形槽2的长为100cm、宽为15cm,矩形槽2的个数为4,恒流泵5流速为60L/h时,出液管1的高度为4mm培养效果较好。
(4)恒流泵5流速对醋酸菌菌浓度的影响
不同恒流泵5流速及培养96小时后菌浓度测定结果见表19。
表19 恒流泵5流速对培养效果的影响
由表19可知,在矩形槽2的长为100cm、宽为15cm,矩形槽2的个数为4,出液管1的高度为4mm时,恒流泵5流速为80L/h培养效果较好。
(5)矩形槽2个数对醋酸菌菌浓度的影响
不同矩形槽2个数及培养96小时后菌浓度测定结果见表20。
表20 矩形槽2个数对培养效果的影响
由表20可知,在矩形槽2的长为100cm、宽为15cm,出液管1的高度为4mm时,恒流泵5流速为80L/h,矩形槽2的个数为4培养效果较好。
4、醋酸菌浅层生长培养基的优化
考虑在培养过程中,不同的生长培养基成分与配比对培养效果的影响,设定不同单因素试验进行生长培养基成分与配比的优化处理。根据试验2的结果,本试验选择矩形槽2的长为100cm、宽为15cm,出液管1的高度为4mm,恒流泵5流速为80L/h,矩形槽2的个数为4,其余零部件及零部件的连接关系与实施例1相同。在密闭条件下,将醋酸菌液态浅层循环培养装置用质量分数为95%的冰醋酸水溶液熏蒸24小时,同时使用55W紫外灭菌灯辐照2小时,每立方米密闭空间里质量分数为95%的冰醋酸水溶液的使用量为150mL。将二级扩大培养后的N-9醋酸菌菌悬液接入浅层生长培养基中,并将其转入醋酸菌液态浅层循环培养装置的浅层生长培养基储存罐3中,再通过单向流加泵4泵入培养槽最上面一层矩形槽2内,待培养液逐级向下充满矩形槽2且从最底部矩形槽2的出液管1流入加热槽6的培养液高于加热槽6下部的两个出口后,关闭单向流加泵4,开启加热槽6加热培养液使其维持在30±1℃,并开启恒流泵5使加热槽6和培养槽内的培养液循环流动。培养96小时后通过OD660测定菌浓度。
(1)浅层生长培养基中碳源的筛选
向每100mL蒸馏水中加入1g酵母提取物、1g大豆蛋白粉,并分别加入4g葡萄糖、蔗糖、甘露醇、乳糖、4.2mL 95%Vol食用酒精(灭菌后加入)、4mL冰乙酸(灭菌后加入),作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表21。
表21 不同碳源的浅层生长培养基对培养效果的影响
由表21可知,浅层生长培养基中使用葡萄糖、95%Vol食用酒精与冰乙酸作为碳源时培养效果较好,故本发明选取葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源。
(2)浅层生长培养基中混合碳源葡萄糖添加量
向每100mL蒸馏水中加入1g酵母提取物、1g大豆蛋白粉、并加入葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源,其中葡萄糖添加量分别为:2、4、6、8、10、12g,灭菌后加入4.2mL 95%Vol食用酒精与4mL冰乙酸,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表22。
表22 不同葡萄糖添加量在浅层循环培养设备中培养效果
由表22可知,浅层生长培养基中使用葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源时,葡萄糖添加量为6g培养效果较好。
(3)浅层生长培养基中混合碳源95%Vol食用酒精添加量
向每100mL蒸馏水中加入1g酵母提取物,1g大豆蛋白粉,并加入葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源,其中加入6g葡萄糖,灭菌后分别加入0.53、1.05、2.10、3.16、4.21、5.26mL 95%Vol食用酒精与4mL冰乙酸,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表23。
表23 不同95%Vol食用酒精添加量对培养效果的影响
由表23可知,浅层生长培养基中使用葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源时,95%Vol食用酒精添加量为2.10mL培养效果较好。
(4)浅层生长培养基中混合碳源冰乙酸添加量
向每100mL蒸馏水中加入1g酵母提取物,1g大豆蛋白粉,并加入葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源,其中加入6g葡萄糖,灭菌后加入4.21mL95%Vol食用酒精,并且冰乙酸的添加量分别为:0.1、0.5、1、2、3、4mL,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表24。
表24 不同冰乙酸添加量对培养效果的影响
由表24可知,浅层生长培养基中使用葡萄糖、95%Vol食用酒精与冰乙酸作为混合碳源时,冰乙酸添加量为1mL培养效果较好。
(5)浅层生长培养基中氮源的筛选
向每100mL蒸馏水中加入6g葡萄糖,并分别加入4g酵母提取物、大豆蛋白粉、牛肉膏、酵母粉、酵母浸出汁、丙氨酸作为氮源,灭菌后加入2.1mL 95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表25。
表25 不同氮源的浅层生长培养基对培养效果的影响
由表25可知,浅层生长培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为氮源时培养效果较好,本发明选取酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源。
(6)浅层生长培养基中混合氮源酵母提取物添加量
向每100mL蒸馏水中加入6g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中4g大豆蛋白粉、4g丙氨酸、酵母提取物添加量分别为1、2、3、4、5、6g,灭菌后加入2.1mL 95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表26。
表26 不同酵母提取物添加量对培养效果的影响
由表26可知,浅层生长培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源时,酵母提取物添加量为2g培养效果较好。
(7)浅层生长培养基中混合氮源大豆蛋白粉添加量
向每100mL蒸馏水中加入6g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中2g酵母提取物、4g丙氨酸,大豆蛋白粉添加量分别为1、2、3、4、5、6g,灭菌后加入2.1mL95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表27。
表27 不同大豆蛋白粉添加量对培养效果的影响
由表27可知,浅层生长培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源时,大豆蛋白粉添加量为2g培养效果较好。
(8)浅层生长培养基中混合氮源丙氨酸添加量
向每100mL蒸馏水中加入6g葡萄糖,并加入酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源,其中2g酵母提取物、2g大豆蛋白粉,丙氨酸添加量分别为0.1、0.5、1、2、3、4g,灭菌后加入2.1mL95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表28。
表28 不同丙氨酸添加量对培养效果的影响
由表28可知,浅层生长培养基中使用酵母提取物、大豆蛋白粉与丙氨酸作为混合氮源时,丙氨酸添加量为0.5g培养效果较好。
(9)浅层生长培养基中无机盐及生长因子的筛选
向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸,并分别加入0.01g辅酶Q10、醋酸钠、氯化钠、氯化钙、叶酸,灭菌后再加入2.1mL体积分数为95%的食用酒精和1mL冰乙酸,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表29。
表29 不同碳源的浅层生长培养基对培养效果的影响
由表29可知,浅层生长培养基中使用辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子时培养效果较好,故本发明选取辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子。
(10)浅层生长培养基中生长因子辅酶Q10添加量
向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中0.01g醋酸钠、0.01g叶酸,辅酶Q10添加量分别为0.0005、0.001、0.005、0.01、0.02、0.03g,灭菌后加入2.1mL 95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表30。
表30 不同辅酶Q10添加量对培养效果的影响
由表30可知,浅层生长培养基中使用辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子时,辅酶Q10添加量为0.005g培养效果较好。
(11)浅层生长培养基中无机盐醋酸钠添加量
向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中0.005g辅酶Q10、0.01g叶酸,醋酸钠添加量分别为0.0005、0.001、0.005、0.01、0.02、0.03g,灭菌后加入2.1mL 95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表31。
表31 不同醋酸钠添加量对培养效果的影响
由表31可知,浅层生长培养基中使用辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子时,醋酸钠添加量为0.01g培养效果较好。
(12)浅层生长培养基中生长因子叶酸添加量
向每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸,并加入辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子,其中0.005g辅酶Q10、0.01g醋酸钠,叶酸添加量分别为0.0005、0.001、0.005、0.01、0.02、0.03g,灭菌后加入2.1mL 95%Vol食用酒精,作为浅层生长培养基。按照试验4的方法培养醋酸菌,培养96小时后通过OD660测定菌浓度,结果见表32。
表32 不同叶酸添加量对培养效果的影响
由表32可知,浅层生长培养基中使用辅酶Q10、醋酸钠与叶酸作为无机盐及生长因子时,叶酸添加量为0.005g培养效果较好。
综合上述试验结果,本发明最佳选择浅层生长培养基的组成为:每100mL蒸馏水中加入6g葡萄糖、2g酵母提取物、2g大豆蛋白粉、0.5g丙氨酸、0.005g辅酶Q10、0.01g醋酸钠、0.005g叶酸,灭菌后再加入2.10mL体积分数为95%的食用酒精和1mL冰乙酸。
5、不同培养方法的培养效果
(1)三种醋酸菌培养方法得到菌悬液浓度对比
分别采用现有工厂醋酸菌生产中的液态摇床振荡培养与液态发酵罐搅拌培养,以及本发明的液态浅层循环培养对二级扩大培养后的N-9醋酸菌菌悬液进行培养,其中液态摇床振荡培养使用台式水浴恒温振荡器(转速150rpm)与往复式水浴恒温振荡器(转速150rpm),摇床培养方法同普通摇床培养;液态发酵罐搅拌培养使用发酵罐生物反应器(搅拌转速200rpm),发酵罐培养方法同发酵罐培养方法;液态浅层循环培养按照试验4的装置和方法培养醋酸菌。三种培养方法使用的培养基均为试验4确定的最佳组成的浅层生长培养基。培养96小时后通过OD660测定菌浓度,结果见表33。
表33 不同培养装置得到菌悬液浓度对比
由表33可知,本发明使用的液态浅层循环培养比现有工厂醋酸菌生产中的液态摇床振荡培养与液态发酵罐搅拌培养方法更能得到高浓度的醋酸菌菌悬液。数据表明,液态浅层循环培养产生的醋酸菌菌悬液浓度为其他两种方法的3.81~4.87倍。
(2)三种醋酸菌培养方法培养过程中乙醇、乙酸含量变化情况
按照试验5中(1)的方法培养醋酸菌,培养时间为11d,在培养过程中每24h使用气相色谱仪检测各培养液的乙醇、乙酸含量(检测方法与试验1相同)。结果见表34与表35。
表34 不同培养方法培养11d培养液中乙醇含量变化
表35 不同培养方法培养11d培养液中乙酸含量变化
由表34与表35可知,液态摇床振荡培养、液态浅层循环培养、液态发酵罐搅拌培养分别于第8d、第4d、第11d时培养液中乙醇含量明显降低乙酸含量明显升高。液态浅层循环培养中可观察到培养液乙酸含量于第4d含量明显升高,随后出现波动变化,考虑到醋酸菌的生长可进行过氧化作用,即分解醋酸进而维持自身的生长代谢与繁殖,故该现象符合醋酸菌的生理生长变化情况。
综上上述试验结果可见,本发明液态浅层循环培养方法不论从最终菌体的浓度或同等培养过程中营养物质的使用情况上判断,培养效果均明显优于其他二者。
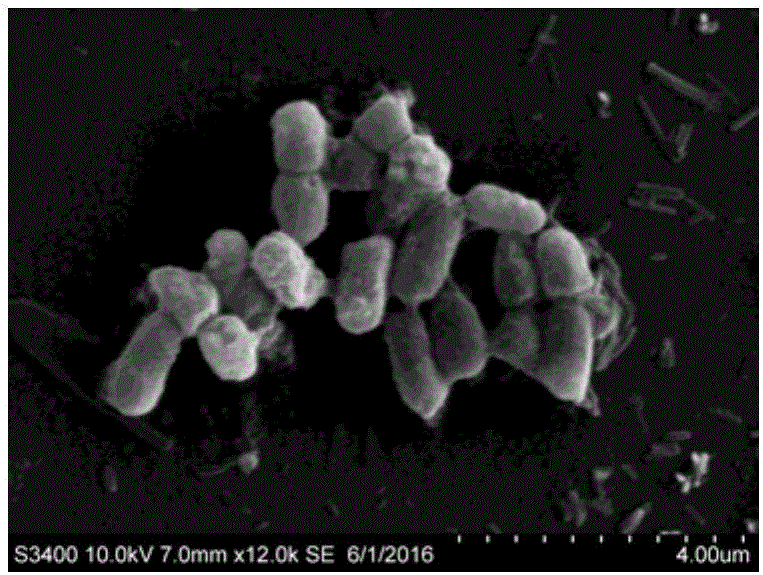
(3)三种醋酸菌培养方法培养醋酸菌菌体形态比较
将试验5中(1)的3种培养方法所得到的醋酸菌收集后用扫描电子显微镜进行形态观察对比,确定该菌在不同培养装置中生长状态,以确保菌株是否发生变异等情况。由图2~图4可知,液态摇床振荡培养:细胞间连丝情况较明显。液态浅层循环培养:细胞间连丝情况不明显,细胞单体成膜结构较为明显。液态发酵罐搅拌培养:除了细胞间有明显连丝情况,也有少量细胞间成膜结构。经革兰氏染色与扫描电子显微镜形态观察可得出本发明液态浅层循环培养所得到的醋酸菌形态学观察正常。
综上所述,本发明液态浅层循环培养所得醋酸菌与传统方法得到的醋酸菌等同,并且本发明方法能使醋酸菌的生产得到更大化发展,可实现人力资源使用量的大大减少,并且现有工厂生产中能轻易实现,具有节约能源、培养效率高、可机械化操作等优点。
6、提高同批次产量的方法
考虑在培养过程中,通过补充培养基同时回收菌悬液的方式达到提高同批次产量的目的。并且经前期对培养基的回收检测试验表明,培养基中损失较大物质为碳源与氮源,故应对培养基中的碳源与氮源进行适当补充。
矩形槽2的规格为长100cm、宽为15cm,出液管1的高度为4mm,恒流泵5流速为80L/h,矩形槽2的个数为4。其余零部件及零部件的连接关系与实施例1相同。在密闭条件下,将醋酸菌液态浅层循环培养装置用质量分数为95%的冰醋酸水溶液熏蒸24小时,同时使用55W紫外灭菌灯辐照2小时,每立方米密闭空间里质量分数为95%的冰醋酸水溶液的使用量为150mL。将二级扩大培养后的菌悬液接入浅层生长培养基中,并将其转入醋酸菌液态浅层循环培养装置的浅层生长培养基储存罐3中,再通过单向流加泵4泵入培养槽最上面一层矩形槽2内,待培养液逐级向下充满矩形槽2且从最底部矩形槽2的出液管1流入加热槽6的培养液高于加热槽6下部的两个出口后,关闭单向流加泵4,开启加热槽6加热培养液使其维持在30±1℃,并开启恒流泵5使加热槽6和培养槽内的培养液循环流动。培养48小时后,开启双向流加泵7,向加热槽6内泵入补充培养基储存罐9中的补充培养基,其中双向流加泵7的流速为14mL/h,补充培养基的泵入总体积为浅层生长培养基总体积的37.5%。培养72小时后,将双向流加泵7的流速增加至28mL/h。开启双向流加泵7后,从加热槽6泵出的菌悬液均流入菌悬液回收罐8内。培养96小时后通过OD660测定菌浓度。
(1)补充培养基中混合碳源葡萄糖添加量
向每100mL蒸馏水中加入2g酵母提取物、2g大豆蛋白粉,并分别加入1、2、3、4、5、6g葡萄糖,灭菌后加入2.10mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养72、96h时取样通过OD660测定菌浓度,结果见表36。
表36 补充培养基中葡萄糖添加量对培养效果的影响
由表36可知,补充培养基中使用葡萄糖与95%Vol食用酒精作为混合碳源时,葡萄糖添加量为2g培养效果较好。
(2)补充培养基中混合碳源95%Vol食用酒精添加量
向每100mL蒸馏水中加入2g葡萄糖、2g酵母提取物、2g大豆蛋白粉,灭菌后分别加入0.53、1.05、2.10、3.16、4.21、5.26mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养72、96h时取样通过OD660测定菌浓度,结果见表37。
表37 补充培养基中95%Vol食用酒精添加量对培养效果的影响
由表37可知,补充培养基中使用葡萄糖与95%Vol食用酒精作为混合碳源时,95%Vol食用酒精添加量为3.16mL培养效果较好。
(3)补充培养基中混合氮源酵母提取物添加量探究
向每100mL蒸馏水中加入2g葡萄糖、2g大豆蛋白粉,并分别加入0.1、0.5、1.0、2.0、3.0、4.0g酵母提取物,灭菌后加入3.16mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养72、96h时取样通过OD660测定菌浓度,结果见表38。
表38 补充培养基中酵母提取物添加量对培养效果的影响
由表38可知,补充培养基中使用酵母提取物与大豆蛋白粉作为混合氮源时,酵母提取物添加量为1.0g培养效果较好。
(4)补充培养基中混合氮源大豆蛋白粉添加量
向每100mL蒸馏水中加入2g葡萄糖、1g酵母提取物,并分别加入0.1、0.5、1.0、2.0、3.0、4.0g大豆蛋白粉,灭菌后加入3.16mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养72、96h时取样通过OD660测定菌浓度,结果见表39。
表39 补充培养基中大豆蛋白粉添加量对培养效果的影响
由表39可知,补充培养基中使用酵母提取物与大豆蛋白粉作为混合氮源时,大豆蛋白粉添加量为1.0g培养效果较好。
(5)补充培养基中碱性无机盐的筛选
向每100mL蒸馏水中2g加入葡萄糖、1g酵母提取物、1g大豆蛋白粉,并分别加入4g氢氧化钠、碳酸钙、无水碳酸钠、无水碳酸氢钠作为唯一碱性无机盐,灭菌后加入3.16mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养96h时取样通过OD660测定菌浓度,结果见表40。
表40 补充培养基中碱性无机盐种类对培养效果的影响
由表40可知,使用无水碳酸钠和无水碳酸氢钠作为碱性无机盐时培养效果较好,考虑到碳酸氢铵不易保存且成本较高,故选取无水碳酸钠作为培养基中的碱性无机盐。
(6)补充培养基中碱性无机盐无水碳酸钠添加量
向每100mL蒸馏水中加入2g葡萄糖、1g酵母提取物、1g大豆蛋白粉,并分别加入1、3、5、7、9g无水碳酸钠,灭菌后加入3.16mL 95%Vol食用酒精,作为补充培养基。按照试验6的方法培养醋酸菌,培养72、96h时取样通过OD660测定菌浓度,结果见表41。
表41 补充培养基中无水碳酸钠添加量对培养效果的影响
由表41可知,补充培养基中使用无水碳酸钠作为碱性无机盐时,无水碳酸钠添加量为5g培养效果较好。
综合上述试验结果,本发明最佳选择补充培养基的组成为:向每100mL蒸馏水中加入2g葡萄糖、1g酵母提取物、1g大豆蛋白粉、5g无水碳酸钠,灭菌后再加入3.2mL体积分数为95%的食用酒精。
- 还没有人留言评论。精彩留言会获得点赞!