一种鸡毒支原体荧光定量检测试剂盒及其检测方法与流程
本发明属于动物检疫技术领域,具体涉及一种鸡毒支原体荧光定量检测试剂盒及其检测方法。
背景技术:
鸡毒支原体(Mycoplasma gallisepticum,MG)感染是鸡慢性呼吸道病的一种,感染MG的鸡临床症状包括咳嗽、打喷嚏、鼻炎、结膜炎,呼吸时伴有鼻分泌物,也有可能患上单侧或者双侧鼻窦炎。感染后会引起蛋鸡产蛋率下降,肉鸡体重减轻。鸡毒支原体不同菌株的感染性和致病性不同,有时感染性并不明显。传播方式主要为垂直传播和水平传播,1943年,Delaplane等首次从感染鸡群中分离出该病原体,此病流行范围遍布世界,我国支原体感染阳性率已达50%~80%,成为威胁我国养禽业的重要疾病之一。
鸡毒支原体感染,主要表现为慢性呼吸道症状,无其他特征性的临床症状,同时易与其他细菌或病毒继发和混合感染,给临床诊断带来困难。支原体培养营养要求高,体外培养生长缓慢,耗时较长,所以传统的分离培养法不能满足临床诊断的需要,目前分子生物学方法在临床诊断中因快速、灵敏的特点,应用越来越广泛。
技术实现要素:
本发明针对现有技术中存在的不足,目的在于提供一种鸡毒支原体荧光定量检测试剂盒及其检测方法。
为实现上述发明目的,本发明所采用的技术方案为:
一种鸡毒支原体荧光定量检测试剂盒,包括:荧光定量PCR反应液、阳性对照和阴性对照,所述荧光定量PCR反应液中包含上游引物和下游引物。
上述方案中,所述上游引物的序列为:5’-GAGCTAATCTGTAAAGTTGGTC-3’;所述下游引物的序列为:5’-GCTTCCTTGCGGTTAGCAAC-3’。
上述方案中,所述荧光定量PCR反应液中还包含SYBR Premix Ex Taq(Tli RNaseH Plus)。
上述方案中,所述荧光定量PCR反应液的组成为:10μmol/L上游引物0.25μL,10μmol/L下游引物0.25μL,SYBR Premix Ex Taq(Tli RNaseH Plus)5μL。
上述方案中,所述阴性对照为DEPC处理水。
上述方案中,所述阳性对照为:灭活的鸡毒支原体活疫苗按1:1000倍稀释的稀释液。
利用上述试剂盒进行鸡毒支原体荧光定量PCR的检测方法,包括如下步骤:
(1)将待测样品溶于DEPC水,煮沸、冰浴、离心后取上清作为待测样品检测模板DNA;
(2)取步骤(1)所得样品检测模板DNA与荧光定量PCR反应液配成反应体系进行荧光定量PCR反应;同时配制阳性对照反应体系、阴性对照反应体系同步进行荧光定量PCR反应;
(3)读取样品检测通道、阳性对照检测通道和阴性对照检测通道的荧光数据,进行结果判定:阴性对照检测通道应均无Ct值并且无扩增曲线;阳性对照检测通道应均有特征性“S”型扩增曲线,且Ct值小于32,Tm值为84.7℃±1.5℃,则表明实验成功,可进行样品的阴性/阳性结果判断,否则实验视为无效;
样品阴性结果判断:样品检测通道无特征性扩增曲线、或Ct值≥32但Tm值不在84.1℃±1.5℃范围内,则表明样品中不含鸡毒支原体;
样品阳性结果判断:样品检测通道出现“S”型扩增曲线,且Ct值小于32,且Tm值为84.1℃±1.5℃,则表明样品中含有鸡毒支原体。
上述方案中,所述荧光定量PCR反应为:第一阶段,预变性,95℃3min;第二阶段,95℃15s,59℃40s,40个循环,每次循环的59℃退火延伸时收集荧光信号;第三阶段,生成融解曲线。
本发明所述鸡毒支原体荧光定量PCR检测方法中,若检测样品出现典型的扩增曲线,Ct值大于或等于32,且Tm值在84.1℃±1.5℃范围内,应将样品进行10倍稀释后复检;若仍出现典型扩增曲线,Ct值大于或等于32,且Tm值为84.1℃±1.5℃,则判为阳性,否则判为阴性。
本发明分别选择鸡毒支原体(MG)的16s rRNA基因的保守序列设计引物。引物长度为22个碱基左右,引物内无二级结构和重复性,引物间和引物内无互补序列,引物间的融解温度(Tm值)相差小于5℃。
本发明的有益效果:
(1)采用本发明所述试剂盒对样品进行鸡毒支原体荧光定量PCR检测,样品的预处理过程非常简单,即不需要对样品进行支原体培养,也不需要对样品中进行支原体基因提取,只需将样品直接煮沸后冷却即可,本发明所述检测方式简化了常规荧光定量PCR检测方法中样品的预处理过程,具有省时、省操作、节约成本等优点;同时全封闭反应,无需PCR后处理,操作安全;并且通过PCR产物进行实时荧光监控,PCR结束即可获得结果,具有快速检测的优势;
(2)本发明所述鸡毒支原体荧光定量检测试剂盒具有检测灵敏度高、特异性好、重复稳定性好等优点:试剂盒的灵敏度可达100拷贝/反应;使用试剂盒检测大肠杆菌、沙门氏菌、巴氏杆菌、副鸡嗜血杆菌、葡萄球菌等细菌,均显示无交叉反应,使用试剂盒检测鸡毒支原体显示出良好的特异性;使用试剂盒多次对含有不同浓度模板DNA的样品进行重复检测,均能检测出来,说明可重复度高;
(3)本发明所述试剂盒及其检测方法非常适用于鸡咽喉拭子中鸡毒支原体(MG)的检测,适用于隐性感染或带毒鸡群的快速筛查。
附图说明
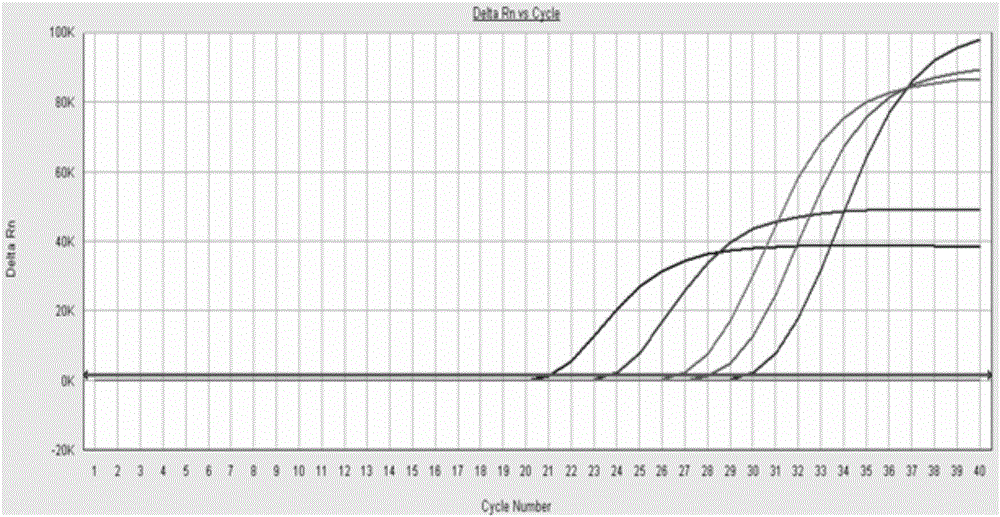
图1为以灭活的鸡毒支原体活疫苗(F36株)为样品的检测结果,曲线从左到右依次为样本进行10-2、10-3、10-4、10-5、10-6稀释后的扩增曲线。
图2为以灭活的鸡毒支原体活疫苗(F36株)为样本的检测结果,峰高从高到低的曲线依次为样本进行10-2、10-3、10-4、10-5、10-6稀释、扩增后融解曲线。
图3为以大肠杆菌、沙门氏菌、巴氏杆菌、副鸡嗜血杆菌、葡萄球菌为样本,以灭活的鸡毒支原体活疫苗为阳性对照的检测结果,其中“S”型曲线为阳性对照的扩增曲线,其他样本的均为起线。
图4为以大肠杆菌、沙门氏菌、巴氏杆菌、副鸡嗜血杆菌、葡萄球菌为样本,以灭活的鸡毒支原体活疫苗为阳性对照的检测结果,其中,有融解峰的曲线为阳性对照融解曲线,其他样本均没有出现融解峰。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
实施例1
(1)引物的设计
根据Genbank登录的已发表的鸡毒支原体(MG)16S rRNA基因序列(Genbank登录号KC995374.1)设计引物。通过分析实验,得到以下引物:
鸡毒支原体-上游引物:5’-GAGCTAATCTGTAAAGTTGGTC-3’
鸡毒支原体-上游引物:5’-GCTTCCTTGCGGTTAGCAAC-3’。
(2)待检样品处理
a.取灭菌的1.5mL离心管,加入400μL无菌的PBS,将采集的咽喉拭子于PBS中旋转洗涤,保留洗涤液;
b.将上述洗涤液12000r/min离心10min,弃上清,保留沉淀物;
c.将沉淀物加入400μL DEPC水混匀,于100℃水浴锅中煮沸10min,煮沸后冰浴10min,2000r/min离心3min,上清作为样品检测模板DNA;
d.同时取阳性对照10μl加入400μLDEPC水混匀,重复步骤c的操作,上清作为阳性对照检测模板DNA。
(3)PCR扩增反应体系配制
5μL SYBR Premix Ex Taq(Tli RNaseH Plus)分别加入0.25μL、10μmol/L上游引物、0.25μL、10μmol/L下游引物,充分混合均匀后,即得到荧光PCR反应液(见表1),再在荧光PCR反应液中加入4.5μL样品检测模板DNA/阳性对照检测模板DNA/阴性对照检测模板DNA,最终配成10μL的PCR扩增反应体系(1羽份)。
表1荧光PCR反应液(1羽份,5.5μl)
其中,SYBR Premix Ex Taq(Tli RNaseH Plus)购于大连宝生物生物工程有限公司,引物由生工生物工程(上海)股份有限公司合成。
实施例2鸡毒支原体荧光定量PCR检测
(1)将上述PCR扩增反应体系进行荧光定量PCR检测,荧光定量PCR反应的参数设计如下:第一阶段:预变性,95℃3min;第二阶段:95℃15s,59℃40s,40个循环,在第二阶段每次循环的59℃退火延伸时收集荧光;第三阶段,生成融解曲线。
(2)分别读取样品检测通道、阳性对照检测通道和阴性对照检测通道的荧光数据,进行结果判定:阴性对照检测通道应均无Ct值并且无扩增曲线,阳性对照检测通道应均有特征性“S”型扩增曲线,且Ct值小于32,Tm值为84.7℃±1.5℃,则表明实验成功,可进行样品的阴性/阳性结果判断,否则实验视为无效;
样品阴性结果判断:样品检测通道无特征性扩增曲线、或Ct值≥32但Tm值不在84.1℃±1.5℃范围内,则表明样品中不含鸡毒支原体;
样品阳性结果判断:样品检测通道出现“S”型扩增曲线,且Ct值小于32,且Tm值为84.1℃±1.5℃,则表面样品中含有鸡毒支原体。
同时,若检测样品出现典型的扩增曲线,Ct值大于或等于32,且Tm值在84.1℃±1.5℃范围内,应将样品进行10倍稀释后复检;若仍出现典型扩增曲线,Ct值大于或等于32,且Tm值为84.1℃±1.5℃,则判为阳性,否则判为阴性。
实施例3可行性实验
以灭活的鸡毒支原体活疫苗为样品,采用实施例1、实施例2的方法进行鸡毒支原体荧光定量PCR检测,检测结果显示:样品出现典型的扩增曲线,Ct值小于32,Tm值为84.1℃。说明本发明所述试剂盒及其检测方法具有确定的可行性。
实施例4灵敏性实验
以灭活的鸡毒支原体活疫苗为样品,将其用DEPC水进行10-2、10-3、10-4、10-5、10-6稀释后,采用实施例1、实施例2的方法进行鸡毒支原体荧光定量PCR检测,检测结果如图1、图2所示,图1从左到右的曲线分别代表稀释了10-2、10-3、10-4、10-5、10-6的鸡毒支原体活疫苗样品,图2中峰高从高到低的曲线分别代表稀释了10-2、10-3、10-4、10-5、10-6的鸡毒支原体活疫苗样品,从图1和图2可以看出:鸡毒支原体稀释10-6倍数后仍然能被本发明所述试剂盒及其检测方法检出,说明本发明所述试剂盒具有非常好的特异性和非常高的灵敏性。通过对鸡毒支原体活疫苗样品进行拷贝数测定后,再采用本发明所述试剂盒进行检测,结果显示,本发明所述试剂盒的灵敏度能达到100拷贝/反应;同时使用本发明所述试剂盒多次对含有不同浓度模板DNA的样品进行重复检测,均能检测出来,说明可重复度高。
实施例5特异性实验
分别以大肠杆菌、沙门氏菌、巴氏杆菌、副鸡嗜血杆菌、葡萄球菌为样品,以鸡毒支体为阳性对照,采用实施例1、2的方法进行荧光定量PCR,结果如图3、图4所示,从图3和图4可以看出:大肠杆菌、沙门氏菌、巴氏杆菌、副鸡嗜血杆菌、葡萄球菌样品均无特征性扩增曲线,无特异性融解峰,而阳性对照(鸡毒支原体样品)出现“S”型曲线扩增曲线和特异性融解峰,表明本发明所述试剂盒具有非常好的特异性。
显然,上述实施例仅仅是为清楚地说明所作的实例,而并非对实施方式的限制。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而因此所引申的显而易见的变化或变动仍处于本发明创造的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!