一种共价有机聚合物及其制备方法和应用与流程
本发明涉及药物领域,尤其涉及一种共价有机聚合物及其制备方法和应用。
背景技术:
癌症是危害人类健康的主要疾病之一,随着科学技术的发展,光动力疗法(photodynamic therapy,PDT)是一种新兴的肿瘤治疗方法,与传统的化疗、放疗以及外科手术治疗相比,光动力疗法具有更安全、并发症少、对生物体损伤小的优点,因而受到越来越多的关注。光动力治疗通过特定波长的光激发在肿瘤部位富集的光敏分子,产生具有细胞毒性的活性氧,通过损坏肿瘤细胞基因结构引起肿瘤受损和死亡,达到治疗目的。
共价有机聚合物(covalent organic polymer,COP)是近年来广泛关注的新型的聚合物材料,通过将各种有机单元以共价键链接的形式构筑的有机材料。其具有比表面积大、热稳定性好、结构可控及多功能性的优点,并且其框架结构中特有的纳米孔洞可被用来负载其他功能性客体分子,从而具有潜在的应用价值。但是,目前利用COP材料作为无载体纳米药物输送体系尚不多见。而将共价有机聚合物作为药物输送载体应用于癌症的光动力与化疗联合治疗更是未曾见报道。
技术实现要素:
有鉴于此,本发明所要解决的技术问题在于提供共价有机聚合物及其制备方法和应用,本发明提供的共价有机聚合物不仅可以作为光动力治疗,而且该聚合物为酸敏感型聚合物还可以作为化疗药物输送的载体,进而使得该共价有机聚合物制备的光动力与化疗联合治疗的药物输送体系具有更强的抑制肿瘤细胞增殖的能力。
本发明提供了一种共价有机聚合物,由氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到;
优选的,所述式(I)结构的化合物与氨基封端的聚乙二醇的摩尔比为1∶(1~2)。
优选的,所述式(I)结构的化合物与氨基封端的聚乙二醇的摩尔比为1∶(1.3~1.5)。
优选的,所述式(I)结构的化合物与所述仲胺的摩尔比为1∶(0.3~0.6)。
优选的,所述仲胺为4,4-丙基哌啶基哌啶、N,N′-二甲基乙二胺、N,N′-二苄基乙二胺、N,N′-双(2-羟乙基)乙二胺、1,3-双((三羟甲基)甲基氨基)丙烷。
优选的,所述氨基封端的聚乙二醇的分子量为1KDa~10KDa。
优选的,所述共价有机聚合物的粒径为50~200纳米。
本发明还提供了一种共价有机聚合物的制备方法,包括:将氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到共价有机聚合物;
优选的,所述式(I)结构的化合物按照以下方法制备得到:
将5,10,15,20-四(4-羟苯基)卟啉、丙烯酰氯与有机碱混合反应制备得到式(I)结构的化合物。
本发明还提供了一种本发明所述的共价有机聚合物在制备光动力治疗与化疗联合治疗的药物中的应用。
与现有技术相比,本发明提供的一种共价有机聚合物,本发明所述的共价有机聚合物由氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到;该化合物通过使式(I)结构的化合物与仲胺和氨基封端的聚乙二醇通过β-氨基酯交联从而使得其在酸性条件下可裂解;且该酸敏感型共价有机聚合物(a-THPP-PEG)具有非常好的水溶性和生物相容性,在冷冻干燥后依然具有良好的复溶能力;在水和生理条件下均具有很好的分散性;得到的纳米颗粒在不仅激光照射下可产生单线态氧,而且在肿瘤部位弱酸性的条件下纳米颗粒发生解离,释放出预先负载的抗癌药物,在肿瘤的光动力治疗与化疗的联合治疗中具有一定的应用;而且该共价有机聚合物a-THPP-PEG可作功能性药物输送体系使用,从而有效避免了由于惰性载体的额外引入从而导致的包括对正常组织的毒副作用、对肾脏等器官引起的代谢压力以及由于载体降解引起的局部炎症等一系列不良后果。实验结果表明,本发明提供的酸敏感型共价有机聚合物(a-THPP-PEG)纳米颗粒,通过对小鼠尾静脉注射,并由荧光成像技术对其进行监测;发现该共价有机聚合物颗粒能够在肿瘤的部位具有很高的富集,且分布较好;然后用激光进行光动力治疗,结合化疗效果显著,对肿瘤细胞增殖具有明显的联合抑制能力,而且该载药的共价有机聚合物颗粒在体内具有相对较长的循环时间;可见,本发明提供共价有机聚合物不仅可以作为光动力治疗的聚合物用于光动力与化疗联合治疗的药物中,而且该聚合物还可以作为化疗药物输送的载体,避免了化疗药物使用额外的载体。
附图说明
图1为实施例1所述的共价有机聚合物(a-THPP-PEG)的核磁共振氢谱图;
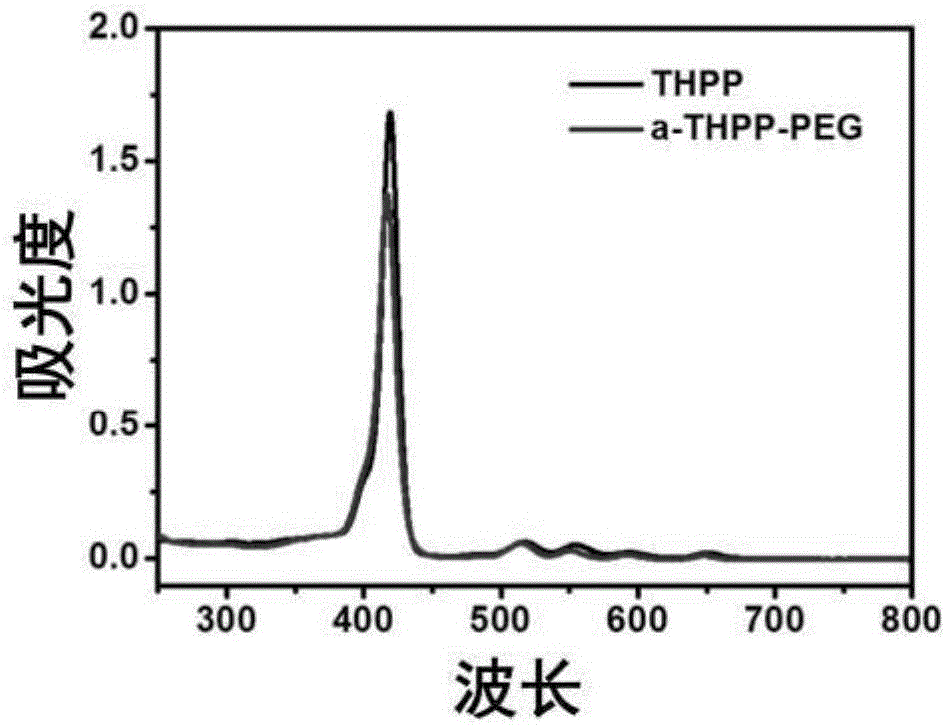
图2为实施例1所述的共价有机聚合物(a-THPP-PEG)的紫外-可见吸收谱图;
图3为实施例1所述的a-THPP-PEG在660nm激光照射下SOSG的相对荧光强度图;
图4为所述a-THPP-PEG的动态激光粒径分布图;
图5为所述a-THPP-PEG的透射电镜照片图;
图6为所述a-THPP-PEG在不同pH值的缓冲液中的累积释放曲线图;
图7为所述a-THPP-PEG在不同pH值的缓冲液中的粒径变化曲线图;
图8为660nm激光照射下,载有抗癌药物阿霉素(DOX)的a-THPP-PEG纳米颗粒和a-THPP-PEG以及单纯DOX与小鼠乳腺癌细胞(4T1细胞)共培养的细胞存活率图;
图9为载药a-THPP-PEG的血液循环数据;
图10为载药a-THPP-PEG在主要器官中分布的荧光照片;
图11为载药a-THPP-PEG在主要器官中分布的具体数值。
具体实施方式
本发明提供了一种共价有机聚合物,由氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到;
按照本发明,所述共价有机聚合物中,所述式(I)结构的化合物与氨基封端的聚乙二醇的摩尔比优选为1∶(1~2),更优选为1∶(1.3~1.5);所所述式(I)结构的化合物与所述仲胺的摩尔比为1∶(0.3~0.6),更优选为1∶(0.4~0.5);所述仲胺优选为4,4-丙基哌啶基哌啶、N,N′-二甲基乙二胺、N,N′-二苄基乙二胺、N,N′-双(2-羟乙基)乙二胺或1,3-双((三羟甲基)甲基氨基)丙烷;所述氨基封端的聚乙二醇为单氨基封端的聚乙二醇,即所述氨基封端的聚乙二醇的分子量优选为1KDa~10Kda,更优选为3KDa~8KDa;所述共价有机聚合物的粒径优选为50~200nm,更优选为65~150nm,最优选为80~120nm;其中,所述共价有机聚合物中,所述式(I)结构的化合物与氨基封端的聚乙二醇和仲胺通过β-氨基酯连接。
本发明还提供了一种共价有机聚合物的制备方法,包括:将氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到共价有机聚合物;
按照本发明,本发明将氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到共价有机聚合物;其中,所述氨基封端的聚乙二醇为单氨基封端的聚乙二醇,即所述氨基封端的聚乙二醇的分子量优选为1KDa~10Kda,更优选为3KDa~8KDa;所述仲胺优选为4,4-丙基哌啶基哌啶、N,N′-二甲基乙二胺、N,N′-二苄基乙二胺、N,N′-双(2-羟乙基)乙二胺或1,3-双((三羟甲基)甲基氨基)丙烷;所述反应的溶剂优选为二甲基亚砜;所述式(I)结构的化合物与所述氨基封端的聚乙二醇的摩尔比为1∶(0.8~2),更优选为1∶(1~1.5);所述式(I)结构的化合物与所述仲胺的摩尔比为1∶(0.1~1),更优选为1∶(0.5~0.8);所述反应的温度优选为50~80℃,更优选为65~70℃;所述反应的时间优选为24h~72h,更优选为48~60h。
本发明中,为了使反应能够更好的进行,本发明优选首先将式(I)结构的化合物和仲胺混合反应20~36h后,再加入氨基封端的聚乙二醇反应,得到共价有机聚合物;其中,所述式(I)结构的化合物和仲胺混合反应的时间优选为24~30h;所述加入氨基封端的聚乙二醇后反应的时间优选为24~48h。
本发明中,本发明对式(I)结构的化合物的来源没有特殊要求,可以购买也可以自制,其中,自制时,本发明优选按照以下步骤进行:将5,10,15,20-四(4-羟苯基)卟啉、丙烯酰氯与有机碱混合反应制备得到式(I)结构的化合物。其中,所述反应的温度优选为室温,所述反应的时间优选为12~24小时;所述反应的溶剂优选为四氢呋喃。
本发明还提供了一种本发明所述共价有机聚合物在制备光动力治疗与化疗联合治疗的药物中的应用。
本发明提供的一种共价有机聚合物,本发明所述的共价有机聚合物由氨基封端的聚乙二醇、式(I)结构的化合物和仲胺混合反应得到;该化合物通过使式(I)结构的化合物与仲胺和氨基封端的聚乙二醇通过β-氨基酯交联从而使得其在酸性条件下可裂解;且该酸敏感型共价有机聚合物(a-THPP-PEG)具有非常好的水溶性和生物相容性,在冷冻干燥后依然具有良好的复溶能力;在水和生理条件下均具有很好的分散性;得到的纳米颗粒在不仅激光照射下可产生单线态氧,而且在肿瘤部位弱酸性的条件下纳米颗粒发生解离,释放出预先负载的抗癌药物,在肿瘤的光动力治疗与化疗的联合治疗中具有一定的应用;而且该共价有机聚合物a-THPP-PEG可作功能性药物输送体系使用,从而有效避免了由于惰性载体的额外引入从而导致的包括对正常组织的毒副作用、对肾脏等器官引起的代谢压力以及由于载体降解引起的局部炎症等一系列不良后果。实验结果表明,本发明提供的酸敏感型共价有机聚合物(a-THPP-PEG)纳米颗粒,通过对小鼠尾静脉注射,并由荧光成像技术对其进行监测;发现该共价有机聚合物颗粒能够在肿瘤的部位具有很高的富集,且分布较好;然后用激光进行光动力治疗,结合化疗效果显著,对肿瘤细胞增殖具有明显的联合抑制能力,而且该载药的共价有机聚合物颗粒在体内具有相对较长的循环时间;可见,本发明提供共价有机聚合物不仅可以作为光动力治疗的聚合物用于光动力与化疗联合治疗的药物中,而且该聚合物还可以作为化疗药物输送的载体,避免了化疗药物使用额外的载体。
下面将结合本发明实施例的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
制备酸敏感型共价有机聚合物a-THPP-PEG,具体包括以下步骤:
将135.6mg的5,10,15,20-四(4-羟苯基)卟啉、245mg三乙胺溶于干燥过的四氢呋喃中,随后向体系中逐滴加入217.2mg丙烯酰氯,接着在室温氮气氛围下搅拌反应12小时;将溶液过滤后浓缩后溶解于二氯甲烷中,依次用0.1M的碳酸钠水溶液萃取3遍,饱和氯化钠水溶液萃取3遍,合并有机相并用无水硫酸钠干燥2小时后过滤,将滤液浓缩后滴加入冰正己烷中并离心,取底部固体真空干燥后得到具有式(I)结构的5,10,15,20-四(4-羟苯基)卟啉的衍生物。
将26mg的5,10,15,20-四(4-羟苯基)卟啉衍生物、3.1mg的4,4-丙基哌啶基哌啶溶于超干二甲亚砜中,在65℃条件下反应24小时后,向体系中加入145.3mg氨基封端的聚乙二醇继续反应24小时后,冷却至室温,用超纯水透析48小时,将透析袋中的液体经过6000转离心后取上清液冷冻干燥,得到所述酸敏感型共价有机聚合物。
对实施例1得到的共价有机聚合物进行表征(包括:核磁共振氢谱、紫外-可见吸收光谱、动态光散射、透射电镜、单线态氧产生能力)。
其中,图1为实施例1所述的共价有机聚合物(a-THPP-PEG)的核磁共振氢谱,从图中可以找到各个质子峰与对应结构的归属,在化学位移6.5~9.5ppm处归属于卟啉环的质子峰的出现可证明含有卟啉的共价有机聚合物已成功制备。
图2为实施例1所述的共价有机聚合物(a-THPP-PEG)的紫外-可见吸收谱图,从图中可以看出卟啉的特征吸收峰,进一步表明材料的成功制备,并且在近红外区卟啉的吸收峰得到了保留,表明所制备的a-THPP-PEG具有进行光动力治疗的可能。接着通过检测SOSG的荧光强度来验证经660nm激光照射后,a-THPP-PEG产生单线态氧的能力,结果见图3,图3为实施例1所述的a-THPP-PEG在660nm激光照射下SOSG的相对荧光强度图,从图中可以看出,与水相比,所制备的a-THPP-PEG具有良好的产生单线态氧的能力,进一步验证了a-THPP-PEG作为光动力治疗试剂的可能。
图4为所述a-THPP-PEG的动态激光粒径分布图,从图中可以看出,a-THPP-PEG所形成的纳米颗粒直径约为65nm,并且呈现单分散;图5为所述a-THPP-PEG的透射电镜照片图,由于透射电镜测试为干燥情况,PEG部分难以被拍摄到,图中疏水内核部分的粒径约为30nm,并且粒径大小相对均一。
实施例2:a-THPP-PEG在不同pH值的缓冲液中的降解性能测试
由于a-THPP-PEG通过酸性可裂解β-氨基酯集团的交联,在肿瘤微环境弱酸性条件下可发生解离,卟啉分子失去交联后成为游离状态,可从结构中脱离。为了研究a-THPP-PEG在弱酸性条件下的降解,我们分别测试了在不同pH值缓冲液中的卟啉释放情况和纳米颗粒的粒径变化。
图6为所述a-THPP-PEG在不同pH值的缓冲液中的累积释放曲线图,从图中可以看出,随着时间的延长,在pH 6.0的缓冲液中,卟啉累积释放率远超于在pH 7.4的缓冲液中的累积释放率;
图7为所述a-THPP-PEG在不同pH值的缓冲液中的粒径变化曲线图;从图中可以看出,随着时间的延长,在pH 6.0的缓冲液,纳米颗粒的粒径持续增长,表明纳米颗粒发生解离后,疏水部分发生聚集,而在pH 7.4的缓冲液中,纳米颗粒的粒径基本保持不变。证明a-THPP-PEG纳米颗粒具有明显的酸敏感性。
实施例3:载药a-THPP-PEG纳米颗粒对肿瘤细胞的杀伤能力实验
选取抗癌药物阿霉素以及单纯a-THPP-PEG作为对照组,外加条件为660nm激光照射,选取4T1细胞验证载药a-THPP-PEG纳米颗粒对肿瘤细胞的杀伤能力。
通过MTT测试检验4T1细胞与载药a-THPP-PEG纳米颗粒,阿霉素以及单纯a-THPP-PEG在有无660nm激光照射共培养24小时的累积存活率。结果见图8,图8为660nm激光照射下,载有抗癌药物阿霉素(DOX)的a-THPP-PEG纳米颗粒和a-THPP-PEG以及单纯DOX与小鼠乳腺癌细胞(4T1细胞)共培养的细胞存活率图;从图中可以看出,与单一化疗的阿霉素组合、单一的光动力治疗的a-THPP-PEG组相比,载药a-THPP-PEG纳米颗粒具有更强的杀伤力,细胞的存活率明显较低,证明联合疗法具有更强的抑制肿瘤细胞增殖的能力。
实施例4:载药a-THPP-PEG纳米颗粒在生物体内的血液循环实验
将载药a-THPP-PEG纳米颗粒通过尾静脉注射到小鼠体内,在预定的时间点从老鼠眼球取出15μL左右的血液,通过萃取测试血液中DOX的荧光强度来检验载药a-THPP-PEG纳米颗粒在小鼠体内的血液循环情况。结果见图9,图9为载药a-THPP-PEG的血液循环数据,从图中可以看出,载药a-THPP-PEG纳米颗粒具有相对较长的循环时间,具有良好的应用价值。
实施例5:载药a-THPP-PEG纳米颗粒在生物体内的分布实验
将载药a-THPP-PEG纳米颗粒通过尾静脉注射到小鼠体内,24小时后,实验小鼠牺牲,取出重要的器官置于表面皿中,在小动物成像系统上拍摄荧光照片,观察各个器官及肿瘤部位载药a-THPP-PEG纳米颗粒的富集量。
载药a-THPP-PEG纳米颗粒在小鼠体内的富集情况见图10,图10为载药a-THPP-PEG在主要器官中分布的荧光照片;结果表明,24小时后,肿瘤部位具有较强的荧光,表明载药a-THPP-PEG在肿瘤部位的富集量较高;将小鼠各器官剪碎匀浆后萃取后测试阿霉素在各器官中的分布,结果见图11,图11为载药a-THPP-PEG在主要器官中分布的具体数值,从图中可以看出,该结果与器官的荧光成像结果相符,进一步说明纳米颗粒在小鼠体内的分布较好,满足治疗需求。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!