胱天蛋白酶募集域蛋白6在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种胱天蛋白酶募集域蛋白6(caspase recruitment domain-containing protein 6,CARD6)作为靶基因在制备预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物中应用。
背景技术:
脂肪肝包括酒精性肝病和非酒精性脂肪性肝病,两者都是全球常见的慢性肝病。随着生活方式的和饮食结构的影响,非酒精性脂肪性肝病的发病率逐年增加,已成为危害人类健康的三大肝病之一。非酒精性脂肪性肝是遗传、环境、代谢应激等多因素影响造成的疾病,而肥胖、高脂血症、糖尿病、高胰岛素血症和收缩压升高是其高危因素。
糖尿病是一种常见的有遗传倾向的内分泌代谢病。随着人们生活方式的改变,尤其是高能量食品的摄入过多及体力活动减少,糖尿病的发病率大幅上升,已严重危害到人们身体的健康,其中以Ⅱ型糖尿病患者居多。Ⅱ型糖尿病约占糖尿病患者的90%,多发于40岁以上的成年人或老年人,是由于体内胰岛素分泌相对不足、靶细胞对胰岛素敏感性降低,导致机体内糖、脂肪、蛋白质、水和电解质的代谢紊乱型疾病。长期存在的高血糖,会导致多种并发症的发生。对身体的各种组织产生损害,特别是眼、肾、心脏、血管、神经的慢性损害以及功能障碍。
糖尿病人群发生非酒精性脂肪肝的机制可能为糖尿病患者存在胰岛素抵抗和胰岛素绝对或相对不足,胰岛素抑制脂肪酶活性下降,外周脂肪组织分解增多,游离脂肪酸增多,肝脏对游离脂肪酸氧化和利用不足,脂化形成甘油三酯增加,大量甘油三酯生成超过肝脏运转的能力,在肝细胞内聚集,引起肝细胞变性、肿大,形成脂肪肝。故糖尿病患者更易发生脂肪肝,早期干预尤为重要。非酒精性脂肪肝性肝病不仅可导致转氨酶持续异常、失代偿期肝硬化、肝功能衰竭等严重肝病,也与心血管疾病、Ⅱ型糖尿病、代谢综合征的发生存在密切联系,严重威胁着人们的健康。因此,非酒精性脂肪性肝合并Ⅱ型糖尿病的治疗越来越受到重视。
胱天蛋白酶募集域蛋白6是CARDs家族的重要成员之一,目前已发现人类28个CARDs和小鼠21个CARDs相关蛋白,广泛存在于哺乳动物的各个组织器官中[1]。人类CARD6基因定位于5号同源染色体上,且人类CARD6的转录产物在绝大多数组织器官中表达,而小鼠的CARD6的mRNA高表达于脾脏、肝脏等组织中。此外,CARD6编码的序列有1037个氨基酸残基,其中包括有4个关键功能结构域,N-末端包含的一个CARD结构域,同时连接着一个富含谷氨酸的结构域(GARR)和一个核心氨基酸结构域,C-末端包含一个富含脯氨酸结构域(PRR),且人类与小鼠在氨基酸序列上的一致性高达53.2%[2]。CARD6可与蛋白激酶RIP家族成员形成复合体,是NOD样受体(NOD-like receptors,NLRs)及TLR样受体(Toll-like receptors,TLRs)通路的重要媒介物,在机体先天性及后天性免疫反应和炎症应答等各方面起重要调控作用[3-5]。
参考文献:
[1].Inohara,N.,et al.,Nod1,an Apaf-1-like activator of caspase-9 and nuclear factor-kappaB.J Biol Chem,1999.274(21):p.14560-7.
[2].Werts,C.,S.E.Girardin and D.J.Philpott,TIR,CARD and PYRIN:three domains for an antimicrobial triad.Cell Death Differ,2006.13(5):p.798-815.
[3].Bouchier-Hayes,L.and S.J.Martin,CARD games in apoptosis and immunity.EMBO Rep,2002.3(7):p.616-21.
[4].Stehlik,C.,et al.,CARD6 is a modulator of NF-kappa B activation by Nod1-and Cardiak-mediated pathways.J Biol Chem,2003.278(34):p.31941-9.
[5].Dufner,A.,S.Pownall and T.W.Mak,Caspase recruitment domain protein 6 is a microtubule-interacting protein that positively modulates NF-kappaB activation.Proc Natl Acad Sci U S A,2006.103(4):p.988-93.
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于提供一种CARD6基因的表达与脂肪肝、Ⅱ型糖尿病之间的相互关系,提供一个用于治疗脂肪肝、Ⅱ型糖尿病的靶基因CARD6的新用途,进而把CARD6基因应用于脂肪肝、Ⅱ型糖尿病的治疗。
本发明的目的通过以下技术方案实现:
本发明以野生型C57小鼠、构建条件性敲除的CARD6蛋白正常表达的CARD6 Flox小鼠与肝细胞特异性CARD6基因敲除(CARD6 KO)小鼠为实验对象,通过高脂饮食诱导的肥胖小鼠模型(diet induced obesity,DIO)研究CARD6基因的功能,结果发现与CARD6 Flox小鼠对比,CARD6基因敲除小鼠表现出肥胖,其体重明显高于同种饲料饲养的CARD6 Flox小鼠,空腹血糖水平高于对照组CARD6 Flox小鼠。进一步通过腹腔注射葡萄糖耐量实验发现CARD6基因敲除小鼠对葡萄糖的耐受能力明显减弱。从小鼠肝脏重量及肝脏/体重比以及脂质成分病理染色结果等均说明HFD组(High fat diet,高脂饮食)的CARD6 KO小鼠脂肪肝病变明显严重,脂质蓄积显著增加。这表明CARD6基因敲除会加剧脂肪肝、Ⅱ型糖尿病的发生,CARD6基因能够改善脂肪肝、Ⅱ型糖尿病的发生。
本发明人的研究证明了:在高脂诱导的脂肪肝、Ⅱ型糖尿病模型中,CARD6具有抑制肥胖,降低血糖,减少肝脏脂质蓄积,保护肝功能,特别是改善脂肪肝、Ⅱ型糖尿病的作用。
针对CARD6的上述功能,提供CARD6作为药物靶标在筛选保护肝脏及维持糖代谢稳态的药物中的应用。
针对CARD6的上述功能,提供CARD6作为药物靶标在筛选预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物中的应用。
以上药物是指能够促进CARD6基因表达的药物。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现CARD6基因的新功能,即CARD6基因具有能够保护脂肪肝、Ⅱ型糖尿病疾病的作用。
(2)基于CARD6在保护脂肪肝、Ⅱ型糖尿病疾病中的作用,其可以用于制备预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物。
附图说明
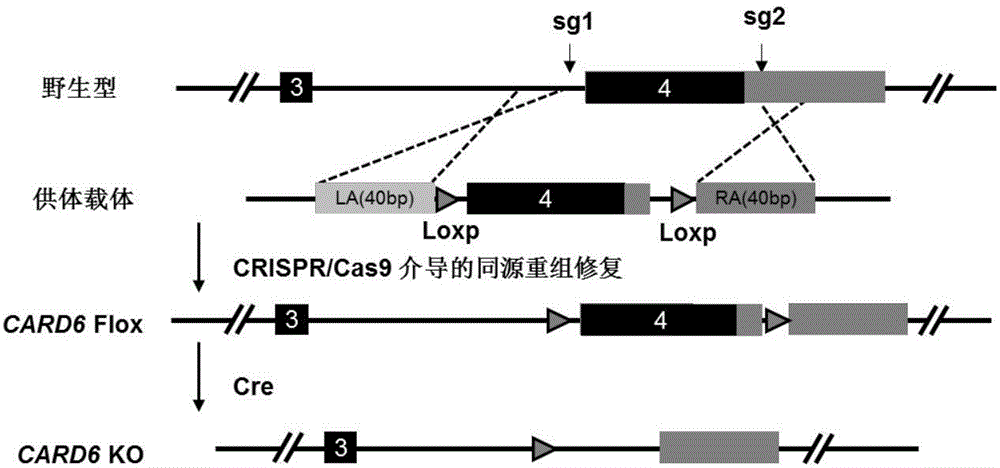
图1是肝细胞特异性CARD6基因敲除小鼠的构建策略图
图2是CARD6 Flox和CARD6 KO小鼠的体重、空腹血糖结果图;
A为小鼠体重结果图,B为空腹血糖水平统计图(*:p<0.05 vs Flox NC组,#:p<0.05 vs Flox HFD组)。
图3是CARD6 Flox和CARD6 KO小鼠通过腹腔注射葡萄糖耐量结果图;
A为通过腹腔注射葡萄糖后不同时间点小鼠血糖水平统计图,B为各组小鼠糖耐量曲线下面积(area under the curve,AUC)比较图(*:p<0.05 vs Flox NC组,#:p<0.05 vs Flox HFD组)。
图4是CARD6 Flox和CARD6 KO小鼠的肝脏重量结果图;
A为肝脏重量统计柱状图,B为肝脏重量与小鼠本身体重比值统计柱状图(*:p<0.05 vs Flox NC组,#:p<0.05 vs Flox HFD组)。
图5是CARD6 Flox和CARD6 KO小鼠的HE和油红O染色图。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
实验用动物及饲养:
实验动物种属,性别,周龄及来源:选用8-10周龄、体重在24g-27g,背景为雄性C57BL/6品系的野生型小鼠(WT,购自北京华阜康生物科技有限公司)、CARD6蛋白正常表达的CARD6 Flox小鼠(由武汉大学动物实验中心李红良老师实验室构建)以及肝细胞特异性CARD6基因敲除(CARD6 KO)小鼠(由CARD6 Flox小鼠与肝脏特异性Alb-Cre(购自The Jackson Laboratory,货号003574)转基因小鼠交配得到)为实验对象。
肝细胞特异性CARD6基因敲除小鼠的构建(构建策略见图1):
根据CARD6基因信息,利用CRISPR Design(网址http://crispr.mit.edu/)分别在内含子3和外显子4的非编码区中各设计一个CRISPR的打靶位点。靶序列分别为:
CARD6-sgRNA1:GgAGAGTAGGCAACATGACT TGG
CARD6-sgRNA 2:gGTGAAAGCAGTTATCAGTA GGG
此外还设计了一个用于同源修复的供体质粒(Donor Vector)pBluescript SK(+)-2loxp,它包括两侧同源臂、中间的外显子4以及两个同向的loxp序列。
①打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4 DNA连接酶连入经过限制性内切酶BsaI处理过的pUC57-sgRNA载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。
②供体载体(Donor Vector)的构建:根据引物设计原则,设计如下引物(表1)用于扩增供体载体的左右同源臂以及中间的外显子部分。扩增得到的产物连入经表1中所示限制性内切酶酶切的条件性敲除骨架载体中,得到Donor Vector。
表1用于扩增供体载体的左右同源臂以及中间的外显子部分的引物
③打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体(pST1374-Cas9)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7 mMESSAGE mMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscriptTM Kit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasy Micro Kit(Qiagen,217084)进行纯化。
④CARD6 Flox条件性敲除小鼠的制作
将上述成熟的mRNA产物与供体质粒一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得CARD6 Flox纯合小鼠。
⑤肝细胞特异性CARD6基因敲除小鼠的制作
将上述CARD6 Flox小鼠与肝脏特异性Alb-Cre(购自The Jackson Laboratory,货号003574)转基因小鼠交配,筛选得到CARD6flox/flox/Alb-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到肝脏细胞特异性CARD6基因敲除小鼠。
实验动物饲料配方:高脂饲料(HFD)(购自北京华阜康生物科技有限公司,货号D12942):热量百分比:蛋白质:20%;碳水化合物:20%;脂肪:60%,总的热量质量比:5.24kcal/g。低脂饲料(NC)(购自北京华阜康生物科技有限公司,货号D12450B):热量百分比:蛋白质:20%;碳水化合物:70%;脂肪:10%,总的热量质量比:3.85kcal/g。
动物饲养及环境条件:所有的实验小鼠均饲养在武汉大学SPF级动物房。每12小时交替照明,温度24±2℃,湿度40%-70%,小鼠自由饮水进食。
【实施例1】小鼠脂肪肝、Ⅱ型糖尿病模型(diet induced obesity,DIO)获得
(1)实验动物分组:选用8周龄,雄性,CARD6 Flox小鼠和CARD6 KO小鼠,分别给与两种特殊饲料D12942高脂饲料(High fat diet,HFD)和D12450B低脂饲料(Normal chow,NC)饲养,即Flox NC组,KO NC组,Flox HFD组,KO HFD组共4个组别。
(2)模型通过高脂饲料诱导操作流程:
采用Flox与KO小鼠,建立DIO模型,进行表型相关分析,明确CARD6基因对脂肪肝、Ⅱ型糖尿病发挥的作用。选用8周龄,雄性,CARD6 Flox小鼠和CARD6 KO小鼠,分别给与两种特殊饲料D12942高脂饲料(Highfat diet,HFD)和D12450B低脂饲料(Normal chow,NC)饲养,即Flox NC组,KO NC组,Flox HFD组,KO HFD组共4个组别。小鼠空腹体重和空腹血糖每隔4周检测1次。实验第22周,进行腹腔注射葡萄糖实验(IPGTT),以评价小鼠机体对葡萄糖耐受能力。第24周终末取材,取出小鼠肝脏拍照,然后一部分置于甲醛溶液中固定或O.C.T冰冻切片包埋剂(Tissue Freezing Medium)包埋作为病理分析用。
【实施例2】小鼠体重、血糖水平测定
(1)小鼠空腹体重检测
1)体重检测。
①禁食:上午8:00将待实验小鼠禁食(不禁水),下午2:00开始实验操作。
②称重:分别在第0周、4周、8周、12周、16周、20周、24周称重,将一塑料小桶放在动态电子天平上,抓起小鼠,放入称量小桶中,测量体重记录数据。
(2)空腹血糖水平检测实验
将所有待实验的小鼠从上午8:00至下午2:00间禁食(不禁水),即禁食6小时后开始实验操作。
①血糖仪准备:检查血糖仪(美国强生公司,ONETOUCH)电池,按右侧开关,将试纸正确放入左侧插槽,屏幕显示与血糖试纸条相应代码的数字,随后显示滴血图案,提示血糖仪进入待测状态。
②固定小鼠:右手抓鼠尾,左手持一块毛巾,将毛巾对折,用拇指和食指捏住毛巾对折处,将鼠头部和身体包入手掌内的毛巾,拇指和食指在将鼠尾根部固定。
③剪尾:眼科剪迅速在距鼠尾末端0.1-0.2cm处剪下鼠尾,待血滴自行流出。
④血糖检测:将血糖仪试纸边缘轻触血滴,血液浸入试纸,血糖仪倒计时5秒显示读数。
Ⅱ型糖尿病损伤严重程度的评估指标主要包括体重、血糖等水平,体重、血糖变化结果如图2所示,Flox小鼠在给与HFD饲料饲养后,从第4周开始体重明显高于其NC饲料组,给与CARD6 KO小鼠24周的HFD饲料和NC饲料饲养后,从第4周开始HFD组的CARD6 KO小鼠体重明显高于HFD组的CARD6 Flox小鼠体重,一直持续到第24周(见图2A);经空腹血糖检测发现在HFD组的小鼠从第4周、8周、12周、16周、20周、24周的空腹血糖水平明显较相应NC对照组升高,HFD组的CARD6 KO小鼠空腹血糖水平也明显高于CARD6 Flox组小鼠空腹血糖水平(见图2B)。表明CARD6基因敲除后显著影响了小鼠在HFD饲养状态下的糖代谢稳态,CARD6基因能显著提高小鼠的糖代谢能力,表明CARD6基因在高脂诱导引起的Ⅱ型糖尿病中起到重要作用。
【实施例3】葡萄糖耐量实验(intraperitoneal glucose tolerance test,IPGTT)
实验第22周,进行腹腔注射葡萄糖实验(IPGTT),以评价小鼠机体对糖耐受能力。
(1)在测血糖之前,先测量小鼠的空腹体重,根据10μL/g计算葡萄糖的注射体积。
(2)先检测葡糖糖注射前即0分钟时空腹血糖,在检测完毕后迅速经腹腔注射葡萄糖液。
(3)腹腔注射操作方法:①固定小鼠;抓起小鼠,左手的小指和无名指抓小鼠的尾巴,另三手指抓住小鼠的颈部,使小鼠的头部向下,将小鼠腹部充分暴露。②进针定位及注射:从腹部一侧进针右手持注射器,将尖端与小鼠腹部成45°的夹角,进针,回抽,注射时针头在腹部皮下穿行一小段距离,穿过腹中线后在腹部另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。
(4)分别于腹腔注射后15分、30分、60分、120分钟时间点剪尾测小鼠血糖值,并记录血糖数值和检测时间。
进一步通过腹腔注射葡萄糖耐量实验(intraperitoneal glucose tolerancetests,IPGTT)来评估各组小鼠对葡萄糖的处理能力,在实验第22周,通过注射1.0g/kg体重的葡萄糖后,HFD组的CARD6 Flox小鼠和CARD6-KO小鼠血糖水平在15分钟时间点剧增达到峰值,随着时间推移至注射后60分钟,两组小鼠血糖水平稍微下降,但仍处于高于空腹血糖水平(0分钟时血糖),在2小时时恢复至空腹血糖水平,且CARD6-KO小鼠血糖水平从0分钟至2小时一直处于高于CARD6 Flox小鼠的血糖水平(图3A)。比较各组小鼠血糖曲线下面积(area under the curve,AUC),发现CARD6 Flox小鼠HFD组的AUC显著高于NC组,CARD6 KO HFD组的AUC显著大于CARD6 Flox HFD组的AUC(图3B),表明CARD6对维持糖代谢稳态具有强大的调控能力。
【实施例4】肝脏大体外观及肝脏组织脂质成分测定
(1)终末肝脏组织取材
1)小鼠称重后,迅速脱颈处死。仰卧固定小鼠,用蒸馏水将小鼠胸部,腹部毛发润湿。
2)用一镊子钳夹小鼠腹部正中皮肤,沿腹部正中向头部剪开皮肤至剑突下,向尾端剪开皮肤,逐层暴露皮下筋膜,肌肉等,打开腹腔,充分暴露各脏器。
3)迅速找到并取下小鼠的肝脏,将取下的肝脏标本置于灭菌纱布上,拭干肝脏表面上残留血液,将肝脏置于无菌培养皿中,迅速称重。
4)石蜡标本:切取部分肝脏置于10%中性福尔马林中固定。冰冻标本:切取部分肝脏,置于有OCT的锡纸模具中包埋,放在干冰上冰冻固定。
2.肝脏组织处理及病理染色相关实验
1)肝脏脱水,透明,浸蜡
切取10%中性福尔马林中固定好的部分肝叶组织于标记的包埋框内,在小流量流水冲洗30分钟以上。按照以下流程在机器上设置以下程序,①脱水:75%酒精(45分钟)→75%酒精(45分钟)→85%酒精(45分钟)→85%酒精(45分钟)→95%酒精(45分钟)→95%酒精(45分钟)→无水酒精(1小时)→无水酒精(1小时);②透明:二甲苯(1小时)→二甲苯(1小时);③浸腊(65℃):石蜡(1小时)→石蜡(1小时)。待组织冲洗完毕后,将包含组织的包埋框装进机器篮筐内,启动上述程序。上述程序完成后,取出组织包埋框送病理室包埋组织,同时清洗机器备用。
2)肝脏组织切片
使用切片机切片(切片厚度5μm)。
3)肝脏组织苏木精-伊红(HE)染色
将肝脏组织石蜡切片放入65℃烘箱(30分钟)→二甲苯中(5分钟×3次)→100%酒精(1分钟)→90%酒精(1分钟)→70%酒精(1分钟)→蒸馏水洗→苏木素(5分钟)→自来水洗去切片上的浮色→1%盐酸酒精(1至3秒)→自来水洗数下→Scott促蓝液(碳酸氢钠0.35g,硫酸镁2g,蒸馏水100mL)(1分钟)→自来水洗数下→伊红(1分钟)→蒸馏水洗去切片上的浮色→70%酒精一下→90%酒精一下→100%酒精(30秒×3次)→二甲苯(2分钟×3次)→在二甲苯未干时封片,拍照。
4)肝脏组织油红O染色
①将冰冻肝脏组织切片在通风橱中风干30分钟,4%多聚甲醛固定10分钟。置于双蒸水中稍洗10分钟,以除去组织表明的多聚甲醛。
②以60%异丙醇处理1分钟。
③用油红O(公司sigma,货号O0625,浓度0.5克/100mL 100%异丙醇)染色30分钟。
④之后以60%异丙醇漂洗1分钟×3次,直至背景干净。
⑤用Mayer’s苏木素染液(5滴)淡染细胞核。
⑥水漂洗,稀碳酸锂水溶液中促蓝,充分水洗,水洗至细胞核蓝化。
⑦用甘油明胶封片,拍照。
肝脏重量统计结果如图4所示,在HFD组的CARD6 KO小鼠无论肝脏重量还是肝脏重量与小鼠本身体重比值均较HFD组的CARD6 Flox小鼠高。进一步通过组织切片,进行HE和油红O染色,显微镜下观察各组小鼠肝脏组织在高脂饮食饲养条件下发生了显著的病理改变。通过肝脏HE染色,可以观察到在HFD饲养条件下,CARD6 Flox小鼠和CARD6 KO小鼠肝脏组织均有脂肪沉积,可以看到CARD6 Flox组小鼠的肝细胞发生脂肪变性、空泡化且融合连成片状,肝脏细胞形态已几乎完全破坏,而CARD6-KO组小鼠的肝细胞形态变化更为严重(如图5上)。通过肝脏油红O染色来检测肝组织中脂质,可以发现在HFD组的CARD6 Flox小鼠的肝门静脉周围呈大片红色,提示有大量的脂质沉积,而在HFD组的CARD6 KO小鼠的肝门静脉周围的脂质沉积更显著(如图5下)。这些结果说明CARD6基因敲除小鼠的脂肪肝明显恶化。
上述结果显示CARD6 KO小鼠在HFD的诱导下发生的Ⅱ型糖尿病和脂肪肝病变显著加重。这些结果表明CARD6基因对改善Ⅱ型糖尿病和脂肪肝具有显著的作用。本发明结果说明CARD6基因在脂肪肝、Ⅱ型糖尿病疾病模型中有着重要的保护作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉大学
<120> 胱天蛋白酶募集域蛋白6在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用
<160> 8
<170> PatentIn version 3.3
<210> 1
<211> 23
<212> DNA
<213> CARD6-sgRNA1
<400> 1
ggagagtagg caacatgact tgg 23
<210> 2
<211> 23
<212> DNA
<213> CARD6-sgRNA 2
<400> 2
ggtgaaagca gttatcagta ggg 23
<210> 3
<211> 54
<212> DNA
<213> loxp1-F
<400> 3
agcttgacgt cataacttcg tatagcatac attatagcaa tttataccgg tgat 54
<210> 4
<211> 50
<212> DNA
<213> loxp1-R
<400> 4
atcaccggta taaattgcta taatgtatgc tatacgaagt tatgacgtca 50
<210> 5
<211> 52
<212> DNA
<213> loxp2-F
<400> 5
gatcccttaa gataacttcg tatagcatac attatagcaa tttatacgcg ta 52
<210> 6
<211> 52
<212> DNA
<213> loxp2-R
<400> 6
ctagtacgcg tataaattgc tataatgtat gctatacgaa gttatcttaa gg 52
<210> 7
<211> 104
<212> DNA
<213> CARD6-F
<400> 7
ggggtaccgt atagatttgt taaaaatgaa agtagagtag gcaacatgat aacttcgtat 60
agcatacatt atagcaattt atacttggag tgaaccaact cttg 104
<210> 8
<211> 112
<212> DNA
<213> CARD6-R
<400> 8
ataagaatgc ggccgcaccc tgtaggtgtg tgccaccttg cccagccaga ccctacataa 60
attgctataa tgtatgctat acgaagttat tgataactgc tttcacagtt cc 112
- 还没有人留言评论。精彩留言会获得点赞!