一种亚麻高纤维素含量分子标记制备及应用的制作方法
本发明涉及分子育种技术领域,具体为一种亚麻高纤维素含量分子标记制备及应用。
背景技术:
分子育种是将分子生物学技术应用于育种中,在分子水平上进行育种,通常包括:分子标记辅助育种和遗传修饰育种,分子标记辅助育种是利用分子标记与决定目标性状基因紧密连锁的特点,通过检测分子标记,即可检测到目的基因的存在,达到选择目标性状的目的,具有快速、准确、不受环境条件干扰的优点,转基因育种就是将基因工程应用于育种工作中,通过基因导入,从而培育出一定要求新品种的育种方法,传统的对于高纤维素含量亚麻幼苗的选育,培育时间较长,选育的品种质量不高,同时选育的成本较高,为此,我们提出一种亚麻高纤维素含量分子标记制备及应用。
技术实现要素:
本发明的目的在于提供一种亚麻高纤维素含量分子标记制备及应用,以解决上述背景技术中提出传统的对于高纤维素含量亚麻幼苗的选育,培育时间较长,选育的品种质量不高,同时选育的成本较高的问题。
为实现上述目的,本发明提供如下技术方案:一种亚麻高纤维素含量分子标记制备,该亚麻高纤维素含量分子标记制备的方法步骤如下:
S1:DNA提取:取亚麻幼嫩干净叶片0.2-0.6g,置于离心管中-70℃保存,将叶片从离心管中取出放入研钵中加入0.5-1ml抽提缓冲液,并用玻璃棒研碎成匀浆,移入离心管中,60℃水浴65-75min,水浴的同时定期轻轻的摇动,取出离心管冷却至室温,加入等体积苯酚:氯仿:异戊醇=(25:24:1)充分混匀时间为15-20min,12000r/min离心15min,小心转移上清液到另一离心管中,再加入60-75ul的缓冲液和2倍体积无水乙醇,轻轻上下颠倒5-8次至白色沉淀物出现,-20℃放置60min,用枪头轻轻挑起沉淀DNA,再加入(1-2ml)75%乙醇浸泡清洗沉淀的DNA,轻轻上下颠倒多次后静置10-15min,倒掉乙醇把含有DNA沉淀的离心管倒置在常温中晾干,再加入100ul的TE溶解DNA,-20℃保存备用;
S2:SSR标记的PCR扩增:将提取的DNA测定浓度后稀释至50ng/ul,作为模板进行PCR扩增,SSR扩增体系为:94℃扩增4min;94℃变性1min,60℃退火30s,72℃延伸45s,10个循环,每个循环退火降0.5℃;然后94℃变性1min,55℃退火30s,72℃延伸45s,30个循环;72℃延伸至10min,最后25℃保存10min;
S3:AFLP标记的PCR扩增:包括总DNA的酶切,接头制备,连接,预扩增和选择性扩增;
总DNA的酶切:取总DNA 250ng,5U EcoR I和5U Mse I限制性内切酶,最终体积为25ul,先在37℃水浴3h后,转入65℃水浴1h,最后的酶切产物在-20℃的环境下保持备用;
接头制备:EcoR I接头序列:
左接头(EF):5’-CTCGTAGACTGCTACC-3’
右接头(ER):3’-CTGACGCATGGTTAA-5’
Mse I接头序列:
左接头(MF):5’-GACGATGAGTCCTGAG-3’
右接头(MR):3’-TACTCAGGACTCAT-5’
先将EcoR I、Mse I的左右接头稀释为100umol/L,然后等体积的左右引物混合同一灭菌的离心管中进行复性,复性的PCR程序为:94℃变性1min,70℃退火10min,37℃延伸10min,25℃保存10min,一个循环,反应后放置在冰上10min,最后在-20℃的环境下保存备用;
连接:将双切酶产物加入连接混合液中,总体积为50ul,混匀后4℃过夜,连接完毕后用ddH2O稀释5倍作为预扩增的模板;
预扩增:在25μl PCR反应体系有,含有50ng EA引物,50ng MC引物,5μl酶切连接产物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,20个PCR反应循环参数为:94℃变性30s,56℃退火30s,72℃延伸1min,反应完成后,取5μl PCR产物进行1%琼脂糖凝胶检测,分子量应在250~750bp之间,呈现弥散状,剩余产物稀释30倍,作为下一步PCR扩增的模板,在-20℃环境下保存备用;
预扩增对应的引物序列为:
EA:5’-GACTGCGTACCAATTCA-3’
MC:5’-GATGAGTCCTGAGTAAC-3’
选择性扩增:在15μl PCR反应体系中2ul预扩增产物,50ng EA引物,50ng MC引物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,2mmol/L MgCl2,PCR第一个循环参数为:94℃变性30s,65℃退火30s,72℃延伸1min,共12个循环,每个循环退火温度降0.7℃;然后94℃变性30s,56℃退火30s,72℃延伸1min,24个循环,最后72℃扩增5min,25℃持续10min;
S4:扩增产物的电泳检测:包括PAGE胶的制备,电泳分离和银染显影;
PAGE胶的制备:用洗涤剂将背板和面板彻底洗净,先用去离子水淋洗,再用无水乙醇淋洗并晾干,背板上用光滑的滤纸均匀涂抹无水乙醇擦洗2-3次,晾干后再用1ml硅化液均匀涂抹背板晾晒备用,面板的清洁方式与背板的清洁方式相同,将垫片用水冲洗干净,用吸水纸擦干,放在面板的两侧,将背板道口在面板上,下端对其,两端放置均匀,夹上夹子,用制胶梳试两板之间空隙的松紧,调整夹子的位置从而调节松紧,然后用水平仪将套好的板调至水平,用水把烧杯冲洗干净,加入约(45-50ml)16%的PAGE胶和40ul TEMED,玻璃棒搅拌均匀,将倒胶口一端调高,顺着胶口均匀的倒入凝胶,在凝胶接近末端时将玻璃板调平,然后水平插入制胶梳,插入深度约5mm左右,夹上夹子放置40min备用;
电泳分离:将制好的凝胶上的夹子取下,用水将玻璃板冲洗干净,取下胶口上的胶条,用水将胶口冲洗干净,将扩增产物放置在胶板的垂直槽上,夹紧夹子,加入1×TBE的缓冲液,上端要淹没电极,电泳的参数设置为:U:2000V、I:100mA、P:80W,预电泳30min后,停掉电源,用注射器将点样槽里的气泡和杂质清除,插入点样梳,点完样后按预电泳参数继续电泳,SSR标记待第一条指示剂泳道出胶后即可终止电泳,AFLP标记待第二条指示剂泳道离板底约4cm左右即可终止电泳;
银染显影:电泳完毕后,剥离下胶板,将其浸入(1L)10%冰乙酸中,轻轻摇动置指示剂消失为止,然后用去离子水漂洗胶板2-3次,然后放入1L染色液中进行染色,轻微晃动的时间为30-40min,取出胶板,用蒸馏水中迅速漂洗,立即转入1L预冷的显影液,轻轻摇动至出现清晰可见的条带停止显影,最后用自来水漂洗5min,室温晾干,拍照保存。
优选的,一种亚麻高纤维素含量分子标记应用的方法步骤如下:
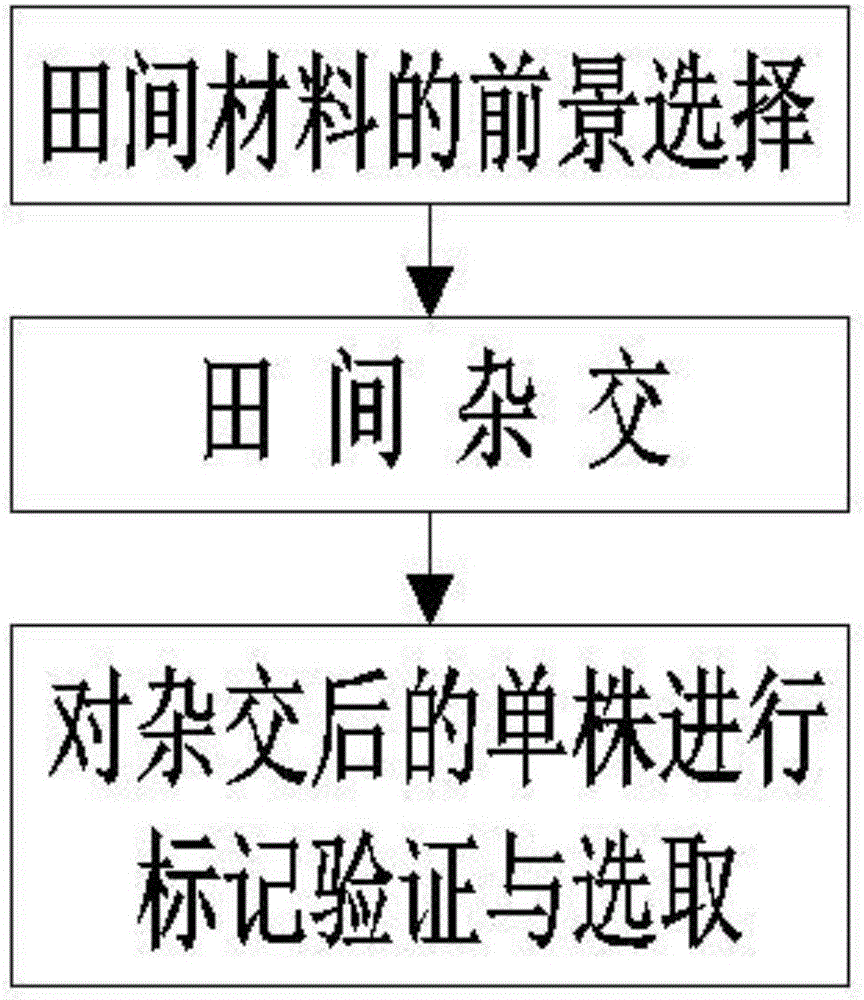
S1:田间材料的前景选择:用基因池筛选得到前景标记对回交组合后代进行前景选择,分离单株中在前景标记点选择表现为杂合即表示携带了目的性状的区段,确定为目的单株;
S2:田间杂交:首先用供体亲本和轮回亲本进行杂交,在后代个体中选择具有目的性状的单株继续与轮回亲本进行杂交,每次回交都对分离单株进行前景和背景选择,选择后挑选目的单株继续后续的回交;
S3:对杂交后的单株进行标记验证与选取:选取杂交单株后代20-30粒饱满种子磨碎后倒入试管中,在试管中加入2ml乙醚:石油醚=(1:1)的混合溶液,然后加入等体积的甲醇进行酯化反应,静置1小时使其充分反应,最后加入蒸馏水定容至10ml萃取,取上层溶液进行电泳检测,通过与扩增产物的电泳检测获取的影像对比,筛选出含有被标记的亚麻高纤维素含量的亲本。
与现有技术相比,本发明的有益效果是:本发明通过对高亚麻纤维素的DNA进行SSR标记和AFLP标记,有利于选育出具有高纤维素含量的幼苗,通过选育出的幼苗得到高纤维素的种子,方便对幼苗的培育和筛选,加速育苗的培育,缩短育种年限,减少选育成本。
附图说明
图1为本发明制备方法步骤图;
图2为本发明应用方法步骤图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一
一种亚麻高纤维素含量分子标记制备,该亚麻高纤维素含量分子标记制备的方法步骤如下:
S1:DNA提取:取亚麻幼嫩干净叶片0.2g,置于离心管中-70℃保存,将叶片从离心管中取出放入研钵中加入0.5ml抽提缓冲液,并用玻璃棒研碎成匀浆,移入离心管中,60℃水浴65min,水浴的同时定期轻轻的摇动,取出离心管冷却至室温,加入等体积苯酚:氯仿:异戊醇=(25:24:1)充分混匀时间为15min,12000r/min离心15min,小心转移上清液到另一离心管中,再加入60ul的缓冲液和2倍体积无水乙醇,轻轻上下颠倒5-8次至白色沉淀物出现,-20℃放置60min,用枪头轻轻挑起沉淀DNA,再加入(1ml)75%乙醇浸泡清洗沉淀的DNA,轻轻上下颠倒多次后静置10min,倒掉乙醇把含有DNA沉淀的离心管倒置在常温中晾干,再加入100ul的TE溶解DNA,-20℃保存备用;
S2:SSR标记的PCR扩增:将提取的DNA测定浓度后稀释至50ng/ul,作为模板进行PCR扩增,SSR扩增体系为:94℃扩增4min;94℃变性1min,60℃退火30s,72℃延伸45s,10个循环,每个循环退火降0.5℃;然后94℃变性1min,55℃退火30s,72℃延伸45s,30个循环;72℃延伸至10min,最后25℃保存10min;
S3:AFLP标记的PCR扩增:包括总DNA的酶切,接头制备,连接,预扩增和选择性扩增;
总DNA的酶切:取总DNA 250ng,5U EcoR I和5U Mse I限制性内切酶,最终体积为25ul,先在37℃水浴3h后,转入65℃水浴1h,最后的酶切产物在-20℃的环境下保持备用;
接头制备:EcoR I接头序列:
左接头(EF):5’-CTCGTAGACTGCTACC-3’
右接头(ER):3’-CTGACGCATGGTTAA-5’
Mse I接头序列:
左接头(MF):5’-GACGATGAGTCCTGAG-3’
右接头(MR):3’-TACTCAGGACTCAT-5’
先将EcoR I、Mse I的左右接头稀释为100umol/L,然后等体积的左右引物混合同一灭菌的离心管中进行复性,复性的PCR程序为:94℃变性1min,70℃退火10min,37℃延伸10min,25℃保存10min,一个循环,反应后放置在冰上10min,最后在-20℃的环境下保存备用;
连接:将双切酶产物加入连接混合液中,总体积为50ul,混匀后4℃过夜,连接完毕后用ddH2O稀释5倍作为预扩增的模板;
预扩增:在25μl PCR反应体系有,含有50ng EA引物,50ng MC引物,5μl酶切连接产物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,20个PCR反应循环参数为:94℃变性30s,56℃退火30s,72℃延伸1min,反应完成后,取5μl PCR产物进行1%琼脂糖凝胶检测,分子量应在250~750bp之间,呈现弥散状,剩余产物稀释30倍,作为下一步PCR扩增的模板,在-20℃环境下保存备用;
预扩增对应的引物序列为:
EA:5’-GACTGCGTACCAATTCA-3’
MC:5’-GATGAGTCCTGAGTAAC-3’
选择性扩增:在15μl PCR反应体系中2ul预扩增产物,50ng EA引物,50ng MC引物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,2mmol/L MgCl2,PCR第一个循环参数为:94℃变性30s,65℃退火30s,72℃延伸1min,共12个循环,每个循环退火温度降0.7℃;然后94℃变性30s,56℃退火30s,72℃延伸1min,24个循环,最后72℃扩增5min,25℃持续10min;
S4:扩增产物的电泳检测:包括PAGE胶的制备,电泳分离和银染显影;
PAGE胶的制备:用洗涤剂将背板和面板彻底洗净,先用去离子水淋洗,再用无水乙醇淋洗并晾干,背板上用光滑的滤纸均匀涂抹无水乙醇擦洗2-3次,晾干后再用1ml硅化液均匀涂抹背板晾晒备用,面板的清洁方式与背板的清洁方式相同,将垫片用水冲洗干净,用吸水纸擦干,放在面板的两侧,将背板道口在面板上,下端对其,两端放置均匀,夹上夹子,用制胶梳试两板之间空隙的松紧,调整夹子的位置从而调节松紧,然后用水平仪将套好的板调至水平,用水把烧杯冲洗干净,加入约(45ml)16%的PAGE胶和40ul TEMED,玻璃棒搅拌均匀,将倒胶口一端调高,顺着胶口均匀的倒入凝胶,在凝胶接近末端时将玻璃板调平,然后水平插入制胶梳,插入深度约5mm左右,夹上夹子放置40min备用;
电泳分离:将制好的凝胶上的夹子取下,用水将玻璃板冲洗干净,取下胶口上的胶条,用水将胶口冲洗干净,将扩增产物放置在胶板的垂直槽上,夹紧夹子,加入1×TBE的缓冲液,上端要淹没电极,电泳的参数设置为:U:2000V、I:100mA、P:80W,预电泳30min后,停掉电源,用注射器将点样槽里的气泡和杂质清除,插入点样梳,点完样后按预电泳参数继续电泳,SSR标记待第一条指示剂泳道出胶后即可终止电泳,AFLP标记待第二条指示剂泳道离板底约4cm左右即可终止电泳;
银染显影:电泳完毕后,剥离下胶板,将其浸入(1L)10%冰乙酸中,轻轻摇动置指示剂消失为止,然后用去离子水漂洗胶板2次,然后放入1L染色液中进行染色,轻微晃动的时间为30min,取出胶板,用蒸馏水中迅速漂洗,立即转入1L预冷的显影液,轻轻摇动至出现清晰可见的条带停止显影,最后用自来水漂洗5min,室温晾干,拍照保存。
本发明还提供了一种亚麻高纤维素含量分子标记应用的方法步骤如下:
S1:田间材料的前景选择:用基因池筛选得到前景标记对回交组合后代进行前景选择,分离单株中在前景标记点选择表现为杂合即表示携带了目的性状的区段,确定为目的单株;
S2:田间杂交:首先用供体亲本和轮回亲本进行杂交,在后代个体中选择具有目的性状的单株继续与轮回亲本进行杂交,每次回交都对分离单株进行前景和背景选择,选择后挑选目的单株继续后续的回交;
S3:对杂交后的单株进行标记验证与选取:选取杂交单株后代20粒饱满种子磨碎后倒入试管中,在试管中加入2ml乙醚:石油醚=(1:1)的混合溶液,然后加入等体积的甲醇进行酯化反应,静置1小时使其充分反应,最后加入蒸馏水定容至10ml萃取,取上层溶液进行电泳检测,通过与扩增产物的电泳检测获取的影像对比,筛选出含有被标记的亚麻高纤维素含量的亲本。
实施例二
一种亚麻高纤维素含量分子标记制备,该亚麻高纤维素含量分子标记制备的方法步骤如下:
S1:DNA提取:取亚麻幼嫩干净叶片0.4g,置于离心管中-70℃保存,将叶片从离心管中取出放入研钵中加入0.75ml抽提缓冲液,并用玻璃棒研碎成匀浆,移入离心管中,60℃水浴70min,水浴的同时定期轻轻的摇动,取出离心管冷却至室温,加入等体积苯酚:氯仿:异戊醇=(25:24:1)充分混匀时间为18min,12000r/min离心15min,小心转移上清液到另一离心管中,再加入70ul的缓冲液和2倍体积无水乙醇,轻轻上下颠倒5-8次至白色沉淀物出现,-20℃放置60min,用枪头轻轻挑起沉淀DNA,再加入(1.5ml)75%乙醇浸泡清洗沉淀的DNA,轻轻上下颠倒多次后静置13min,倒掉乙醇把含有DNA沉淀的离心管倒置在常温中晾干,再加入100ul的TE溶解DNA,-20℃保存备用;
S2:SSR标记的PCR扩增:将提取的DNA测定浓度后稀释至50ng/ul,作为模板进行PCR扩增,SSR扩增体系为:94℃扩增4min;94℃变性1min,60℃退火30s,72℃延伸45s,10个循环,每个循环退火降0.5℃;然后94℃变性1min,55℃退火30s,72℃延伸45s,30个循环;72℃延伸至10min,最后25℃保存10min;
S3:AFLP标记的PCR扩增:包括总DNA的酶切,接头制备,连接,预扩增和选择性扩增;
总DNA的酶切:取总DNA 250ng,5U EcoR I和5U Mse I限制性内切酶,最终体积为25ul,先在37℃水浴3h后,转入65℃水浴1h,最后的酶切产物在-20℃的环境下保持备用;
接头制备:EcoR I接头序列:
左接头(EF):5’-CTCGTAGACTGCTACC-3’
右接头(ER):3’-CTGACGCATGGTTAA-5’
Mse I接头序列:
左接头(MF):5’-GACGATGAGTCCTGAG-3’
右接头(MR):3’-TACTCAGGACTCAT-5’
先将EcoR I、Mse I的左右接头稀释为100umol/L,然后等体积的左右引物混合同一灭菌的离心管中进行复性,复性的PCR程序为:94℃变性1min,70℃退火10min,37℃延伸10min,25℃保存10min,一个循环,反应后放置在冰上10min,最后在-20℃的环境下保存备用;
连接:将双切酶产物加入连接混合液中,总体积为50ul,混匀后4℃过夜,连接完毕后用ddH2O稀释5倍作为预扩增的模板;
预扩增:在25μl PCR反应体系有,含有50ng EA引物,50ng MC引物,5μl酶切连接产物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,20个PCR反应循环参数为:94℃变性30s,56℃退火30s,72℃延伸1min,反应完成后,取5μl PCR产物进行1%琼脂糖凝胶检测,分子量应在250~750bp之间,呈现弥散状,剩余产物稀释30倍,作为下一步PCR扩增的模板,在-20℃环境下保存备用;
预扩增对应的引物序列为:
EA:5’-GACTGCGTACCAATTCA-3’
MC:5’-GATGAGTCCTGAGTAAC-3’
选择性扩增:在15μl PCR反应体系中2ul预扩增产物,50ng EA引物,50ng MC引物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,2mmol/L MgCl2,PCR第一个循环参数为:94℃变性30s,65℃退火30s,72℃延伸1min,共12个循环,每个循环退火温度降0.7℃;然后94℃变性30s,56℃退火30s,72℃延伸1min,24个循环,最后72℃扩增5min,25℃持续10min;
S4:扩增产物的电泳检测:包括PAGE胶的制备,电泳分离和银染显影;
PAGE胶的制备:用洗涤剂将背板和面板彻底洗净,先用去离子水淋洗,再用无水乙醇淋洗并晾干,背板上用光滑的滤纸均匀涂抹无水乙醇擦洗2-3次,晾干后再用1ml硅化液均匀涂抹背板晾晒备用,面板的清洁方式与背板的清洁方式相同,将垫片用水冲洗干净,用吸水纸擦干,放在面板的两侧,将背板道口在面板上,下端对其,两端放置均匀,夹上夹子,用制胶梳试两板之间空隙的松紧,调整夹子的位置从而调节松紧,然后用水平仪将套好的板调至水平,用水把烧杯冲洗干净,加入约(48ml)16%的PAGE胶和40ul TEMED,玻璃棒搅拌均匀,将倒胶口一端调高,顺着胶口均匀的倒入凝胶,在凝胶接近末端时将玻璃板调平,然后水平插入制胶梳,插入深度约5mm左右,夹上夹子放置40min备用;
电泳分离:将制好的凝胶上的夹子取下,用水将玻璃板冲洗干净,取下胶口上的胶条,用水将胶口冲洗干净,将扩增产物放置在胶板的垂直槽上,夹紧夹子,加入1×TBE的缓冲液,上端要淹没电极,电泳的参数设置为:U:2000V、I:100mA、P:80W,预电泳30min后,停掉电源,用注射器将点样槽里的气泡和杂质清除,插入点样梳,点完样后按预电泳参数继续电泳,SSR标记待第一条指示剂泳道出胶后即可终止电泳,AFLP标记待第二条指示剂泳道离板底约4cm左右即可终止电泳;
银染显影:电泳完毕后,剥离下胶板,将其浸入(1L)10%冰乙酸中,轻轻摇动置指示剂消失为止,然后用去离子水漂洗胶板3次,然后放入1L染色液中进行染色,轻微晃动的时间为35min,取出胶板,用蒸馏水中迅速漂洗,立即转入1L预冷的显影液,轻轻摇动至出现清晰可见的条带停止显影,最后用自来水漂洗5min,室温晾干,拍照保存。
本发明还提供了一种亚麻高纤维素含量分子标记应用的方法步骤如下:
S1:田间材料的前景选择:用基因池筛选得到前景标记对回交组合后代进行前景选择,分离单株中在前景标记点选择表现为杂合即表示携带了目的性状的区段,确定为目的单株;
S2:田间杂交:首先用供体亲本和轮回亲本进行杂交,在后代个体中选择具有目的性状的单株继续与轮回亲本进行杂交,每次回交都对分离单株进行前景和背景选择,选择后挑选目的单株继续后续的回交;
S3:对杂交后的单株进行标记验证与选取:选取杂交单株后代25粒饱满种子磨碎后倒入试管中,在试管中加入2ml乙醚:石油醚=(1:1)的混合溶液,然后加入等体积的甲醇进行酯化反应,静置1小时使其充分反应,最后加入蒸馏水定容至10ml萃取,取上层溶液进行电泳检测,通过与扩增产物的电泳检测获取的影像对比,筛选出含有被标记的亚麻高纤维素含量的亲本。
实施例三
一种亚麻高纤维素含量分子标记制备,该亚麻高纤维素含量分子标记制备的方法步骤如下:
S1:DNA提取:取亚麻幼嫩干净叶片0.6g,置于离心管中-70℃保存,将叶片从离心管中取出放入研钵中加入1ml抽提缓冲液,并用玻璃棒研碎成匀浆,移入离心管中,60℃水浴75min,水浴的同时定期轻轻的摇动,取出离心管冷却至室温,加入等体积苯酚:氯仿:异戊醇=(25:24:1)充分混匀时间为15-20min,12000r/min离心15min,小心转移上清液到另一离心管中,再加入75ul的缓冲液和2倍体积无水乙醇,轻轻上下颠倒5-8次至白色沉淀物出现,-20℃放置60min,用枪头轻轻挑起沉淀DNA,再加入(2ml)75%乙醇浸泡清洗沉淀的DNA,轻轻上下颠倒多次后静置15min,倒掉乙醇把含有DNA沉淀的离心管倒置在常温中晾干,再加入100ul的TE溶解DNA,-20℃保存备用;
S2:SSR标记的PCR扩增:将提取的DNA测定浓度后稀释至50ng/ul,作为模板进行PCR扩增,SSR扩增体系为:94℃扩增4min;94℃变性1min,60℃退火30s,72℃延伸45s,10个循环,每个循环退火降0.5℃;然后94℃变性1min,55℃退火30s,72℃延伸45s,30个循环;72℃延伸至10min,最后25℃保存10min;
S3:AFLP标记的PCR扩增:包括总DNA的酶切,接头制备,连接,预扩增和选择性扩增;
总DNA的酶切:取总DNA 250ng,5U EcoR I和5U Mse I限制性内切酶,最终体积为25ul,先在37℃水浴3h后,转入65℃水浴1h,最后的酶切产物在-20℃的环境下保持备用;
接头制备:EcoR I接头序列:
左接头(EF):5’-CTCGTAGACTGCTACC-3’
右接头(ER):3’-CTGACGCATGGTTAA-5’
Mse I接头序列:
左接头(MF):5’-GACGATGAGTCCTGAG-3’
右接头(MR):3’-TACTCAGGACTCAT-5’
先将EcoR I、Mse I的左右接头稀释为100umol/L,然后等体积的左右引物混合同一灭菌的离心管中进行复性,复性的PCR程序为:94℃变性1min,70℃退火10min,37℃延伸10min,25℃保存10min,一个循环,反应后放置在冰上10min,最后在-20℃的环境下保存备用;
连接:将双切酶产物加入连接混合液中,总体积为50ul,混匀后4℃过夜,连接完毕后用ddH2O稀释5倍作为预扩增的模板;
预扩增:在25μl PCR反应体系有,含有50ng EA引物,50ng MC引物,5μl酶切连接产物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,20个PCR反应循环参数为:94℃变性30s,56℃退火30s,72℃延伸1min,反应完成后,取5μl PCR产物进行1%琼脂糖凝胶检测,分子量应在250~750bp之间,呈现弥散状,剩余产物稀释30倍,作为下一步PCR扩增的模板,在-20℃环境下保存备用;
预扩增对应的引物序列为:
EA:5’-GACTGCGTACCAATTCA-3’
MC:5’-GATGAGTCCTGAGTAAC-3’
选择性扩增:在15μl PCR反应体系中2ul预扩增产物,50ng EA引物,50ng MC引物,0.2mmol/L dNTPs,1U Taq酶,1×PCR缓冲液,2mmol/L MgCl2,PCR第一个循环参数为:94℃变性30s,65℃退火30s,72℃延伸1min,共12个循环,每个循环退火温度降0.7℃;然后94℃变性30s,56℃退火30s,72℃延伸1min,24个循环,最后72℃扩增5min,25℃持续10min;
S4:扩增产物的电泳检测:包括PAGE胶的制备,电泳分离和银染显影;
PAGE胶的制备:用洗涤剂将背板和面板彻底洗净,先用去离子水淋洗,再用无水乙醇淋洗并晾干,背板上用光滑的滤纸均匀涂抹无水乙醇擦洗2-3次,晾干后再用1ml硅化液均匀涂抹背板晾晒备用,面板的清洁方式与背板的清洁方式相同,将垫片用水冲洗干净,用吸水纸擦干,放在面板的两侧,将背板道口在面板上,下端对其,两端放置均匀,夹上夹子,用制胶梳试两板之间空隙的松紧,调整夹子的位置从而调节松紧,然后用水平仪将套好的板调至水平,用水把烧杯冲洗干净,加入约(50ml)16%的PAGE胶和40ul TEMED,玻璃棒搅拌均匀,将倒胶口一端调高,顺着胶口均匀的倒入凝胶,在凝胶接近末端时将玻璃板调平,然后水平插入制胶梳,插入深度约5mm左右,夹上夹子放置40min备用;
电泳分离:将制好的凝胶上的夹子取下,用水将玻璃板冲洗干净,取下胶口上的胶条,用水将胶口冲洗干净,将扩增产物放置在胶板的垂直槽上,夹紧夹子,加入1×TBE的缓冲液,上端要淹没电极,电泳的参数设置为:U:2000V、I:100mA、P:80W,预电泳30min后,停掉电源,用注射器将点样槽里的气泡和杂质清除,插入点样梳,点完样后按预电泳参数继续电泳,SSR标记待第一条指示剂泳道出胶后即可终止电泳,AFLP标记待第二条指示剂泳道离板底约4cm左右即可终止电泳;
银染显影:电泳完毕后,剥离下胶板,将其浸入(1L)10%冰乙酸中,轻轻摇动置指示剂消失为止,然后用去离子水漂洗胶板3次,然后放入1L染色液中进行染色,轻微晃动的时间为40min,取出胶板,用蒸馏水中迅速漂洗,立即转入1L预冷的显影液,轻轻摇动至出现清晰可见的条带停止显影,最后用自来水漂洗5min,室温晾干,拍照保存。
本发明还提供了一种亚麻高纤维素含量分子标记应用的方法步骤如下:
S1:田间材料的前景选择:用基因池筛选得到前景标记对回交组合后代进行前景选择,分离单株中在前景标记点选择表现为杂合即表示携带了目的性状的区段,确定为目的单株;
S2:田间杂交:首先用供体亲本和轮回亲本进行杂交,在后代个体中选择具有目的性状的单株继续与轮回亲本进行杂交,每次回交都对分离单株进行前景和背景选择,选择后挑选目的单株继续后续的回交;
S3:对杂交后的单株进行标记验证与选取:选取杂交单株后代30粒饱满种子磨碎后倒入试管中,在试管中加入2ml乙醚:石油醚=(1:1)的混合溶液,然后加入等体积的甲醇进行酯化反应,静置1小时使其充分反应,最后加入蒸馏水定容至10ml萃取,取上层溶液进行电泳检测,通过与扩增产物的电泳检测获取的影像对比,筛选出含有被标记的亚麻高纤维素含量的亲本。
根据实施例一、二、三的实验结果总结得出:最佳实施方案为实施例二。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!