抗逆相关蛋白IbCPK28及其编码基因与应用的制作方法
本发明属于生物技术领域,具体涉及抗逆相关蛋白IbCPK28及其编码基因与应用。
背景技术:
甘薯(Ipomoea batatas(L.)Lam.)是一种重要的粮食、饲料以及工业原料用作物,并且在当今世界上作为一种新型能源植物,其地位显得尤为重要。我国是世界上最大的甘薯生产国,年种植面积338.7万hm2,占世界总种植面积的42.2%,年产量占世界总产量的67.94%。随着耕地面积的不断减少和能源压力的不断增大,大部分的甘薯种植于东南沿海坡地和西部的广大旱区,这些地区的土壤含盐分高、旱区土壤返盐严重,给甘薯生产的进一步发展带来了一定的因难。此外,甘薯真菌病害严重影响着甘薯生产,尤其是甘薯蔓割病、软腐病、黑斑病已成为我国甘薯主要种植区的主要病害,对甘薯产量和品质造成巨大的危害。因此,选育抗逆性强的甘薯新品种成为我国育种的主要目标,抗逆性具体可为抗盐性、抗旱性、抗氧化性和抗病性。
甘薯是无性繁殖作物,具有种间、种内杂交不亲和的特性,该特性严重限制了甘薯育种中的资源利用和亲本自由组配。长期育种实践表明,常规杂交育种方法难以选育出优质、高产、抗蔓割病的甘薯新品种。因此,采用基因工程技术培育甘薯抗逆新品种是一种可行途径。
技术实现要素:
本发明所要解决的技术问题是如何提高植物的抗逆性。
为解决上述问题,本发明首先提供了一种抗逆相关蛋白。
本发明所提供的抗逆相关蛋白,名称为蛋白质IbCPK28,来源于甘薯(Ipomoea batatas(L.)Lam.),为如下1)或2)或3):
1)氨基酸序列是序列表中序列2所示的蛋白质;
2)在序列表中序列2所示的蛋白质的N端或/和C端连接标签得到的融合蛋白质;
3)将1)或2)所示的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物抗逆性相关的蛋白质。
其中,序列表中序列2由559个氨基酸残基组成。
为了使1)中的蛋白质便于纯化,可在序列表中序列2所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1.标签的序列
上述3)中的蛋白质IbCPK28,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
上述3)中的蛋白质IbCPK28可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述3)中的蛋白质IbCPK28的编码基因可通过将序列表中序列1自5′末端起第1至1680位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。
编码所述蛋白质IbCPK28的核酸分子也属于本发明的保护范围。
所述编码蛋白质IbCPK28的核酸分子可为如下(a1)或(a2)或(a3)或(a4)所示的DNA分子:
(a1)编码区如序列表中序列1自5′末端起第1至1680位所示的DNA分子;
(a2)核苷酸序列是序列表中序列1自5′末端起第1至1680位所示的DNA分子;
(a3)与(a1)或(a2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质IbCPK28的DNA分子;
(a4)在严格条件下与(a1)或(a2)限定的核苷酸序列杂交,且编码所述蛋白质IbCPK28的DNA分子。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
其中,序列表中序列1由2136个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码蛋白质IbCPK28的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的蛋白质IbCPK28的核苷酸序列75%或者更高同一性的核苷酸,只要编码蛋白质IbCPK28且与植物抗逆性相关,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表中序列2所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
含有编码所述蛋白质IbCPK28的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系也属于本发明的保护范围。
所述表达盒可为表达盒A;所述表达盒A包括启动子、编码所述蛋白质IbCPK28的核酸分子和终止子。所述启动子可为CaMV35S启动子、NOS启动子或OCS启动子。所述终止子可为NOS终止子或OCS polyA终止子。
所述表达盒A的序列可为序列表中序列3所示。所述表达盒A中:序列表中序列3自5′末端起第1至835位为CaMV35S启动子,第848至2527位为IbCPK28蛋白的编码基因,第2544至2796位为NOS终止子。
所述重组载体可为将编码所述蛋白质IbCPK28的核酸分子(即序列表中序列1自5′末端起第1至1680位所示的DNA分子)通过含有编码所述蛋白质IbCPK28的核酸分子的表达盒插入出发质粒得到的重组质粒。
所述重组载体具体可为重组质粒pCB-IbCPK28。重组质粒pCB-IbCPK28的构建过程如下:(A)用限制性内切酶HindIII和EcoRI双酶切载体pCAMBIA3301得到载体骨架,用限制性内切酶HindIII和EcoRI双酶切载体pBI121,回收约3032bp的片段,将载体骨架和片段连接,得到重组质粒pCBGUS;(B)用序列表中序列1自5′末端起第1至1680位所示的DNA分子替换重组质粒pCBGUS的限制性内切酶XbaI和SacI识别序列间的片段(重组质粒pCBGUS被限制性核酸内切酶XbaI和SacI切成一个大片段和一个小片段,该DNA为该小片段)得到的重组质粒pCB-IbCPK28,重组质粒pCB-IbCPK28表达序列表中序列2所示的蛋白质IbCPK28。
所述重组微生物可通过将所述重组载体导入出发微生物得到。
所述出发微生物可为酵母、细菌、藻类或真菌。所述细菌可为革兰氏阳性细菌或革兰氏阴性细菌。所述革兰氏阴性细菌可为根癌农杆菌(Agrobacterium tumefaciens)。所述根癌农杆菌(Agrobacterium tumefaciens)具体可为根癌农杆菌EHA105。
所述重组微生物具体可为EHA105/pCB-IbCPK28。EHA105/pCB-IbCPK28是将重组质粒重组质粒pCB-IbCPK28转化根癌农杆菌EHA105得到的重组农杆菌。
所述转基因植物细胞系均不包括繁殖材料。所述转基因植物理解为不仅包含将所述IbCPK28基因(即IbCPK28蛋白的编码基因)转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
下述b1)或b2)也属于本发明的保护范围:
b1)所述蛋白质IbCPK28,或,编码所述蛋白质IbCPK28的核酸分子,或,含有编码所述蛋白质IbCPK28的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系,在调控植物抗逆性中的应用;
b2)所述蛋白质IbCPK28,或,编码所述蛋白质IbCPK28的核酸分子,或,含有编码所述蛋白质IbCPK28的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系,在培育抗逆性改变的转基因植物中的应用。
上述应用中,所述调控植物抗逆性可为提高植物抗逆性或降低植物抗逆性。
上述应用中,所述抗逆性改变可为抗逆性提高或抗逆性降低。
为解决上述技术问题,本发明还提供了培育转基因植物的方法。
本发明所提供的培育转基因植物的方法,具体可为培育转基因植物的方法一,包括将编码所述蛋白质IbCPK28的核酸分子导入受体植物中,得到转基因植物的步骤;所述转基因植物与所述受体植物相比抗逆性提高。
上述培育转基因植物的方法一中,所述编码蛋白质IbCPK28的核酸分子可为如下(a1)或(a2)或(a3)或(a4)所示的DNA分子:
(a1)编码区如序列表中序列1自5′末端起第1至1680位所示的DNA分子;
(a2)核苷酸序列是序列表中序列1自5′末端起第1至1680位所示的DNA分子;
(a3)与(a1)或(a2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质IbCPK28的DNA分子;
(a4)在严格条件下与(a1)或(a2)限定的核苷酸序列杂交,且编码所述蛋白质IbCPK28的DNA分子。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
其中,序列表中序列1由2136个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
上述培育转基因植物的方法一中,所述“将编码所述蛋白质IbCPK28的核酸分子导入受体植物中”可通过向受体植物中导入重组载体甲实现;所述重组载体甲可为向表达载体或克隆载体插入编码所述蛋白质IbCPK28的核酸分子得到的重组质粒。
所述重组载体甲具体可为所述重组质粒pCB-IbCPK28。
本发明所提供的培育转基因植物的方法,具体可为培育转基因植物的方法二,包括向受体植物中导入抑制所述蛋白质IbCPK28表达的物质,得到转基因植物的步骤;所述转基因植物与所述受体植物相比抗逆性降低。
上述培育转基因植物的方法二中,所述“向受体植物中导入抑制所述蛋白质IbCPK28表达的物质”可通过向受体植物中导入重组载体乙实现。所述重组载体乙具体可为重组质粒pFGC5941-IbCPK28。重组质粒pFGC5941-IbCPK28为将载体pFGC5941的限制性内切酶BamHI和XbaI识别序列间的小片段替换为序列表中序列1自5′末端起第1669至2075位所示的DNA分子的反向互补序列,将限制性内切酶XhoI和SwaI识别序列间的小片段替换为序列表中序列1自5′末端起第1669至2075位所示的DNA分子,得到的重组质粒。
为解决上述技术问题,本发明还提供植物育种方法。
本发明所提供的植物育种方法,具体可为植物育种方法一,包括如下步骤:增加植物中所述蛋白质IbCPK28的含量或活性,从而提高植物的抗逆性。
上述植物育种方法一中,所述“增加植物中所述蛋白质IbCPK28的含量或活性”可通过多拷贝、改变启动子、调控因子、转基因等本领域熟知的方法,达到增加植物中所述蛋白质IbCPK28的含量或活性的效果。
本发明所提供的植物育种方法,具体可为植物育种方法二,包括如下步骤:降低植物中所述蛋白质IbCPK28的含量或活性,从而降低植物的抗逆性。
上述植物育种方法二中,所述“降低植物中所述蛋白质IbCPK28的含量或活性”可通过RNA干扰、同源重组、基因定点编辑等本领域熟知的方法,达到降低植物中所述蛋白质IbCPK28的含量或活性的目的。
上述任一所述抗逆性可为抗盐性和/或抗旱性和/或抗氧化性和/或抗病性。
所述抗病性可为c1)或c2):c1)抗蔓割病;c2)抗甘薯蔓割病菌引起的病害。
上述任一所述植物是如下c1)至c5)中的任一种:
c1)双子叶植物;
c2)单子叶植物;
c3)薯蓣科植物;
c4)甘薯;
c5)甘薯品种栗子香。
实验证明,利用本发明提供的抗逆相关蛋白IbCPK28及其编码基因能提高植物的抗逆性:在甘薯中过表达IbCPK28基因可提高甘薯的抗逆性,干涉IbCPK28基因则可降低甘薯的抗逆性;抗逆性可为抗盐性和/或抗旱性和/或抗氧化性和/或抗病性;抗病性为抗蔓割病或抗甘薯蔓割病菌引起的病害。因此,抗逆相关蛋白IbCPK28及其编码基因在调控植物抗逆性中具有重要的理论意义和实用价值。
附图说明
图1为甘薯拟转基因植株的PCR扩增结果。
图2为甘薯植株的生长状态。
图3为甘薯植株的表型指标统计结果。
图4为甘薯植株的生长状态。
图5为甘薯植株的表型指标统计结果。
图6为生理生化指标的测定结果。
图7为生理生化指标的测定结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
甘薯耐盐突变体ND98记载于如下文献中:何绍贞.甘薯耐盐突变体的离体筛选及耐盐候选基因的克隆.中国农业大学博士学位论文,2008。公众可从中国农业大学甘薯遗传育种研究室获得,以重复本实验。
栗子香(王玉萍等,中国农业科学,2003,36(9):1000-1005)为一甘薯品种,公众可从中国农业大学甘薯遗传育种研究室获得,以重复本实验。
克隆载体pMD19-T为宝生物工程(大连)公司产品,产品目录号为6013。载体pCAMBIA3301为Cambia公司产品。载体pBI121为Clontech公司产品。植物总RNA提取试剂盒为天根生化科技(北京)有限公司产品,目录号为DP432。pEASY-Blunt simple载体为北京全式金生物技术有限公司的产品。PrimeScriptTM 1st Strand cDNA Synthesis Kit为宝生物工程(大连)有限公司的产品,产品目录号为6110A。
甘薯蔓割病菌和PDA培养基均记载于如下文献中:户勋,余萍,方一泓,李薇.甘薯蔓割病菌对甘薯的诱导抗性和PR蛋白的性质测定.2007年11月,福建师范大学学报(自然科学版)。
载体pFGC5941记载于如下文献中:K Mcginnis,et al.Transgene-induced RNA interference as a tool for plant functional genomics.Methods in Enzymology,2005,392:1-24,公众可从中国农业大学甘薯遗传育种研究室获得,以重复本实验。
1/2霍格兰营养液记载于如下文献中:刘德高.过表达IbP5CR、IbERD3、IbELT、IbNFU1基因的甘薯植株的获得及耐盐性鉴定.北京.2014年.中国农业大学博士毕业论文。
实施例1、IbCPK28基因的获得
IbCPK28基因的获得的步骤如下:
1、模板的获得
用植物总RNA提取试剂盒提取甘薯耐盐突变体ND98的幼嫩叶片的总RNA,将该总RNA用PrimeScriptTM 1st Strand cDNA Synthesis Kit反转录出第一链cDNA。
2、构建cDNA-AFLP差减库,获得序列表中序列4所示的EST序列。根据EST序列的核苷酸序列,设计并人工合成引物3CPK-57和3CPK-81。
3、完成步骤2后,以步骤1获得的cDNA为模板,以步骤3合成的3CPK-57和3CPK-81为引物,利用RACE方法扩增获得约1500bp的3′-RACE片段,将3′-RACE片段和克隆载体pMD19-T连接,得到重组质粒2。将重组质粒2进行测序,获得3′-RACE片段的核苷酸序列。
4、根据EST序列的核苷酸序列,设计并人工合成引物5CPK-77、5CPK-130和5CPK-259。
5、完成步骤4后,以步骤1获得的cDNA为模板,以步骤4合成的5CPK-77、5CPK-130和5CPK-259为引物,利用RACE方法扩增获得约1400bp的5′-RACE片段,将5′-RACE片段和克隆载体pMD19-T连接,得到重组质粒3。将重组质粒3进行测序,获得5′-RACE片段的核苷酸序列。
6、根据步骤3获得的3′-RACE片段的核苷酸序列和步骤5获得的5′-RACE片段的核苷酸序列,利用DNAMAN 6.0软件拼接候选的IbCPK28基因。依据拼接候选的IbCPK28基因序列进一步设计并人工合成引物O-F和O-R。
7、完成步骤6后,以步骤1获得的cDNA为模板,以步骤6合成的O-F和O-R为引物,进行PCR扩增,获得约1680bp的PCR扩增产物并测序。
上述3CPK-57、3CPK-81、5CPK-77、5CPK-130、5CPK-259、O-F和O-R的核苷酸序列信息详见表2。
结果表明,步骤7获得的PCR扩增产物的核苷酸序列如序列表中序列1自5′末端起第1至1680位所示,将该序列所示的基因命名为IbCPK28基因,其编码的蛋白命名为IbCPK28蛋白或蛋白质IbCPK28,氨基酸序列如序列表中序列2所示。
表2.引物序列信息
实施例2、IbCPK28蛋白在调控甘薯抗逆性中的应用
一、重组质粒的构建
A、重组质粒pCB-IbCPK28的构建
1、人工合成序列表的序列1自5′末端起第1至1680位所示的双链DNA分子。以该双链DNA分子为模板,以AU3-XbaI:5′-GCTCTAGAATGGGTACCTGCTTTTCCAGC-3′(下划线为限制性内切酶XbaI的识别序列)和AU3-SacI:5′-CGAGCTCTTAAAGTCTCGAGCCTCGCCT-3′(下划线为限制性内切酶SacI的识别序列)为引物进行PCR扩增,得到N端含有限制性内切酶XbaI和C端含有限制性内切酶SacI的双链DNA分子。
2、将N端含有限制性内切酶XbaI和C端含有限制性内切酶SacI的双链DNA分子连接至pEASY-Blunt simple载体,得到重组质粒pEASY-IbCPK28。
3、完成步骤2后,用限制性内切酶XbaI和SacI双酶切重组质粒pEASY-IbCPK28,回收约1.7kb的片段1。
4、用限制性内切酶HindIII和EcoRI双酶切载体pCAMBIA3301,回收约11256bp的载体骨架1。
5、用限制性内切酶HindIII和EcoRI双酶切载体pBI121,回收包含约3032bp的片段2。
6、将片段2与载体骨架1连接,得到重组质粒pCBGUS。
7、用限制性内切酶XbaI和SacI双酶切重组质粒pCBGUS,回收约12388bp的载体骨架2。
8、将片段1与载体骨架2连接,得到重组质粒pCB-IbCPK28。
根据测序结果,对重组质粒pCB-IbCPK28进行结构描述如下:将重组质粒pCBGUS的限制性内切酶XbaI和SacI识别序列间的小片段替换为序列表中序列1自5′末端起第1至1680位所示的DNA分子。重组质粒pCB-IbCPK28表达序列表中序列2所示的IbCPK28蛋白。
重组质粒pCB-IbCPK28具有一个表达盒A,表达盒A的核苷酸序列如序列表中序列3所示,其中序列表中序列3自5′末端起第1至835位为CaMV35S启动子,第848至2527位为IbCPK28蛋白的编码基因,第2544至2796位为NOS终止子。
B、重组质粒pFGC5941-IbCPK28的构建
1、人工合成序列表的序列1所示的双链DNA分子。以该双链DNA分子为模板,以IbCPK28-Ri-DF(BamHI):5′-CGGGATCCTGAACAAAATGGAGAAACTGATGC-3′(下划线为限制性内切酶BamHI的识别序列)和IbCPK28-Ri-DR(XbaI):5′-GCTCTAGATCGAGACTTTAACGTCGACCAAG-3′(下划线为限制性内切酶XbaI的识别序列)为引物进行PCR扩增,得到DNA片段甲。
2、完成步骤1后,用限制性内切酶BamHI和XbaI双酶切DNA片段甲,回收420bp的片段1。
3、用限制性内切酶BamHI和XbaI双酶切载体pFGC5941,回收约10kb的载体骨架1。
4、将片段1与载体骨架1连接,得到重组质粒pFGC5941-D。
5、用限制性内切酶XhoI和SwaI双酶切重组质粒pFGC5941-D,回收约10kb的载体骨架2。
6、人工合成序列表的序列1所示的双链DNA分子。以该双链DNA分子为模板,以IbCPK28-Ri-UF(XhoI):5′-CCGCTCGAGTCGAGACTTTAACGTCGACCAAG-3′(下划线为限制性内切酶XhoI的识别序列)和IbCPK28-Ri-UR(SwaI):5′-GCGATTTAAATTGAACAAAATGGAGAAACTGATGC-3′(下划线为限制性内切酶SwaI的识别序列)为引物进行PCR扩增,得到DNA片段乙。
7、完成步骤6后,用限制性内切酶XhoI和SwaI双酶切DNA片段乙,回收约420bp的片段2。
8、将片段2与载体骨架2连接,得到重组质粒pFGC5941-IbCPK28。
根据测序结果,对重组质粒pFGC5941-IbCPK28进行结构描述如下:将载体pFGC5941的限制性内切酶BamHI和XbaI识别序列间的小片段替换为序列表中序列1自5′末端起第1669至2075位所示的DNA分子的反向互补序列,将限制性内切酶XhoI和SwaI识别序列间的小片段替换为序列表中序列1自5′末端起第1669至2075位所示的DNA分子。
二、重组农杆菌的获得和甘薯转基因植株的再生
A、甘薯转基因阳性植株的再生
1、将重组质粒pCB-IbCPK28转化根癌农杆菌EHA105,得到重组农杆菌甲,将重组农杆菌甲命名为EHA105/pCB-IbCPK28。
2、剥取长约0.5mm的栗子香的茎尖分生组织,置于胚性愈伤组织诱导固体培养基(含2.0mg/L 2,4-D和3.0%蔗糖的MS固体培养基)上,27±1℃培养8周,得到胚性愈伤组织,然后将胚性愈伤组织置于胚性愈伤组织诱导液体培养基(含2.0mg/L 2,4-D和3.0%蔗糖的MS液体培养基)中,水平摇床上振荡光暗交替培养3d(具体条件为:100r/min;27℃;光暗交替培养的周期为:光照时间为13h,黑暗时间11h;光照强度为500lx),得到直径为0.7-1.3mm的胚性细胞团。
3、完成步骤2后,采用农杆菌介导的方法将EHA105/pCB-IbCPK28转化胚性细胞团,然后置于共培养基(含30mg/L AS、2.0mg/L 2,4-D的MS固体培养基)上,28℃暗培养3d。
4、完成步骤3后,将胚性细胞团用含900mg/L头孢噻肟钠(cefotaxime sodium,CS)和2.0mg/L 2,4-D的MS液体培养基洗涤2次,然后置于选择培养基(含2.0mg/L2,4-D、300mg/L CS和0.5mg/L草铵膦(phosphinothricin,PPT)的固体MS培养基)上,27±1℃暗培养10-12周(每2周需更换一次选择培养基)。
5、完成步骤4后,将胚性细胞团置于体细胞胚诱导培养基(含有1.0mg/L ABA、300mg/L CS和0.5mg/L PPT的MS固体培养基)上,27±1℃光暗交替培养(光暗交替培养的周期为:光照时间为13h,黑暗时间11h;光照强度为3000lx)2-4周,得到抗性愈伤组织。
6、完成步骤5后,将抗性愈伤组织置于MS固体培养基上,27±1℃光暗交替培养(光照时间为13h,黑暗时间11h;光照强度为3000lx)4-8周,即获得260株甘薯拟转基因植株,依次命名IbCPK28-OX1至IbCPK28-OX260。
7、分别提取步骤6获得的甘薯拟转基因植株的幼嫩叶片的基因组DNA,并以该基因组DNA为模板,以pBI 121-35S 51:5'-GAGGCTTACGCAGCAGGTC-3'和A-D-624:5'-TAGCATCTGCCGCACAACT-3'为引物进行PCR扩增,得到PCR扩增产物;如果PCR扩增产物中含有1453bp的条带,则相应的甘薯拟转基因植株即为甘薯转基因阳性植株。用等体积水代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为阴性对照。用甘薯品种栗子香野生型植株的幼嫩叶片的基因组DNA代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为对照。用重组质粒pCB-IbCPK28代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为阳性对照。
实验结果见图1中A(M为DNA分子Marker,W为阴性对照,P为阳性对照,WT为甘薯品种栗子香野生型植株的幼嫩叶片的基因组DNA,IbCPK28-OX37、IbCPK28-OX76、IbCPK28-OX114、IbCPK28-OX134、IbCPK28-OX188和IbCPK28-OX259均为甘薯拟转基因植株)。结果表明,IbCPK28-OX37、IbCPK28-OX76、IbCPK28-OX114、IbCPK28-OX134和IbCPK28-OX259均为甘薯转基因阳性植株。
B、甘薯RNAi阳性植株的再生
1、将重组质粒pFGC5941-IbCPK28转化根癌农杆菌EHA105,得到重组农杆菌乙,将重组农杆菌乙命名为EHA105/pFGC5941-IbCPK28。
2、按照步骤A中2至6的方法,将EHA105/pCB-IbCPK28替换为EHA105/pFGC5941-IbCPK28,其它步骤均不变,获得15株甘薯RNAi植株,依次命名IbCPK28-RNAi 1至IbCPK28-RNAi 15。
3、分别提取步骤2获得的甘薯RNAi植株的幼嫩叶片的基因组DNA,并以该基因组DNA为模板,以int-F:5′-CAACCACAAAAGTATCTATGAGCCT-3′和int-R:5′-TTCACATGTCAGAAACATTCTGATG-3′为引物进行PCR扩增,得到PCR扩增产物;如果PCR扩增产物中含有888bp的条带,则相应的甘薯RNAi植株即为甘薯RNAi阳性植株。用等体积水代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为阴性对照。用甘薯品种栗子香野生型植株的幼嫩叶片的基因组DNA代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为对照。用重组质粒pFGC5941-IbCPK28代替甘薯拟转基因植株的幼嫩叶片的基因组DNA,进行PCR扩增,作为阳性对照。
实验结果见图1中B(M为DNA分子Marker,W为阴性对照,P为阳性对照,WT为甘薯品种栗子香野生型植株的幼嫩叶片的基因组DNA,IbCPK28-RNAi3、IbCPK28-RNAi4、IbCPK28-RNAi5、IbCPK28-RNAi6、IbCPK28-RNAi7和IbCPK28-RNAi8均为甘薯RNAi植株)。结果表明,IbCPK28-RNAi3、IbCPK28-RNAi4、IbCPK28-RNAi5、IbCPK28-RNAi6、IbCPK28-RNAi7和IbCPK28-RNAi8均为甘薯RNAi阳性植株。
采用无性繁殖的方法扩繁甘薯转基因阳性植株和甘薯RNAi阳性植株,由一株转基因幼苗扩繁得到的植株作为一个株系。将IbCPK28-OX37的株系命名为OX-37,IbCPK28-OX114的株系命名为OX-114,将IbCPK28-RNAi3的株系命名为RNAi-3,将IbCPK28-RNAi4的株系命名为RNAi-4。
五、抗逆性鉴定
1、抗盐性鉴定
甘薯植株为甘薯品种栗子香的野生型植株(WT)、OX-37的植株、OX-114的植株、RNAi-3的植株或RNAi-4的植株。
实验重复三次,每次重复的步骤如下:
(1)取甘薯植株的茎段(约25cm长且至少有3个茎节),种植于装有人工土壤(由1体积份蛭石和1体积份营养土混合而成)的盆池中,每个盆池种植3株。
(2)完成步骤(1)后,每个盆池用1/2霍格兰营养液灌溉2周。
(3)完成步骤(2)后,每个盆池用含200mM NaCl的1/2霍格兰营养液灌溉3周进行盐胁迫(每2天灌溉1次,每株甘薯植株每次灌溉200mL)。3周后,观察甘薯植株的生长状态,测量并统计甘薯植株的表型指标(如单株平均鲜重(g)、单株平均干重(g)、单株平均根长(cm)和单株平均根数(根))。
按照上述方法,将步骤(3)中的含200mM NaCl的1/2霍格兰营养液替换为1/2霍格兰营养液,其它步骤均不变,作为空白对照。
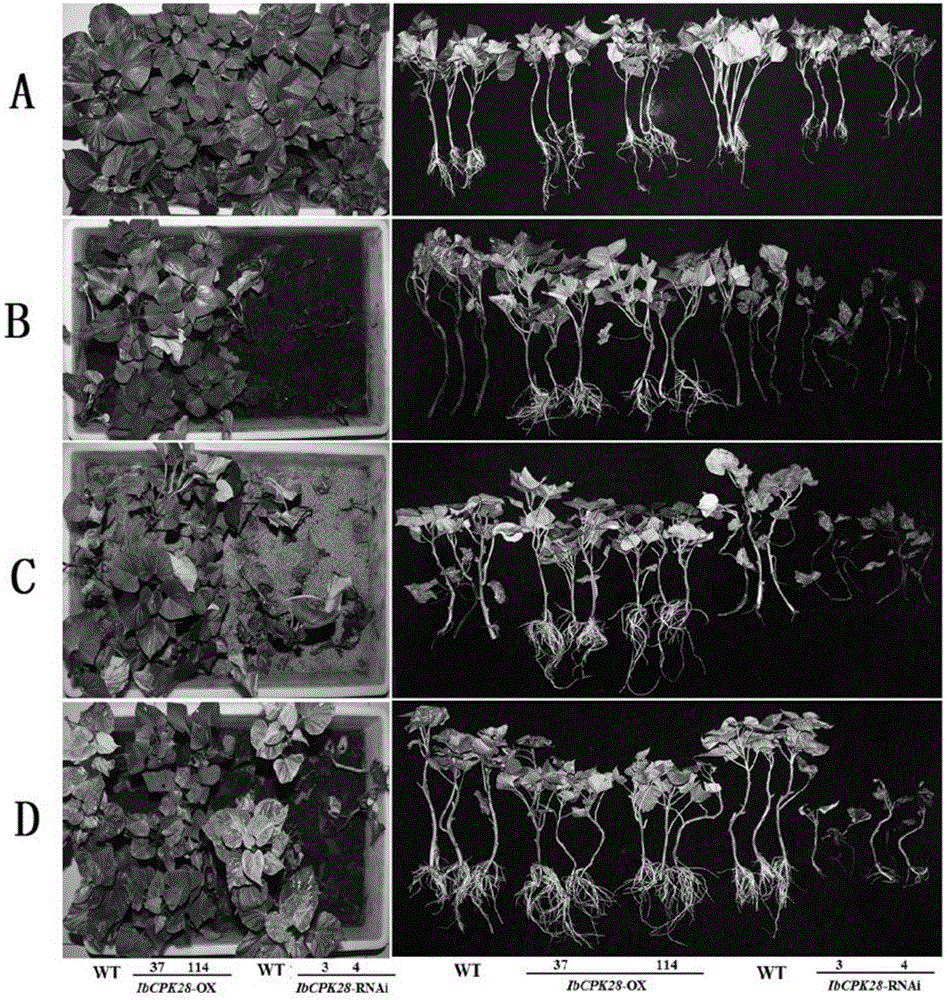
甘薯植株的生长状态见图2中A和B(A为空白对照,左图为甘薯植株在盆池的生长状态,右图为从盆池取出洗净的甘薯植株;B为盐胁迫,左图为甘薯植株在盆池的生长状态,右图为从盆池取出洗净的甘薯植株)。甘薯植株的表型指标统计结果见图3中A和B(A为空白对照,B为盐胁迫)。结果表明,盐胁迫一段时间后,RNAi-3的植株和RNAi-4的植株最先死亡,甘薯品种栗子香的野生型植株的生长状态显著变差,而OX-37的植株和OX-114的植株的生长状态和表型指标均良好。因此,在甘薯中过表达IbCPK28基因可提高甘薯的抗盐性,干涉IbCPK28基因则可降低甘薯的抗盐性。
2、抗旱性鉴定
甘薯植株为甘薯品种栗子香的野生型植株(WT)、OX-37的植株、OX-114的植株、RNAi-3的植株或RNAi-4的植株。
实验重复三次,每次重复的步骤如下:
(1)取甘薯植株的茎段(约25cm长且至少有3个茎节),种植于装有人工土壤(由1体积份蛭石和1体积份营养土混合而成)的盆池中,每个盆池种植3株。
(2)完成步骤(1)后,每个盆池用1/2霍格兰营养液灌溉2周。
(3)完成步骤(2)后,每个盆池自然干旱胁迫8周(即不进行任何处理,包括不灌溉任何水分和营养液)。8周后,观察甘薯植株的生长状态,测量并统计甘薯植株的表型指标(如单株平均鲜重(g)、单株平均干重(g)、单株平均根长(cm)和单株平均根数(根))。
甘薯植株的生长状态见图2中C(左图为甘薯植株在盆池的生长状态,右图为从盆池取出洗净的甘薯植株)。甘薯植株的表型指标统计结果见图3中C。结果表明,干旱胁迫一段时间后,RNAi-3的植株和RNAi-4的植株最先死亡,甘薯品种栗子香的野生型植株的生长状态显著变差,而OX-37的植株和OX-114的植株的生长状态和表型指标均良好。因此,在甘薯中过表达IbCPK28基因可提高甘薯的抗旱性,干涉IbCPK28基因则可降低甘薯的抗旱性。
3、抗氧化性鉴定
甘薯植株为甘薯品种栗子香的野生型植株(WT)、OX-37的植株、OX-114的植株、RNAi-3的植株或RNAi-4的植株。
实验重复三次,每次重复的步骤如下:
(1)取甘薯植株的茎段(约25cm长且至少有3个茎节),种植于装有人工土壤(由1体积份蛭石和1体积份营养土混合而成)的盆池中,每个盆池种植3株。
(2)完成步骤(1)后,每个盆池用1/2霍格兰营养液灌溉2周。
(3)完成步骤(2)后,每个盆池用氧化剂溶液(含200μmol/L MV和0.1%(质量百分比)吐温-20的水溶液)喷施2周进行氧化胁迫(每2天喷施1次,每株甘薯植株每次喷施20mL)。2周后,观察甘薯植株的生长状态,测量并统计甘薯植株的表型指标(如单株平均鲜重(g)、单株平均干重(g)、单株平均叶片发黄率(%)和单株平均叶片死亡率(%)。单株平均叶片发黄率=单株发黄叶片数/单株总叶片数×100%。单株平均叶片死亡率=单株死亡叶片数/单株总叶片数×100%。
甘薯植株的生长状态见图2中D(左图为甘薯植株在盆池的生长状态,右图为从盆池取出洗净的甘薯植株)。甘薯植株的表型指标统计结果见图3中D。结果表明,氧化胁迫一段时间后,RNAi-3的植株和RNAi-4的植株最先死亡,甘薯品种栗子香的野生型植株的生长状态显著变差,而OX-37的植株和OX-114的植株的生长状态和表型指标均良好。因此,在甘薯中过表达IbCPK28基因可提高甘薯的抗氧化性,干涉IbCPK28基因则可降低甘薯的抗氧化性。
4、蔓割病抗性鉴定
甘薯植株为甘薯品种栗子香的野生型植株(WT)、OX-37的植株、OX-114的植株、RNAi-3的植株或RNAi-4的植株。
实验重复三次取平均值,每个株系每次种植3株,每次重复的步骤如下:
a、将甘薯蔓割病菌接种于PDA培养基,28℃光暗交替培养(光暗交替培养的周期为:光照时间为13h,黑暗时间11h;光照强度为500lx)3d,然后28℃暗培养7d,得到菌丝。
b、完成步骤a后,将所述菌丝转移至三角瓶,加入100mL无菌蒸馏水,100r/min振荡30min,然后用双层无菌纱布过滤,用血球计数板在显微镜下计数,得到甘薯蔓割病菌孢子浓度为1×107个/mL的孢子悬浮液。
c、将长势基本一致的甘薯植株的幼苗剪口,对齐后置于孢子悬浮液中30min,然后种植于装有无菌沙土的盆池中(每个盆池种植3株),然后正常培养。分别于种植的第0d、种植的第3d、种植的第5d、种植的第7d、种植的第9d和种植的第11d,观察甘薯植株的生长状态。测量并统计种植的第11d的甘薯植株的表型指标(如单株平均发病叶片数(个)、单株平均叶片死亡数(个)、单株平均新生根数(根)、单株平均茎段褐化长度(cm))。
甘薯植株在盆池的生长状态见图4(0d为种植的第0d,3d为种植的第3d,5d为种植的第5d,7d为种植的第7d,9d为种植的第9d,11d为种植的第11d,Z为种植的第11d的从盆池取出洗净的甘薯植株)。甘薯植株的表型指标统计结果见图5。实验结果如下:(a1)种植的第3d,RNAi-3的植株和RNAi-4的植株已有较明显的感病症状(叶片变黄),甘薯品种栗子香的野生型植株的叶片颜色均变浅,OX-37的植株和OX-114的植株的生长状态均良好;(a2)种植的第9d,RNAi-3的植株和RNAi-4的植株的叶片几乎全部变黄、部分老叶脱落、茎段部分褐化变软,甘薯品种栗子香的野生型植株的大部分叶片变黄,OX-37的植株和OX-114的植株出现较轻的过敏反应;(a3)种植的第11d,RNAi-3的植株和RNAi-4的植株的叶片枯萎脱落、茎段褐化、整株死亡,甘薯品种栗子香的野生型植株的叶片几乎全部变黄、部分老叶脱落、茎段部分褐化变软,OX-37的植株和OX-114的植株叶片变黄数量较少、部分茎段较小程度褐化、但植株仍能正常生长;(a4)种植的第11d,OX-37的植株和OX-114的植株的表型指标均良好。因此,在甘薯中过表达IbCPK28基因可提高甘薯的蔓割病抗性,干涉IbCPK28基因则可降低甘薯的蔓割病抗性。
5、生理生化指标的测定
(1)脯氨酸含量测定
植物在正常条件下,游离脯氨酸含量很低,但遇到干旱、低温、盐等胁迫时,游离的氨基酸便会大量积累,并且积累指数和植物的抗逆性有关。因此,脯氨酸可以作为植物抗逆性的一项生化指标。
参考文献(He SZ,Han YF,Wang YP,Zhai H,Liu QC.In vitro selection and identification of sweetpotato(Ipomoea batatas(L.)Lam.)plants tolerant to NaCl.Plant Cell Tissue Organ Cult,2009,96:69-74)的方法,检测甘薯植株的脯氨酸含量。甘薯植株为步骤1空白对照中处理2周的甘薯植株、步骤1盐胁迫2周的甘薯植株、步骤2中干旱胁迫4周的甘薯植株或步骤3中氧化胁迫1周的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图6中A(Normal为空白对照,NaCl为盐胁迫,Drought为干旱胁迫,MV为氧化胁迫)。结果表明,OX-37的植株和OX-114的植株的脯氨酸含量显著高于其它甘薯植株。
(2)SOD活性测定
SOD活性可以作为植物抗逆性的一项生化指标。SOD的活性越低,植物遭受逆境伤害的程度越大。
参考文献(He SZ,Han YF,Wang YP,Zhai H,Liu QC.In vitro selection and identification of sweetpotato(Ipomoea batatas(L.)Lam.)plants tolerant to NaCl.Plant Cell Tissue Organ Cult,2009,96:69-74)的方法,检测甘薯植株的SOD活性。甘薯植株为步骤1空白对照中处理2周的甘薯植株、步骤1盐胁迫2周的甘薯植株、步骤2中干旱胁迫4周的甘薯植株、步骤3中氧化胁迫1周的甘薯植株或步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图6中B(Normal为空白对照,NaCl为盐胁迫,Drought为干旱胁迫,MV为氧化胁迫)和图7中A(步骤4中种植的第5d的甘薯植株)。结果表明,OX-37的植株和OX-114的植株的SOD活性显著高于其它甘薯植株。
(3)丙二醛(MDA)含量测定
植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度,即MDA的含量越高,植物遭受逆境伤害的程度越大。
参考文献(Gao S,Yuan L,Zhai H,Liu CL,He SZ,et al.Transgenic sweetpotato plants expressing an LOS5gene are tolerant to salt stress.Plant Cell Tissue Organ Cult,2011,107:205-213)的方法,检测甘薯植株的MDA含量。甘薯植株为步骤1空白对照中处理2周的甘薯植株、步骤1盐胁迫2周的甘薯植株、步骤2中干旱胁迫4周的甘薯植株、步骤3中氧化胁迫1周的甘薯植株或步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图6中C(Normal为空白对照,NaCl为盐胁迫,Drought为干旱胁迫,MV为氧化胁迫)和图7中C(步骤4中种植的第5d的甘薯植株)。结果表明,OX-37的植株和OX-114的植株的MDA含量显著低于其它甘薯植株。
(4)H2O2含量测定
植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。因此,H2O2的含量越高,植物遭受逆境伤害的程度越大。
参考文献(王爱国等,1990)的方法,检测甘薯植株的H2O2含量。甘薯植株为步骤1空白对照中处理2周的甘薯植株、步骤1盐胁迫2周的甘薯植株、步骤2中干旱胁迫4周的甘薯植株、步骤3中氧化胁迫1周的甘薯植株或步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图6中D(Normal为空白对照,NaCl为盐胁迫,Drought为干旱胁迫,MV为氧化胁迫)和图7中D(步骤4中种植的第5d的甘薯植株)。结果表明,OX-37的植株和OX-114的植株的H2O2含量显著低于其它甘薯植株。
(5)POD活性测定
POD活性可以作为植物抗逆性的一项生化指标。POD的活性越低,植物遭受逆境伤害的程度越大。
参考文献(王爱国等,1990)的方法,检测甘薯植株的POD活性。甘薯植株为步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图7中B。结果表明,OX-37的植株和OX-114的植株的POD活性显著高于其它甘薯植株。
(6)总酚含量测定
总酚含量可以作为植物抗逆性的一项生化指标。总酚含量越低,植物遭受逆境伤害的程度越大。
参考文献(王连平等,2004)的方法,检测甘薯植株的总酚含量。甘薯植株为步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图7中E。结果表明,OX-37的植株和OX-114的植株的总酚含量显著高于其它甘薯植株。
(7)木质素含量测定
木质素含量可以作为植物抗逆性的一项生化指标。总酚含量越低,植物遭受逆境伤害的程度越大。
参考文献(王连平等,2004)的方法,检测甘薯植株的木质素含量。甘薯植株为步骤4中种植的第5d的甘薯植株。实验需重复三次,结果取平均值。
实验结果见图7中F。结果表明,OX-37的植株和OX-114的植株的木质素含量显著高于其它甘薯植株。
上述结果表明,在甘薯中过表达IbCPK28基因可提高甘薯的抗逆性,干涉IbCPK28基因则可降低甘薯的抗逆性;所述抗逆性可为抗盐性、抗旱性、抗氧化性和抗蔓割病。
<110> 中国农业大学
<120> 抗逆相关蛋白IbCPK28及其编码基因与应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 2136
<212> DNA
<213> 甘薯Ipomoea batatas(L.) Lam.
<400> 1
atgggtacct gcttttccag ctcaaaagtc actggctcta acagcaacgc cgcttcttcc 60
ggcgcaaacg ccgcgaacac gcgcgagacc atcacgaagc cgccgcccat caccactacg 120
aagcgggagg tgccgcattg ctctcagcag aaggctaaag aaaccgctca gaagcatcag 180
cagcaacagc aaccgaggaa ttccaatgtg aaggccagtt ccaggaaagg tgttattccc 240
tgtggaaaaa gaacggattt tggatatgat aaggattttg ggcagaggta tagtcttggg 300
aagctgttag ggcacggcca attcgggtac acctatgttg ccacggataa gtctaatgga 360
gatcgtgttg ctgttaagag aattgagaag agcaagatgc ttcttcctat agctgttgag 420
gatgtcaggc gtgaagtgaa aatattgaag gccttagccg gtcatgagaa tgtggttcag 480
tttcataacg cgtttgagga tgaaaattat gtgtatattg taatggaatt atgtgaaggc 540
ggagaattac tcgaccgtat tttggcaaaa aaagacagcc gttatagcga gaaggatgca 600
gcaatagttg tgcggcagat gctaaaagtt gcagcagaat gccacttaca tggtttggtg 660
catcgtgata tgaaaccgga gaattttctt ttcaaatcac caaaaacgga ttctccattg 720
aaggccactg attttggtct ttcagacttc atcagaccag ggaagaaatt tcaagatatt 780
gttggtagtg catattatgt tgccccagag gtattgaagc gtagatcagg ccctgaatca 840
gatgtttgga gtatcggagt aataacttat attttgctct gtggtcggcg gcccttttgg 900
gacaaaaccg aagatggtat attcaaggag gtcctaagaa ataagcccga tttccgccgc 960
aagccatggc caaccataag caacagtgct aaagattttg ttaagaaatt attggtgaag 1020
gatccacgtg tcagactcac tgctgctcag gccctatcac atccatgggt ccgggaaggt 1080
ggaaatgcat ctgacatccc attagacatt tctgtactat ccaacatgcg acaatttgtt 1140
aagtatggcc atctaaagca gtttgcatta agggccctag cgacgacact tcaagaggag 1200
gagttggccg atctcaaaga tcaatttgct gccattgatg tggataaaaa tggtgtcatt 1260
agtcttgaag aaatgagaca ggctcttgct aaggatcttc catggaagat gaaagaatca 1320
cgtgttcttg agattcttca agcgattggc agcaatacag acggacttgt ggatttccaa 1380
gagttcgttg ctgccacgtt acatgtcaac cagatggagg aacataattc cgaaaattgg 1440
caacaaagat cgcaagccgc ttttgagaaa tttgacatcg acaaagatgg atatataacc 1500
ccagaagaac ttaaattgca caccggatta agaggctcca tagacccgct cctagaggaa 1560
gcagacatcg acaaagacgg gaagataagc ttatcagagt tccgcaagct tctaagaaca 1620
gcaagcatgg ggtcccggac agtcactagt ctatctgcaa ggcgaggctc gagactttaa 1680
cgtcgaccaa gttgtataga agcgtgtgtg cacgagtgga actttctttt ggttggaaga 1740
tcattataca tgtgtatggc tattggcccg tcgatctgca ctgtcatcaa acacaggact 1800
gctgcattgg cttcaagaat ggctgtcata catctgtaat gacatatttt gtggtgcttt 1860
tgccctccat agaaagcgtt taaagcacga atttctcttc aatcaaggaa aaaaatgtgg 1920
tctgtatcat gtacattgtt cgtcgaatgt taccagtcat gagtcgttgg ttctcatgtt 1980
tttttgtggt acagatttca atcccaaatt gtgtgcttta cagtgtaaaa atgtgtatag 2040
tggaaatatg ggcatcagtt tctccatttt gttcaacatt atgtaacctt aaacgttaat 2100
cgttatccat tatagtttga gaaccaaaaa aaaaaa 2136
<210> 2
<211> 559
<212> PRT
<213> 甘薯Ipomoea batatas(L.) Lam.
<400> 2
Met Gly Thr Cys Phe Ser Ser Ser Lys Val Thr Gly Ser Asn Ser Asn
1 5 10 15
Ala Ala Ser Ser Gly Ala Asn Ala Ala Asn Thr Arg Glu Thr Ile Thr
20 25 30
Lys Pro Pro Pro Ile Thr Thr Thr Lys Arg Glu Val Pro His Cys Ser
35 40 45
Gln Gln Lys Ala Lys Glu Thr Ala Gln Lys His Gln Gln Gln Gln Gln
50 55 60
Pro Arg Asn Ser Asn Val Lys Ala Ser Ser Arg Lys Gly Val Ile Pro
65 70 75 80
Cys Gly Lys Arg Thr Asp Phe Gly Tyr Asp Lys Asp Phe Gly Gln Arg
85 90 95
Tyr Ser Leu Gly Lys Leu Leu Gly His Gly Gln Phe Gly Tyr Thr Tyr
100 105 110
Val Ala Thr Asp Lys Ser Asn Gly Asp Arg Val Ala Val Lys Arg Ile
115 120 125
Glu Lys Ser Lys Met Leu Leu Pro Ile Ala Val Glu Asp Val Arg Arg
130 135 140
Glu Val Lys Ile Leu Lys Ala Leu Ala Gly His Glu Asn Val Val Gln
145 150 155 160
Phe His Asn Ala Phe Glu Asp Glu Asn Tyr Val Tyr Ile Val Met Glu
165 170 175
Leu Cys Glu Gly Gly Glu Leu Leu Asp Arg Ile Leu Ala Lys Lys Asp
180 185 190
Ser Arg Tyr Ser Glu Lys Asp Ala Ala Ile Val Val Arg Gln Met Leu
195 200 205
Lys Val Ala Ala Glu Cys His Leu His Gly Leu Val His Arg Asp Met
210 215 220
Lys Pro Glu Asn Phe Leu Phe Lys Ser Pro Lys Thr Asp Ser Pro Leu
225 230 235 240
Lys Ala Thr Asp Phe Gly Leu Ser Asp Phe Ile Arg Pro Gly Lys Lys
245 250 255
Phe Gln Asp Ile Val Gly Ser Ala Tyr Tyr Val Ala Pro Glu Val Leu
260 265 270
Lys Arg Arg Ser Gly Pro Glu Ser Asp Val Trp Ser Ile Gly Val Ile
275 280 285
Thr Tyr Ile Leu Leu Cys Gly Arg Arg Pro Phe Trp Asp Lys Thr Glu
290 295 300
Asp Gly Ile Phe Lys Glu Val Leu Arg Asn Lys Pro Asp Phe Arg Arg
305 310 315 320
Lys Pro Trp Pro Thr Ile Ser Asn Ser Ala Lys Asp Phe Val Lys Lys
325 330 335
Leu Leu Val Lys Asp Pro Arg Val Arg Leu Thr Ala Ala Gln Ala Leu
340 345 350
Ser His Pro Trp Val Arg Glu Gly Gly Asn Ala Ser Asp Ile Pro Leu
355 360 365
Asp Ile Ser Val Leu Ser Asn Met Arg Gln Phe Val Lys Tyr Gly His
370 375 380
Leu Lys Gln Phe Ala Leu Arg Ala Leu Ala Thr Thr Leu Gln Glu Glu
385 390 395 400
Glu Leu Ala Asp Leu Lys Asp Gln Phe Ala Ala Ile Asp Val Asp Lys
405 410 415
Asn Gly Val Ile Ser Leu Glu Glu Met Arg Gln Ala Leu Ala Lys Asp
420 425 430
Leu Pro Trp Lys Met Lys Glu Ser Arg Val Leu Glu Ile Leu Gln Ala
435 440 445
Ile Gly Ser Asn Thr Asp Gly Leu Val Asp Phe Gln Glu Phe Val Ala
450 455 460
Ala Thr Leu His Val Asn Gln Met Glu Glu His Asn Ser Glu Asn Trp
465 470 475 480
Gln Gln Arg Ser Gln Ala Ala Phe Glu Lys Phe Asp Ile Asp Lys Asp
485 490 495
Gly Tyr Ile Thr Pro Glu Glu Leu Lys Leu His Thr Gly Leu Arg Gly
500 505 510
Ser Ile Asp Pro Leu Leu Glu Glu Ala Asp Ile Asp Lys Asp Gly Lys
515 520 525
Ile Ser Leu Ser Glu Phe Arg Lys Leu Leu Arg Thr Ala Ser Met Gly
530 535 540
Ser Arg Thr Val Thr Ser Leu Ser Ala Arg Arg Gly Ser Arg Leu
545 550 555
<210> 3
<211> 2796
<212> DNA
<213> 人工序列
<220>
<223>
<400> 3
agattagcct tttcaatttc agaaagaatg ctaacccaca gatggttaga gaggcttacg 60
cagcaggtct catcaagacg atctacccga gcaataatct ccaggaaatc aaataccttc 120
ccaagaaggt taaagatgca gtcaaaagat tcaggactaa ctgcatcaag aacacagaga 180
aagatatatt tctcaagatc agaagtacta ttccagtatg gacgattcaa ggcttgcttc 240
acaaaccaag gcaagtaata gagattggag tctctaaaaa ggtagttccc actgaatcaa 300
aggccatgga gtcaaagatt caaatagagg acctaacaga actcgccgta aagactggcg 360
aacagttcat acagagtctc ttacgactca atgacaagaa gaaaatcttc gtcaacatgg 420
tggagcacga cacacttgtc tactccaaaa atatcaaaga tacagtctca gaagaccaaa 480
gggcaattga gacttttcaa caaagggtaa tatccggaaa cctcctcgga ttccattgcc 540
cagctatctg tcactttatt gtgaagatag tggaaaagga aggtggctcc tacaaatgcc 600
atcattgcga taaaggaaag gccatcgttg aagatgcctc tgccgacagt ggtcccaaag 660
atggaccccc acccacgagg agcatcgtgg aaaaagaaga cgttccaacc acgtcttcaa 720
agcaagtgga ttgatgtgat atctccactg acgtaaggga tgacgcacaa tcccactatc 780
cttcgcaaga cccttcctct atataaggaa gttcatttca tttggagaga acacggggga 840
ctctagaatg ggtacctgct tttccagctc aaaagtcact ggctctaaca gcaacgccgc 900
ttcttccggc gcaaacgccg cgaacacgcg cgagaccatc acgaagccgc cgcccatcac 960
cactacgaag cgggaggtgc cgcattgctc tcagcagaag gctaaagaaa ccgctcagaa 1020
gcatcagcag caacagcaac cgaggaattc caatgtgaag gccagttcca ggaaaggtgt 1080
tattccctgt ggaaaaagaa cggattttgg atatgataag gattttgggc agaggtatag 1140
tcttgggaag ctgttagggc acggccaatt cgggtacacc tatgttgcca cggataagtc 1200
taatggagat cgtgttgctg ttaagagaat tgagaagagc aagatgcttc ttcctatagc 1260
tgttgaggat gtcaggcgtg aagtgaaaat attgaaggcc ttagccggtc atgagaatgt 1320
ggttcagttt cataacgcgt ttgaggatga aaattatgtg tatattgtaa tggaattatg 1380
tgaaggcgga gaattactcg accgtatttt ggcaaaaaaa gacagccgtt atagcgagaa 1440
ggatgcagca atagttgtgc ggcagatgct aaaagttgca gcagaatgcc acttacatgg 1500
tttggtgcat cgtgatatga aaccggagaa ttttcttttc aaatcaccaa aaacggattc 1560
tccattgaag gccactgatt ttggtctttc agacttcatc agaccaggga agaaatttca 1620
agatattgtt ggtagtgcat attatgttgc cccagaggta ttgaagcgta gatcaggccc 1680
tgaatcagat gtttggagta tcggagtaat aacttatatt ttgctctgtg gtcggcggcc 1740
cttttgggac aaaaccgaag atggtatatt caaggaggtc ctaagaaata agcccgattt 1800
ccgccgcaag ccatggccaa ccataagcaa cagtgctaaa gattttgtta agaaattatt 1860
ggtgaaggat ccacgtgtca gactcactgc tgctcaggcc ctatcacatc catgggtccg 1920
ggaaggtgga aatgcatctg acatcccatt agacatttct gtactatcca acatgcgaca 1980
atttgttaag tatggccatc taaagcagtt tgcattaagg gccctagcga cgacacttca 2040
agaggaggag ttggccgatc tcaaagatca atttgctgcc attgatgtgg ataaaaatgg 2100
tgtcattagt cttgaagaaa tgagacaggc tcttgctaag gatcttccat ggaagatgaa 2160
agaatcacgt gttcttgaga ttcttcaagc gattggcagc aatacagacg gacttgtgga 2220
tttccaagag ttcgttgctg ccacgttaca tgtcaaccag atggaggaac ataattccga 2280
aaattggcaa caaagatcgc aagccgcttt tgagaaattt gacatcgaca aagatggata 2340
tataacccca gaagaactta aattgcacac cggattaaga ggctccatag acccgctcct 2400
agaggaagca gacatcgaca aagacgggaa gataagctta tcagagttcc gcaagcttct 2460
aagaacagca agcatggggt cccggacagt cactagtcta tctgcaaggc gaggctcgag 2520
actttaagag ctcgaatttc cccgatcgtt caaacatttg gcaataaagt ttcttaagat 2580
tgaatcctgt tgccggtctt gcgatgatta tcatataatt tctgttgaat tacgttaagc 2640
atgtaataat taacatgtaa tgcatgacgt tatttatgag atgggttttt atgattagag 2700
tcccgcaatt atacatttaa tacgcgatag aaaacaaaat atagcgcgca aactaggata 2760
aattatcgcg cgcggtgtca tctatgttac tagatc 2796
<210> 4
<211> 312
<212> DNA
<213> 人工序列
<220>
<223>
<400> 4
gaacacgcgc gagaccatca cgaagccgcc gcccatcacc actacgaagc gggaggtgcc 60
gcattgctct cagcagaagg ctaaagaaac cgctcagaag catcagcagc aacagcaacc 120
gaggaattcc aatgtgaagg ccagttccag gaaaggtgtt attccctgtg gaaaaagaac 180
ggattttgga tatgataagg attttgggca gaggtatagt cttgggaagc tgttagggca 240
cggccaattc gggtacacct atgttgccac ggataagtct aatggagatc gtgttgctgt 300
taagagaatt ga 312
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺