循环血肿瘤细胞的联合分选纯化装置及分选检测方法与流程
本发明属于细胞分选用器械及其细胞分选方法,特别是针对循环血中肿瘤细胞的分选器械及分选方法,具体涉及为一种循环血肿瘤细胞的联合分选纯化装置及分选检测方法。
背景技术:
肿瘤转移是造成肿瘤患者死亡的重要原因之一,研究发现肿瘤患者循环血中肿瘤细胞(CTC)与患者转移和预后密切相关。对CTC的分选有助于肿瘤转移风险的预测和判断、为疾病提供重要的预后信息及个体化治疗。故从循环血中去除血细胞,分离纯度高的CTC已成为诊断肿瘤、判断预后的关键。但由于CTC在外周血中数目极少,而且入血呈现不连续性,并有很强的异质性,CTC分选具有一定挑战。
现有的CTC分选、检测方法主要基于肿瘤细胞与其他血细胞在物理性质(密度和大小)、特异性抗原表达等方面的差异进行。基于特异性抗原表达的免疫细胞化学技术的CellSearch分选富集系统,针对肿瘤细胞表面上皮细胞粘附分子(epithelialcelladhesionmolecule,EpCAM)进行CTC分选,该系统已被美国FDA批准用于检测乳腺癌、结肠癌和前列腺癌CTC。但由于EpCAM局限于上皮来源肿瘤细胞,此外肿瘤细胞在转移过程中可能发生上皮间质转化(EMT),EpCAM和CK表达下调,也会造成捕获率下降。因此以上缺陷限制了CellSearch系统CTC的检测能力。此外该系统价格昂贵,难以在临床上广泛使用。基于物理性质分选富集具有操作简便,成本低的特点,但灵敏度相对不足,进行存在特异度、敏感度差,操作繁琐等问题。
免疫磁珠分选技术是一种新的细胞分离技术,是基于细胞表面抗原能与磁珠表面包被具有免疫原性的抗体特异性结合,在外加磁场中,通过抗体与磁珠相连的细胞吸附聚集,无该种表面抗原的细胞由于不能与磁珠特异性结合而不具有磁性,从而将细胞分离。除此之外,免疫磁珠体积小,在细胞培养中能生物降解而无需进行专门的去除,并不影响细胞活性。而且现有的微流控芯片技术可以初步实现细胞的分选。如果能将微流控芯片技术及免疫磁珠分选技术合理联合定能为检测CTC提供一种更为高效的方法。
本发明针对现有技术的CTC分选纯化技术成本高,灵敏度低,特异性差等问题,将微流控芯片技术与免疫磁珠分选技术进行联合,提供一种循环血肿瘤细胞的联合分选纯化装置及分选检测方法。
技术实现要素:
为了克服现有技术的CTC分选纯化技术成本高,灵敏度低,特异性差等问题,本发明将微流控芯片技术与免疫磁珠分选技术进行联合提供一种循环血肿瘤细胞的联合分选纯化装置及其循环血肿瘤细的检测方法。
一种循环血肿瘤细胞的联合分选纯化装置,包括分选结构、纯化结构及控制结构;其特征在于,所述控制结构伸出导线连接分选结构及纯化结构;控制结构控制分选结构及纯化结构,所述分选结构包括微流控芯片,双喷气压泵、氮气罐、显微镜,各部分连接构建自动化气压泵压力驱动微流控芯片系统;所述微流控芯片内包含一到数列阵列通道;所述阵列通道包括两侧微阵列柱形成的小细胞过道,及两侧微柱阵列中间的大细胞过道,小细胞过道汇集一个出口,大细胞过道汇集一个出口;所述纯化结构包括纯化芯片,永磁铁,供永磁铁运动的两个带轨道的步进电机,永磁铁设置于纯化芯片下方,两个步进电机垂直设置,且一个步进电机设置在另一个步进电机上;永磁铁设置于一个步进电机上,控制结构控制步进电机的运动;微流控芯片通过管状结构连接纯化芯片,控制结构包括电源,控制单元,电路板。本装置的小细胞过道通过的是白细胞等小细胞,大细胞过道通过的是肿瘤细胞及少量白细胞。本装置可以实现微阵列芯片及免疫磁珠技术的结合,将通过微阵列的大细胞过道的循环血细胞移入纯化芯片,并通过在纯化芯片内加入免疫磁珠,两步进电机带动永磁铁运动,达到充分混合的目的,最后通过固定永磁铁将白细胞吸附于底部,在上清液中得到纯化的肿瘤细胞。
进一步,所述分选结构还包括支撑件,支撑件支撑微流控芯片。用于支撑微流控芯片到一定高度,支撑件支撑微流控芯片可以更好的稳定微流控芯片。
进一步,阵列通道两侧微阵列柱可以为任意形状的微阵列柱,如平行四边形,正方形,三角形等;其中优选的微阵列柱为正三角形微阵列柱,正三角形微阵列柱之间形成小细胞过道,及微阵列柱中间为大细胞过道。
进一步,正三角形微柱的边长为25um,柱子水平的间距为30um,垂直间距为20um,阵列的前斜角为3.2°。
进一步,微流控芯片与纯化芯片水平高度相同。
进一步,一个步进电机上设置永磁铁,永磁铁通过设置在轨道上的滑块设置在步进电机轨道上;而设置永磁铁的步进电机通过另一个步进电机轨道上的支撑块设置在另一步进电机轨道上。
进一步,所述纯化芯片包括三层结构,为底板层,凹槽层及入口出口设置层;底板层位于最下方,凹槽层位于中间,入口出口设置层设置在最上方,凹槽层的凹槽围成反应室;入口出口层上对应反应室的位置设置入口与出口。
进一步,所述纯化芯片可设置任意适合大小,其中优选大小50mm×40mm,入口出口设置层上入口出口的优选孔径为1.5mm,反应室的容积可设置任意合理的范围,其中优选反应室尺寸11mm×7mm×3mm或者20mm×10mm×3mm。
进一步,所述微流控芯片包括底层与芯片层,芯片层上设置一到数个列阵列通道及出入口。
进一步,所述微流控芯片长70-80mm,宽20-30mm。
进一步,所述单个阵列通道长68mm,宽3.5mm,高50um。
进一步,所述永磁铁形状为圆柱形,其设置于纯化芯片反应室的下方。
进一步,所述单个阵列通道设置两个入口,两个出口;两入口一个为分选细胞入口,另一个为缓冲液入口;两个出口一个为需纯化细胞出口,及一个废液出口,废液出口连通小细胞过道,需纯化细胞出口连通大细胞过道。
进一步,各阵列通道的分选细胞入口相通,缓冲液入口相通,废液出口相桶,各需纯化出口相通,但不同名称的出入口并不相通;最终在微流控芯片表层汇成两个入口一个为总分选细胞入口,另一个为总缓冲液入口,两个出口分别为总废液出口及总需纯化细胞出口。
进一步,所述总需纯化细胞出口通过管状结构连接纯化芯片上的入口。
进一步,所述分选细胞为含肿瘤细胞的血液;所述需纯化细胞为肿瘤细胞及白细胞。
进一步,所述微流控芯片采用PDMS材料及软光刻技术制备。
进一步,所述纯化芯片由PMMA材料制成。
进一步,所述管状结构为软管6。
本发明还公开了上述循环血肿瘤细胞的联合分选纯化装置的制备方法:
分选结构的制备:
1)微流控芯片的制备:设计正三角形微阵列柱结构,采用PDMS材料及软光刻技术进行芯片制作;按照设计的图形制作掩膜;
2)将双喷气压泵、氮气罐、制作好的DLD芯片,控制结构和显微镜连接起来,构建自动化的气压泵压力驱动微流控芯片系统。
纯化结构的制备:
1)纯化芯片的制备:选择聚甲基丙烯酸甲酯(PMMA)材料,通过注塑成型方法制作而成的。应用激光雕刻机对芯片的反应室,入口及出口进行激光刻蚀。将三层制备好的单层芯片通过热压法键和。
2)将步进电机,支撑结构,纯化芯片及控制结构组装。
最后,将分选结构、纯化结构与控制结构连接,并通过管状结构将微流控芯片与纯化芯片连接。
本发明还公开了一种分选检测循环血肿瘤细胞的方法,具体包括:
1)将带肿瘤细胞的外周血及缓冲液引入微流控芯片内;
2)打开控制结构的开关,分选细胞通过大细胞过道与小细胞过道进行分选;
3)通过大细胞过道的需纯化细胞通过微流控芯片上的总需纯化细胞出口经管状结构进入纯化芯片入口,经过小细胞过道的细胞被废弃;
4)在纯化芯片的反应室内加入免疫磁珠;
5)启动纯化装置的步进电机,带动永磁铁运动,使免疫磁珠与白细胞充分混合一定时间,并有效结合,使其下部在永磁铁的吸引作用下位于反应室下方,上清液中的细胞即为肿瘤细胞;
6)将上清液取出放入培养基内培养并进行鉴定。
7)通过免疫抗原抗体反应进行检测,最后在荧光显微镜下观察细胞的不同显色情况,进而将CTC与白细胞鉴定。
进一步,所述缓冲液为PBS缓冲液。
进一步,将带肿瘤细胞的外周血通过微流控芯片上的分选细胞入口进入芯片,所述PBS缓冲液通过缓冲液入口进入芯片内,由气压泵控制液体的流速。
进一步,所述管状结构为设置于微流控芯片需纯化细胞出口及纯化芯片入口之间的软管结构,软管结构为用于运输的管道结构。
进一步,所述的免疫磁珠为CD45免疫磁珠。
进一步,所述培养基为鼠尾胶原蛋白培养基。
进一步,免疫磁珠与白细胞充分混合20min,免疫磁珠与白细胞混合比例为10:1。
进一步,步骤7中免疫抗原抗体反应中使用的试剂是EpCAM抗体、CK抗体、CD45抗体及DAPI标记细胞核。CTC表达EpCAM+/CK+/CD45-/DAPI+,白细胞表达EpCAM-/CK-/CD45+/DAPI+。
与现有技术相比,本发明循环血肿瘤细胞的联合分选纯化装置可以很好的实现肿瘤细胞的分选与纯化,合理的将微流控芯片技术,免疫磁珠技术及细胞免疫荧光反应组合。为有效检测分选处肿瘤细胞提供了更为有效的方式。另外装置具备用时短(总分选时间约为30min),cellsearch为4h,价格低(500VS5000RMB),样本需求量小(3-4mlVS7.5ml),装置小、便捷等优势。
附图说明
图1为本发明整体结构示意图;
图2为本发明整体上视结构透视图;
图3为本发明纯化结构示意图;
图4为本发明微流控芯片与纯化芯片连接示意图;
图5为本发明纯化芯片构示意图;
图6为本发明微流控芯片结构示意图;
图7为本发明正三角形阵列局部放大结构示意图;
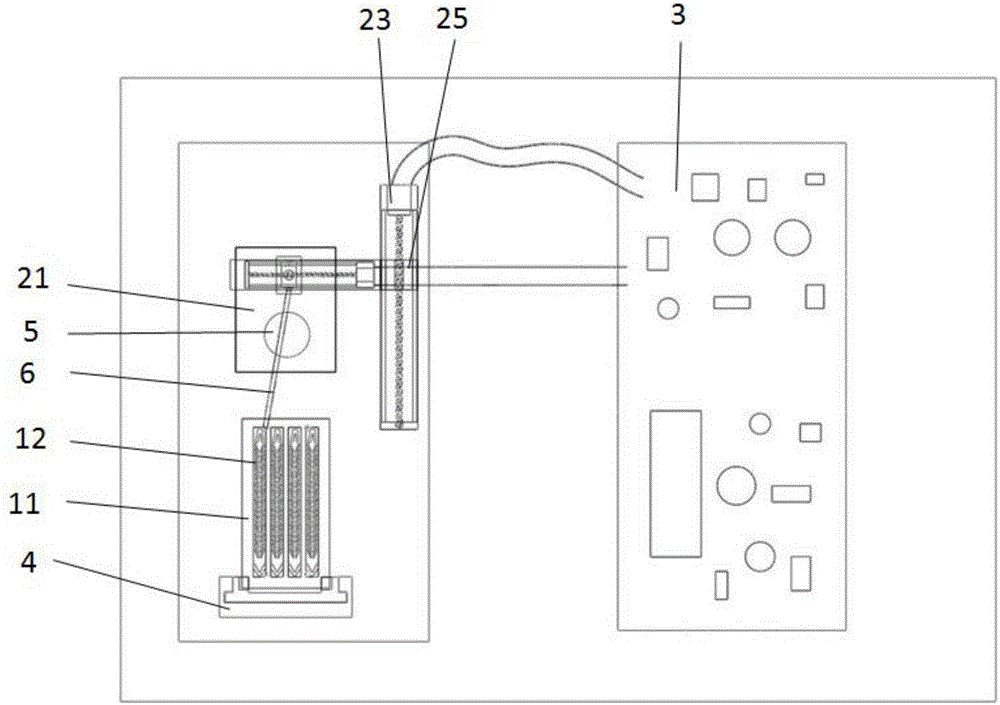
图中,11、微流控芯片;111、底层;112、芯片层;12、阵列通道;13、正三角形微阵列柱;14、小细胞过道;15、大细胞过道;16、总分选细胞入口;17、总缓冲液入口;18、总废液出口;19、总需纯化细胞出口;21、纯化芯片;211、底板层;212、凹槽层;213、入口出口设置层;214、反应室;215、纯化芯片入口;216、纯化芯片出口;22、永磁铁;23、步进电机;24、滑块;25、支撑块;3、控制结构;4、支撑件;5、支撑杆;6、软管。
具体实施方式
实施例1一种循环血肿瘤细胞的联合分选纯化装置
一种循环血肿瘤细胞的联合分选纯化装置,包括分选结构、纯化结构及控制结构3;其中,控制结构3伸出导线连接分选结构及纯化结构;控制结构3控制分选结构及纯化结构;
分选结构包括微流控芯片11,双喷气压泵、氮气罐、显微镜,各部分连接构建自动化气压泵压力驱动微流控芯片11系统;芯片总体大小25.4*76.2mm。其包括底层111与芯片层112,芯片层112上设置一到4个列阵列通道12及两个出口及两个入口,单个阵列通道12长68mm,宽3.5mm,高50um,阵列通道12两侧设置正三角形微阵列柱13,正三角形微阵列柱13之间形成小细胞过道14,及正三角形微阵列柱13中间为大细胞过道15;正三角形微柱的边长为25um,柱子水平的间距为30um,垂直间距为20um,阵列的前斜角为3.2°。小细胞过道14汇集废液出口,大细胞过道15汇集需纯化细胞出口;阵列通道12还包括两个入口,一个为分选细胞入口,另一个为缓冲液入口;各阵列通道12的分选细胞入口相通最终汇聚到芯片层112表层的总分选细胞入口16,缓冲液入口相通最终汇聚到芯片层112表层的总缓冲液细胞入口,废液出口相桶最终汇聚到芯片层112表层的总废液出口18,各需纯化出口相通最终汇聚到芯片层112表层的总需纯化细胞出口19。分选结构还包括一个支撑件4,支撑件4支撑微流控芯片11。用于支撑微流控芯片11到一定高度。微流控芯片11采用PDMS材料及软光刻技术制备。
纯化结构包括纯化芯片21,永磁铁22,供永磁铁22运动的两个带轨道的步进电机23,永磁铁22设置于纯化芯片21下方,两个步进电机23垂直设置,一个步进电机23上设置永磁铁22,永磁铁22通过设置在轨道上的滑块24设置在步进电机23轨道上;而设置永磁铁22的步进电机23通过另一个步进电机23轨道上的支撑块25设置在另一步进电机23轨道上。控制结构3控制步进电机23的运动;纯化芯片21包括三层结构,为底板层211,凹槽层212及入口出口设置层213;底板层211位于最下方,凹槽层212位于中间,入口出口设置层213设置在最上方,凹槽层212的凹槽围成反应室214;入口出口设置层213上对应反应室214的位置设置纯化芯片入口215与纯化芯片出口216。纯化芯片大小50mm×40mm,入口出口设置层213上入口出口的孔径为1.5mm,反应室尺寸11mm×7mm×3mm或者20mm×10mm×3mm。纯化芯片21由PMMA材料制成。纯化芯片21下设置支撑杆5使纯化芯片21与微流控芯片11水平高度相同。
总需纯化细胞出口19通过软管6连接纯化芯片入口215,控制结构3包括电源,控制单元,电路板。永磁铁22形状为圆柱形,其设置于纯化芯片21反应室214的下方。
本装置可以实现微阵列芯片及免疫磁珠技术的结合,将通过微阵列的大细胞过道15的循环血细胞移入纯化芯片21,并通过在纯化芯片21内加入免疫磁珠,两步进电机23带动永磁铁22运动,达到充分混合的目的,最后通过固定永磁铁22将白细胞吸附于底部,将上清液中得到纯化的肿瘤细胞。
实施例2一种循环血肿瘤细胞的联合分选纯化装置的制备方法
一种循环血肿瘤细胞的联合分选纯化装置的制备方法
分选结构的制备:
1)微流控芯片11的制备:设计正三角形微阵列柱13结构,采用PDMS材料及软光刻技术进行芯片制作;按照设计的图形制作掩膜;芯片制作选择聚二甲基硅演烷(PDMS)材料;将PDMS与固化剂按照1:10比例混匀、真空排泡,倒入模板中抽真空排气泡,放入烤箱80℃烘烤1小时,取出后按芯片设计大小切割打孔。取清洁干净的玻片并用氮气吹干净,与切割好的PDMS一起进行等离子清洗、键合,置于烤箱80℃烘烤30分钟。
2)将双喷气压泵、氮气罐、制作好的DLD芯片,控制结构3和显微镜连接起来,构建自动化的气压泵压力驱动微流控芯片11系统。
纯化结构的制备:
1)纯化芯片21的制备:选择聚甲基丙烯酸甲酯(PMMA)材料,通过注塑成型方法制作而成的。应用激光雕刻机对芯片的反应室214,入口及出口进行激光刻蚀。将三层制备好的单层芯片通过热压法键和,热压键合工艺的参数主要有键合压力、键合温度和键合时间,键和压力应在0.5~1.5MPa,键和温度在90℃左右,键和时间为10min。
2)将步进电机23,支撑结构,纯化芯片21及控制结构3组装。
最后,将分选结构、纯化结构与控制结构连接,并通过软管将微流控芯片的总需纯化细胞出口与纯化芯片入口连接。
实施例3一种循环血肿瘤细胞的分选方法
利用实施例1中的循环肿瘤细胞的联合检测装置分析带肿瘤细胞的血样,具体为:
首先取健康人外周血加入示踪的肿瘤细胞构成样本,浓度分别为101/ml,102/ml,103/ml,104/ml,105/ml为计算整体装置的分选率和分选纯度。
将血样通过DLD芯片的总分选细胞入口16,同时将PBS加入芯片的总缓冲液入口17,通过控制结构3控制气压泵进而达到控制液体的流速的目的,压力泵为OB1PressureController(ELVEFLOW,France)。血样流速为1ml/min,在收集口处,几乎全部的红细胞及90%的白细胞都从总废液出口18流出,而示踪的肿瘤细胞(CTC)及约10%的白细胞由总需纯化细胞出口19导入纯化芯片21的入口,进而流入反应室214。
后通过纯化芯片21的出口加入CD45免疫磁珠,接通控制结构3上电源及电路板上的开关,永磁铁22会在反应室214的底部拖动CD45磁珠与白细胞充分混合,混合时间为20min,CD45磁珠与白细胞混合比例10:1,之后将永磁铁22放在反应室214底部,从出口吸出上清液,即包含CTC及极少量的白细胞(约占总白细胞的1%)。
再将上清液放在由鼠尾胶原蛋白包被的培养皿中,进行下一步的鉴定。
实施例4一种循环血肿瘤细胞的分选结果的鉴定使用
1分选率的鉴定实验
实验材料:实施例3分选纯化后的细胞
实验方法:通过免疫抗原抗体反应进行检测,使用的试剂是EpCAM抗体、CK抗体、CD45抗体及DAPI标记细胞核。CTC表达EpCAM+/CK+/CD45-/DAPI+,白细胞表达EpCAM-/CK-/CD45+/DAPI+,在荧光显微镜下观察细胞的不同显色情况,进而将CTC与白细胞鉴定。
实验结果:通过细胞实验,我们得出装置的总体分选率分别为77.8%,91.7%,89.2%,91.2%and 89.5%,对应的浓度为101/ml,102/ml,103/ml,104/ml,105/ml。可见装置的分选率接近90%,分选效果很好。
2细胞活性鉴定实验
实验材料:实施例3分选纯化后的细胞及未经处理的培养箱中的细胞(对照组)
实验方法:分别向实验组、对照组中加入Hochest、PI两种试剂,进而在荧光显微镜下将正常细胞、凋亡细胞和坏死细胞区别开来。正常细胞为低蓝色(Hoechst+),凋亡细胞为高蓝色(Hoechst++),坏死细胞为高红色(PI++)。
实验结果:对细胞活性进行了Hochest/PI检测,细胞活性可达90%,与正常培养,未经分选的细胞无差异。因此得出,该装置对细胞活性无影响。
2临床效果鉴定实验
实验材料:肺腺癌14例(III、IV期)、乳腺癌8例(I-IV期)、结肠癌4例(III、IV期)、骨髓瘤2例(IV期)、胸腺瘤1例(IV期)、膀胱癌1例(III期)
实验方法:取临床患者的循环血,分别采用实施例3的方法及临床分选的金标准Cellsearchsystem进行肿瘤细胞的分选纯化。
实验结果:与CTC的分选金标准Cellsearchsystem进一步对比,得出在分选性能上,与之无明显差异。
上述实施例的说明只是用于理解本发明。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进,这些改进也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!