一种共增菌培养基SSEL的制作方法
本发明涉及农产品检测领域,具体地说是涉及一种可以同时富集肠炎沙门氏菌、金黄色葡萄球菌、大肠杆菌O157:H7和单增李斯特菌的共增菌培养基SSEL。
背景技术:
沙门氏菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和单增李斯特菌(Listeria monocytogenes)是常见的食源性致病菌,它们在食用农产品中存在一定的检出率,是污染这类食品的主要病原菌,并引发过多次大规模的食物中毒事件。开发食源性致病菌的快速检测方法,对于及时有效控制食源性疫情的传播,预防类似事件的发生具有重要意义。
检测食源性致病菌,首先要选用合适的增菌液对样品进行16-24h的增菌培养,该过程不仅可以选择性地富集待检致病菌抑制背景微生物的生长,还可以使受损的细胞复苏,进而使样品中的病原菌浓度达到检测限,从而提高检出率,避免漏检和错检。因此,增菌培养是微生物检测中必不可少的一步,现有的各种微生物快速检测新技术,例如各种聚合酶链式反应(PCR)、基因芯片、酶联免疫吸附(ELISA)等方法因自身检测能力的限制(检测限102~104)及背景微生物的干扰都不能绕过增菌这一富集过程。并且,针对不同的待检致病菌,样品所用的增菌液和选择性培养基也不同,这种只针对某一特定菌种富集的增菌液很大程度上限制了高通量检测技术(例如多重PCR和基因芯片检测技术)的应用,导致了高通量检测方法难以用于实际样品的检测。因此,开发能选择性富集多种目标致病菌的共增菌培养基,对实现快速高效的共检技术起到了关键作用。
目前国内外关于共增菌培养基的研究包括可用于肉制品的SEL(肠炎沙门氏菌、大肠杆菌O157:H7及单增李斯特菌的共增菌液)和SSL(肠炎沙门氏菌、金黄色葡萄球菌及单增李斯特菌的共增菌液);可用于水产品的SVV(沙门氏菌、霍乱弧菌及副溶血弧菌的共增菌液)和SSSV(沙门氏菌、志贺氏菌、金黄色葡萄球菌及副溶血弧菌的共增菌液)等。由于每种致病菌都有各自的生长习性,往往用于富集某种细菌的成分会成为其它细菌的生长抑制剂。因此,在开发共增菌培养基时,每增加一种致病菌都要重新考虑营养成分及抑制剂,这是开发共增菌培养基的一个限定条件。目前,还未见到针对食用农产品中常见的沙门氏菌、金黄色葡萄球菌、大肠杆菌O157:H7及单增李斯特菌进行共增菌培养(本专利中标注为SSEL)的报道。
技术实现要素:
本发明的目的在于提供一种共增菌培养基SSEL,其由基础培养基、抑制剂和水组成,各组分的配比和组成如下:
(1)基础培养基:胰蛋白胨大豆肉汤20~40份,酵母浸膏4~8份;
(2)抑制剂:吖啶黄0.010~0.014份,萘啶酮酸0.0020~0.0030份,去氧胆酸钠8~12份,氯化锂13~17份;
(3)水,900~1100份;
上面所说的份数均为重量份数。
优选的一种共增菌培养基SSEL,其由基础培养基、抑制剂和
水组成,各组分的配比和组成如下:
(1)基础培养基:胰蛋白胨大豆肉汤30份,酵母浸膏6份;
(2)抑制剂:吖啶黄0.012份,萘啶酮酸0.0025份,去氧胆酸钠10份,氯化锂15份;
(3)水,1000份。
本发明的共增菌培养基SSEL是通过如下方法制备的:
分别称取胰蛋白胨大豆肉汤、酵母浸膏、去氧胆酸钠、氯化锂,加水,搅拌均匀;
121℃高压灭菌,冷却至室温;
在上述混合液中,无菌添加吖啶黄和萘啶酮酸,混匀,即制成所需的共增菌培养基(SSEL),该培养基可立即使用或2~8℃保存。
制备好的共增菌培养基,可将检测样品按照1:100的重量比例接入SSEL培养基中,36℃过夜培养16~24h(视样品污染程度或菌液混浊程度),即可用于后续进一步检测。
本发明以肠炎沙门氏菌、金黄色葡萄球菌、大肠O157:H7和单增李斯特菌4种菌为目标菌,研制出可以同时富集这4种菌的选择性培养基,填补了目前共增菌选择性培养基在此方面的空白,构建了样品处理与后续多重PCR等高通量检测方法之间的桥梁。
与特异性的选择性增菌液相比,本发明的共增菌液可同时富集肠炎沙门氏菌、金黄色葡萄球菌、大肠O157:H7和单增李斯特菌四种菌,有望于高通量检测技术联用,达到同时检测多种致病菌的目的;与广谱性增菌液相比,本发明的选择性增菌液在基础培养基的基础上添加了抑菌剂,更好地抑制了非目的菌的生长,避免了杂菌的干扰;同时,该培养基对冷损伤的菌株有一定的修复能力,可以避免亚致死状态下目标菌的漏检。
本发明的优点是:
1、可以进行多种致病菌的共培养。
2、理论上不受检测灵敏度限制。
3、节省待检样本数量,并省时省力。
4、检测样本广泛。
附图说明
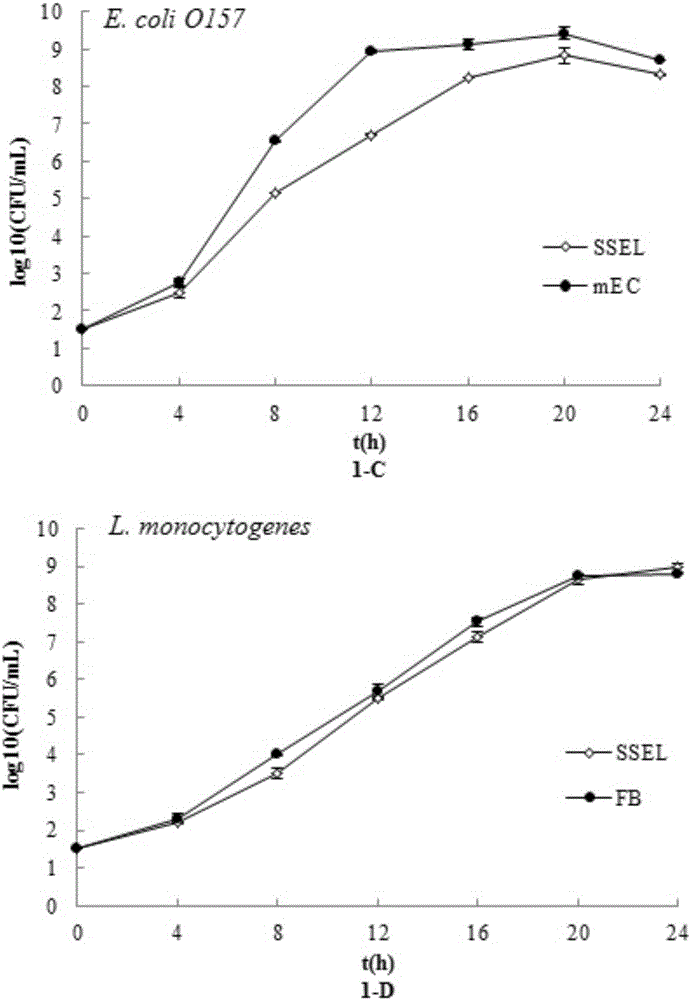
图1为SSEL与商业化增菌液分别对4种目标菌的增菌效果比较。
其中4种商业化增菌液分别为:沙门氏菌RV(1-A)、金黄色葡萄球菌7.5%NaCl肉汤(1-B)、大肠杆菌O157:H7mEC(1-C)和单增李斯特菌FB(1-D)。
图2为4种目标菌按不同比例接入SSEL后,SSEL对4种菌的富集效果。
其中肠炎沙门氏菌(SA),金黄色葡萄球菌(LM),大肠杆菌(O157),单增李斯特菌(SE)的复合接菌比例分别为:1:1:1:1(2-A)、1:10:100:1000(2-B)、10:1:1000:100(2-C)、100:1000:1:10(2-D)和1000:100:10:1(2-E)。
图3为SSEL对实际样本中冷损伤目标菌的修复增菌能力。
包括生菜(市售)中的4种目标菌在4℃贮存2d后,SSEL对目标菌的增菌能力(3-A)和生猪肉(市售)中的4种目标菌在-20℃贮存10.5d(3-B)后,SSEL对目标菌的冷损伤修复能力。
图4为添加极少量(~10CFU/ml)目标菌到增菌培养液SSEL后,多重PCR检测4种目标菌的电泳图。
其中:M:Marker;1:阴性对照;2:单增李斯特菌;3:金黄色葡萄球菌;4:沙门氏菌;5:大肠杆菌O157:H7;6:多重PCR产物
图5为多重PCR检测冷冻猪肉(市售)经增菌培养液SSEL培养后目标菌的电泳图
其中:1:冷冻猪肉多重PCR;2:阳性对照;M:Marker;3:阴性对照
具体实施方式
以下结合附图通过实施例对本发明做进一步说明。
试剂:胰蛋白胨大豆肉汤(OXOID);酵母浸膏(OXOID);去氧胆酸钠(Sigma);氯化锂(Sigma);吖啶黄(Sigma);萘啶酮酸(Sigma);猪肉、生菜(上海市奉贤区南桥镇百联超市);沙门氏菌RV、金黄色葡萄球菌7.5%氯化钠肉汤、大肠杆菌mEC+n、单增李斯特菌FB(均购于广东环凯微生物科技有限公司)。
菌株:肠炎沙门氏菌(ATCC 13076);金黄色葡萄球菌(ATCC 25913);大肠杆菌O157:H7;单增李斯特菌(F 2365);溶菌酶(上海生工有限公司);引物(上海生工有限公司)。
实施例一:共增菌培养液SSEL的单独增菌效果验证
SSEL培养基的制备:分别称取胰蛋白胨大豆肉汤30份、酵母浸膏6份、去氧胆酸钠10份、氯化锂15份,加去离子水1000份,搅拌均匀,121℃高压灭菌,冷却至室温。然后,无菌添加吖啶黄0.012份和萘啶酮酸0.0025份,搅拌均匀,制成SSEL培养基。
SSEL增菌培养:将101一102CFU/mL的沙门氏菌、金黄色葡萄球菌、大肠杆菌O157:H7、单增李斯特菌分别接种至100mL SSEL及各自选择性增菌液中(沙门氏菌:RV、金黄色葡萄球菌:7.5%氯化钠肉汤、大肠杆菌O157:H7:mEC+n、单增李斯特菌:FB)中,37℃振荡培养24h,每4h取一次培养物,用各目标菌选择性分离培养基计数(图1)。从图1可以看出:肠炎沙门氏菌和单增李斯特菌在SSEL中的生长情况与在RV和FB中的相当,由于抑制剂的作用,在SSEL中金黄色葡萄球和O157:H7进入稳定期的时间比在7.5%Nacl肉汤、mEC中长,但经过24h培养,最大菌浓度为108CFU/mL及以上,可满足快速富集菌体,提取菌体DNA的要求。
实施例二:SSEL复合增菌效果验证
SSEL培养基的制备:参照实施例一。
SSEL增菌培养:将沙门氏菌、金黄色葡萄球菌、大肠杆菌O157:H7、单增李斯特菌依次分别按1:1:1:1(102CFU/mL)、1:10:100:1000(101一104CFU/mL)、10:1:1000:100、100:1000:1:10、1000:100:10:1 5种比例混合接种至SSEL中,37℃200rpm振荡培养24h,每4h取一次培养物,用各目标菌选择性分离培养基计数(图2)。从图2可以看出当四种目标菌接菌量相同时,沙门氏菌、金黄色葡萄球菌、O157:H7及单增李斯特菌在SSEL中生长状况良好,生长速度、滞后期、稳定期较为相近。当革兰氏阳性菌接种量低时(SA:LM:O157:SE=1:10:100:1000、SA:LM:O157:SE=10:1:1000:100),阳性菌生长即菌生长速度与接菌量成正相关。金黄色葡萄球菌竞争性最弱,最大菌浓度最小为105CFU/mL,仍能满足现代生物检测技术的检测要求。当革兰氏阴性菌接种量低时(SA:LM:O157:SE=100:1000:1:10、SA:LM:O157:SE=1000:100:10:1),革兰氏阴性菌适应性良好经过16h培养,沙门氏菌、O157:H7最大菌浓度在107CFU/mL以上。
实施例三:SSEL对冷伤目标菌的修复能力验证
SSEL培养基的制备:参照实施例一。
待检样品的处理:取市售生猪肉、生菜各10g,经酒精浸泡消毒风干后,分别接种肠炎沙门氏菌(ATCC 13076),金黄色葡萄球菌(ATCC 25913),大肠感觉O157:H7,单增李斯特菌(F 2365),终浓度均为10CFU/g左右,风干至菌液完全吸收。生菜样品于4℃冰箱中保藏2天。猪肉样品于-20℃冰箱中保藏10.5天。
SSEL增菌培养:将上述人工污染的猪肉、生菜样品10g置于90ml SSEL中,36℃静置培养24h。每4h取一次培养物,用各目标菌选择性分离培养基计数(图3)。从图3可以看出:经过SSEL培养,可有效修复4℃冷藏了2d的生菜和-20℃冷冻了10.5d的猪肉中的目标菌,使肠炎沙门氏菌、金黄色葡萄球菌、O157:H7及单增李斯特菌的菌体浓度能达到106CFU/mL。
实施例四:SSEL结合多重PCR快速检测4种食源性致病菌
SSEL培养基的制备:参照实施例一。
SSEL增菌培养:分别取肠炎沙门氏菌,金黄色葡萄球菌,大肠O157:H7,单增李斯特菌过夜培养的新鲜菌液于100ml SSEL中,菌液的终浓度约为10CFU/ml,36℃180rpm培养24h。
检测模板的准备:取1ml 24h培养的增菌液,12000rpm离心30s,弃上清,加溶菌酶(10mg/ml)100μl,37℃孵育1h;每管加356μl TE,混匀;加入53μl SDS(10%),68℃水浴15min;加入87μl NaCl(1%)和69μl CTAB(1%),68℃水浴15min;加入等体积苯酚:氯仿:异戊醇(25:24:1)混匀,12000rpm离心15min,取上清于新的离心管内;加入氯仿:异戊醇(24:1)混匀,12000rpm离心5min,取上清于新的离心管内;加入2倍体积的冰无水乙醇,-20℃放置2h,12000rpm,离心10min;弃上清,加70%乙醇洗涤(12000rpm离心5min);弃上清,风干,加50μl RNaseA(20μg/ml)无菌水溶解,于分光光度计测定浓度后,置于-20℃保存。
多重PCR检测:选择沙门氏菌invA基因、金黄色葡萄球菌ileS基因、大肠杆菌O157:H7rfbE基因和单增李斯特菌hly基因,利用Primer V5.0和Oligo V6.22软件进行引物的评价和筛选,4种目标菌的上下游引物序列分别为:TTCTCTTGGCGCCCACAATGCGAG与TCCATCAGCAAGGTAGCAGTC(沙门氏菌);CATACAGCACCAGGTCACGGGGAA与GTTCTCCAGTCGTGTGGATAGC(金黄色葡萄球菌);AACGGTTGCTCTTCATTTAG与GAGACCATCCAATAAGTGTG(大肠杆菌O157:H7);GGTTTAGCTTGGGAATGGTG与GATAAAGCGTAGTGCCCCAG(单增李斯特菌)。PCR扩增体系为50μl,包含2×Taq PCR MasterMix 25μL、上下游引物各1μL、模板4μL,加dd H2O补足至50μL。反应条件如下:94℃30min,94℃30s,55℃30s,72℃1min,扩增35循环;72℃延伸10min。PCR产物用2.0%琼脂糖进行电泳(图4),结果显示SSEL可联合多重PCR用于多种菌的快速高效检测。
实施例五:SSEL结合多重PCR快速检测冷冻猪肉(市售)中的4种食源性致病菌
SSEL培养基的制备:参照实施例一。
待检样品的处理:取市售生猪肉10g,猪肉经酒精浸泡消毒风干后,分别接种肠炎沙门氏菌(ATCC 13076),金黄色葡萄球菌(ATCC 25913),大肠O157:H7,单增李斯特菌(F 2365),终浓度均为10CFU/g左右,风干至菌液完全吸收,置均质袋中于-20℃保存7天。
SSEL增菌培养:将人工污染的猪肉(市售)样品10g置于90ml SSEL中,36℃静置培养24h。
检测模板的准备:取1ml 24h培养的增菌液,12000rpm离心30s,加入等体积TE缓冲液悬浮清洗菌体,1 2000rpm离心30s后弃上清,再加入450ml TE缓冲液,40μl 20μg/μl蛋白酶K、50μl 20μg/μl溶菌酶(上海生工),37℃孵育30min,水煮30min后12000rpm离心1min,取上清液作为模板。
多重PCR检测:参照实施例四。经人工污染生猪肉(市售)检测证实(图5),SSEL可联合多重PCR实现4种食源性致病菌在冷冻猪肉样品中的共检测。
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有更改和变化。凡在本发明的精神和原则之内,所作的任何修改、改进等,均应包括在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!