一种用于评估肿瘤免疫治疗效果的分子检测方法及引物组合物及试剂盒与流程
本发明属于分子生物学检测领域,特别是涉及一种用于评估肿瘤免疫治疗效果的分子检测方法及引物组合物及试剂盒。
背景技术:
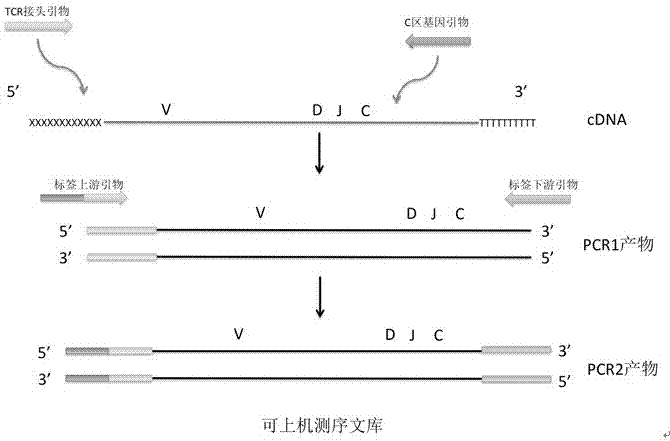
:癌症免疫治疗是继手术、放射治疗、化学治疗之后的又一种对治疗癌症有明确效果的癌症治疗方法,它是通过激活人体自身免疫系统来抵御、杀死肿瘤细胞,是未来癌症治疗发展的方向。不同患者使用不同的免疫疗法均会表现出不同的信息,这就需要对癌症免疫治疗患者进行特异性的免疫系统评估以监控癌症免疫治疗效果。如pd-1抗体是当前备受瞩目,广为关注的一类肿瘤疗法,也是肿瘤免疫疗法中的主力军。pd-1免疫疗法的作用机制是针对pd-1或pd-l1设计特定的蛋白质抗体,阻止pd-1和pd-l1的识别过程,部分恢复具有抗原特异性的细胞毒性t细胞(cd8+tcell)功能,从而使之可以杀死肿瘤细胞。流式细胞仪(fc)做为一项被广泛应用,并能快速地对均质化的细胞样品进行多参数检测的仪器,我们可以通过fc来检测cd8+t细胞的pd1表达量。通过对比治疗前后t细胞上pd-1的表达,我们可以判断pd-1抗体药是否对患者起到了效果。t细胞基因座上大量的v(可变区)、d(多变区)、j(连接区)基因片段在t细胞受体的形成中会产生各种多样性重组。这种v-d-j基因的重组赋予了每一种t细胞自己独特的t细胞受体(tcr),从而使得每一个tcr的序列能有效的成为一个t细胞克隆的唯一生物标志物。因此对t细胞tcr基因的序列组成进行测序,可以很好的定位每一种t细胞。通过tcr测序这种分子检测方法检测到cd8+t细胞的多样性状态和克隆性。低多样性表示一个人的t细胞的免疫多样性少,这种免疫状态通常具有较高感染率和高死亡率,也反映了对各种疾病的抵御能力和被治愈能力较低,同时,其t细胞克隆性增殖也较高。相反,如果t细胞多样性越高的话,说明免疫系统越有能力抵御外来疾病,这是因为高的t细胞多态性可以防止“抗原逃逸”。并且通过对比治疗前后的t细胞多态性和克隆性,从而判断病患的免疫系统是否被免疫治疗所激活。癌症免疫治疗效果监控可为患者提供一个快速的,非侵入性的免疫系统评估。并能帮助医疗工作者和癌症病人早期预测癌症免疫治疗的效果,让病患能在对抗癌症的斗争中更有效的选择治疗手段,避免了浪费癌症病人治疗的时间和金钱。技术实现要素:为了解决以上技术问题,用于评估肿瘤免疫治疗效果的分子检测方法,通过对有活性的cd8+t细胞的pd-1分子进行检测以及高通量测序构建t细胞的tcr文库,以及构建的cdna接头和单对引物,以及文库制备方法,通过从接头的上游引物到c区的下游引物,获得tcr的多态性和克隆性。解决以上技术问题的本发明中的一种用于评估肿瘤免疫治疗效果的分子检测方法,其特征在于:包括如下步骤:(一)获取人血液样本10ml于edta抗凝管;(二)利用淋巴细胞分离液ficoll-1077(美国sigma公司#10771)进行外周血单核细胞(pbmc)的分离;淋巴细胞分离液的作用在于可以从全血里分离淋巴细胞,因为t细胞为我们检测对象,t细胞属于淋巴细胞的一种,分离后的细胞群所获得的rna是除去了红细胞、血小板等细胞的rna的。所以建库使用的总rna内含t细胞rna模板纯度更高。(三)利用流式细胞仪检测cd8+t细胞pd-1分子的表达量;所用的抗体为:anti-cd3、anti-cd8、anti-pd1和anti-4-1bb(美国biolegend公司,anti-cd8fitc,#300906;anti-cd3apc,#300312;pd-1,#329906;4-1bb,#309820.)冰上操作步骤:用80μl的stainingbuffer将细胞沉淀重悬(106细胞)。同时制备对照管(5个1.5ml管):1)在一空白管中加入95μlstainingbuffer(pbs+5%fbs美国gibco#26140079)作为不染色的同型对照,其余的对照管中分别加入90μlstainingbuffer作为单染对照,每管中加入5μl细胞悬液。2)在单染对照管中分别加入5ul的anti-cd3、anti-cd8、anti-pd1和anti-4-1bb抗体(美国biolegend公司,anti-cd8fitc,#300906;anti-cd3apc,#300312;pd-1,#329906;4-1bb,#309820.)。如下表1:表1样品染色:准备抗体混合液(单个样品中anti-cd3、anti-cd8、anti-pd1和anti-4-1bb各5μl),并在样品中加入抗体混合液(20μl)并温和混匀。如下表2:表2sample1sample2sample3sample4细胞悬液(μl)80808080cd3+cd8+pd1+4-1bb(μl)20202020总体积(μl)100100100100避光冰浴25min。用200μlstainingbuffer清洗,1500rpm离心10min。弃上清,加入200μlstainingbuffer重新清洗一遍。用300μlstainingbuffer重悬细胞,转移至facs管。放置冰上并避光,送样上机进行facs检测cd3+cd8+4-1bb+细胞的pd-1表达量。(四)利用流式细胞仪分离cd8+t细胞;(五)利用trizol的方法提取cd8+t细胞的总rna,所用试剂为rnazolrt(美国mrc公司#rn190);trizol的方法具体步骤如下:收获细胞,转移入1.5ml离心管中,加入1mltrizol,混匀,室温静置5min。加入0.2ml氯仿,振荡15s,静置2min。加入0.5ml异丙醇,将管中液体轻轻混匀,室温静置10min。4℃离心,12000g×10min,弃上清。加入1ml75%乙醇,轻轻洗涤沉淀。4℃离心,7500g×5min,弃上清。自然风干,加入50ul的depch2o溶解,得到淋巴细胞总rna。(六)rna反转录成cdna,并同时在cdna5’端添加接头,用于后面pcr扩增时5’端引物结合;在反转录时,同时添加接头,可以最小化rna在多步反应过程中的丢失。rna在操作中稳定性极差,非常容易降解,少量的步骤可以最大程度上减少降解,同时也节约了可用于扩增的cdna制备时间。接头就是cdna5‘端的核酸接头,即下面提到的“tcr5’oligo接头”。(七)pcr1:通过单对引物的方式扩增重组tcrcdna;(八)pcr2和纯化:为pcr1产物(扩增后的tcr序列)添加illumina高通量测序仪的上机接头和标签,同时为增加更多的上机基因量再次扩增;pcr反应结束后,利用磁珠进行dna纯化。pcr产物一般都含有过量的引物、taqdna酶及dntp。这些成分的存在将直接影响到后续的文库质检、测序反应等过程,纯化可以去除这些影响后续实验的副产物。同时,纯化的过程也是一个片段大小筛选的过程,本发明中的dna片段是在700bp左右,可利用不同体积的磁珠与pcr产物混合,磁珠/dna不同的体积比例可以吸附不同大小的片段,利用上述磁珠体积,可以成功去掉pcr扩增时的错误(误差)片段和引物双聚体,让我们的测序上机文库只有我们的测序目标dna片段,使得测序结果更加准确,减少误差。如图3所示,通过文库质检只发现了一个片段的峰。(九)进行高通量测序:将所得的cdna文库通过illuminamiseq平台进行测序,测序模式为pe300,并通过生物信息学分析高通量测序结果;选择测序模式pe300,文库变性浓度为2nm,上机浓度为20pm。对比病人治疗前后超过10%的克隆群的克隆性变化。查看在免疫治疗后,是否相同的t细胞克隆群是否有更多的克隆性增殖。如果有,说明免疫治疗对其免疫系统是起到了一定作用的。所述步骤(六)中,具体步骤如下:按照以下比例混合每一个rna样本:试剂体积1x(μl),rna8,tcr3’oligo(dt)引物(10μm)1,孵化于72℃3分钟,接着4℃1分钟;制备pcr反应缓冲液。所述混合pcr反应缓存液与rna样本,按照下面反应程序开始cdna反转录:42℃60分钟;70℃10分钟;4℃永久。所述pcr反应缓冲液:所述步骤(七)中,按照以下比例制备反应体系:pcr1反应程序为:95℃3分钟;95℃30秒;65℃1分钟,25循环;72℃1分钟;4℃永久。所述步骤(八)中,按照以下比例制备反应体系:pcr2反应程序为:94℃3分钟;94℃30秒;55℃30秒,15循环;72℃20分钟,72℃1分钟,4℃永久。所述步骤(八)中,具体纯化步骤如下:(一)添加80μlampurexpbeads进入pcr2反应产物,混匀;(二)在室温孵化10分钟;(三)放置磁珠-pcr2产物混合物试管于磁力架上,等待所有磁珠吸附于磁力架上后,用移液器吸去所有上清液,丢弃;(四)添加150μl70%乙醇于磁珠上,孵化30秒,用移液器吸去所有上清液,丢弃;(五)重复第四步2次;(六)打开试管盖,等待5分钟,待磁珠风干,没有任何乙醇残留于试管内;(七)把试管从磁力架上取下,并添加50μl去核酸酶水,利用移液器吹打悬浮磁珠;(八)把试管放回磁力架,等待所有磁珠都吸附于磁力架后,转移上清液于新的试管中,上清液里就包含了纯化之后的pcr2产物。本发明中一种用于评估肿瘤免疫治疗效果的分子检测引物组合物,其特征在于:所述引物组合物包括tcr3’oligo(dt)引物,tcr5’oligo接头,tcrc区引物和标签上下游引物;其中每一种引物的序列如下:tcr3’oligo(dt)引物:5’ttttttttttttttttttttga3’;tcr5’oligo接头:5’atgcatcggatcttcagcatgaacttrgrgrg3’;tcr5’端接头引物:5’gtctcgtgggctgggcgatgtgtatgagagacagcatgcatcggatcttcagcatga3’;tcrc区引物:5’tcgtcgccagcgtcggaagtgtataagagacagtcgcagcgtcagatgtgtataagagacag3’;标签上游引物:5’caagcagaagacggcatacgagat[index1]gtctcgtgggctgg3’;标签下游引物:5’aatgatacggcgaccaccgagatctacac[index2]tcgtcgccagcgtc3’。其中,所述index1为atctatcg、tcaggtga、cactagtt、gaattgcc、atgtacaa、gattcagt、ctgttcgt或tatacggc中的一种;index2为tagctact、attatagc、cccgtact、gggtataa、agcaggtg、tatacgta、cacctagt或gttgctac中的一种。本发明中一种用于评估肿瘤免疫治疗效果的分子检测试剂盒,其特征在于:所述试剂盒含有如权利要求1或2所述的引物组合。所述试剂盒还包括pcr缓冲液、q5high-fidelity2xmastermix、去核酸酶水、ampurexpbeads和70%乙醇。本发明中的引物组合能有效的扩增tcr基因的全序列。使tcr二代测序文库构建效率高效,试剂盒为用户提供了简单便捷的使用方法,效率稳定。本发明基于流式细胞仪技术和高通量测序技术,tcr测序单对引物的文库构建方法,通过在获得cd8+t细胞rna后,在进行rna至cdna反转录的同时,给cdna的5’端添加一个接头,从而通过这个已知序列的接头设计tcr扩增上游引物,再配合tcr基因3’端c区基因(不变区)设计下游引物,从而达到扩增整个tcr序列全长基因的目的。本发明中通过检测出来cd8+t细胞的pd-1分子表达量和cd8+t细胞的多态性、克隆性来判断肿瘤病人免疫治疗的效果。目前并未有其他方法可以评价肿瘤免疫治疗的有效性。本发明提供了一种如第一方面所述的基于高通量测序构建tcr文库的cdna接头和单对pcr引物或第二方面所述基于高通量测序构建tcr文库的构建方法在检测cd8+t细胞的多态性和克隆性中的应用。本发明提供基于高通量测序构建tcr文库的接头,引物及方法的有益效果为:1.获得了人tcr全转录组序列;2.获得了人特异性cdr1、cdr2和cdr3序列;3.获得了人t细胞的多态性和克隆性,以便作为评价肿瘤免疫治疗的效果的依据。本发明在高通量测序平台的基础上,通过对人tcr基因测序结果进行全面的生物信息学分析,获得了tcr在vdj重组时的基因偏好性,vdj基因组合信息,tcr克隆种类信息,tcr多样性信息,cdr1、cdr2、cdr3的核酸序列和氨基酸序列信息,基因上的突变信息,等。正是这些因素形成数量庞大且种类多样的tcr组库。提供详细的测序后生物信息学数据分析,并且对整个实验提供有效的质量监控,能最大程度减少实验误差及错误。通过对tcr的测序评估可以快速的,非侵入性的帮助医疗工作者和癌症病人早期预测癌症免疫治疗的效果,让病患能在对抗癌症的斗争中更有效的选择治疗手段,避免了浪费癌症病人治疗的时间和金钱。通过简单的采集血液样本,利用流式细胞仪对受试者的cd8+t细胞表面蛋白(pd-1)进行分子分析以及t细胞受体基因进行二代测序和生物信息学临床分析后,获得的pd-1表达量、cd8+t细胞的多态性和克隆性,从而给出一个目前的免疫系统对肿瘤免疫治疗的应激情况,评价免疫治疗的效果。附图说明图1本发明中rna反转录cdna示意图图2为本发明中利用两次pcr扩增tcrcdna并添加测序上机接头示意图图3为本发明中测序文库质检结果。图4为本发明中tcr测序结果进行生物信息学分析比对,找出每条序列的信息(部分)图5为本发明中tcr测序结果3d森林图。展示受试者tcr的多样性和克隆性情况,每一条柱代表一种tcr克隆,克隆性增值的tcr表示了白血病癌细胞的增值情况,增值的这一条tcr序列就可作为免疫治疗效果的生物标志物,在治疗后对比统一克隆,看是否有更多的克隆性增值。图6为本发明中,对比肿瘤病人pd-1抗体药免疫治疗前后t细胞pd-1的变化。图7为本发明中,对比肿瘤病人pd-1抗体药免疫治疗前后t细胞克隆性的变化。(x轴:v基因;y轴:j基因;z轴:tcr克隆数)具体实施方式下面结合具体实施方式对本发明作进一步的详细描述,以下引物由美国invitrogen公司合成:实施例1运用本发明中的引物组合物和试剂盒,从而基于高通量测序用于评估肿瘤免疫治疗效果的分子检测,包括如下步骤:(一)获取人血液样本10ml于edta抗凝管;(二)利用淋巴细胞分离液ficoll-1077(美国sigma公司#10771)进行外周血单核细胞(pbmc)的分离;(三)利用流式细胞仪分离cd8+t细胞;所用的抗体为:anti-cd3、anti-cd8和anti-4-1bb(美国biolegend公司,anti-cd8fitc,#300906;anti-cd3apc,#300312;pd-1,#329906;4-1bb,#309820.)(四)利用trizol的方法提取cd8+t细胞的总rna,所用试剂为rnazolrt(美国mrc公司#rn190);(五)rna反转录成cdna,并在cdna5’端添加接头用于后面pcr扩增时5’端引物结合,具体步骤如下,所使用到的试剂:tcr3’oligo(dt)引物(10μm)5x反转录缓冲液(250mmtris-hcl(ph8.3),375mmkcl,15mmmgcl2)二硫苏糖醇,dtt(20mm)美国thermoscientific#r0861dntpmix(10mm)美国invitrogen#18427088rnaseout(40u/μl)美国invitrogen#10777019tcr5’oligo接头(10μm)superscriptiirt(200u/μl)美国invitrogen#18064022按照以下比例混合每一个rna样本:试剂体积1x(μl)rna8tcr3’oligo(dt)引物(10μm)1孵化于72℃3分钟,接着4℃1分钟。按照以下比例制备pcr反应缓冲液试剂体积1x(μl)5x反转录缓冲液3.5dtt(20mm)1dntp(10mm)1rnaseout1tcr5’oligo接头(10μm)1superscriptiirt1混合pcr反应缓存液与rna样本,按照下面反应程序开始cdna反转录42℃60分钟70℃10分钟4℃永久反应结束后,就可获得已在5’端添加了接头的总cdna(如图)(六)pcr1。通过“单对”引物的方式扩增重组tcrcdna,具体步骤如下:所使用到的试剂:q5high-fidelity2xmastermix(美国neb#m0492l)tcr5’端接头引物(上游引物)tcrc区引物(下游引物)去核酸酶水(美国thermoscientificam9914g)按照以下比例制备反应体系:pcr1反应程序为:(七)pcr2(标签pcr)。为pcr1产物(扩增后的tcr序列)添加illumina高通量测序仪的上机接头和标签,同时为增加更多的上机基因量再次扩增。具体步骤如下:所使用到的试剂:q5high-fidelity2xmastermix(美国neb#m0492l)标签上游引物标签下游引物去核酸酶水(美国thermoscientificam9914g)按照以下比例制备反应体系:pcr2反应程序为:(八)pcr2产物纯化。上述pcr反应结束后,利用磁珠进行dna纯化,具体步骤如下:所使用到的试剂:agencourtampurexpbeads(美国beckman#a63882)具体纯化步骤如下:1.添加80μlampurexpbeads进入pcr2反应产物,混匀。2.在室温孵化10分钟。3.放置磁珠-pcr2产物混合物试管于磁力架上,等待所有磁珠吸附于磁力架上后,用移液器吸去所有上清液,丢弃。4.添加150μl70%乙醇于磁珠上,孵化30秒,用移液器吸去所有上清液,丢弃。5.重复第四步2次。6.打开试管盖,等待5分钟,待磁珠风干,没有任何乙醇残留于试管内。7.把试管从磁力架上取下,并添加50μl去核酸酶水,利用移液器吹打悬浮磁珠。8.把试管放回磁力架,等待所有磁珠都吸附于磁力架后,转移上清液于新的试管中。上清液里就包含了纯化之后的pcr2产物。(九)进行高通量测序。将所得的cdna文库通过illumina平台(美国illumina公司)进行测序,测序模式为pe300,并通过生物信息学分析高通量测序结果。材料及试剂说明肺鳞癌症患者:来源河南省人民医院;肿瘤免疫治疗药:美国默沙东pd-1抑制剂keytruda;患者知情同意。非特殊说明,本发明采用的试剂均为市售商品,本发明实施例采用的数据库均为公开的在线数据库。具体地,本发明反转录5’端接头序列、引物序列如下(5’-3’):反转录步骤tcr3’oligo(dt)引物:5’ttttttttttttttttttttga3’tcr5’oligo接头:5’atgcatcggatcttcagcatgaacttrgrgrg3’pcr1步骤tcr5’端接头引物:5’gtctcgtgggctgggcgatgtgtatgagagacagcatgcatcggatcttcagcatga3’tcrc区引物:5’tcgtcgccagcgtcggaagtgtataagagacagtcgcagcgtcagatgtgtataagagacag3’pcr2步骤标签上游引物:5’caagcagaagacggcatacgagat[index1]gtctcgtgggctgg3’标签下游引物:5’aatgatacggcgaccaccgagatctacac[index2]tcgtcgccagcgtc3’rg=rna核苷酸标签引物中下划线部分为illumina测序标签序列,内序列可更换为下表序列,用于同时检测多个样本时,利用不同的index1/index2组合和生物信息学算法区分各个样本测序结果。引物设计:针对rna反转录时在tcr5’端添加的接头序列和tcrc区基因进行分析,采用oligo7.36和primerpremier6.0对引物二聚体以及茎环错配进行分析,在tcr5’端人工接头设置了上游引物,针对c基因下游设计反向引物,扩增tcr全长转录子区域序列,其中包含了tcr的fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4区域。实施例2本发明实施例1提供了一种t淋巴细胞受体(tcr)rna样品的制备方法,包括如下步骤:收集新鲜的外周血样本10毫升(ml),按照ficoll-1077(美国sigma公司#10771)的说明书操作,获得相对较纯的外周血单核细胞(pbmc);采用trizol的方法提取cd8+t细胞的总rna,所用试剂为rnazolrt(美国mrc公司#rn190),所获得的总rna,利用2.0fluorometer(美国thermofisherscientific公司#q32866),配合rnahsassaykit试剂盒(美国thermofisherscientific公司#q32852)测定rna浓度,然后反转录rna;实施例3本发明实施例2提供了一种用于评估肿瘤免疫治疗效果的分子检测方法,包括如下步骤:利用流式细胞仪检测cd8+t细胞pd-1分子的表达量;所用的抗体为:anti-cd3、anti-cd8、anti-pd1和anti-4-1bb(美国biolegend公司,anti-cd8fitc,#300906;anti-cd3apc,#300312;pd-1,#329906;4-1bb,#309820.)具体步骤如下:冰上操作:用80μl的stainingbuffer将细胞沉淀重悬(106细胞)。同时制备对照管(5个1.5ml管):1)在一空白管中加入95μlstainingbuffer作为不染色的同型对照,其余的对照管中分别加入90μlstainingbuffer作为单染对照,每管中加入5μl细胞悬液。2)在单染对照管中分别加入5ul的anti-cd3、anti-cd8、anti-pd1和anti-4-1bb抗体。如下表3:表3样品染色:准备抗体混合液(单个样品中anti-cd3、anti-cd8、anti-pd1和anti-4-1bb各5μl),并在样品中加入抗体混合液(20μl)并温和混匀。如下表4:表4sample1sample2sample3sample4细胞悬液(μl)80808080cd3+cd8+pd1+4-1bb(μl)20202020总体积(μl)100100100100避光冰浴25min。用200μlstainingbuffer清洗,1500rpm离心10min。弃上清,加入200μlstainingbuffer重新清洗一遍。用300μlstainingbuffer重悬细胞,转移至facs管。放置冰上并避光,送样上机进行facs检测cd3+cd8+4-1bb+细胞的pd1表达量。对比治疗前后cd3+cd8+4-1bb+细胞的pd1表达量的变化,如图6所示:治疗后,外周血cd3+t细胞数量相对治疗前增加了5倍。cd8+t细胞(毒性t细胞)占总t细胞的百分比也有所增加,且占总淋巴细胞的百分比由治疗前的3.26%增加到了18.11%。表达pd1的毒性t细胞,也从治疗前的99.9%降低为43.3%。说明pd-1抗体药免疫治疗方法对t细胞的凋亡抑制起到了一定的作用。以实施例1所得的rna为反转录模板,按照上述“第二方面”中第六部分中的试剂和步骤获得加上了tcr5’端接头的cdna。再按照上述“第二方面”中第七、八部分中的试剂和步骤进行pcr1、pcr2(标签pcr)和pcr2的产物(文库)纯化。文库纯化结束后,利用agilent2100bioanalyzer(美国agilent公司#g2939aa)检测文库的纯度和大小,使用的试剂盒是agilentdna1000kit(美国agilent公司#5067-1504),检测结果如图3所示,文库大小在738bp左右,并且文库纯度相当高,并未见到其他非特异性扩增序列。利用2.0fluorometer(美国thermofisherscientific公司#q32866),配合dsdnahsassaykit试剂盒(美国thermofisherscientific公司#q32851)测定dna文库浓度,并送公司进行高通量测序(采用illuminamiseq,2*300pair-end)。采用本发明的tcr5’端接头、引物以及文库构建后,高通量测序得到大约几百万条tcr序列。测序结果进行生物信息学分析(生物信息分析采用bowtie2aligner(ver.2.1.0),tcr数据库匹配来源于国际免疫基因信息系统www.imgt.org),部分分析比对结果如下图4、5所示。通过生物信息学分析,可以准确的知道每条tcr序列的信息,氨基酸信息,条数以及所占比例。经过tcr对比分析,本发明获得了高通量测序序列tcr代表性克隆的统计分析结果,结果如图4和5所示,图5为tcr的重组基因v-j组合使用情况、t细胞多态性和克隆性可视化图。由图7可知,通过本发明的tcr5’端接头、pcr引物以及测序文库制备方法获得的近百万条的tcr序列中,可以提示受检者的cd8+t细胞在和治疗前出现的具有克隆性增值的t细胞群治疗后仍然存在,其中最大的和第二大的克隆性增值t细胞群分别从治疗前的16.02%增长到了28.01%和10.65%增长到了13.74%,提示pd-1抗体药抑制了能识别到肿瘤细胞的cd8+t细胞的凋亡,为免疫系统能有效的消灭肿瘤细胞提供了帮助。上述结果表明,利用本发明的方法构建tcr文库能够覆盖tcr基因的多样性信息,提高低拷贝数t细胞克隆的检出率,并且利用流式细胞仪的pd-1表达量的检测结果和t细胞的克隆性结果,可以用于评估肿瘤免疫治疗的效果。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。序列表sequencelisting<110>孙涛<120>一种用于评估肿瘤免疫治疗效果的分子检测方法及引物组合物及试剂盒<160>20<170>patentinversion3.3<210>1<211>32<212>dna<213>人工合成<220><223>tcr5’oligo接头<400>1atgcatcggatcttcagcatgaacttrgrgrg32<210>2<211>22<212>dna<213>人工合成<220><223>tcr3’oligo(dt)引物<400>2ttttttttttttttttttttga22<210>3<211>57<212>dna<213>人工合成<220><223>tcr5’端接头<400>3gtctcgtgggctgggcgatgtgtatgagagacagcatgcatcggatcttcagcatga57<210>4<211>62<212>dna<213>人工合成<220><223>tcrc区引物<400>4tcgtcgccagcgtcggaagtgtataagagacagtcgcagcgtcagatgtgtataagagacag62<210>5<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>5caagcagaagacggcatacgagatatctatcggtctcgtgggctgg46<210>6<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>6caagcagaagacggcatacgagattcaggtgagtctcgtgggctgg46<210>7<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>7caagcagaagacggcatacgagatcactagttgtctcgtgggctgg46<210>8<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>8caagcagaagacggcatacgagatgaattgccgtctcgtgggctgg46<210>9<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>9caagcagaagacggcatacgagatatgtacaagtctcgtgggctgg46<210>10<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>10caagcagaagacggcatacgagatgattcagtgtctcgtgggctgg46<210>11<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>11caagcagaagacggcatacgagatctgttcgtgtctcgtgggctgg46<210>12<211>46<212>dna<213>人工合成<220><223>标签上游引物<400>12caagcagaagacggcatacgagattatacggcgtctcgtgggctgg46<210>13<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>13aatgatacggcgaccaccgagatctacactagctacttcgtcgccagcgtc51<210>14<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>14aatgatacggcgaccaccgagatctacacattatagctcgtcgccagcgtc51<210>15<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>15aatgatacggcgaccaccgagatctacaccccgtacttcgtcgccagcgtc51<210>16<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>16aatgatacggcgaccaccgagatctacacgggtataatcgtcgccagcgtc51<210>17<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>17aatgatacggcgaccaccgagatctacacagcaggtgtcgtcgccagcgtc51<210>18<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>18aatgatacggcgaccaccgagatctacactatacgtatcgtcgccagcgtc51<210>19<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>19aatgatacggcgaccaccgagatctacaccacctagttcgtcgccagcgtc51<210>20<211>51<212>dna<213>人工合成<220><223>标签下游引物<400>20aatgatacggcgaccaccgagatctacacgttgctactcgtcgccagcgtc51当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1