一种抗肿瘤过继免疫活性细胞CIK的制备方法与流程
本发明属于生物技术领域,具体涉及一种高增殖力,高细胞毒活性的抗肿瘤过继免疫活性细胞CIK的制备方法。
背景技术:
近年来随着基础医学研究的进展,人们对肿瘤认识不断深入,肿瘤治疗取得了一定的成果。传统的手术治疗和放疗、化疗是治疗肿瘤的三大常规方法,而生物治疗则是以现代分子生物学、免疫学和细胞生物学等前沿科学为基础,通过免疫、神经内分泌、基因表达、血管生成等环节调节机体自身的生物学反应,直接或间接抑制肿瘤或减轻治疗相关的不良反应。免疫细胞过继治疗属于肿瘤生物治疗的范畴,主要通过输注免疫活性细胞、增强肿瘤患者免疫功能达到抗肿瘤效果。细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK细胞)是目前用于肿瘤过继免疫输注治疗的主要细胞之一。CIK细胞是一组同时表达CD3+CD56+两种膜蛋白分子的T细胞群,又称为自然杀伤细胞(natural killer cell,NK)样T淋巴细胞,兼具有T淋巴细胞强大的抗瘤活性,和NK细胞的非主要组织相容性复合体(major histocompatibility complex,MHC)限制性杀瘤优点。不同组合的细胞因子可诱导出多种CIK细胞,目前CD3单克隆抗体(CD3 monoclonal antibody,CD3 mAb)和γ干扰素(Interferon–γ,IFN-γ)常作为诱导成分的必须因子,其他常用因子有:IL-2、植物血凝素(Phytohemagglutinin,PHA)、IL-7、IL-12等。通过因子诱导及常规培养,外周血中的CD3+CD56+细胞可得到扩增,回输给肿瘤患者体内后可溶解多种肿瘤细胞。并且CIK具有免疫系统的调节作用,在清除肿瘤病灶的同时还可提高患者的生活质量,延长带瘤生存时间,因此CIK细胞在抗肿瘤过继细胞免疫治疗中应用较为广泛。
免疫细胞的数量和功能是临床过继性免疫细胞治疗的关键,同时大量的临床证据表明CD4+CD25+调节性T细胞(regulatory T cells,Treg)数量及功能的上调是导致免疫抑制和抗肿瘤免疫失效的关键因素。因此,在肿瘤过继性免疫细胞治疗中靶向Treg细胞的策略如人为去除Treg细胞、抑制单个核细胞向Treg细胞转化及抑制Treg功能等均成为未来极有前景的治疗策略。目前传统的CIK细胞制备方法所得到的CIK细胞增殖能力较低,获得的效应细胞群数量有限,且细胞培养周期长,治疗效果不甚理想,也不利于大规模进行临床推广。
技术实现要素:
本发明提供了一种高增殖力,高细胞毒活性(高效)的抗肿瘤过继免疫活性细胞CIK的制备方法,克服了现有技术所制备CIK细胞存在的细胞增殖能力低,获得的效应细胞群数量有限及细胞培养周期长等问题。
本发明采用如下技术方案:
一种抗肿瘤过继免疫活性细胞CIK的制备方法,其特征在于,包括以下步骤:
1)外周血单个核细胞(PBMC)的采集及制备:
1.1)通过静脉穿刺,肝素钠(4万U/L)抗凝采集外周血50‐100ml;于超净工作台内将血液样本和生理盐水以1:1体积比混合稀释,人外周血淋巴细胞分离液(FICOLL配置)分离PBMC,淋巴细胞分离液与稀释血样以1:2体积比加入离心管,室温下,2000‐2500rpm离心20‐30min;
1.2)离心后收集白膜层,即PBMC部分;加入生理盐水调整体积至45‐50ml并混匀,于1500‐1800rpm离心5‐10min,以上步骤重复洗涤细胞2‐3次后得到PBMC;
2)CIK细胞的制备:
2.1)调整细胞密度为1×106/ml‐2×106/ml,接种于含终浓度为75‐150ng/ml IL‐6及75‐150ng/ml IL‐21的CIK基础培养基中,37℃,5%CO2培养箱中常规孵育;
2.2)18‐24h后,将细胞移至含有终浓度为850‐1200U/ml IFN‐γ的CIK基础培养基中常规培养;
2.3)18‐24h后,向培养体系中加入终浓度为350‐650ng/ml人胸腺球蛋白500‐650U/ml IL‐2及5.5‐13.5ng/ml IL‐27;
2.4)此后每隔3‐4d补充等量含有终浓度500‐650U/ml IL‐2及5.5‐13.5ng/ml IL‐27的CIK基础培养基中,持续培养9‐11d。可得到高增殖力,高细胞毒活性的抗肿瘤过继免疫活性细胞CIK。
进一步地,所述步骤(2.1)中CIK细胞基础培养基是含终浓度5‐13ml/L自体血浆的无血清培养基,具体为改良型RPMI‐1640培养基。
本发明步骤(2)是制备高增殖力,高细胞毒活性CIK细胞的关键步骤。
所述步骤2.1主要为解决免疫治疗中Treg细胞对机体免疫抑制及抗肿瘤免疫失效的技术问题。将IL‐6及IL‐21联合使用对PBMC进行预处理,可以达到两方面有益效益:其一,可抑制在CIK制备过程中,单个核细胞向Treg细胞的分化,降低该培养体系中Treg细胞含量,其二,可增加CIK细胞数量及效应细胞CD3+CD56+的比例,增强其对肿瘤的杀伤功能。IL‐6和IL‐21均是机体重要的免疫调节因子。IL‐6主要由成纤维细胞、内皮细胞和淋巴细胞产生,可以抑制Treg细胞的产生,解除Treg细胞对机体的免疫抑制作用,同时还可促进CIK细胞的增殖以及增强对肿瘤细胞的杀伤活性。IL‐21主要由活化的CD4+T细胞产生,可干扰Treg细胞的诱导生成过程,降低Treg细胞的产生进而解除其对免疫细胞的抑制能力及对机体免疫状态的抑制作用,增强人体的抗肿瘤免疫。因此本发明将IL‐21与IL‐6联合应用,一方面可通过降低Treg细胞比例进一步提高CIK效应细胞抗肿瘤免疫治疗效果,另一方面还可显著增强CIK细胞培养体系细胞的增殖力及其杀伤肿瘤细胞的能力。
所述步骤2.2使用人胸腺球蛋白TG代替目前常规使用的单克隆抗体CD3mAb。所述TG在临床主要用于预防和(或)治疗肾移植排斥反应,是一种对免疫系统内多种表面抗原具有特异性的免疫抑制类药物。本实验室前期实验发现,TG同CD3mAb相比,能够更特异的提高CD3+CD56+细胞群的扩增、分化及成熟,效应细胞比例的增加可进一步提升肿瘤杀伤活性。并且作为一种已批准用于临床治疗的药物,TG安全性较高,因此可作为提高CIK数量和细胞毒活性的优化方案。
所述步骤2.3通过小剂量IL‐27和IL‐2的联合应用,降低IL‐2的使用剂量,促进CIK细胞成熟,缩短CIK细胞培养周期。以达到三个有益结果:1)降低IL‐2对患者的毒副作用;2)减少因大剂量使用IL‐2带来的Treg细胞群的增加;3)缩短CIK细胞的制备周期,促进抗肿瘤过继免疫活性细胞CIK的临床大规模推广。
IL‐2是在培养体系中是不可缺少的促进淋巴细胞增殖与存活的细胞因子,但已有研究表明,IL‐2同样可有效促进诱导性Treg细胞的生成。CIK细胞的制备过程中大剂量IL‐2的持续作用会引起Treg细胞的继发性产生,从而一定程度上抑制CIK细胞的杀瘤活性。IL‐27主要来源于活化的单核细胞和树突状细胞,可促进CIK细胞增殖及杀伤能力。因此,我们将IL‐27与IL‐2联合培养,主要可带来以下三方面的有益结果:降低了大剂量使用细胞因子带来的细胞毒副作用及病患不良反应发生率;可获得足够数量和功能的CIK细胞;缩短CIK细胞培养周期,促进CIK细胞成熟,利于后期临床大规模推广应用。
综上所述,本发明制备的CIK细胞通过L‐6和IL‐21的联合应用处理CIK前期细胞,减少Treg细胞数量,相对提高了效应细胞的数量及肿瘤杀伤能力,随后利于TG代替CD3 mAb,针对性的提高CD3+CD56+细胞群的扩增、分化及成熟。并且临床应用级别的TG是目前CIK制备体系在安全性及有效性的优化和完善。最后本发明通过IL‐27与IL‐2联合培养CIK细胞,进一步提高了最终所制备CIK细胞的数量和效能,减少由细胞因子引起的患者不良反应,且CIK细胞培养周期的缩短更适合临床治疗的应用。
以下结合实例对本发明技术方案做进一步的说明。
附图说明
图1是本发明制备的CIK细胞作为实验组同常规制备的CIK细胞作为对照组在培养9d后的细胞形态图。
图2是各组CIK细胞培养9d后的增殖数量情况(×1010)
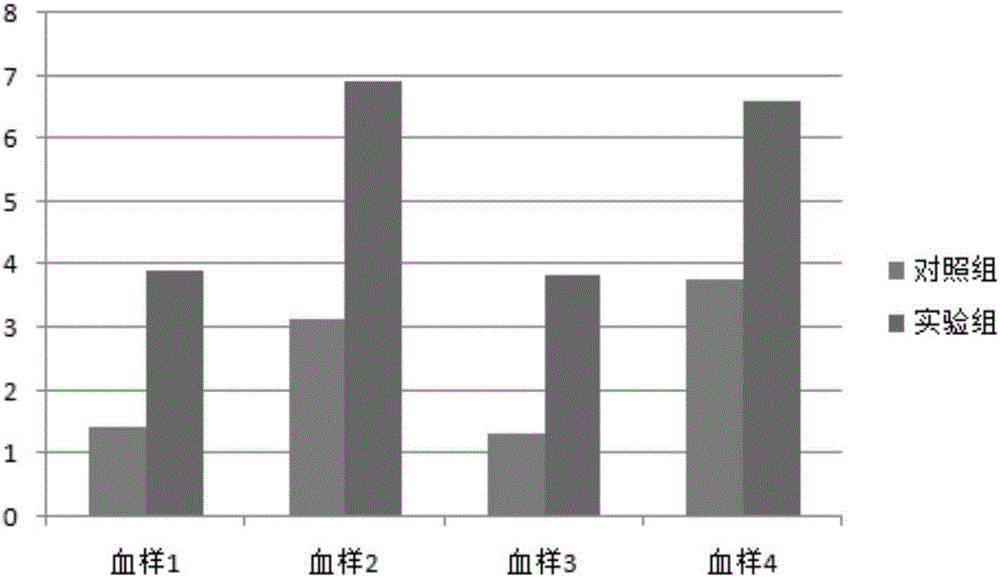
图3是各组CIK细胞培养9d后细胞活性表面分子标志表达:CD3+CD56+比率(%)
图4是各组CIK细胞培养9d后细胞活性表面分子标志表达:CD4+CD25+比率(%)
具体实施方式
实施例1本发明CIK细胞的制备
一种抗肿瘤过继免疫活性细胞CIK的制备方法,其特征在于,包括以下步骤:
1)外周血单个核细胞的采集及制备
1.1)抽取4例肿瘤患者外周血液样本。通过静脉穿刺,肝素钠(4万U/L)抗凝分别采集外周血80ml。超净工作台内将采集好的血液样本和生理盐水1:1体积比混合稀释,淋巴细胞分离液Ficoll‐Paque PREMIUM分离PBMC,淋巴细胞分离液与稀释血样以1:2体积比加入离心管,室温下,2500rpm离心20min;
1.2)离心后收集各个患者血样的白膜层,即PBMC部分,加入生理盐水调整体积至50ml并混匀,于1800rpm离心5min,以上步骤重复洗涤细胞2次后得到PBMC。
2)CIK细胞的制备
2.1)调整细胞密度为1×106/ml,接种于含终浓度为100ng/ml IL‐6及100ng/ml IL‐21的CIK细胞基础培养基中,37℃,5%CO2培养箱中常规孵育;
2.2)待24h后,将细胞移至含有终浓度为1000U/ml IFN‐γ的CIK细胞基础培养基中常规培养;
2.3)待24h后向培养体系中加入终浓度为500ng/ml人胸腺球蛋白、500U/ml IL‐2及10ng/ml IL‐27;
2.4)此后每隔3d补充等量含有终浓度为500U/ml IL‐2及10ng/ml IL‐27的CIK细胞基础培养基,持续培养9d,可得到高增殖力,高细胞毒活性的抗肿瘤过继免疫活性细胞CIK。
CIK细胞基础培养基是含终浓度5‐13ml/L自体血浆的改良型RPMI‐1640培养基。
实施例2常规CIK细胞的制备
将得到的PBMC洗涤两次,悬浮于终浓度5‐13ml/L自体血浆的改良型RPMI‐1640培养基中,调整细胞密度为1×106/ml,加入1000U/ml IFN‐γ,24h后加入终浓度为100ng/ml的CD3mAb,1000U/ml的IL‐2,于37℃,5%CO2培养箱中常规孵育。持续培养9d收集细胞用于后续检测。
CIK细胞各指标检测如下:
实施例3 CIK细胞形态学检测
将上述实验组(实施例1)及对照组(实施例2)在培养第9d时于镜下进行细胞形态观察,镜下可见对照组细胞在培养液中悬浮生长,细胞呈圆形,数量少,偶有细胞集落样生长;实验组细胞数量明显多于对照组,多呈集落样悬浮生长,且细胞集落团较多。
实施例4 CIK细胞增殖能力及细胞表型检测
将培养9d的实验组(实施例1)及对照组(实施例2)细胞使用流式细胞仪检测各组细胞数量及细胞表面CD3、CD4、CD56、CD25等分子的表达。尽管存在个体差异,但是实验组的细胞增殖能力均明显高于对照组;CD3+CD56+细胞的比例均高于对照组;患者CD4+CD25+Treg细胞比例明显小于对照组。
- 还没有人留言评论。精彩留言会获得点赞!