一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制作方法
本发明涉及抗肿瘤药物制剂领域,更特别地,涉及一种修饰微泡的多肽,使用所述多肽制备的靶向GBM的微泡载剂和药物制剂。
背景技术:
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是成人常见的高度恶性的中枢神经系统肿瘤,具有病程短、进展快、预后差等特点,中位生存期仅10-12个月。目前,针对GBM的治疗存在很多困难,其原因是多方面的。首先,GBM呈浸润性生长,与正常脑组织无明显分界,导致手术难以彻底切除,术后复发率高;其次,由于血-脑屏障的存在,绝大部分化疗药物无法抵达病灶杀伤胶质瘤细胞;此外,GBM位于中枢神经系统,而传统化疗药物不具备组织选择性,在杀伤肿瘤细胞的同时也会造成对中枢神经系统的损害,副作用巨大。
为了克服血-脑屏障的问题,有人提出使用微泡(microvesicle,MV)来搭载抗肿瘤药物。微泡是机体细胞在静息和应激状态下分泌产生的直径在100~1000nm之间的膜性囊泡,是一种新发现的作用关键却长期被忽略的细胞间通讯方式。MV通过高效结合,将其内容物(miRNA、cirRNA、蛋白质或其他信号分子)横向传递给受体细胞从而调节受体细胞的表型和生物学功能。进一步研究显示,MV具有以下特点:1)可通过多种方式(孵育、电穿击)包载各类药物(化疗药物、siRNA、miRNA)以避免其到达病灶前降解;2)在血液中稳定性好,MV装载的药物在体内可保持一个较长的循环半衰期从而提高疗效;3)生物相容性良好,无毒副作用;4)作为一种内源性的生物成分,MV广泛分布于生物体液和培养细胞上清中,来源广泛,极易获取;5)尤为重要的是,MV可穿过生物屏障,如血-脑屏障。因此,脂质双层结构的微泡作为一种内源性的细胞间物质传递介质,具备天然药物载体的巨大潜力。然而,微泡不能特异性地靶向肿瘤组织,仍然避免不了对正常组织的伤害。
为拓展开发具有肿瘤靶向性的微泡药物,有学者通过基因转染母体细胞,使其分泌带有特定肿瘤靶向的MV载药系统,但该方法面临转染效率低,靶向MV获得不可控,耗时费力等弊端,仅停留在研究层面,如何实现高效、简便、易操作和可控性好的MV靶向修饰成为该领域亟待解决的难题。
技术实现要素:
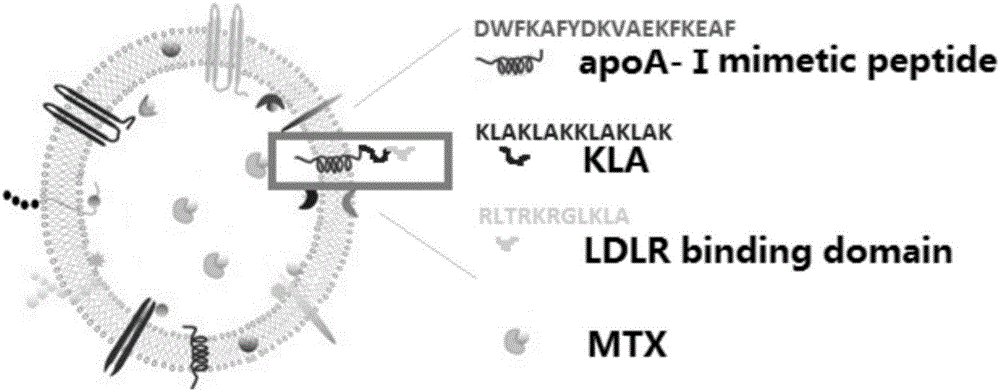
为解决以上问题,本发明提供了一种用于修饰微泡的多肽,其包括从N端到C端依次排列的亲脂性结构域、细胞杀伤结构域和肿瘤靶向结构域,所述肿瘤靶向结构域为低密度脂蛋白模拟肽,所述亲脂性结构域与细胞杀伤结构域之间以及所述细胞杀伤结构域与肿瘤靶向结构域之间,由柔性连接肽连接。
优选地,所述低密度脂蛋白模拟肽的序列如SEQ ID NO:1所示。
优选地,所述亲脂性结构域的序列如SEQ ID NO:2所示,并且该序列的N端天冬氨酸残基被乙酰化。
优选地,所述细胞杀伤结构域的序列如SEQ ID NO:3所示,并且该序列中的所有氨基酸残基均为D型。
优选地,其特征在于,所述柔性连接肽由两个相连的甘氨酸残基组成。
本发明还提供了一种靶向GBM的微泡载剂,其由上述多肽修饰微泡得到。
本发明还提供了一种靶向GBM的药物制剂,其由上述微泡载剂搭载抗GBM药物得到。
优选地,所述抗GBM药物为甲氨蝶呤。
本发明还提供了一种制备上述靶向GBM的药物制剂的方法,其包括以下步骤:
S1:使用抗肿瘤药物孵育细胞,使细胞分泌包载有所述抗GBM药物的微泡,收集所述包载有抗GBM药物的微泡;
S2:将所述包载有抗GBM药物的微泡与所述用于修饰微泡的多肽混合孵育,所得产物经离心后得到所述药物制剂。
优选地,产生微泡的细胞有很多中,常用的有树突状细胞、肿瘤细胞、成纤维细胞。
本发明具有以下优点:
1)理化特性优良:纳米粒度仪测得LDL-KLA修饰的微泡制剂中位粒径为270nm,表面Zeta电位为-10mV。电镜结果显示,纳米颗粒的粒径均一、分散性好,无聚集现象。
2)生物相容性好:制备该材料所使用的原料为细胞分泌的微泡、多肽,这些原材料均为生物材料,具有良好的生物相容性。
3)制备工艺简单,本发明的微泡制剂与现有通过真核表达质粒转染母体细胞使其分泌靶向性微泡的方法不同,是通过物理化学的方法用肽段中的亲脂性结构域将细胞杀伤结构域和靶向结构域直接锚定于微泡表面,从而赋予微泡细胞杀伤和肿瘤靶向的功能,因此能够更加简单灵活地设计和添加上述功能结构域,其制备工艺更加直接简单,且针对性强。
4)治疗效果好:体内外研究结果显示LDL-KLA修饰的微泡制剂能有效杀伤2D、3D培养的胶质瘤细胞和原位胶质瘤荷瘤鼠,其携带的KLA和MTX具有协同效应。
5)靶向性能好,正常组织的毒副作用低:含LDL模拟肽的修饰可以增加载药MV与胶质瘤细胞表面LDLR受体的相互作用,体外细胞、3D肿瘤球和在体动物实验研究结果显示,LDL-KLA修饰的微泡制剂靶向性好,易被U87胶质瘤细胞摄取,实体瘤深层亦可摄取。
6)功能可扩展:多功能融合肽修饰的载药微泡除了直接应用于胶质母细胞瘤的治疗外,其核心装置还可装载其他类型的治疗药物用于神经系统疾病,如炎症、退行性变的治疗,此外LDL模拟肽亦可替换成其他类型的靶向性肽段,实现疾病的协同靶向和协同治疗的功效。
附图说明
图1为LDL-KLA修饰的MTX微泡制剂的结构示意图;
图2为LDL-KLA修饰的MTX微泡制剂的透射电镜图;
图3为LDL-KLA修饰的MTX微泡制剂的粒径分布图;
图4为胶质瘤细胞U87摄取MTX微泡制剂、LDL修饰的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂的荧光显微镜照片;
图5为流式细胞术检测胶质瘤细胞U87摄取MTX微泡制剂、LDL修饰的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂后凋亡分布图;
图6为分别摄取了PKH26标记的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂的U87胶质瘤球体的荧光显微镜照片;
图7为MTX微泡制剂、LDL修饰的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂(MTX浓度相同)处理后的胶质瘤球体积变化情况;
图8为Dir标记的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂经尾静脉注射后颅内荧光强度及持续时间;
图9为对照组、MTX微泡制剂、LDL修饰的MTX微泡制剂和LDL-KLA修饰的MTX微泡制剂处理原位移植胶质瘤小鼠的生存曲线。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
1.包载甲氨蝶呤(MTX)的MV的制备
鼠成纤维细胞L929常规培养,取5×106对数生长期细胞置于培养皿中,经终浓度为50μg/ml的MTX处理1h,随后将开盖状态的培养皿置于300J/m2的紫外UBV照射1h;16h后收集细胞培养上清,利用差速法离心提取MV:经4000g离心20min除去细胞及细胞碎片;取上清,经14000g离心2min进一步除去细胞碎片;取上清,经14000g离心60min后的沉淀即为包载有MTX的MV,并用1×PBS重悬备用。
2.LDL-KLA修饰的MTX微泡制剂的制备与表征
合成靶向性多肽,其序列如SEQ ID NO:4所示。将浓度为10μM的靶向性多肽与MV(质量比为1:1000)在常温下置于摇床上2-3h,再将其置于4℃孵育过夜;所得产物经14000g离心60min,弃去游离多肽,分散沉淀获得LDL-KLA修饰的MTX微泡制剂。
LDL-KLA修饰的MTX微泡制剂的表征:
所述LDL-KLA修饰的MTX微泡制剂结构如图1所示,由磷脂囊泡包载MTX而成,MTX位于囊泡内部空间中,并且靶向性多肽位于囊泡表面,其中,亲脂性结构域跨越囊泡的磷脂膜,从而将靶向性多肽锚定在囊泡上,细胞杀伤结构域和靶向性结构域暴露在囊泡外。
采用粒径分析仪测定纳米粒的粒径及Zeta电位,经过1%(w/v,pH7.0)磷钨酸负染色后,透射电镜观察LDL-KLA修饰的MTX微泡制剂的形态。如图2和3所示,微泡制剂形状规则圆整,直径约为270nm,表面Zeta电位为-10mV。
3.LDL-KLA修饰的MTX微泡制剂对胶质瘤细胞U87的杀伤性
将U87细胞以2×104/孔的浓度接种于激光共聚焦专用培养皿中,待贴壁后分别与微泡(PKH26标记)、LDL修饰的MTX微泡制剂(PKH26标记)及LDL-KLA修饰的MTX微泡制剂(PKH26标记)共孵育,12h后吸弃培养基并用CFSE标记U87,然后行激光共聚焦检测胶质瘤细胞摄取纳米药物情况。结果显示,相较于未经靶向多肽修饰的MV,相同条件下U87摄取LDL修饰的MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂显著增多,表现为细胞内PKH26红色荧光信号显著增强,提示靶向LDLR多肽修饰能促进胶质瘤细胞对MV的摄取。本研究还发现,LDL-KLA修饰的MTX微泡制剂处理组U87细胞对活性染料CFSE摄取显著下降,提示LDL-KLA修饰的MTX微泡制剂具有兼具胶质瘤细胞靶向和杀伤功能。
4.体外胶质瘤细胞凋亡试验
将U87细胞以6×104/每孔的浓度接种于6孔板中,24h后分别与MTX、MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂共处理(各组含MTX剂量统一为5ug/ml),未处理组做对照,48h后将各组细胞收集起来经Annexin V/PI染色后行流式凋亡检测。流式细胞法检测凋亡结果如图所示,对照组和MTX裸药组U87细胞早、晚期凋亡很少,与对照组相比,MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂处理后细胞早、晚期凋亡率均有显著增加,细胞总凋亡率显著升高,其中LDL-KLA修饰的MTX微泡制剂组处理后细胞的总凋亡率最高,达49.32%。
5.体外穿透肿瘤球实验
将低熔点琼脂糖粉末溶于无血清培养基中配制成2%溶液,高压灭菌后按200μL/孔平铺于48孔板中,冷却后将U87细胞按2000/孔接种于48孔板中,每孔的培养基终体积为500μL。培养7天后,使之成为无血管肿瘤球体。选择直径约500μm且大小规则的肿瘤球行后续实验;将PKH26标记的微泡制剂(MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂)分别加入到48孔板中,与肿瘤球共孵育12h后采用双光子共聚焦检测分析不同组MV的渗透能力。结果显示,孵育12h后,LDL-KLA修饰的MTX微泡制剂不仅在肿瘤球边缘有较强的分布,在肿瘤球内部亦有一定的分布,进入肿瘤球深度约117μm,而未修饰MV主要分布在肿瘤球的边缘,进入肿瘤球的深度约为70μm,且荧光强度弱于LDL-KLA修饰的MTX微泡制剂。说明LDL-KLA修饰不仅有利于纳米粒进入肿瘤细胞,并且还可以更好地渗透到肿瘤球内部,较未修饰可以被更多的肿瘤细胞摄取,达到更深的肿瘤组织。
6.体外抑制肿瘤球生长实验
将直径相同的U87肿瘤球分别与MTX、MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂共孵育(MTX终浓度统一为5ug/ml),未处理组做对照,每隔一天测量肿瘤球的长短径,连续测4次,体外肿瘤球的体积V=1/2×ab2(a,肿瘤球长径;b,肿瘤球短径),通过绘制肿瘤球体积的变化曲线来分析不同药物的肿瘤球生长抑制作用。如图,对照组肿瘤球体积持续增长,第8天的体积约为第0天的7.03倍,而经过相同药物浓度不同药物制剂处理的肿瘤球生长受到不同程度的抑制。三个组第8天的肿瘤球体积分别为第0天的2.61、1.51和1.09倍,死亡细胞球折光性降低,该结果与肿瘤球渗透实验结果相一致,说明LDL-KLA的修饰可以促进载药MV到达肿瘤球内部。因此不仅可以杀死肿瘤球的表层细胞,还可以进一步杀死其内部的细胞。
实施例7.脑胶质瘤活体成像实验
分别将近红外染料Dir标记的MTX微泡制剂、LDL-KLA修饰的MTX微泡制剂尾静脉注射入Bablc小鼠体内,24h后4%多聚甲醛心脏灌流,取脑组织,通过小动物活体成像观察MV及靶向修饰MV组在脑组织内的分布,研究显示(图8),LDL-KLA修饰的MTX微泡制剂组在注射后1h至24h中任意时间点的荧光强度均显著高于MTX微泡制剂组,说明在纳米粒表面修饰LDL-KLA能有效促进载药微泡透过血-脑屏障在颅内蓄积。
用4-6周Bablc裸鼠建立荷U87Luci胶质瘤细胞原位脑肿瘤动物模型,将带有U87Luci胶质瘤的Bablc裸鼠随机分为4组:生理盐水组、MTX组、MTX微泡制剂组和LDL-KLA修饰的MTX微泡制剂组。于肿瘤细胞接种后第7天开始每周分别给予每只小鼠5mg/Kg的2次治疗,共治疗4周。如图9荷瘤鼠生存曲线所示,在荷瘤后20天,对照组中开始出现小鼠死亡,并在荷瘤后的28d内全部死完。而MTX裸药组与MTX微泡制剂组分别在27、40天开始出现小鼠死亡,LDL-KLA修饰的MTX微泡制剂组在51开始出现,且死亡的速度明显降低。经析因分析,各组间差异有统计学意义。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 华中科技大学同济医学院附属协和医院
<120> 一种用于修饰微泡的多肽以及靶向GBM的药物制剂
<130> 1
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> 人工序列
<400> 1
Arg Leu Thr Arg Lys Arg Gly Leu Lys Leu Ala
1 5 10
<210> 2
<211> 18
<212> PRT
<213> 人工序列
<400> 2
Asp Trp Phe Lys Ala Phe Tyr Asp Lys Val Ala Glu Lys Phe Lys Glu
1 5 10 15
Ala Phe
<210> 3
<211> 14
<212> PRT
<213> 人工序列
<400> 3
Lys Leu Ala Lys Leu Ala Lys Lys Leu Ala Lys Leu Ala Lys
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向脑胶质瘤的双重修饰脂质体给药系统的制备和应用的制作方法与工艺
- 一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
- 用于靶向遗传修饰的方法和组合物,以及这些组合物的使用方法与流程
- DUOX2修饰的DC疫苗及其靶向杀伤胰腺癌起始细胞的应用的制造方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程
- 脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
- 肿瘤抑制基因的杂合修饰和1型神经纤维瘤病的猪模型的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 用于通过单步多重靶向进行靶向遗传修饰的方法和组合物与流程
- 导致单性结实坐果的经修饰的基因的制造方法与工艺
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法