一种抗菌疏水性生物可降解膜的制备方法与流程
技术领域
本发明涉及复合膜技术领域,具体涉及一种抗菌疏水性生物可降解膜的制备方法。
背景技术:
长期以来,以石油为原料的薄膜,在食品包装以及其他工业领域占着主导地位,例如生物医药、废水处理和化妆品等。尽管他们具有良好的机械性能和韧性,制备过程简单且廉价,但是合成的这种聚合物难以降解,对环境造成严重污染,因此更多研究者已经利用可降解性聚合物制备。
壳聚糖是一种天然可降解生物材料,在农业、食品、化妆品、印染、医学等领域均有广泛应用。壳聚糖是甲壳素脱乙酰基的衍生物,而甲壳素是甲壳类动物及昆虫细胞壁的主要成分,产量仅次于纤维素,是地球上第二大可再生资源。壳聚糖可以制备溶液、凝胶、海绵状以及薄膜等,但其存在着缺点是溶液和凝胶易流动,不易在局部形成较高浓度,薄膜以及海绵状物其机械性能和韧度较差。已有文献报道,用戊二醛、乙二醛、双官能团酸酐等交联剂与壳聚糖交联,可提高膜的机械强度,但醛类交联剂与壳聚糖生成的Schiff碱具有化学不稳定性;双官能团酸酐与壳聚糖交联需在高温下进行,易使壳聚糖降解;而且,壳聚糖分子内大量的羟基和氨基形成了复杂的分子内和分子间氢键,使其不溶于水和碱性溶液,只能溶于弱酸性溶液,这限制了它在更广泛pH范围的应用。
羧甲基纤维素钠因具有良好的成膜性、生物降解性和生物相容性被广泛应用于食品涂膜保鲜中。但单一的羧甲基纤维素钠膜质脆、耐水性差、抑菌效果不明显,限制了其在保鲜方面的应用。虽然已有将海藻酸钠与羧甲基纤维素钠共混制作食品包装膜的报道,但是制得的海藻酸钠与羧甲基纤维素钠共混膜,力学性能较差,只能做一些食品的内包装。
技术实现要素:
针对上述现有技术的缺陷,本发明的其中一个目的是提供一种抗菌疏水性生物可降解膜的制备方法,包括下列步骤:
1)称取一定量的改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温静置溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为0.5~5%的改性壳聚糖溶液和质量分数为0.5~5%的羧甲基纤维素钠溶液;
2)将上述配置的改性壳聚糖溶液与羧甲基纤维素钠溶液按一定溶质质量配比在一定条件下混合,制得均一的改性壳聚糖/羧甲基纤维素钠水溶液,然后将混合溶液倒入膜具,放入鼓风干燥箱干燥,待溶剂完全蒸发后,即得到干的改性壳聚糖/羧甲基纤维素钠复合膜。
优选的,在步骤2)中,所述的改性壳聚糖溶液与羧甲基纤维素钠溶液的溶质质量比为0.5:10~3:10,更为优选的为1:10~2:10,例如1:10~1.2:10、1:10~1.5:10、1:10~1.8:10、1.2:10~1.5:10、1.2:10~1.8:10、1.2:10~2:10、1.5:10~1.8:10、1.5:10~2:10或1.8:10~2:10。
优选的,在步骤2)中,所述的改性壳聚糖溶液与羧甲基纤维素钠溶液混合时的温度为15~60 ℃。
优选的,在步骤2)中,所述的改性壳聚糖溶液与羧甲基纤维素钠溶液混合时的温度为20~50 ℃,更为优选的为25~40 ℃,例如25~30 ℃、25~35 ℃、30~35 ℃、30~40 ℃、35~40 ℃、25 ℃、26 ℃、27 ℃、28 ℃、29 ℃、30 ℃、31 ℃、32 ℃、33 ℃、34 ℃、35 ℃、36 ℃、37 ℃、38 ℃、39 ℃或40 ℃。
优选的,在步骤2)中,所述干燥条件为干燥温度35~60 ℃,干燥时间24~120 h。
优选的,在步骤2)中,所述干燥条件为干燥温度35~55 ℃,更为优选的为35~45 ℃,例如35~40 ℃、40~45 ℃、35 ℃、36 ℃、37 ℃、38 ℃、39 ℃、40 ℃、41 ℃、42 ℃、43 ℃、44 ℃或45 ℃;干燥时间36~90 h,更为优选的为48~90 h,例如48~60 h、48~72 h、48~90 h、60~72 h、60~90 h、72~90 h、48 h、50 h、55 h、60 h、65 h、70 h、72 h、75 h、80 h、85 h或90 h。
优选的,在步骤1)中,所述改性壳聚糖粉末的取代度为0.56~0.93,更为优选的为0.70~0.93,例如0.70~0.75、0.70~0.80、0.70~0.85、0.70~0.90、0.75~0.80、0.75~0.85、0.75~0.90、0.75~0.93、0.80~0.85、0.80~0.90、0.80~0.93、0.85~0.90、0.85~0.93、0.70、0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78、0.79、0.80、0.81、0.82、0.83、0.84、0.85、0.86、0.87、0.88、0.89、0.90、0.91、0.92或0.93。
优选的,在步骤1)中,所述改性壳聚糖粉末由烷基季铵盐与壳聚糖反应制得,或由烷基季铵盐与氧取代壳聚糖羧酸盐反应制得。
优选的,所述氧取代壳聚糖羧酸盐为O-烷基羧基壳聚糖,其中所述烷基为甲基、乙基或丙基。
优选的,所述烷基季铵盐为2,3-环氧丙基三甲基氯化铵、2,3-环氧丙基二甲基癸基氯化铵、2,3-环氧丙基二甲基十二烷基氯化铵、2,3-环氧丙基二甲基十四烷基氯化铵、2,3-环氧丙基二甲基十六烷基氯化铵、2,3-环氧丙基二甲基十八烷基氯化铵或3-氯-2-羟丙基三甲基氯化铵中的一种。
优选的,所述改性壳聚糖粉末通过以下一种方法制得:
a)将壳聚糖加入到离子液体中,于60~100 ℃,0.01~0.06 MPa负压的条件下,恒温搅拌1~6 h,使壳聚糖溶解于离子液体中,所述壳聚糖在壳聚糖/离子液体溶液中的质量百分比浓度为0.5~2.5%;
b)向所述壳聚糖/离子液体溶液中加入所述烷基季铵盐,于60~120 ℃,0.01~0.06 MPa负压的条件下,反应0.5~10 h,所述n(烷基季铵盐):n(壳聚糖)为1:1~6:1,其中n(壳聚糖)指的是壳聚糖的重复单元数;
c)反应结束后,向冷却至室温的步骤2)的反应液中加入丙酮-乙醇混合溶液,离心析出沉淀物,沉淀物用所述丙酮-乙醇混合溶液重复洗涤2~3次,并于50~80 ℃条件下干燥8~24 h,得到氮取代壳聚糖季铵盐;
d)将混有丙酮和乙醇的离子液体,蒸馏分离,分别回收丙酮、乙醇和离子液体;
其中所述离子液体为1-丁基-3-甲基氯化咪唑、1-丁基-3-甲基溴化咪唑、1-烯丙基-3-甲基氯化咪唑或1-乙基-3-甲基咪唑醋酸盐中的一种。
优选的,在步骤b)中,所述的n(烷基季铵盐):n(壳聚糖)为2:1~4:1,反应温度为80~100 ℃,反应时间为6~8 h,所述n(壳聚糖)指的是壳聚糖的重复单元数。
优选的,在步骤a)中,所述的溶解温度为80 ℃,溶解时间4 h。
优选的,所述壳聚糖的脱乙酰度为75~95%,平均分子量为200~2000 mPa.s。
优选的,所述步骤c)的丙酮-乙醇混合溶液中,丙酮与乙醇的体积比为1:1~1:4。
优选的,在步骤c)中,所述的干燥温度为60 ℃,干燥时间为12 h。
优选的,所述步骤d)具体操作为:将混有乙醇和丙酮的离子液体溶液置于电加热套上,常压蒸馏冷凝分离丙酮和乙醇;回收离子液体,用乙酸乙酯萃取后,三次旋蒸除去多余的乙酸乙酯,于60~100 ℃的真空干燥箱中0.06~0.1 MPa负压下干燥10~24 h。
一种通过另一种方法制得的改性壳聚糖粉末,在上述改性壳聚糖粉末制备方法中,用氧取代壳聚糖羧酸盐替换所述壳聚糖。
本发明的另一目的是提供一种抗菌疏水性生物可降解膜的制备方法,用海藻酸钠替换上述制备方法中的羧甲基纤维素钠。
本发明中所述羧甲基纤维素钠为USP级,粘度400~1400 mPa.s;所述海藻酸钠购于青岛明月海藻集团有限公司,粘度分为60 mPa.s、370 mPa.s、540 mPa.s三种;其余所用原料、试剂等未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明另一目的在于提供一种利用上述方法制备得到的抗菌疏水性生物可降解膜。
本发明的又一目的在于提供上述抗菌疏水性生物可降解膜在食品包装,特别是在湿食品的包装中的应用。
本发明制备的抗菌疏水性生物可降解膜的力学性能测试:采用济南天辰公司的电子万能拉力机测试本发明制备的抗菌疏水性生物可降解膜的拉伸长度以及断裂伸长率。具体操作为:选择均匀、干净、无瑕疵的本发明制备的样品及对比样品纯的HTCC膜、CMC膜。样品的厚度约0.07 mm,将样品裁剪成长方形,长100 mm,宽16 mm。测试时夹距50 mm,拉伸速率10 mm/min。
本发明制备的抗菌疏水性生物可降解膜的抗菌性能测试:大肠杆菌和金黄色葡萄球菌是常见的革兰氏阴性菌和革兰氏阳性菌,因此选这2种菌来测试本发明制备的抗菌疏水性生物可降解膜的抗菌性能。具体操作为将定量滤纸片裁剪成8mm大小的圆片,放入灭菌锅里121 ℃下灭菌20 min。在洁净工作台上将灭菌过的滤纸片,沾取不同溶质质量配比的复合膜溶液样品及对比样品溶液,并用玻片压实,然后小心的贴在平板培养基表面上,最后将平板置于生化培养箱中于36 ℃培养24 h,测试样品的抗菌性能。
与现有技术相比,本发明提供的抗菌疏水性生物可降解膜的制备方法利用的是改性壳聚糖与羧甲基纤维素钠或海藻酸钠反应,而非传统的壳聚糖,由于改性的壳聚糖中接入季铵盐基团,赋予壳聚糖良好的水溶性,这使得该方法在操作过程中无需通过加盐酸、醋酸等方法使壳聚糖质子化、溶解,简便了反应操作,消除了对反应设备的酸性腐蚀损耗;而且由本发明提供的方法制备得到的复合膜具有良好的生物可降解性、杀菌抑菌性能及疏水性,与不具备杀菌抑菌性、疏水性的羧甲基壳聚糖膜形成鲜明的对比;同时本发明制备的复合膜的抗张强度和断裂伸长率与单一的羧甲基纤维素膜、海藻酸钠膜或改性壳聚糖膜相比均有显著增加。
附图说明
图1为本发明实施例2~4制备的2,3-环氧丙基三甲基氯化铵改性壳聚糖/羧甲基纤维素钠膜(HTCC/CMC膜)及纯的HTCC膜、纯的CMC膜的透光性对比图,其中a)代表纯CMC膜的透光性对比图;b)代表HTCC与CMC质量比为0.05的膜的透光性对比图;c)代表HTCC与CMC质量比为0.10的膜的透光性对比图;d)代表HTCC与CMC质量比为0.15的膜的透光性对比图;e)代表纯HTCC膜的透光性对比图。
图2为本发明实施例2~4制备的HTCC/CMC膜及纯的HTCC膜、纯CMC膜的切面的扫描电子显微镜照片,其中a)代表纯CMC膜的电镜照片;b)代表HTCC与CMC质量比为0.05的膜的电镜照片;c)代表HTCC与CMC质量比为0.10的膜的电镜照片;d)代表HTCC与CMC质量比为0.15的膜的电镜照片;e)代表纯HTCC膜的电镜照片。
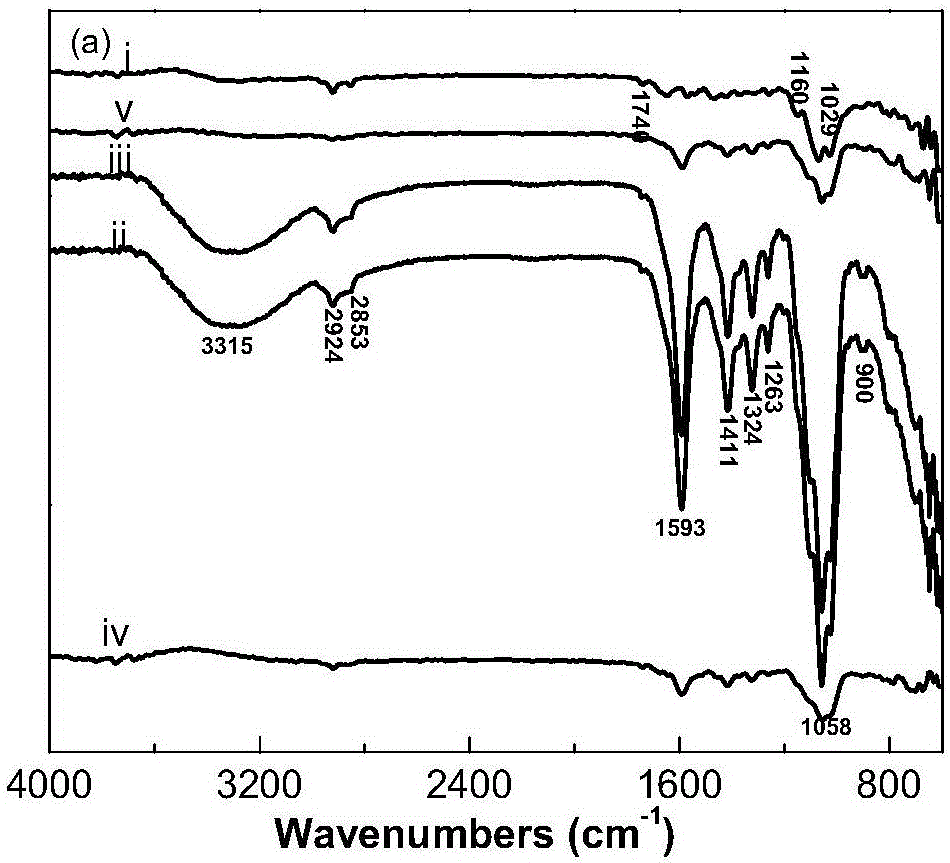
图3为本发明实施例2~4制备的HTCC/CMC膜的红外谱图,其中i)代表纯CMC膜的红外谱图;ii)代表HTCC与CMC质量比为0.05的膜的红外谱图;iii)代表HTCC与CMC质量比为0.10的膜的红外谱图;iv)代表HTCC与CMC质量比为0.15的膜的红外谱图;v)代表纯HTCC膜的红外谱图。
图4为本发明实施例2~4制备的HTCC/CMC膜及纯的HTCC膜、纯CMC膜的应力-应变曲线,其中i)代表纯CMC膜的应力-应变曲线;ii)代表HTCC与CMC质量比为0.05的膜的应力-应变曲线;iii)代表HTCC与CMC质量比为0.10的膜的应力-应变曲线;iv)代表HTCC与CMC质量比为0.15的膜的应力-应变曲线;v)代表纯HTCC膜的应力-应变曲线。
图5为本发明实施例2~4制备的HTCC/CMC膜及纯的HTCC膜、纯的CMC膜的接触角图,其中a)代表纯HTCC膜的接触角图;b)代表HTCC与CMC质量比为0.05的膜的接触角图;c)代表HTCC与CMC质量比为0.10的膜的接触角图;d)代表HTCC与CMC质量比为0.15的膜的接触角图;e)代表纯CMC膜的接触角图。
图6为本发明实施例2~6制备的HTCC/CMC膜及纯的HTCC膜对金黄色葡萄球菌(黑色方形点)和大肠杆菌(红色圆形点)的抗菌活性结果图。
具体实施方式
下面结合具体实施例,对本发明进行详细描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
实施例1
下面实施例用到的改性壳聚糖按以下步骤制备得到:
在100 mL的单口烧瓶中加入20 g离子液体1-丁基-3-甲基溴化咪唑和0.5 g黏度为300 mPa.s的壳聚糖,所述壳聚糖为经氢溴酸预处理并冷冻干燥制得,将单口烧瓶抽真空后密封,在0.06 MPa负压条件下,搅拌均匀,置于100 ℃的油浴中恒温搅拌4 h。通过偏光显微镜观察壳聚糖完全溶解后,向单口烧瓶中加入n(烷基季铵盐) : n(壳聚糖)为6:1的环氧当量为0.85的2,3-环氧丙基三甲基氯化铵(GTMAS),重新保持0.06 MPa负压并将单口烧瓶置于80 ℃的油浴中恒温反应8 h,以保证壳聚糖和GTMAS充分反应。
反应完成,向单口烧瓶中加入60 mL的丙酮-乙醇混合液,所述混合液中丙酮与乙醇的体积比为1:4,充分搅拌、静置,使壳聚糖季铵盐析出,以同样的方法重复洗涤产物2次。最终产物置于60 ℃的真空干燥箱中干燥24 h,即得环氧丙基三甲基氯化铵改性壳聚糖。
洗涤液回收、蒸馏,分两段温度分别收集55-56 ℃的馏分丙酮和78-79 ℃的馏分乙醇,残液为离子液体。将残液离子液体用乙酸乙酯萃取后,三次旋蒸除去多余的乙酸乙酯,于60 ℃的真空干燥箱中,0.06 MPa负压下干燥24 h。
本实施例中制得的改性壳聚糖的取代度为0.93。
实施例2
称取一定量的取代度为0.56的HTCC粉末和CMC粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为2%的HTCC溶液和质量分数为2%的CMC溶液;
按溶质质量比为0.5:10的比例称取上述配置的HTCC溶液与CMC溶液,并于25 ℃水浴下混合,制得均一的HTCC/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱45 ℃干燥24 h,待溶剂完全蒸发后,即得到干的HTCC/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的HTCC分子和CMC分子之间存在良好的相容性和显著的相互作用。复合膜的抗张强度为26.45 MPa,与纯CMC膜的11.95 MPa相比,其抗张强度增加了121%;断裂伸长率由纯CMC膜的1.55%增加至2.82%。室温下,水在HTCC/CMC复合膜的接触角为119o,而水在纯CMC膜的接触角仅为72.5o。根据文献报道,单一的CMC膜没有杀菌抑菌性,纯HTCC膜对金黄色葡萄球菌和大肠杆菌的抑制圈直径分别为1.23 cm和1.07 cm,而HTCC/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.13 cm,对大肠杆菌的抑菌圈直径为1.00 cm,与纯HTCC膜对上述两种菌的抑制能力相当。
实施例3
实施条件与步骤同实施案例2,只是将配置好的HTCC溶液与CMC溶液的溶质质量比0.5:10替换为1:10。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的HTCC分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为28.56 MPa,比纯CMC膜的抗张强度增加了139%;断裂伸长率为2.86%;水在复合膜的接触角为90o,大于在纯CMC膜的接触角,表现出良好的疏水性;HTCC/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.28 cm,对大肠杆菌的抑菌圈直径为1.03 cm。
实施例4
实施条件与步骤同实施案例2,只是将配置好的HTCC溶液与CMC溶液的溶质质量比0.5:10替换为1.5:10。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的HTCC分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为21.82 MPa,比纯CMC膜的抗张强度增加了82.6%;断裂伸长率为2.27%;水在复合膜的接触角为117o,大于在纯CMC膜的接触角,表现出良好的疏水性;HTCC/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.43 cm,对大肠杆菌的抑菌圈直径为1.07 cm。
实施例5
实施条件与步骤同实施案例2,只是将配置好的HTCC溶液与CMC溶液的溶质质量比0.5:10替换为2:10。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的HTCC分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为27.82 MPa,比纯CMC膜的抗张强度增加了132.8%;断裂伸长率为2.57%;水在复合膜的接触角为114o,大于在纯CMC膜的接触角,表现出良好的疏水性;HTCC/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.53 cm,对大肠杆菌的抑菌圈直径为1.10 cm。
实施例6
实施条件与步骤同实施案例2,只是将配置好的HTCC溶液与CMC溶液的溶质质量比0.5:10替换为2.5:10。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的HTCC分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为28.95 MPa,比纯CMC膜的抗张强度增加了142.2%;断裂伸长率为3.02%;水在复合膜的接触角为120o,大于在纯CMC膜的接触角,表现出良好的疏水性;HTCC/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.67 cm,对大肠杆菌的抑菌圈直径为1.17 cm。
实施例7
称取一定量的取代度为0.56的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖粉末和海藻酸钠(Sodium alginate, SA)粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为0.5的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖溶液和质量分数为0.5的海藻酸钠溶液;
按溶质质量比为0.5:10的比例称取上述配置的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于25 ℃水浴下混合,制得均一的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱55 ℃干燥90 h,待溶剂完全蒸发后,即得到干的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为17.32 MPa,比纯SA膜的抗张强度增加了102.3%;断裂伸长率为5.81%。水在复合膜的接触角为93o,大于在纯SA膜的接触角,表现出良好的疏水性。2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为1.17 cm,对大肠杆菌的抑菌圈直径为1.15厘米。
实施例8
称取一定量的取代度为0.65的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为1.5的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖溶液和质量分数为1.5的羧甲基纤维素钠溶液;
按溶质质量比为1.5:10的比例称取上述配置的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖溶液与羧甲基纤维素钠溶液,并于15 ℃水浴下混合,制得均一的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱37 ℃干燥36 h,待溶剂完全蒸发后,即得到干的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖分子和羧甲基纤维素钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为31.53MPa,比纯CMC膜的抗张强度增加了163.8%;断裂伸长率为10.81%。水在复合膜的接触角为133o,大于在纯CMC膜的接触角,表现出良好的疏水性。2-羟基丙基-N-二甲基十二烷基氯化铵改性壳聚糖/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为2.07 cm,对大肠杆菌的抑菌圈直径为1.63 cm。
实施例9
称取一定量的取代度为0.80的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为2.5的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖溶液和质量分数为2.5的海藻酸钠溶液;
按溶质质量比为2:10的比例称取上述配置的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于50 ℃水浴下混合,制得均一的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱48 ℃干燥100 h,待溶剂完全蒸发后,即得到干的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2-羟基丙基-N-二甲基癸基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为19.20MPa,比纯SA膜的抗张强度增加了124.3%;断裂伸长率为9.81%。水在复合膜的接触角为123o,大于在纯SA膜的接触角,表现出良好的疏水性。2-羟基丙基-N-二甲基十八烷基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为2.17 cm,对大肠杆菌的抑菌圈直径为1.65 cm。
实施例10
称取一定量的取代度为0.70的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为3.5的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖溶液和质量分数为3.5的羧甲基纤维素钠溶液;
按溶质质量比为1.2:10的比例称取上述配置的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖溶液与羧甲基纤维素钠溶液,并于60 ℃水浴下混合,制得均一的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱38 ℃干燥48 h,待溶剂完全蒸发后,即得到干的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的3-氯-2-羟丙基三甲基氯化铵改性壳聚糖分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为28.05 MPa,比纯CMC膜的抗张强度增加了134.7%;断裂伸长率为3.82%。水在复合膜的接触角为118o,大于在纯CMC膜的接触角,表现出良好的疏水性。3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为1.79 cm,对大肠杆菌的抑菌圈直径为1.28 cm。
实施例11
称取一定量的取代度为0.93的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为4.5的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖溶液和质量分数为4.5的海藻酸钠溶液;
按溶质质量比为1:10的比例称取上述配置的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于35 ℃水浴下混合,制得均一的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱52 ℃干燥80 h,待溶剂完全蒸发后,即得到干的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为23.20 MPa,比纯SA膜的抗张强度增加了171.0%;断裂伸长率为9.91%。水在复合膜的接触角为130o,大于在纯SA膜的接触角,表现出良好的疏水性。2-羟基丙基-N-二甲基十四烷基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为2.37 cm,对大肠杆菌的抑菌圈直径为1.75 cm。
实施例12
称取一定量的取代度为0.60的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为5.0的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖溶液和质量分数为5.0的羧甲基纤维素钠溶液;
按溶质质量比为3:10的比例称取上述配置的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖溶液与羧甲基纤维素钠溶液,并于20 ℃水浴下混合,制得均一的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱42 ℃干燥24 h,待溶剂完全蒸发后,即得到干的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖分子和羧甲基纤维素钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为29.53 MPa,比纯CMC膜的抗张强度增加了147.1%;断裂伸长率为10.16%。水在复合膜的接触角为143o,大于在纯CMC膜的接触角,表现出良好的疏水性。2-羟基丙基-N-二甲基十六烷基氯化铵改性壳聚糖/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为2.57 cm,对大肠杆菌的抑菌圈直径为1.85 cm。
实施例13
称取一定量的取代度为0.75的2,3-环氧丙基三甲基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为2.5的2,3-环氧丙基三甲基氯化铵改性壳聚糖溶液和质量分数为2.5的海藻酸钠溶液;
按溶质质量比为0.8:10的比例称取上述配置的2,3-环氧丙基三甲基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于18 ℃水浴下混合,制得均一的2,3-环氧丙基三甲基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱40 ℃干燥120 h,待溶剂完全蒸发后,即得到干的2,3-环氧丙基三甲基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的2,3-环氧丙基三甲基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为15.16 MPa,比纯SA膜的抗张强度增加了77.10%;断裂伸长率为2.23%。水在复合膜的接触角为86o,大于在纯SA膜的接触角,表现出良好的疏水性。2,3-环氧丙基三甲基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为1.08 cm,对大肠杆菌的抑菌圈直径为0.97 cm。
实施例14
称取一定量的取代度为0.91的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为3.0的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖溶液和质量分数为3.0的羧甲基纤维素钠溶液;
按溶质质量比为1.8:10的比例称取上述配置的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖溶液与羧甲基纤维素钠溶液,并于30 ℃水浴下混合,制得均一的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱45 ℃干燥30 h,待溶剂完全蒸发后,即得到干的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖分子和CMC分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为20.63 MPa,比纯CMC膜的抗张强度增加了72.64%;断裂伸长率为6.82%。水在复合膜的接触角为90o,大于在纯CMC膜的接触角,表现出良好的疏水性。O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为2.67 cm,对大肠杆菌的抑菌圈直径为2.57 cm。
实施例15
称取一定量的取代度为0.88的O-甲基羧基-2,3-环氧丙基三甲基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为4.0的O-甲基羧基-2,3-环氧丙基三甲基氯化铵改性壳聚糖溶液和质量分数为4.0的海藻酸钠溶液;
按溶质质量比为2.5:10的比例称取上述配置的O-甲基羧基-2,3-环氧丙基三甲基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于55 ℃水浴下混合,制得均一的O-甲基羧基-2,3-环氧丙基三甲基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱58 ℃干燥40 h,待溶剂完全蒸发后,即得到干的O-甲基羧基-2,3-环氧丙基三甲基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为18.33 MPa,比纯SA膜的抗张强度增加了114.1%;断裂伸长率为15.36%。水在复合膜的接触角为97o,大于在纯SA膜的接触角,表现出良好的疏水性。O-甲基羧基-3-氯-2-羟丙基三甲基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为2.07 cm,对大肠杆菌的抑菌圈直径为1.83 cm。
实施例16
称取一定量的取代度为0.58的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为2.0的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖溶液和质量分数为2.0的海藻酸钠溶液;
按溶质质量比为2.8:10的比例称取上述配置的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于25 ℃水浴下混合,制得均一的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱60 ℃干燥70 h,待溶剂完全蒸发后,即得到干的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为17.33 MPa,比纯SA膜的抗张强度增加了102.4%;断裂伸长率为13.30%。水在复合膜的接触角为128o,大于在纯SA膜的接触角,表现出良好的疏水性。O-乙基羧基-2,3-环氧丙基二甲基十四烷基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为2.37 cm,对大肠杆菌的抑菌圈直径为2.15 cm。
实施例17
称取一定量的取代度为0.90的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖粉末和海藻酸钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为1.0的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖溶液和质量分数为1.0的海藻酸钠溶液;
按溶质质量比为2.2:10的比例称取上述配置的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖溶液与海藻酸钠溶液,并于45 ℃水浴下混合,制得均一的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖/SA水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱35 ℃干燥110 h,待溶剂完全蒸发后,即得到干的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖/SA复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖分子和海藻酸钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为17.90 MPa,比纯SA膜的抗张强度增加了109.1%;断裂伸长率为14.63%。水在复合膜的接触角为115o,大于在纯SA膜的接触角,表现出良好的疏水性。O-丙基羧基-2,3-环氧丙基二甲基十八烷基氯化铵改性壳聚糖/SA复合膜对金黄色葡萄球菌的抑菌圈直径为2.07 cm,对大肠杆菌的抑菌圈直径为2.05 cm。
实施例18
称取一定量的取代度为0.85的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖粉末和羧甲基纤维素钠粉末,分别向其中加入一定量的去离子水,先于60 ℃水浴下恒温溶胀一定时间,然后搅拌至均匀,搅拌结束后于室温下放置24 h,最终分别得到质量分数为4.5的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖溶液和质量分数为4.5的羧甲基纤维素钠溶液;
按溶质质量比为2.7:10的比例称取上述配置的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖溶液与羧甲基纤维素钠溶液,并于58 ℃水浴下混合,制得均一的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖/CMC水溶液,然后将混合溶液倒入膜具,使混合溶液的厚度尽可能均匀,放入鼓风干燥箱50 ℃干燥60 h,待溶剂完全蒸发后,即得到干的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖/CMC复合膜。
本实施例制备的复合膜具有良好的透光性,膜的切面和傅里叶变化红外谱图显示复合膜中的O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖分子和羧甲基纤维素钠分子之间存在良好的相容性和显著的相互作用;复合膜的抗张强度为27.90 MPa,比纯CMC膜的抗张强度增加了133.5%;断裂伸长率为15.06%。水在复合膜的接触角为120o,大于在纯CMC膜的接触角,表现出良好的疏水性。O-乙基羧基-2,3-环氧丙基二甲基癸基氯化铵改性壳聚糖/CMC复合膜对金黄色葡萄球菌的抑菌圈直径为2.10 cm,对大肠杆菌的抑菌圈直径为2.15 cm。
以上所述,仅用于说明本发明,而不应视为限定本发明的范围,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。例如,具体地用2,3-环氧丙基二甲基十八烷基氯化铵、2,3-环氧丙基二甲基癸基氯化铵、2,3-环氧丙基二甲基十二烷基氯化铵、2,3-环氧丙基二甲基十四烷基氯化铵、2,3-环氧丙基二甲基十六烷基氯化铵或3-氯-2-羟丙基三甲基氯化铵中的一种替换2,3-环氧丙基三甲基氯化铵,用O-甲基羧基改性壳聚糖、O-乙基羧基改性壳聚糖或O-丙基羧基改性壳聚糖中的一种替换壳聚糖,用1-烯丙基-3-甲基氯化咪唑、1-丁基-3-甲基氯化咪唑或1-乙基-3-甲基咪唑醋酸盐中的一种替换1-丁基-3-甲基溴化咪唑,仍按照上述制备改性壳聚糖的方法,在不同条件下制备出不同取代度的相应的改性壳聚糖季铵盐。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!