确定的多偶联寡核苷酸的制作方法
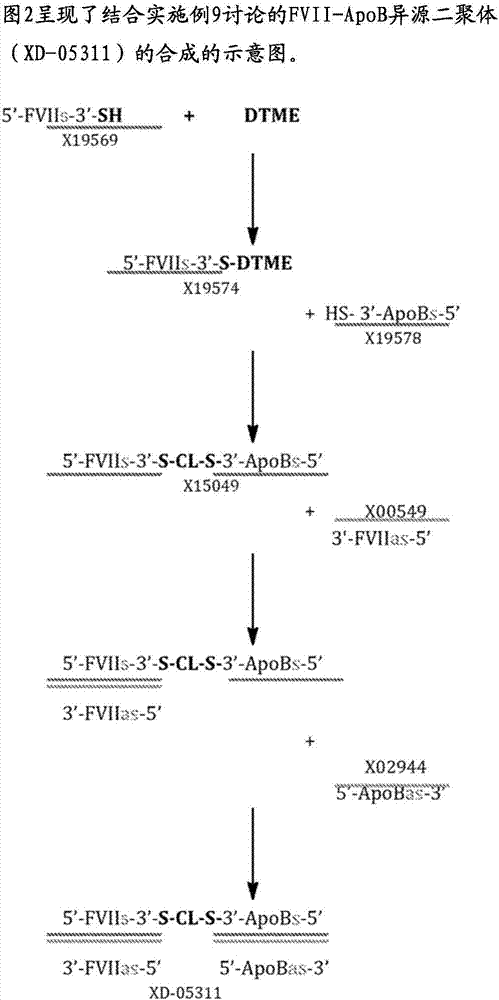
发明领域本发明涉及具有预定大小和组成的确定的多偶联寡核苷酸。例如,在多个实施方案中,本发明涉及具有有利特性的确定的多偶联寡核苷酸,例如是具有增强的细胞内递送和/或多基因沉默效应的确定的多偶联sirna(即,包括两个、三个或更多个sirna)的形式。在多个实施方案中,本发明还涉及合成确定的多偶联寡核苷酸的新的合成中间体和方法。本发明还涉及例如在减少基因表达、生物学研究、治疗或预防医学状况中使用确定的多偶联寡核苷酸,或用于在细胞或生物体中产生新的或改变的表型的方法。发明背景目前有许多新的治疗和生物工程方式涉及递送生物学活性分子,仅举几例,例如小的干扰rna(sirna)和microrna(mirna),其穿过细胞膜和细胞壁以在细胞内产生生物学效应来抑制蛋白质产生(例如在sirna和mirna的情况下)。递送到细胞中的其他技术和/或生物活性分子具有增强基因表达和蛋白质产生的作用。然而,处于其天然状态的rna和其他寡核苷酸在体内是不稳定的并且在短时间内容易分解。而且,它们中的许多像rna是阴离子型的,其使得细胞膜传输困难,导致细胞内递送效率低。以sirna为例,增加其递送效率的努力包括通过sirna与各种阳离子载体材料(例如阳离子聚合物、脂质或肽)的离子键合来制备纳米尺寸的离子复合物。jeongetal.,bioconjugatechem,20(1):5-14(2009)。然而,存在与稳定的sirna/阳离子载体复合物的制备相关的挑战。提高寡核苷酸如sirna的递送效率的其他努力包括寡核苷酸与特定细胞靶向部分的偶联。例如,nairetal.,“mulivalentn-acetylgalactosamine-conjugatedsirnalocalizesinhepatocytesandelicitsrobustrnai-mediatedgenesilencing,”jamchemsoc,136(49):16958-16961(2014)。然而,这些和其他现有技术方法不能解决寡核苷酸递送的问题。因此,仍然需要改进的寡核苷酸组合物。发明概述本发明涉及具有预定大小和组成的确定的多偶联寡核苷酸。本发明还涉及使用确定的多偶联寡核苷酸的方法。本发明还涉及合成确定的多偶联寡核苷酸的方法,以及用于合成确定的多偶联寡核苷酸的新的中间体化合物。因此,本发明提供了具有预定大小和组成、改进的电荷密度、改进的递送和/或改进的功效(例如,与未偶联状态下的相同部分相比)的rna和/或dna多偶联物。当多偶联物与合适的载体络合和/或与另一种化学或生物部分如细胞靶向配体偶联时,它们可以以更高的效率和安全性递送穿过细胞膜或细胞壁,用于增强的生物或治疗效果。因此,本发明确定的多偶联寡核苷酸的优点可以包括:增加寡核苷酸递送至细胞(例如,每个细胞靶向配体结合事件递送更多的寡核苷酸),递送预定化学计量比的不同寡核苷酸至细胞(例如,在包含三种不同寡核苷酸的三聚多偶联物的情况下为1:1:1)的能力,和/或递送治疗性寡核苷酸的组合作为单一化学实体(例如,包含三种不同寡核苷酸的三聚多偶联物是一个分子)的能力,从而简化了它们的使用和监管审查。本发明还至少部分基于开发新的合成方法和中间体,其允许制备具有预定大小和组成的确定的多偶联寡核苷酸。在多个方面,本发明提供了与共价接头偶联的寡核苷酸,其可以用于例如合成具有预定大小和组成的确定的多偶联寡核苷酸。一方面,本发明提供了根据结构1的化合物:x-r1-r2-a-r3-b(结构1)其中:x是通过其3’或5’末端与r1键合的核酸;r1为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇,或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是亲核体和亲电体的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是亲核体或亲电体。一方面,本发明提供了根据结构2的化合物:其中:x是在其3’或5’末端经由磷酸酯或硫代磷酸酯与r1键合的核酸;每个r1独立地为c2-c10烷基、烷氧基或芳基;和r2是硫代丙酸酯或二硫化物基团。一方面,本发明提供了根据结构3的化合物:x-r1-r2-a-r3-b(结构3)其中:x是通过其3’或5’末端与r1键合的核酸;r1是磷酸酯、硫代磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是第一和第二反应部分的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是第三反应部分。在多个方面,本发明提供了用于合成与共价接头偶联的寡核苷酸的方法。一方面,本发明提供了用于合成根据结构1的化合物(或适合于合成根据结构2或3的化合物)的方法,所述方法包括:在x-r1-r2-a’的稀释溶液中并且利用化学计量过量的a”-r3–b使功能化的核酸x-r1-r2-a’和共价接头a”-r3–b发生反应,其中a’和a”包含亲核体和亲电体,由此形成化合物x-r1-r2-a-r3-b(结构1)其中:x是通过其3’或5’末端与r1键合的核酸;r1为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇,或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是亲核体和亲电体的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是亲核体或亲电体。该方法可以进一步包括通过以下合成功能化核酸x-r1-r2-a’的步骤,其中a’包含巯基(-sh):(i)在核酸的固相合成过程中使用亚磷酰胺寡聚化化学引入巯基或(ii)还原在固相合成过程中引入的二硫化物。在多个方面,本发明提供了二聚化确定的多偶联寡核苷酸。一方面,本发明提供了根据结构4的分离的化合物:结构4:其中:每个是双链寡核苷酸,其被设计为与体内相同的分子靶标反应,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为亲核体和亲电体的反应产物,和r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构5的分离的化合物:其中:是第一单链寡核苷酸是第二单链寡核苷酸,其具有与第一单链寡核苷酸不同的序列,和●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地是磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃,或胺和羧基的反应产物,和r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构6的分离的化合物:其中:是第一双链寡核苷酸是与第一双联寡核苷酸具有不同序列的第二双链寡核苷酸,和●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地是磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物,和r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构11的分离的化合物:其中:是双链寡核苷酸,是单链寡核苷酸,和●是连接相邻单链寡核苷酸的单链的共价接头。在多个方面,本发明提供了用于合成二聚化的确定的多偶联寡核苷酸的方法。一方面,本发明提供了合成结构5的化合物的方法:其中是第一单链寡核苷酸,是与第一单链寡核苷酸具有不同序列的第二单链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)使第一单链寡核苷酸与双功能连接部分○反应,其中r1是能够在产生单取代产物的条件下与○反应的化学基团;(ii)使与第二单链寡核苷酸反应,其中r2是能够与○反应的化学基团,由此形成该方法可以进一步包括使互补的和退火以产生结构6的步骤:一方面,本发明提供了合成结构4的分离的化合物的方法:其中每个是双链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)使第一单链寡核苷酸与双功能连接部分○反应,其中r1是能够与○反应的化学基团,由此形成单取代的产物(ii)使与第二单链寡核苷酸反应,其中r2是能够与○反应的化学基团,由此形成单链二聚体(iii)同时或依次退火单链寡核苷酸,由此形成一方面,本发明提供了合成结构4的分离的化合物的方法:其中每个是双链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下方式形成(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成并使与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应形成共价接头●的化学部分,由此形成或(b)使第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并使第一单链寡核苷酸和退火,由此形成(ii)使和第四单链寡核苷酸退火,由此形成一方面,本发明提供了合成结构4的分离的化合物的方法:其中每个是双链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(a)使第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成(b)使第三单链寡核苷酸和第四单链寡核苷酸退火,由此形成(b)使和与其中r1和r2反应,其中r1和r2是能够直接或间接反应形成共价接头●的化学部分,由此形成在多个方面,本发明提供了多聚化的(n>2)确定的多偶联寡核苷酸,包括确定的三偶联物和确定的四偶联物。一方面,本发明提供了根据结构7或8的化合物:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m是≥1的整数,并且n是≥0的整数。一方面,本发明提供了根据结构9的化合物并且其中n=0:一方面,本发明提供了根据结构10的化合物,其中m=1:一方面,本发明提供了根据结构12、13、14或15的化合物:其中:每个是双链寡核苷酸,每个是单链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m为≥1的整数,并且n为≥0的整数。在多个方面,本发明提供了用于合成多聚化的(n>2)确定的多偶联寡核苷酸,包括确定的三偶联物和确定的四偶联物的方法。一方面,本发明提供了用于合成根据结构7或8的化合物的方法:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m是≥1的整数,并且n是≥0的整数,所述方法包括以下步骤:(i)通过以下方式形成(a)使第一单链寡核苷酸与第二单链寡核苷酸退火,由此形成并且使与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)使第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并且使第一单链寡核苷酸与退火,由此形成(ii)使与第二单链二聚体退火,由此形成并且任选地使一个或多个额外的单链二聚体与退火,由此形成或其中m是≥1的整数,n是≥0的整数;并且(iii)使第四单链寡核苷酸与步骤(ii)的产物退火,由此形成结构7或8。一方面,本发明提供了用于合成根据结构7或8的化合物的方法:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m是≥1的整数,并且n是≥0的整数,所述方法包括以下步骤:(i)使第一单链寡核苷酸和第一单链二聚体退火,由此形成(ii)使与第二单链二聚体退火,由此形成并且,任选地,使一个或多个额外的单链二聚体与退火,由此形成,或其中m是≥1的整数并且n是≥0的整数;并且(iii)使第二单链寡核苷酸与步骤(ii)的产物退火,由此形成结构7或8。一方面,本发明提供了用于合成结构9的化合物的方法:其中每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下形成(a)使第一单链寡核苷酸与第二单链寡核苷酸退火,由此形成并且使与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)使第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并且使第一单链寡核苷酸与退火,由此形成(ii)使与单链二聚体退火,由此形成并且(iii)使与第四单链寡核苷酸退火,由此形成一方面,本发明提供了用于合成结构10的化合物的方法:其中每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下形成(a)使第一单链寡核苷酸与第二单链寡核苷酸退火,由此形成并且使与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)使第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并且使第一单链寡核苷酸与退火,由此形成(ii)使与单链二聚体退火,由此形成(iii)使与第二单链二聚体退火,由此形成并且(iv)使与第四单链寡核苷酸退火,由此形成在多个方面,本发明提供了有义-反义多偶联寡核苷酸,以及它们的合成方法。一方面,本发明提供了本发明提供了包含多个分子的组合物,每个分子具有结构16:其中n是≥1的整数;每个是单链寡核苷酸;每个是与杂交的单链寡核苷酸;是双链寡核苷酸;并且每个●是连接相邻单链寡核苷酸的单链的共价接头。一方面,本发明提供了用于合成包含多个分子的组合物的方法,每个分子具有结构16,所述方法包括:(i)使第一单链寡核苷酸与双功能连接部分○反应,其中r1是能够在产生单取代产物的条件下与○反应的化学基团;(ii)使与第二单链寡核苷酸反应,其中r2是能够与○反应的化学基团,由此形成(iii)使多个退火,由此形成包含多个分子的组合物,每个分子具有结构16。在多个方面,本发明提供了用于合成多偶联寡核苷酸的方法。一方面,本发明提供了用于合成包含多个分子的组合物的方法,所述分子包含结构17:其中n是≥1的整数;每个是单链寡核苷酸;每个是与杂交的单链寡核苷酸;是双链寡核苷酸;并且每个●是连接相邻单链寡核苷酸的单链以形成和的共价接头,该方法包括以下步骤:在下述条件下使多个和退火:(i)对于和以约200-300μm的总寡核苷酸浓度,(ii)约0.1-0.3x磷酸盐缓冲盐水(pbs),和(iii)在约70-80℃至约20-30℃的温度下进行约1.5-2.5小时。在多个方面,本发明提供了包含多偶联寡核苷酸的药物组合物。一方面,本发明提供了包含(i)根据本发明的化合物或组合物和(ii)药学上可接受的赋形剂的组合物(例如,药物组合物)。一方面,本发明提供了根据本发明的化合物或组合物其用于药物或用于制造药物。该药物可以用于沉默或减少至少一个过表达的基因的表达,例如用于沉默或减少2、3、4或更多个过表达的基因的表达。一方面,本发明提供了包含在脂质纳米颗粒(lnp)、外来体、微泡或病毒载体中配置的根据本发明的化合物或组合物的组合物(例如,药物组合物)。在多个方面,本发明提供了使用多偶联寡核苷酸的方法。一方面,本发明提供了用于减少基因表达的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者。一方面,本发明提供了用于治疗受试者的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者。一方面,本发明提供了用于沉默两个或更多个基因的方法,其包括将有效量的根据本发明化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含靶向两个或更多个基因的寡核苷酸。所述化合物或组合物可以包含靶向两个、三个、四个或更多个基因的寡核苷酸。一方面,本发明提供了用于每个靶向配体结合事件将两个或更多个寡核苷酸递送至细胞的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含靶向配体。一方面,本发明提供了用于将预定化学计量比的两个或更多个寡核苷酸递送至细胞的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含预定化学计量比的两个或更多个寡核苷酸。在多个方面,本发明提供了具有特定序列的寡核苷酸。一方面,本发明提供了具有seqidno:106的sirna。一方面,本发明提供了具有seqidno:115的sirna。本领域技术人员将认识到,上述方面可以与下面描述的一个或多个合适的特征组合。在多个实施方案中,共价接头(例如●中的一个或全部)可以包含亲核体和亲电体的反应产物。例如,共价接头(例如●中的一个或全部)可以包含巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃,或胺和羧基的反应产物。在多个实施方案中,共价接头不是寡核苷酸。在多个实施方案中,亲核体和亲电体(例如,结构1或4-6中的a的)可以包含巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃,或胺和羧基。类似地,结构3中的反应部分可以包含亲核体和亲电体,例如巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃,或胺和羧基。在多个实施方案中,亲核体或亲电体(例如,结构1中的b的)可包含巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基。在多个实施方案中,接头(例如结构1-3中所示的●或接头)可包含dtme(二硫代双马来酰亚胺乙烷)、bm(peg)2(1,8-双(马来酰亚胺基)二亚乙基乙二醇)、bm(peg)3(1,11-双马来酰亚胺-三甘醇)、bmoe(双马来酰亚胺乙烷)、bmh(双马来酰亚胺己烷)或bmb(1,4-双马来酰亚胺丁烷)的反应产物。例如,接头●可以包含巯基和dtme(二硫代双马来酰亚胺乙烷)、bm(peg)2(1,8-双(马来酰亚胺基)二甘醇)、bm(peg)3(1,11-双马来酰亚胺基三乙二醇)、bmoe(双马来酰亚胺己烷)、bmh(双马来酰亚胺己烷)或bmb(1,4-双马来酰亚胺丁烷)的反应产物。在包含两个或更多个共价接头●的多个实施方案中(例如,结构7-16中),接头全部相同。或者,化合物或组合物可以包含两个或更多个不同的共价接头●。在多个实施方案中,在结构1中,r1是磷酸二酯或硫代磷酸二酯;r2是c2-c10烷基;a是巯基和马来酰亚胺的反应产物;r3是二硫化物;和b是巯基或马来酰亚胺。在多个实施方案中,核酸(例如x)或寡核苷酸(例如,或)是rna、dna,或者包含人造或非天然核酸类似物。在多个实施方案中,核酸或寡核苷酸是dna,例如反义dna(adna)或反义gapmer。在多个实施方案中,核酸或寡核苷酸是rna,例如反义rna(arna)、crisprrna(crrna)、长非编码rna(lncrna)、microrna(mirna),piwi相互作用rna(pirna)、小干扰rna(sirna)、信使rna(mrna)、短发夹rna(shrna)、小活化(sarna)、antagomir或核酶。在一个实施方案中,rna是sirna。在多个实施方案中,核酸或寡核苷酸是适体(aptamer)。在多个实施方案中,核酸或寡核苷酸还包含化学修饰。化学修饰可以包含修饰的核苷、修饰的主链、修饰的糖或修饰的末端。在多个实施方案中,核酸或寡核苷酸还包含靶向配体。靶向配体可以(例如直接)与核酸结合,例如通过其3’或5’末端。在一个实施方案中,靶向配体包含n-乙酰半乳糖胺(galnac)、胆固醇、生育酚、叶酸、2-[3-(1,3-二羧基丙基)-脲基]戊二酸(dupa)或茴香酰胺。在多个实施方案中,所述方法可以包括将靶向配体偶联至分子。在多个实施方案中,核酸或寡核苷酸是单链的。在多个实施方案中,核酸或寡核苷酸是双链的。在多个实施方案中,核酸或寡核苷酸长度是15-30、17-27、19-26、20-25、40-50、40-150、100-300、1000-2000或至多10000个核苷酸。在多个实施方案中,核酸或寡核苷酸通过磷酸二酯或硫代磷酸二酯(例如,结构1中的r1是磷酸二酯或硫代磷酸二酯)与接头连接。在多个实施方案中,核酸或寡核苷酸经由c2-c10、c3-c6或c6烷基(例如,结构1中的r2是c2-c10、c3-c6或c6烷基)与接头连接。在多个实施方案中,核酸或寡核苷酸通过巯基和马来酰亚胺基的反应产物(例如,结构1中的a是巯基和马来酰亚胺基的反应产物)与接头连接。在多个实施方案中,接头(例如,●、结构1中的r3、结构2中的r1-r2-r1或结构3中的a-r3-b)是可切割的。在一个实施方案中,可切割的共价接头包含酸可切割的酯键、肼键或缩醛键。在一个实施方案中,可切割的共价接头包含还原剂可切割的键。在一个实施方案中,还原剂可切割的键是二硫键。在一个实施方案中,可切割的共价接头在细胞内条件下是可切割的。在一个实施方案中,可切割的共价接头包含生物可切割的键。在一个实施方案中,可切割的共价接头包含酶可切割的键。在多个实施方案中,接头不可切割。在一个实施方案中,一个或多个●包含不可切割的共价接头。在一个实施方案中,不可切割的共价接头包含酰胺键或氨基甲酸酯键。不可切割的共价接头可以是烷基、芳基或类似的烃基。在多个实施方案中,接头包含硫代丙酸酯或二硫化物(例如,r3是硫代丙酸酯或二硫化物)。在多个实施方案中,结构2中的部分包含dtme(二硫代双马来酰亚胺乙烷)、bm(peg)2(1,8-双(马来酰亚胺基)二甘醇)、bm(peg)3(1,11-双马来酰亚胺基-三甘醇)、bmoe(双马来酰亚胺乙烷)、bmh(双马来酰亚胺基己烷)或bmb(1,4-双马来酰亚胺丁烷)的反应产物。在多个实施方案中,接头是同型双功能接头。例如,在一个实施方案中,在结构1或结构3中b包含与a相同的基团之一。在多个实施方案中,接头是异双功能接头。例如,在一个实施方案中,在结构1或结构3中b包含与a不同的基团。在多个实施方案中,化合物是分离的或基本上纯的。例如,该化合物可以是至少75、80、85、90、95、96、97、98、99或100%纯。在一个实施方案中,该化合物为约85-95%纯。同样地,用于合成根据本发明的化合物和组合物的方法可以产生至少75、80、85、90、95、96、97、98、99或100%纯的产物。在一个实施方案中,产物为约85-95%纯。在多个实施方案中,每个双链寡核苷酸是sirna和/或具有15-30个碱基对的长度。在多个实施方案中,每个可独立地包含两个有义或两个反义寡核苷酸。在多个实施方案中,每个可独立地包含一个有义和一个反义寡核苷酸。在多个实施方案中,化合物或组合物包含基本上相同的双链寡核苷酸的同源多聚体。基本相同的双链寡核苷酸可各自包含靶向体内相同分子靶标的sirna。在多个实施方案中,化合物或组合物包含两个或更多个基本上不同的双链寡核苷酸的异源多聚体。基本不同的双链寡核苷酸可各自包含靶向不同基因的sirna。在多个实施方案中,化合物包含结构9并且其中n=0:该化合物可以进一步包含靶向配体。该化合物可以进一步包含2或3个基本上不同的双链寡核苷酸其各自包含靶向体内不同分子靶标的sirna。所述化合物可以进一步包含靶向配体、包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链的一个包含靶向载脂蛋白b的第二sirna引导链和与第二引导链杂交的第二随从链的一个和包含靶向ttr的第三sirna引导链和与第三引导链杂交的第三随从链的一个靶向配体可以包含n-乙酰半乳糖胺(galnac)。在多个实施方案中,该化合物包含结构10并且其中m=1:该化合物可以进一步包含靶向配体。该化合物可进一步包含2、3或4个基本上不同的双链寡核苷酸每个包含靶向体内不同分子靶标的sirna。所述化合物可以进一步包含靶向配体、包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链的一个包含靶向载脂蛋白b的第二sirna引导链和与第二引导链杂交的第二随从链的一个和包含靶向ttr的第三sirna引导链和与第三引导链杂交的第三随从链的一个靶向配体可以包含n-乙酰半乳糖胺(galnac)。在涉及结构16的多个实施方案中,每个具有15-30个碱基对的长度;每个是sirna;和/或n是从1至100的整数。在多个实施方案中,每个双链寡核苷酸(例如,结构4中的)包含靶向因子vii的sirna引导链和与引导链杂交的随从链。在多个实施方案中(例如结构4中),化合物进一步包含靶向配体,每个双链寡核苷酸(例如)包含sirna引导链和与引导链杂交的随从链,并且该化合物为至少75、80、85、90、95、96、97、98、99或100%纯。在多个实施方案中,至少一个双链寡核苷酸(例如,结构6中的)包含靶向因子vii的第一sirna引导链和与引导链杂交的第一随从链,并且至少一个双链寡核苷酸(例如,结构6中的)包含靶向载脂蛋白b的第二sirna引导链和与第二引导链杂交的第二随从链。在多个实施方案中,用于合成结构1的化合物的方法进一步包括合成结构2的化合物:在多个实施方案中,在基本上有利于形成结构1或2并且基本上防止x的二聚体化的条件下进行用于合成结构1或2的化合物的方法。所述条件可以改善反应的产率(例如,改善产品的纯度)。在多个实施方案中,在低于约1mm、500μm、250μm、100μm或50μm的x-r1-r2-a’浓度下进行用于合成结构1或2的化合物的方法,使功能化的核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。或者,x-r1-r2-a’浓度可以是约1mm、500μm、250μm、100μm或50μm。在多个实施方案中,以至少约5、10、15、20、25、30、35、40、45、50或100摩尔过量的a”-r3–b进行用于合成结构1或2的化合物的方法,使功能化的核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。或者,摩尔过量的a”-r3-b可以是约5、10、15、20、25、30、35、40、45、50或100。在多个实施方案中,在低于约7、6、5或4的ph下进行用于合成结构1或2的化合物的方法,使功能化的核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。或者,ph可以是约7、6、5或4。在多个实施方案中,在包含水和水混溶有机共溶剂的溶液中进行用于合成结构1或2的化合物的方法,使功能化的核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。所述水混溶有机共溶剂可以包含dmf、nmp、dmso或乙腈。所述水混溶有机共溶剂可以包含所述溶液的约10、15、20、25、30、40或50%v(v/v)。在多个实施方案中(例如,用于合成结构17),所述方法进一步包括使多个和/或退火的步骤,由此形成多个包含结构18的分子:和/或在多个实施方案中(例如,用于合成结构17),所述方法进一步包括使与多个多个和退火。在多个实施方案中(例如,用于合成结构17),与的摩尔比为约5:100、10:100、20:100、30:100、40:100或50:100。在多个实施方案中(例如,用于合成结构17),所述方法进一步包括使与多个多个和退火。在多个实施方案中(例如,用于合成结构17),与的摩尔比为约5:100、10:100、20:100、30:100、40:100或50:100。在多个实施方案中(例如,用于合成结构17),与的摩尔比为约1:1。在多个实施方案中(例如,用于合成结构17),与的摩尔比或与的摩尔比为约100:90、100:80、100:75、100:70或100:60。在多个实施方案中(例如,用于合成结构17),每个具有15-30个碱基对的长度。在多个实施方案中(例如,用于合成结构17),每个是sirna。在多个实施方案中(例如,用于合成结构17),每个包含靶向因子vii的sirna引导链和与引导链杂交的随从链。在多个实施方案中(例如,用于合成结构17),n是1至100的整数。在多个实施方案中(例如,用于合成结构17),●是可切割的或不可切割的接头。在多个实施方案中,该方法进一步包括在纳米颗粒中配置任何化合物或组合物。在多个实施方案中,寡核苷酸具有特定的序列,例如本文公开的任何一个序列。在一个实施方案中,寡核苷酸是具有seqidno:106的sirna。在一个实施方案中,寡核苷酸是具有seqidno:115的sirna。在多个实施方案中,所述受试者是细胞、哺乳动物或人。当参照附图和以下描述时,本技术的这些和其他优点将变得显而易见。附图简述图1呈现了三触角n-乙酰半乳糖胺配体的化学结构。图2呈现了结合实施例9讨论的fvii-apob异源二聚体(xd-05311)的合成的示意图。图3呈现了结合实施例10讨论的显示了来自小鼠血清的体内fvii活性的数据。图4呈现了结合实施例10讨论的显示动物实验mausrnai-tv30中来自肝组织的fvii和apobmrna水平的数据。图5呈现了结合实施例11讨论的5’-galnac-fvii经典对照。图6呈现了结合实施例12讨论的galnac-同型二聚体偶联物(xd-06330)。图7呈现了结合实施例13讨论的galnac-同型二聚体偶联物(xd-06360)的合成的示意图。图8呈现了结合实施例14讨论的galnac-同型二聚体偶联物(xd-06329)的合成的示意图。图9呈现了结合实施例15讨论的显示小鼠血清中的fvii活性(通过fvii同型二聚体galnac偶联物的敲低)的数据。图10a和10b以及10c呈现了结合实施例15讨论的小鼠血清中的fvii活性(通过针对galnac含量归一化的fvii同型二聚体galnac偶联物的敲低)的数据。图11呈现了结合实施例16讨论的独立靶向fvii、apob和ttr的经典galnac-sirna。图12呈现了结合实施例17讨论的galnac-异源三聚体偶联物(xd06726)。说明:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图13呈现了结合实施例17讨论的galnac-偶联的异源三聚体(xd06726)的合成策略的示意图。说明:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图14呈现了结合实施例18讨论的galnac-异源三聚体偶联物(xd06727)。说明:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图15呈现了结合实施例18讨论的galnac偶联的异源三聚体(xd06727)的合成策略的示意图。说明:在本实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图16呈现了结合实施例18讨论的x20336与x20366作用的反应的hplc分析的数据。图17呈现了结合实施例18讨论的将x19580添加至反应的hplc分析的数据。图18呈现了结合实施例18讨论的将x18795(5’-sifvii反义-3’)添加至反应混合物中以产生xd-06727的hplc分析的数据。图19a和19b呈现了结合实施例20讨论的血清样品中ttr蛋白水平的数据(通过elisa测量)。图20a和20b呈现了结合实施例20讨论的血清样品中fvii酶活性的数据。图21a和21b呈现了结合实施例20讨论的血清样品中的apob蛋白水平的数据(通过elisa测量)。图22a和22b呈现了结合实施例20讨论的肝脏数据中的靶向敲低。图23呈现了结合实施例21讨论的galnac-异源四聚体偶联物(xd-07140)。说明:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图24呈现了结合实施例21讨论的galnac-异源四聚体偶联物(xd-07140)的合成的示意图。说明:在该实施例中,“genea”是sifvii;“geneb”是siapob;并且“genec”是sittr。图25呈现了结合实施例21讨论的galnac-sifvii-siapob-sittr-sifvii四聚体(xd-07140)的hplc分析。图26呈现了结合实施例21讨论的同型二聚体的合成。图27呈现了结合实施例22讨论的xd-05305的sechplc分析。图28呈现了结合实施例22讨论的xd-05305的sechplc分析。图29呈现了结合实施例22讨论的xd-05305的iexhplc分析。图30呈现了结合实施例22讨论的xd-05305的sechplc分析。多聚体sirna是左手边的峰;二聚体sirna是中间的峰;而经典的sirna是右手边的峰。图31呈现了结合实施例22讨论的盐浓度和反应温度对多聚sirna混合物的影响。图32呈现了以下的数据,其显示了终止链(在这种情况下,反义链被用作终止子)的浓度越高,多聚sirna部分越小。结合实施例22讨论了所述数据。图33呈现了以下的数据,其显示了有义同型二聚体的浓度越小,多聚sirna部分越小。结合实施例22讨论了所述数据。图34a呈现了结合实施例22讨论的样品编号1-15的凝胶。图34b呈现了结合实施例22讨论的样品编号1’-10’的凝胶。图35呈现了以下的数据,其显示了结合实施例23讨论的在动物实验mausrnai-tv29中从小鼠血清确定的fvii活性。图36呈现了以下的数据,其显示了结合实施例23讨论的在动物实验mausrnai-tv30中从小鼠血清确定的fvii活性。图37呈现了结合实施例24讨论的fviis-fviias异源二聚体(x12714)。图38呈现了结合实施例24讨论的异源二聚体x12714(泳道12)的凝胶分析。图39呈现了结合实施例26讨论的apob筛选nmuli细胞的剂量响应数据。虽然本发明包含许多不同形式的实施方案,但是在附图中显示并将在此处详细描述若干具体实施方案,同时理解应该认为本公开是技术原理的示例并不旨在将本发明限制在所说明的实施方案。发明详述本发明的多个方面共同具有含有寡核苷酸的多偶联物的制造和用途。多偶联物可以含有rna和/或dna。rna可以是适于本文提供的多缀合反应条件的生物活性rna的任何形式,例如sirna、mirna和小活化rna(sarna)。用于本发明多个方面的寡核苷酸可以是任何感兴趣的或用于以下的寡核苷酸:(a)医学领域,例如,来抑制或增强受试者中靶基因或蛋白质的表达,和用于将受益于靶基因或蛋白质表达的抑制或增强的任何疾病的治疗或预防;(b)进行生物学研究;和(c)用于在动物和植物中产生新的或改变的表型。作为非限制性实例,寡核苷酸可以是用于rna干扰、rna活化或基因治疗的任何rna,或预期将在不久的将来使用的任何rna,如被设计为与c-myc、c-myb、c-fos、c-jun、bcl-2或vegf、vegf-b、vegf-c、vegf-d或pigf有关的活性rna。本文所述的制造方法产生比先前在本领域中已经描述的纯度水平更高的各种多偶联物。本发明的这一特征对于多偶联物的治疗应用是特别有利的,并且可能对在其他应用如研究中多偶联物的制造和用途产生优势。本发明的一个方面是具有预定大小和组成的含寡核苷酸的多偶联物,以及制备这种多偶联物的方法。该方法产生比本领域先前描述的纯度水平更高的多偶联物。下面依次讨论本发明的各种特征。核酸在多个实施方案中,核酸或寡核苷酸是rna、dna,或者包含人造或非天然核酸类似物。在多个实施方案中,核酸或寡核苷酸是单链的。在多个实施方案中,核酸或寡核苷酸是双链的(例如反向平行的双链)。在多个实施方案中,核酸或寡核苷酸是rna,例如反义rna(arna)、crisprrna(crrna)、长非编码rna(lncrna)、microrna(mirna)、piwi相互作用rna(pirna)、小干扰rna(sirna)、信使rna(mrna)、短发夹rna(shrna)、小活化(sarna)或核酶。在一个实施方案中,rna是sirna。例如,每个双链寡核苷酸是sirna和/或具有15-30个碱基对的长度。在多个实施方案中,核酸或寡核苷酸是适体。sirna(小干扰rna)是由19-22个核酸组成的短双链rna,其靶向基因(其核苷酸序列与其有义链相同)的mrna(信使rna),以通过分解靶基因来抑制基因的表达(elbashir,s.m.,harborth,j.,lendeckel,w.,yalcin,a.,weber,k.,和tuschl,t.(2001)duplexesof21-nucleotidernasmediaternainterferenceinculturedmammaliancells.nature411:494-8)。可用于本发明方法的另一类核酸是mirna。mirna是在转录后基因调控中起关键作用的非编码rna。mirna可以调节30%的所有哺乳动物蛋白质编码基因的表达。发现了通过双链rna(rnai)的特异性和有效的基因沉默,加上另外的小的非编码rna(canver,m.c.etal.,nature(2015))。pre-mirna是长度为约70个核苷酸的短的茎环,具有突出到成熟的19-25核苷酸双链体中的2-核苷酸3’突出端。具有较低碱基配对稳定性的mirna链(引导链)可以加载到rna诱导的沉默复合体(risc)上。随从引导链可以是功能性的,但通常被降解。成熟的mirna将risc捆绑到主要在3’非翻译区(utr)内发现的靶标mrna中的部分互补的序列基序上并诱导转录后基因沉默(bartel,d.p.cell,136:215-233(2009);saj,a.&lai,e.c.curropingenetdev,21:504-510(2011))。例如在美国专利号8,765,709中描述了mirna模拟物。在一些实施方案中,rna可以是短发夹rna(shrna),例如,如美国专利号8,202,846和8,383,599中所述。在一些实施方案中,rna可以是crisprrna(crrna),例如可以将类型v的crispr阵列加工成长度为42-44个核苷酸的短的成熟crrna,其中每个成熟的crrna以19个核苷酸的直接重复开始,随后是23-25个核苷酸的间隔序列。或者,ii型系统中的成熟crrna可以以20-24个核苷酸的间隔序列开始,随后是约22个核苷酸的直接重复。例如在美国专利号8,771,945,jineketal.,science,337(6096):816-821(2012)和国际专利申请公开号wo2013/176772中描述了crispr系统。在多个实施方案中,核酸或寡核苷酸长度是15-30、17-27、19-26、20-25、40-50、40-150、100-300、1000-2000或至多10000个核苷酸。在多个实施方案中,寡核苷酸是双链的并且互补的。互补可以是100%互补,或低于100%互补,但是其中所述寡核苷酸在相关条件(例如生理相关条件)下杂交并且保持双链。例如,双链寡核苷酸可以是至少约80、85、90或95%互补的。在一些实施方案中,rna是长的非编码rna(lncrna)。lncrna是大的且不同类型的转录rna分子,具有超过200个核苷酸的长度,不编码蛋白质(或缺少大于100个氨基酸的开放读码框)。lncrna被认为在人类中包括近3万种不同的转录物,因此lncrna转录物占非编码转录组的主要部分(参见例如derrienetal.,thegencodev7catalogofhumanlongnoncodingrnas:analysisoftheirgenestructure,evolution,andexpression.genomeres,22(9):1775-89(2012))。在又一其他实施方案中,rna是信使rna(mrna)。例如在国际专利申请公开号wo2013/151736中描述了mrna及其作为递送方法用于体内蛋白质的产生的应用。在其他实施方案中,rna可以是小活化(sarna)(例如,如chappelletal.,naturechemicalbiology,11:214-220(2015)中所述),或核酶(dohertyetal.,annrevbiophysbiomostruct,30:457-475(2001))。在一些实施方案中,核酸或寡核苷酸是dna,例如反义dna(adna)(例如antagomir)或反义gapmer。例如在subramanianetal.,nucleicacidsres,43(19):9123–9132(2015)和国际专利申请公开号wo2013/040429中描述了dna的实例,包括gapmer和多聚体。例如在美国专利号7,232,806描述了antagamirs的实例。在多个实施方案中,寡核苷酸具有特定序列,例如本文公开的任何一个序列。在一个实施方案中,寡核苷酸是具有seqidno:106的sirna。在一个实施方案中,寡核苷酸是具有seqidno:115的sirna。在下面的实施例中提供了用于寡核苷酸合成的一般程序。可以适用于本发明使用的其他方法是本领域已知的。对核酸的修饰在多个实施方案中,核酸或寡核苷酸还包含化学修饰。化学修饰可以包含修饰的核苷、修饰的主链、修饰的糖或修饰的末端。含磷连接包括但不限于,但不限于具有正常3’-5’连接的硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、包含3’-亚烷基膦酸酯和手性膦酸酯的甲基和其他烷基膦酸酯、亚膦酸酯、包含3’-氨基磷酰胺酯的氨基磷酸酯和氨基烷基氨基磷酸酯、硫代磷酰胺酯、硫代烷基膦酸酯、硫代烷基磷酸三酯和硼烷基磷酸酯、这些的2’-5’连接类似物和具有反向极性的那些,其中相邻的核苷单元对以3’-5’连接到5’-3’或2’-5’连接到5’-2’。可以使用本领域已知的各种策略修饰包含在本发明多偶联物中的寡核苷酸以产生多种效果,包括例如改善的功效和体外和体内稳定性。在这些策略中有:人工核酸,例如2’-o-甲基取代的rna;2’-氟-2’脱氧rna、肽核酸(pna);吗啉;锁定的核酸(lna);未锁定的核酸(una);桥接的核酸(bna);乙二醇核酸(gna);和苏糖核酸(tna);或更一般地,核酸类似物,例如二环和三环核苷类似物,其在结构上与天然存在的rna和dna类似,但在天然存在的分子的一个或多个磷酸主链、糖或核碱基部分中具有改变。通常,类似物核碱基尤其赋予不同的碱基配对和碱基堆积性质。实例包括通用碱基,其可以与所有四个canon碱基配对。磷酸糖主链类似物的实例包括pna。在braaschetal.,biochemistry,41(14):4503-4510(2002)和美国专利号5,539,082;5,714,331;5,719,262;和5,034,506中描述了基于吗啉代的寡聚化合物。在本文所述的制造方法中,一些寡核苷酸在末端通过用化学官能团取代而被修饰。取代可以在寡核苷酸的3’或5’末端进行,并且优选在单体的有义链和反义链的3’末端进行,但不总是限于此。化学官能团可以包括例如巯基(-sh)、羧基(-cooh)、胺基(-nh2)、羟基(-oh)、甲酰基(-cho)、羰基(-co-)、醚基(-o-)、酯基(-coo-)、硝基(-no2)、叠氮基(-n3)或磺酸基(-so3h)。包含在本发明的多偶联物中的寡核苷酸可以被修饰,还可以包括额外或替代地核碱基(在本领域中通常简称为“碱基”)修饰或取代。修饰的核碱基包括在天然核酸中仅稀少或暂时发现的核碱基,例如次黄嘌呤、6-甲基腺嘌呤、5-me嘧啶,特别是5-甲基胞嘧啶(也称为5-甲基-2’-脱氧胞嘧啶并且在本领域中通常被称为5-me-c)、5-羟甲基胞嘧啶(hmc)、糖基hmc和gentobiosylhmc,以及合成的核碱基,例如,2-氨基腺嘌呤、2-(甲氨基)腺嘌呤、2-(咪唑烷基)腺嘌呤、2-(氨基烷基氨基)腺嘌呤或其他杂取代的烷基腺嘌呤、2-硫尿嘧啶、2-硫胸腺嘧啶、5-溴尿嘧啶、5-羟甲基尿嘧啶、8-氮杂鸟嘌呤、7-脱氮鸟嘌呤、n6(6-氨基己基)腺嘌呤和2,6-二氨基嘌呤。kornberg,a.,dnareplication,w.h.freeman&co.,sanfrancisco,pp75-77(1980);gebeyehuetal.,nucl.acidsres,15:4513(1997)。也可以包括本领域已知的“通用”碱基,例如肌苷。已显示5-me-c取代使核酸双链体稳定性增加0.6-1.2℃.(sanghvi,y.s.,incrooke,s.t.和lebleu,b.,eds.,antisenseresearchandapplications,crcpress,bocaraton,pp276-278(1993)),并且是碱基取代的方面。修饰的核碱基可以包括其他合成的和天然的核碱基,如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物、2-硫尿嘧啶、2-硫代胸腺嘧啶和2-硫代胞嘧啶、5-卤代尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、8-卤代、8-氨基、8-巯基、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤、5-卤代特别是5-溴、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮腺嘌呤,和3-脱氮鸟嘌呤和3-脱氮腺嘌呤。核酸末端的羟基(-oh)可以被官能团如巯基(-sh)、羧基(-cooh)或胺基(-nh2)取代。取代可以在3’末端或5’末端进行,并且优选发生在有义和反义两者的3’末端被这样的官能团取代,但不总是限于此。接头在本发明的多个方面和实施方案中,寡核苷酸共价连接。接头可以是可切割的(例如,在细胞内条件下,以促进寡核苷酸递送和/或作用)或是不可切割的。尽管在下文中以及在实施例中在接头的上下文中一般性描述了亲核体-亲电体化学,但是其他化学和构型是可能的。而且,如本领域普通技术人员将理解的,各种接头,包括其组成、合成和用途在本领域中是已知的,并且可以适用于本发明。在多个实施方案中,共价接头可以包含亲核基团和亲电基团的反应产物。例如,共价接头可以包含巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物。如本文所述,这些基团之一连接寡核苷酸(例如,在3’或5’端的巯基(-sh)功能化),并且第二个分子(例如,连接剂)包括其他基团,其最终连接两个寡核苷酸(例如,dtme中的马来酰亚胺)。在多个实施方案中,核酸或寡核苷酸通过磷酸二酯或硫代磷酸二酯(例如,结构1中的r1是磷酸二酯或硫代磷酸二酯)与接头连接。在多个实施方案中,核酸或寡核苷酸通过c2-c10、c3-c6或c6烷基(例如,结构1中的r2是c2-c10、c3-c6或c6烷基)与接头连接。或者,这些部分(例如,结构1中的r1和/或r2)是可选的并且可能是直接连接。在多个实施方案中,核酸或寡核苷酸通过巯基和马来酰亚胺基团的反应产物(例如,结构1中的a是巯基和马来酰亚胺基团的反应产物)与接头连接。利用该化学反应的优选连接剂包括dtme(二硫代双马来酰亚胺乙烷)、bm(peg)2(1,8-双(马来酰亚胺基)二甘醇)、bm(peg)3(1,11-双马来酰亚胺基-三甘醇)、bmoe(双马来酰亚胺乙烷)、bmh(双马来酰亚胺己烷)或bmb(1,4-双马来酰亚胺丁烷)。再次,这些实例是说明性的而不是限制性的。在多个实施方案中,寡核苷酸可以通过功能性末端取代直接连接在一起,或通过连接剂间接连接。在多个实施方案中,寡核苷酸可以直接结合到接头(例如,结构1的r1和r2缺失)。例如可以通过使用可根据本领域普通技术人员制备的3’-硫代核苷来实现这种键合。参见例如sunetal.“synthesisof3’-thioribonucleosidesandtheirincorporationintooligoribonucleotidesviaphosphoramiditechemistry”rna.1997nov;3(11):1352-63。在多个实施方案中,连接剂可以是非离子型亲水性聚合物,如聚乙二醇(peg)、聚乙烯吡咯烷酮和聚噁唑啉,或疏水性聚合物,如plga和pla。用作共价键介体的聚合物连接剂可以是非离子型亲水聚合物,包括peg、pluronic、聚乙烯吡咯烷酮、聚噁唑啉或其共聚物;或一种或多种可生物降解的聚酯聚合物,包括聚-l-乳酸、聚-d-乳酸、聚-d,l-乳酸、聚乙醇酸、聚-d-乳酸-乙醇酸共聚物、聚-l-乳酸-乙醇酸共聚物、聚-d,l-乳酸-乙醇酸共聚物、聚己内酯、聚戊内酯、聚羟基丁酸酯、聚羟基戊酸酯或其共聚物,但并总不限于此。连接剂可以具有100-10,000道尔顿的分子量。此类连接剂的实例包括二硫-双-马来酰亚胺基乙烷(dime)、1,8-双马来酰亚胺基二甘醇(bm(peg)2)、三(2-马来酰亚胺基乙基)胺(tmea)、氨基三乙酸三琥珀酰亚胺酯(tsat)/3-arm-聚(乙二醇)(3-armpeg)、马来酰亚胺、n-羟基琥珀酰亚胺(nhs)、乙烯基砜、碘乙酰基、硝基苯基叠氮化物、异氰酸酯、吡啶基二硫化物、酰肼和羟基苯基叠氮化物。本文可以使用具有可切割键(如被细胞溶质的化学环境切割的还原剂键)的连接剂或具有不可切割键的连接剂。例如,本发明上述方面的连接剂可以具有不可切割的键,如酰胺键或氨基甲酸酯键。或者,本发明前述方面的连接剂可以具有可切割键,如酸可切割键(例如,酯,腙或缩醛的共价键)、还原剂可切割键(例如,二硫键)、生物可切割的键或酶可切割的键。在一个实施方案中,可切割的共价接头在细胞内条件下是可切割的。此外,可用于药物改性的任何连接剂可以用于本发明的前述方面而没有限制。此外,官能团和连接剂的组合可以包括:(a)当官能团是氨基和巯基时,连接剂可以是琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯或琥珀酰亚胺基6-([3(2-吡啶基二硫代)丙酸酯]己酸酯;(b)当官能团是氨基时,连接剂可以是3,3’-二硫代二丙酸二-(n-琥珀酰亚胺酯)、二硫代-双(乙基-1h-咪唑-1-羧酸酯),或二硫代-双(乙基1h-咪唑-1-羧酸酯);(c)当官能团是氨基和炔烃时,连接剂可以是磺基-n-琥珀酰亚胺基3-[[2-(对叠氮基水杨酰氨基)乙基]-1,3’-二硫代]丙酸酯;并且(d)当官能团y是巯基时,连接剂是二硫代双马来酰亚胺乙烷(dtme);1,8-双马来酰亚胺基二甘醇(bm(peg)2);或二硫代双(磺基琥珀酰亚胺基丙酸酯)(dtssp)。在制备化合物的上述方法中,可以包括活化官能团的附加步骤。可用于活化官能团的化合物包括但不限于1-乙基-3,3-二甲基氨基丙基碳化二亚胺、咪唑、n-羟基琥珀酰亚胺、二氯己基碳化二亚胺、n-β-马来酰亚胺丙酸、n-β-马来酰亚胺丙基琥珀酰亚胺酯或n-琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯。单体中间体化合物在多个方面,本发明提供了与共价接头偶联的寡核苷酸,其可以用于例如合成具有预定尺寸和组成的确定的多偶联寡核苷酸。一方面,本发明提供了根据结构1的化合物:x-r1-r2-a-r3-b(结构1)其中:x是通过其3’或5’末端与r1键合的核酸;r1为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇,或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是亲核体和亲电体的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是亲核体或亲电体(例如巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基)。一方面,本发明提供了根据结构2的化合物:其中:x是在其3’或5’末端经由磷酸酯或硫代磷酸酯与r1键合的核酸;每个r1独立地为c2-c10烷基、烷氧基或芳基;和r2是硫代丙酸酯或二硫化物基团。一方面,本发明提供了根据结构3的化合物:x-r1-r2-a-r3-b(结构3)其中:x是通过其3’或5’末端与r1键合的核酸;r1是磷酸酯、硫代磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是第一和第二反应部分的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是第三反应部分。在多个方面,本发明还提供了用于合成与共价接头偶联的寡核苷酸的方法。一方面,本发明提供了用于合成根据结构1的化合物(或适合于合成根据结构2或3的化合物)的方法,所述方法包括:在x-r1-r2-a'的稀释溶液中并且利用化学计量过量的a”-r3-b使功能化核酸x-r1-r2-a’和共价接头a”-r3-b反应,其中a’和a”包括亲核体和亲电体,由此形成化合物x-r1-r2-a-r3-b(结构1),其中:x是通过其3’或5’末端与r1键合的核酸;r1为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇或不存在;r2是c2-c10烷基、烷氧基或芳基,或不存在;a是亲核体和亲电体的反应产物;r3是c2-c10烷基、烷氧基、芳基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物;和b是亲核体或亲电体(例如巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺或羧基)。所述方法可以进一步包括通过以下步骤合成功能化核酸x-r1-r2-a’的步骤,其中a’包含巯基(-sh):(i)在核酸的固相合成过程中使用亚磷酰胺寡聚化化学引入巯基或(ii)还原在固相合成过程中引入的二硫化物。。在多个实施方案中,用于合成结构1的化合物的方法还包括合成结构2的化合物。偶联至共价接头的寡核苷酸可以包括本文,包括在实施例中所述的任何一个或多个特征。例如,所述化合物可以包括上述核酸(有或没有修饰)、靶向配体和/或接头中的任何一种或多种,或者概述或实施例中所示的任何特定结构或化学物质。实施例1提供了产生巯基封端的寡核苷酸的示例性方法。实施例2提供了用于制备与接头偶联的寡核苷酸的示例性方法。在多个实施方案中,在基本上有利于结构1或2的形成并基本上防止x的二聚体化的条件下进行合成结构1或2的化合物的方法。所述条件可以提高反应的产率(例如,提高产品的纯度)。在多个实施方案中,在低于约1mm、500μm、250μm、100μm或50μm的x-r1-r2-a’浓度下进行合成结构1或2的化合物的方法、使功能化的核酸x-r1-r2-a'和共价接头a”-r3-b反应的步骤。或者,x-r1-r2-a’浓度可以是约1mm、500μm、250μm、100μm或50μm。在多个实施方案中,利用至少约5、10、15、20、25、30、35、40、45、50或100摩尔过量的a”-r3-b进行合成结构1或2的化合物的方法、使功能化核酸x-r1-r2-a'和共价接头a”-r3-b反应的步骤。或者,摩尔过量的aa”-r3-b可以是约5、10、15、20、25、30、35、40、45、50或100。在多个实施方案中,在低于约7、6、5或4的ph值下进行合成结构1或2的化合物的方法、使功能化的核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。或者,ph可以是约7、6、5或4。在多个实施方案中,在包含水和水可混溶的有机共溶剂的溶液中进行合成结构1或2的化合物的方法、使功能化核酸x-r1-r2-a’和共价接头a”-r3-b反应的步骤。所述水可混溶的有机共溶剂可以包含dmf(二甲基甲酰胺)、nmp(n-甲基-2-吡咯烷酮)、dmso(二甲基亚砜),或乙腈。该水可混溶的有机共溶剂可以包含溶液的约10、15、20、25、30、40或50%v(v/v)。在多个实施方案中,化合物是分离的或基本上纯的。例如,该化合物可以是至少75、80、85、90、95、96、97、98、99或100%纯。在一个实施方案中,该化合物是约85-95%纯。同样地,根据本发明的合成化合物和组合物的方法可以产生至少75、80、85、90、95、96、97、98、99或100%纯的产物。在一个实施方案中,产物是约85-95%纯。制剂可以大于或等于50%纯;优选大于或等于75%纯;更优选大于或等于85%纯;还更优选大于或等于95%纯。如本文所用,术语约根据其近似的通常的含义使用。例如,“约x”包括近似所述的值x,包括在x的值的测量误差内的类似量或与x近似相同的量,并且具有与x基本相同的性质。如本文所用,分离的化合物包括与其他不需要的物质分离的化合物。可以以基本上纯的状态合成分离的化合物或从粗的反应混合物的其他组分中分离该化合物,除了可能残留一定量的杂质,包括剩余量的粗反应混合物的其他组分。类似地,纯的或基本上纯的意思是足够无杂质以允许其预期的用途(例如在药物制剂中或作为随后的化学反应的材料)。x%纯表示通过相关的测量该化合物是整个组合物的x%,其例如可以通过诸如hplc的分析方法测量。二聚化化合物和中间体在多个方面,本发明提供了二聚化的确定的多偶联寡核苷酸。这些化合物包括同型二聚体(例如两个基本上相同的寡核苷酸,例如靶向体内相同的基因)和异源二聚体(例如两个基本上不同的寡核苷酸,例如不同的序列或靶向体内不同的基因)。一方面,本发明提供了根据结构4的分离的化合物:其中:每个都是双链寡核苷酸,其被设计为与体内相同的分子靶标反应,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地为磷酸二酯、硫代磷酸二酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为亲核体和亲电体的反应产物,并且r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构5的分离的化合物:其中:是第一单链寡核苷酸是具有与第一单链寡核苷酸不同序列的第二单链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地是磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物,和r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构6的分离的化合物:其中:是第一双链寡核苷酸是具有与第一双链寡核苷酸不同序列的第二双链寡核苷酸,和●是在其3’或5’末端连接相邻单链寡核苷酸的单链并具有结构-r1-r2-a-r3-a-r2-r1-的共价接头,其中:每个r1独立地是磷酸酯、硫酸酯、酰胺、乙二醇,或不存在;每个r2独立地为c2-c10烷基、烷氧基或芳基,或不存在;每个a独立地为巯基和马来酰亚胺、巯基和乙烯基砜、巯基和吡啶基二硫化物、巯基和碘乙酰胺、巯基和丙烯酸酯、叠氮化物和炔烃或胺和羧基的反应产物,和r3是c2-c10烷基、烷氧基、芳基、烷氧基、烷基二硫基、醚、硫醚、硫代丙酸酯或二硫化物。一方面,本发明提供了根据结构11的分离的化合物:其中:是双链寡核苷酸,是单链寡核苷酸,和●是连接相邻单链寡核苷酸的单链单链的共价接头。在多个方面中,本发明提供了用于合成二聚化的确定的多偶联寡核苷酸的方法。一方面,本发明提供了合成结构5的化合物的方法:其中是第一单链寡核苷酸,是具有与第一单链寡核苷酸不同序列的第二单链寡核苷酸,并且●是在其3’或5’末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括步骤:(i)使第一单链寡核苷酸与双功能连接部分○反应,其中r1是能够在产生单取代产物的条件下与○反应的化学基团;(ii)使与第二单链寡核苷酸反应,其中r2是能够与○反应的化学基团,由此形成该方法可以进一步包括退火互补和以产生结构6的步骤:一方面,本发明提供合成结构4的分离的化合物的方法:其中每个是双链寡核苷酸并且●是在其3'或5'末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)将第一单链寡核苷酸与双官能连接部分○反应,其中r1为能够与○反应的化学基团,由此形成单取代的产物(ii)将与第二单链寡核苷酸反应,其中r2为能够与○反应的化学基团,由此形成单链二聚体(iii)将单链寡核苷酸同时或顺序退火,由此形成一方面,本发明提供合成结构4的分离的化合物的方法:其中每个是双链寡核苷酸并且●是在其3'或5'末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下形成(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成并将与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)将第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并将第一单链寡核苷酸和退火,由此形成(ii)将与第四单链寡核苷酸退火,由此形成该方法可适合于合成根据的分离的化合物,例如通过省略步骤(ii)。一方面,本发明提供合成结构4的分离的化合物的方法:其中每个为双链寡核苷酸并且●是在其3'或5'末端连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成(b)将第三单链寡核苷酸与第四单链寡核苷酸退火,由此形成(c)将和反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成如同根据本发明的其他化合物和组合物,二聚化化合物和中间体可以包括本文包括实施例中所述的任何一种或多种特征。例如,所述化合物可以包括上述的核酸(有或没有修饰)、靶向配体和/或接头中的任何一种或多种、或者概述或实施例中所示的任何特定结构或化学物质。实施例4提供了用于制备二聚化寡核苷酸的示例性方法,并且实施例5提供了用于退火单链寡核苷酸以形成双链寡核苷酸的示例性方法。实施例7提供了用于制备可用于上述合成的各种寡核苷酸前体的示例性方法。实施例8提供了用于制备各种寡核苷酸多聚体的示例性方法,所述寡核苷酸多聚体也可用于上述合成中。实施例9和10中提供了异源二聚体的实例。实施例12-15中提供了同源二聚体的实例。在多个实施方案中,r1、r2和双功能连接部分○可形成本文所述和所示的共价接头●。例如,在多个实施方案中,r1和r2可以各自独立地包含反应部分,例如亲电体或亲核体。在一个实施方案中,r1和r2可以各自独立地选自巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺和羧基。在多个实施方案中,双官能连接部分○包含两个反应部分,所述反应部分可以根据上述步骤(i)和(ii)顺序反应,例如可以与r1和r2中的亲电体/亲核体反应的第二亲电体/亲核体。双功能连接部分的实例包括但不限于dtme、bm(peg)2、bm(peg)3、bmoe、bmh或bmb。这些以及本发明的所有其他合成方法可以进一步包括将靶向配体添加至分子的步骤。实施例6提供了用于添加靶向配体(例如galnac)的示例性方法。添加靶向配体的添加方法是本领域已知的,并且可以由本领域技术人员适用于用于本发明。多聚化(n>2)化合物和中间体在多个方面中,本发明提供了多聚化的(n>2)确定的多偶联寡核苷酸,包括确定的三偶联物和确定的四偶联物。一方面,本发明提供了根据结构7或8的化合物:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m是≥1的整数且n是≥0的整数。一方面,本发明提供根据结构9的化合物且其中n=0:一方面,本发明提供根据结构10的化合物且其中m=1:一方面,本发明提供根据结构12、13、14或15的化合物:其中:每个是双链寡核苷酸,每个是单链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,和m是≥1的整数且n是≥0的整数。在多个方面中,本发明提供合成多聚化的(n>2)确定的多偶联寡核苷酸包括确定的三偶联物和确定的四偶联物的方法。一方面,本发明提供合成根据结构7或8的化合物的方法:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,且m是≥1的整数且n是≥0的整数,所述方法包括以下步骤:(i)通过以下形成(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成并将与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)将第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并将第一单链寡核苷酸和退火,由此形成(ii)将与第二单链二聚体退火,由此形成和任选地,将一个或多个另外的单链二聚体与退火,由此形成,或其中m是≥1的整数并且n是≥0的整数;并且(iii)将第四单链寡核苷酸与步骤(ii)的产物退火,由此形成结构7或8。一方面,本发明提供合成根据结构7或8的化合物的方法:其中:每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,并且m是≥1的整数并且n是≥0的整数,所述方法包括以下步骤:(i)将第一单链寡核苷酸和第一单链二聚体退火,由此形成(ii)将与第二单链二聚体退火,由此形成和任选地,将一个或多个另外的单链二聚体与退火,由此形成,或其中m是≥1的整数并且n是≥0的整数;并且(iii)将第二个单链寡核苷酸与步骤(ii)的产物退火,由此形成结构7或8。一方面,本发明提供用于合成结构9的化合物的方法:(结构9),其中每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下形成(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成并将与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)将第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并将第一单链寡核苷酸和退火,由此形成(ii)将与单链二聚体退火,由此形成和(iii)将与第四单链寡核苷酸退火,由此形成一方面,本发明提供用于合成结构10的化合物的方法:其中每个是双链寡核苷酸,每个●是连接相邻单链寡核苷酸的单链的共价接头,所述方法包括以下步骤:(i)通过以下形成(a)将第一单链寡核苷酸和第二单链寡核苷酸退火,由此形成并将与第三单链寡核苷酸反应,其中r1和r2是能够直接或间接反应以形成共价接头●的化学部分,由此形成或(b)将第二单链寡核苷酸与第三单链寡核苷酸反应,由此形成并将第一单链寡核苷酸和退火,由此形成(ii)将与单链二聚体退火,由此形成(iii)将与第二单链二聚体退火,由此形成和(iv)将与第四单链寡核苷酸退火,由此形成如同根据本发明的其他化合物和组合物,二聚化化合物和中间体可以包括本文包括在实施例中所述的任何一种或多种特征。例如,化合物可以包括上述的核酸(有或没有修饰)、靶向配体和/或接头中的任何一种或多种、或者概述或实施例中所示的任何特定结构或化学成份。实施例7提供了用于制备可用于上述合成的各种寡核苷酸前体的示例性方法。实施例8提供了用于制备各种寡核苷酸多聚体的示例性方法,其也用于上述合成中。在多个实施方案中,r1、r2和双官能连接部分○可形成如本文所述和所示的共价接头●。例如,在多个实施方案中,r1和r2可以各自独立地包含反应部分,例如亲电体或亲核体。在一个实施方案中,r1和r2可以各自独立地选自巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺和羧基。在多个实施方案中,双官能连接部分○包含两个反应部分,所述两个反应部分可以根据上述步骤(i)和(ii)顺序反应,例如可以与r1和r2中的亲电体/亲核体反应的第二亲电体/亲核体。双功能连接部分○的实例包括但不限于dtme、bm(peg)2、bm(peg)3、bmoe、bmh或bmb。在包含两个或更多个共价接头●的多个实施方案中(例如,结构7-16中),接头全部相同。或者,化合物或组合物可以包含两种或更多种不同的共价接头●。在多个实施方案中,每个可独立地包含两个有义或两个反义寡核苷酸。例如,在sirna的情况下,可以包含两条活性链或两条随从链。在多个实施方案中,每个可以独立地包含一个有义寡核苷酸和一个反义寡核苷酸。例如,在sirna的情况下,可以包含一条活性链和一条随从链。在多个实施方案中,化合物或组合物包含基本上相同的双链寡核苷酸的同源多聚体。基本相同的双链寡核苷酸可各自包含靶向体内相同分子靶标的sirna。在多个实施方案中,所述化合物或组合物包含两种或更多种基本不同的双链寡核苷酸的异源多聚体。基本不同的双链寡核苷酸可各自包含靶向不同基因的sirna。在多个实施方案中,化合物包含结构9且n=0:该化合物可以进一步包含靶向配体。该化合物可以进一步包含2或3个基本上不同的双链寡核苷酸其各自包含靶向体内不同分子靶标的sirna。所述化合物可以进一步包含靶向配体,一个包含靶向因子vii的第一sirna引导链和与所述引导链杂交的第一随从链,一个包含靶向载脂蛋白b的第二sirna引导链和与所述第二引导链杂交的第二随从链,并且一个包含靶向ttr的第三sirna引导链和与所述第三引导链杂交的第三随从链。靶向配体可以包含n-乙酰半乳糖胺(galnac)。实施例17、18和20中提供了三聚体的实例。在多个实施方案中,化合物包含结构10并且m=1:该化合物可以进一步包含靶向配体。该化合物可进一步包含2、3或4种基本上不同的双链寡核苷酸其各自包含靶向体内不同分子靶标的sirna。所述化合物可以进一步包含靶向配体,一个包含靶向因子vii的第一sirna引导链和与所述引导链杂交的第一随从链,一个包含靶向载脂蛋白b的第二sirna引导链和与所述第二引导剂杂交的第二随从链,并且一个包含靶向ttr的第三sirna引导链和与所述第三引导链杂交的第三随从链。靶向配体可以包含n-乙酰半乳糖胺(galnac)。实施例21中提供了四聚体的实例。在多个实施方案中,每个双链寡核苷酸(例如例如在结构4中)包含靶向因子vii的sirna引导链和与所述引导链杂交的随从链。在多个实施方案中,(例如,在结构4中),所述化合物还包含靶向配体,每个双链寡核苷酸(例如,)包含sirna引导链和与所述引导链杂交的随从链,并且所述化合物为至少75、80、85、90、95、96、97、98、99或100%纯。在多个实施方案中,至少一个双链寡核苷酸(例如,例如在结构6中)包含靶向因子vii的第一sirna引导链和与所述引导链杂交的第一随从链,并且至少一个双链寡核苷酸(例如,例如在结构6中)包含靶向载脂蛋白b的第二sirna引导链和与所述第二引导链杂交的第二随从链。有义-反义多聚化化合物在多个方面中,本发明提供了有义-反义多偶联寡核苷酸以及它们的合成方法。一方面,本发明提供了包含多个分子的组合物,每个分子具有结构16:其中n是≥1的整数;每个是单链寡核苷酸;每个是与杂交的单链寡核苷酸;是双链寡核苷酸;和每个●是连接相邻单链寡核苷酸的单链的共价接头。类似地,本发明提供了用于合成包含多个分子的组合物的方法,每个分子具有结构16,所述方法包括:(i)使第一单链寡核苷酸与双功能连接部分○反应,其中r1是能够在产生单取代产物的条件下与○反应的化学基团;(ii)使与第二单链寡核苷酸反应,其中r2是能够与○反应的化学基团,由此形成和(iii)退火多个由此形成包含多个分子的组合物,每个分子具有结构16。如同根据本发明的其他化合物和组合物,根据结构16的分子可以包括本文包括在实施例中所述的任何一种或多种特征。例如,所述化合物可以包括上述的核酸(有或没有修饰)、靶向配体和/或接头中的任何一种或多种、或者概述或实施例中所示的任何特定结构或化学物质。例如,在多个实施方案中,每个具有15-30个碱基对的长度;每个是sirna;和/或n是1至100的整数。虽然结构16的具体实例显示为sirna,但结构不一定限于sirna。在多个实施方案中,r1、r2和双功能连接部分○可形成本文所述和所示的共价接头●。例如,在多个实施方案中,r1和r2可以各自独立地包含反应部分,例如亲电体或亲核体。在一个实施方案中,r1和r2可以各自独立地选自巯基、马来酰亚胺、乙烯基砜、吡啶基二硫化物、碘乙酰胺、丙烯酸酯、叠氮化物、炔烃、胺和羧基。在多个实施方案中,双官能连接部分○包含两个反应部分,所述两个反应部分可以根据上述步骤(i)和(ii)顺序反应,例如可以与r1和r2中的亲电体/亲核体反应的第二亲电体/亲核体。双功能连接部分○的实例包括但不限于dtme、bm(peg)2、bm(peg)3、bmoe、bmh或bmb。在一个实施方案中,每个双链寡核苷酸具有基本相同的序列。在其他实施方案中,双链寡核苷酸可以改变。例如,每个都可以是具有相同靶标的sirna活性链,并且每个可以是与至少约80、85、90或95%互补的sirna随从链(例如,的序列可以改变,只要其与杂交)。多聚化化合物的退火条件在多个方面,本发明提供了用于合成多偶联寡核苷酸的方法。一方面,本发明提供了用于合成包含多个含有结构17的分子的组合物的方法:其中n是≥1的整数;每个是单链寡核苷酸;每个是与杂交的单链寡核苷酸;是双链寡核苷酸;并且每个●是连接相邻单链寡核苷酸的单链以形成和的共价接头,所述方法包括以下步骤:在以下条件下将多个和退火:(i)对于和的约200-300μm的总寡核苷酸浓度;(ii)约0.1-0.3x磷酸盐缓冲盐水(pbs),和(iii)在约70-80℃至约20-30℃的温度下持续约1.5-2.5小时。在多个实施方案中,所述方法进一步包括退火多个和/或由此形成多个分子的步骤,所述分子包含结构18:和/或在多个实施方案中,所述方法进一步包括将与多个多个和退火。在多个实施方案中,与的摩尔比为约5:100、10:100、20:100、30:100、40:100或50:100。在多个实施方案中,所述方法进一步包括将与多个多个和退火。在多个实施方案中,与的摩尔比约为5:100、10:100、20:100、30:100、40:100或50:100。在多个实施方案中,和的摩尔比为约1:1。在多个实施方案中,与的摩尔比或者与的摩尔比为约100:90、100:80、100:75、100:70或100:60。在多个实施方案中,每个具有15-30个碱基对的长度。在多个实施方案中,每个是sirna。在多个实施方案中,每个包含靶向因子vii的sirna引导链和与所述引导链杂交的随从链。在多个实施方案中,n是1至100的整数。在多个实施方案中,●是可切割的或不可切割的接头。在多个实施方案中,该方法进一步包括在纳米颗粒中配制多个包含结构17、18、19和/或20的分子。如同根据本发明的其他化合物和组合物,多聚化化合物和中间体可以包括本文所述的任何一种或多种特征(包括方法步骤和包括在实施例中)。例如,所述化合物可以包括上述的核酸(有或没有修饰)、靶向配体和/或接头中的任何一种或多种、或者概述或实施例中所示的任何特定结构或化学物质。实施例22-24说明多聚寡核苷酸的示例性实施方案。药物组合物在多个方面中,本发明提供了包含上述任何一种或多种化合物或组合物的药物组合物。如本文所用,药物组合物包括可用于预防、诊断、缓解、治疗或治愈疾病的除食物以外的物质的组合物。类似地,根据本发明的各种化合物或组合物应被理解为包括用作药物和/或用于制造药物的实施方案。药物组合物可以包括根据本发明的化合物或组合物和药学上可接受的赋形剂。如本文所用,赋形剂可以是与活性成分一起配制的天然或合成物质。为了长期稳定、增加体积(例如填充剂、填料或稀释剂)、或赋予最终剂型中的活性成分治疗增强(例如促进药物吸收、减少粘度或提高溶解度)的目的,可以包括赋形剂。赋形剂也可以是有用的制造和分配,例如以有助于处理活性成分和/或有助于体外稳定性(例如通过防止变性或聚集)。如本领域技术人员将理解的,适当的赋形剂选择可以取决于各种因素,包括施用途径、剂型和活性成分。寡核苷酸可以局部或全身性递送,并且本发明的药物组合物可以相应地改变。例如,施用不一定限于任何特定的递送系统,并且可以包括但不限于肠胃外(包括皮下、静脉内、髓内、关节内、肌内或腹膜内注射)、直肠、局部、经皮或口服。对个体施用可以以单次剂量或重复施用进行,和以各种生理上可接受的盐形式中的任一种进行,和/或与作为药物组合物的一部分可接受的药物载体和/或添加剂进行。生理上可接受的制剂和标准药物制剂技术、剂量和赋形剂为本领域技术人员所熟知(参见,例如physicians’deskreference2005第59版,medicaleconomicscompany,2004;以及remington:thescienceandpracticeofpharmacy,gennadoetal.,第21版,lippincott,williams&wilkins,2005)。药物组合物可以包含有效量的根据本发明的化合物或组合物。如本文所用,有效量可以是导致实现具体的规定目的的浓度或量,或者更多的量是指例如与安慰剂相比足以引起改变的量。当有效量为治疗有效量时,其可以是适合治疗用途的量,例如足以预防、诊断、缓解、治疗或治愈疾病的量。有效量可以通过本领域已知的方法确定。有效量可以凭经验确定,例如通过人类临床试验来确定。也可以使用本领域已知的转换因子从一种动物(例如小鼠、大鼠、猴、猪、狗)中外推有效量来用于另一种动物(例如人)。参见例如freireichetal.,cancerchemotherreports50(4):219-244(1966)。递送载体和靶向配体在多个方面中,本发明提供了在递送运载体中配制的上述化合物或组合物的任何一种或多种。例如,递送载体可以是脂质纳米颗粒(lnp)、外来体、微泡或病毒载体。类似地,在多个方面,本发明提供了上述化合物或组合物的任何一种或多种,并且还包括靶向配体。例如,靶向配体包含n-乙酰半乳糖胺(galnac)、胆固醇、生育酚、叶酸、2-[3-(1,3-二羧基丙基)-脲基]戊二酸(dupa)或茴香酰胺。靶向配体可以与核酸结合(例如直接),例如通过其3’或5’末端。以下讨论可以适用于本发明的其他实例。如本领域技术人员将理解的,无论生物学靶标或作用机制如何,治疗性寡核苷酸都必须克服一系列生理障碍以进入生物体(例如动物,例如人,其需要治疗)的靶细胞中。例如,治疗性寡核苷酸通常必须避免在血流中被清除,进入靶细胞类型,然后进入细胞质,而都不引起不希望的免疫应答。这一过程通常被认为是低效的,例如在体内95%或更多的进入核内体的sirna可能在溶酶体中被降解或被排出细胞而不产生任何基因沉默。为了克服这些障碍,科学家已经设计了许多药物递送载体。除了小分子药物、蛋白质药物和其他治疗分子之外,这些载体已被用于递送治疗性rna。已经从多种物质如糖、脂质、脂质样物质、蛋白质、聚合物、肽、金属、水凝胶、缀合物和肽制成药物递送载体。许多药物递送载体整合了来自这些组的组合的方面,例如,一些药物递送载体可以组合糖和脂质。在其他一些例子中,药物可以直接隐藏在意在模仿细胞的“细胞样”材料中,而在其他情况下,药物可以进入细胞自身内部或放在细胞自身上。药物递送载体可被设计为响应于刺激诸如ph变化、生物分子浓度、磁场和热来释放药物。许多工作集中于将诸如sirna的寡核苷酸递送至肝脏。在过去十年中,有效的sirna向体内肝细胞递送所需的剂量已经降低超过10,000倍——而在2006年报道的递送载体可能需要超过10mg/kg的sirna来靶向蛋白质生产,新的递送载体靶向蛋白质生产现在可以在全身注射0.001mg/kg的sirna后减少。寡核苷酸递送效率的提高可以至少部分归因于递送载体的发展。另一个重要的进步是对辅助组分影响递送的方式的理解增加。辅助组分可以包括添加到初始药物递送系统的化学结构。通常,辅助组分可以改善颗粒稳定性或递送至特定器官。例如,纳米颗粒可以由脂质制成,但是由这些脂质纳米颗粒介导的递送可能会受到亲水性聚合物和/或疏水性分子存在的影响。影响纳米颗粒递送的一种重要的亲水性聚合物是聚(乙二醇)。其他亲水聚合物包括非离子表面活性剂。影响纳米颗粒递送的疏水性分子包括胆固醇、1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc)、1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma)、1,2-二油酰-3-三甲基铵-丙烷(dotap)等。还使用靶向配体或缀合物系统设计了药物递送系统。例如,可将寡核苷酸缀合至胆固醇、糖、肽和其他核酸,以促进递送至肝细胞和/或其他细胞类型。本领域技术人员将会理解,已知的递送载体和靶向配体通常可以适合于根据本发明的使用。递送载体和靶向配体的实例及其用途可见于:sahay,g.,etal.efficiencyofsirnadeliverybylipidnanoparticlesislimitedbyendocyticrecycling.natbiotechnol,31:653-658(2013);wittrup,a.,etal.visualizinglipid-formulatedsirnareleasefromendosomesandtargetgeneknockdown.natbiotechnol(2015);whitehead,k.a.,langer,r.&anderson,d.g.knockingdownbarriers:advancesinsirnadelivery.naturereviews.drugdiscovery,8:129-138(2009);kanasty,r.,dorkin,j.r.,vegas,a.&anderson,d.deliverymaterialsforsirnatherapeutics.naturematerials,12:967-977(2013);tibbitt,m.w.,dahlman,j.e.&langer,r.emergingfrontiersindrugdelivery.jamchemsoc,138:704-717(2016);akinc,a.,etal.targeteddeliveryofrnaitherapeuticswithendogenousandexogenousligand-basedmechanisms.moleculartherapy:thejournaloftheamericansocietyofgenetherapy18,1357-1364(2010);nair,j.k.,etal.multivalentn-acetylgalactosamine-conjugatedsirnalocalizesinhepatocytesandelicitsrobustrnai-mediatedgenesilencing.jamchemsoc,136:16958-16961(2014);ostergaard,m.e.,etal.efficientsynthesisandbiologicalevaluationof5’-galnacconjugatedantisenseoligonucleotides.bioconjugatechemistry(2015);sehgal,a.,etal.anrnaitherapeutictargetingantithrombintorebalancethecoagulationsystemandpromotehemostasisinhemophilia.naturemedicine,21:492-497(2015);semple,s.c.,etal.rationaldesignofcationiclipidsforsirnadelivery.natbiotechnol,28:172-176(2010);maier,m.a.,etal.biodegradablelipidsenablingrapidlyeliminatedlipidnanoparticlesforsystemicdeliveryofrnaitherapeutics.moleculartherapy:thejournaloftheamericansocietyofgenetherapy,21:1570-1578(2013);love,k.t.,etal.lipid-likematerialsforlow-dose,invivogenesilencing.procnatacadusa,107:1864-1869(2010);akinc,a.,etal.acombinatoriallibraryoflipid-likematerialsfordeliveryofrnaitherapeutics.natbiotechnol,26:561-569(2008);eguchi,a.,etal.efficientsirnadeliveryintoprimarycellsbyapeptidetransductiondomain-dsrnabindingdomainfusionprotein.natbiotechnol,27:567-571(2009);zuckerman,j.e.,etal.correlatinganimalandhumanphaseia/ibclinicaldatawithcalaa-01,atargeted,polymer-basednanoparticlecontainingsirna.procnatacadusa,111:11449-11454(2014);zuckerman,j.e.&davis,m.e.clinicalexperienceswithsystemicallyadministeredsirna-basedtherapeuticsincancer.naturereviews.drugdiscovery,14:843-856(2015);hao,j.,etal.rapidsynthesisofalipocationicpolyesterlibraryviaring-openingpolymerizationoffunctionalvalerolactonesforefficacioussirnadelivery.jamchemsoc,29:9206-9209(2015);siegwart,d.j.,etal.combinatorialsynthesisofchemicallydiversecore-shellnanoparticlesforintracellulardelivery.procnatacadusa,108:12996-13001(2011);dahlman,j.e.,etal.invivoendothelialsirnadeliveryusingpolymericnanoparticleswithlowmolecularweight.natnano9,648-655(2014);soppimath,k.s.,aminabhavi,t.m.,kulkarni,a.r.&rudzinski,w.e.biodegradablepolymericnanoparticlesasdrugdeliverydevices.journalofcontrolledrelease:officialjournalofthecontrolledreleasesociety70,1-20(2001);kim,h.j.,etal.preciseengineeringofsirnadeliveryvehiclestotumorsusingpolyioncomplexesandgoldnanoparticles.acsnano,8:8979-8991(2014);krebs,m.d.,jeon,o.&alsberg,e.localizedandsustaineddeliveryofsilencingrnafrommacroscopicbiopolymerhydrogels.jamchemsoc131,9204-9206(2009);zimmermann,t.s.,etal.rnai-mediatedgenesilencinginnon-humanprimates.nature,441:111-114(2006);dong,y.,etal.lipopeptidenanoparticlesforpotentandselectivesirnadeliveryinrodentsandnonhumanprimates.procnatacadusa,111:3955-3960(2014);zhang,y.,etal.lipid-modifiedaminoglycosidederivativesforinvivosirnadelivery.advancedmaterials,25:4641-4645(2013);molinaro,r.,etal.biomimeticproteolipidvesiclesfortargetinginflamedtissues.natmater(2016);hu,c.m.,etal.nanoparticlebiointerfacingbyplateletmembranecloaking.nature,526:118-121(2015);cheng,r.,meng,f.,deng,c.,klok,h.-a.&zhong,z.dualandmulti-stimuliresponsivepolymericnanoparticlesforprogrammedsite-specificdrugdelivery.biomaterials,34:3647-3657(2013);qiu,y.&park,k.environment-sensitivehydrogelsfordrugdelivery.advanceddrugdeliveryreviews,64,supplement,49-60(2012);mui,b.l.,etal.influenceofpolyethyleneglycollipiddesorptionratesonpharmacokineticsandpharmacodynamicsofsirnalipidnanoparticles.molthernucleicacids2,e139(2013);draz,m.s.,etal.nanoparticle-mediatedsystemicdeliveryofsirnafortreatmentofcancersandviralinfections.theranostics,4:872-892(2014);otsuka,h.,nagasaki,y.&kataoka,k.pegylatednanoparticlesforbiologicalandpharmaceuticalapplications.advanceddrugdeliveryreviews,55:403-419(2003);kauffman,k.j.,etal.optimizationoflipidnanoparticleformulationsformrnadeliveryinvivowithfractionalfactorialanddefinitivescreeningdesigns.nanoletters,15:7300-7306(2015);zhang,s.,zhao,b.,jiang,h.,wang,b.&ma,b.cationiclipidsandpolymersmediatedvectorsfordeliveryofsirna.journalofcontrolledrelease123,1-10(2007);illum,l.&davis,s.s.theorganuptakeofintravenouslyadministeredcolloidalparticlescanbealteredusinganon-ionicsurfactant(poloxamer338).febsletters,167:79-82(1984);felgner,p.l.,etal.improvedcationiclipidformulationsforinvivogenetherapy.annalsofthenewyorkacademyofsciences,772:126-139(1995);meade,b.r.&dowdy,s.f.exogenoussirnadeliveryusingpeptidetransductiondomains/cellpenetratingpeptides.advanceddrugdeliveryreviews,59:134-140(2007);endoh,t.&ohtsuki,t.cellularsirnadeliveryusingcell-penetratingpeptidesmodifiedforendosomalescape.advanceddrugdeliveryreviews,61:704-709(2009);和lee,h.,etal.molecularlyself-assemblednucleicacidnanoparticlesfortargetedinvivosirnadelivery.natnano,7:389-393(2012)。在多个实施方案中,本发明的化合物和组合物可以缀合至其他化学部分或生物部分(包括例如生物活性部分)或与其一同递送。生物活性部分是具有生物效应,优选可测量的生物效应的任何分子或试剂。化学或生物部分包括例如蛋白质、肽、氨基酸、核酸(包括例如所有类型的dna、rna,rna和dna适体,反义寡核苷酸,和反义mirna抑制剂)、靶向配体、碳水化合物、多糖、脂质、有机化合物和无机化合物。如本文所用,术语靶向配体可以包括这样的部分,可以使所述部分在纳米颗粒的表面上或者作为递送缀合物的一部分可接近,其用于将纳米颗粒或递送缀合物的有效载荷递送至特定靶标(例如特定的身体组织或细胞类型)的目的,例如通过使得纳米颗粒或递送缀合物能够与细胞受体连接。合适的靶向配体的实例包括但不限于细胞特异性肽或蛋白质(例如,例如转铁蛋白和单克隆抗体)、适体、细胞生长因子、维生素(例如叶酸)、单糖(例如半乳糖和甘露糖)、多糖、精氨酸-甘氨酸-天冬氨酸(rgd)和衍生自n-乙酰半乳糖胺(galnac)的去唾液酸糖蛋白受体配体。配体可以使用本领域已知的多种技术例如通过共价键如二硫键、酰胺键或酯键、或者通过非共价键诸如生物素-链霉抗生物素蛋白或金属-配体络合物整合到本发明的前述化合物中。在本发明范围内的另外的生物活性部分是任何已知的基因编辑材料,包括例如涉及crispr/cas系统、tales、talens和锌指的材料例如寡核苷酸、多肽和蛋白质。在多个实施方案中,本发明的化合物和组合物可以被包封在载体材料中以形成用于细胞内递送的纳米颗粒。已知的载体材料包括阳离子聚合物、脂质或肽或其化学类似物。jeongetal.,bioconjugatechem.,vol.20,no.1,pp.5-14(2009)。阳离子脂质的实例包括二油基磷脂酰乙醇胺、胆固醇二油基磷脂酰胆碱、n-[1-(2,3-二油酰氧基)丙基]-n,n,n--三甲基氯化铵(dotma)、1,2-二油酰氧基-3-(三甲基铵)丙烷(dotap)、1,2-二油酰基-3-(4’-三甲基-铵)丁酰基-sn-甘油(dotb)、1,2-二酰基-3-二甲基铵-丙烷(dap)、1,2-二酰基-3-三甲基铵-丙烷(tap)、1,2-二酰基-sn-甘油-3-乙基磷酸胆碱、3β-[n-(n’,n’-二甲基氨基乙烷)-氨基甲酰基]胆固醇(dc-胆固醇)、二甲基双十八烷基溴化铵(ddab)及其共聚物。阳离子聚合物的实例包括聚乙烯亚胺、聚胺、聚乙烯胺、聚(烷基胺盐酸盐)、聚酰胺胺树枝状聚合物、二乙基氨基乙基-葡聚糖、聚乙烯吡咯烷酮、几丁质、壳聚糖和聚(2-二甲基氨基)甲基丙烯酸乙酯。在一个实施方案中,载体含有一种或多种酰化胺,与其他已知的载体材料相比,其性质可以更适合于体内使用。在一个实施方案中,载体是阳离子肽,例如kala(阳离子融合肽)、聚赖氨酸、聚谷氨酸或鱼精蛋白。在一个实施方案中,载体是阳离子脂质,例如二油酰磷脂酰乙醇胺或胆固醇二油酰磷脂酰胆碱。在一个实施方案中,载体是阳离子聚合物,例如聚乙烯亚胺、聚胺或聚乙烯胺。在多个实施方案中,本发明的化合物和组合物可以包封在外来体中。外来体是存在于生物流体(包括血液、尿液和细胞培养物的培养基)中的直径为30至100nm的细胞来源的囊泡。根据本领域的技术,外来体,包括合成外来体和外来体模拟物可以适用于药物递送。参见例如“acomprehensiveoverviewofexosomesasdrugdeliveryvehicles-endogenousnanocarriersfortargetedcancertherapy”biochimbiophysacta.1846(1):75-87(2014);“exosomesastherapeuticdrugcarriersanddeliveryvehiclesacrossbiologicalmembranes:currentperspectivesandfuturechallenges”actapharmaceuticasinicab,availableonline8march2016(inpress)和“exosomemimetics:anovelclassofdrugdeliverysystems”internationaljournalofnanomedicine,7:1525-1541(2012)。在多个实施方案中,本发明的化合物和组合物可以包封在微泡中。微泡(有时称为循环微泡或微粒)是从几乎所有细胞类型脱落的范围从100nm到1000nm的质膜碎片,并且不同于称为外来体的较小的细胞内产生的胞外囊泡。微泡在细胞间通讯中起作用并可以在细胞之间转运mrna、mirna和蛋白质。根据本领域的技术,微泡包括合成微泡和微泡模拟物可以适用于药物递送。参见例如“microvesicle-andexosome-mediateddrugdeliveryenhancesthecytotoxicityofpaclitaxelinautologousprostatecancercells”journalofcontrolledrelease,220:727-737(2015);“therapeuticusesofexosomes”jcircbiomark,1:0(2013)。在多个实施方案中,本发明的化合物和组合物可以使用病毒载体递送。病毒载体是分子生物学家通常用于将遗传物质递送到细胞中的工具。该过程可以在活生物内(体内)或在细胞培养中(体外)进行。根据本领域的技术,病毒载体可以适用于药物递送。参见例如,“virusesasnanomaterialsfordrugdelivery”methodsmolbiol,26:207-21(2011);“viralandnonviraldeliverysystemsforgenedelivery”advbiomedres,1:27(2012)和“biologicalgenedeliveryvehicles:beyondviralvectors”moleculartherapy,17(5):767-777(2009)。在下面的实施例中提供了用于lnp配制和表征的一般程序,作为lnp配制以及其他体外和体内测试的工作实施例。其他方法在本领域中是已知的,并且可以由普通技术人员适用于本发明。治疗,减少基因表达的方法在多个方面中,本发明提供了使用多偶联寡核苷酸的方法,例如用于医学治疗、研究或用于在动物和植物中产生新的或改变的表型。一方面,本发明提供了用于治疗受试者的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者。在此类治疗性实施方案中,寡核苷酸将是治疗性寡核苷酸,例如sirna或mirna。在这个和其他实施方案中,本发明的组合物和化合物可以以药物组合物的形式、在递送载体中或者与靶向配体偶联来施用。一方面,本发明提供了沉默或降低基因表达的方法,其包括将有效量的根据本发明的化合物或组合物施用于有需要的受试者。在此类治疗性实施方案中,寡核苷酸将是沉默或降低基因表达的寡核苷酸,例如sirna或反义寡核苷酸。类似地,本发明提供了沉默或降低两个或更多个基因的表达的方法,其包括将有效量的本发明的化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含靶向两个或更多个基因的寡核苷酸。化合物或组合物可以包含靶向两个、三个、四个或更多个基因的寡核苷酸。一方面,本发明提供了每个靶向配体结合事件将两种或更多种寡核苷酸递送至细胞的方法,其包括将有效量的本发明的化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含靶向配体。一方面,本发明提供了将预定的化学计量比的两种或更多种寡核苷酸递送至细胞的方法,其包括将有效量的本发明的化合物或组合物施用于有需要的受试者,其中所述化合物或组合物包含预定化学计量比的两种或更多种寡核苷酸。如本文所用,受试者包括经受治疗或施用的细胞或生物体。受试者可以是动物,例如哺乳动物,如实验室动物(小鼠、猴)或兽医患者、或灵长类动物如人。不受限制地,需要治疗或施用的受试者可以包括患有疾病(例如,可以使用本发明的化合物和组合物治疗的疾病)的受试者或具有病况(例如,可以使用本发明的化合物和组合物解决的病况,例如将一种或多种基因沉默或将其表达降低)的受试者。测量基因敲低和动物实验的一般程序在下面的实施例中提供,作为其他体外和体内测试的工作实施例。其他方法在本领域中是已知的,并且可以由普通技术人员适用于本发明。以下实施例是说明性的而非限制性的。在阅读本公开内容后,技术的许多变化对于本领域技术人员将变得显而易见。因此,技术的范围不应该参照实施例来确定,而应该参照所附权利要求以及其等同方案的全部范围来确定。实施例一般程序:单链寡核苷酸合成使用亚磷酰胺化学,在abi394和3900合成仪(appliedbiosystems)上以10μmol级组装寡核糖核苷酸,或在oligopilot10合成仪上以28μmol级组装寡核糖核苷酸。固体支持物是装载有2’-脱氧胸苷的聚苯乙烯(glenresearch,sterling,virginia,usa)或可控多孔玻璃(cpg,具有75μmol/g的装载,其从primesynthesis,aston,pa,usa获得)。从safcproligo(hamburg,germany)获得辅助合成试剂dna-、2’-o-甲基rna-和2’-脱氧-2’-氟-rna亚磷酰胺。具体地说,2’-o-甲基-尿苷(2’-ome-u)、4-n-乙酰基-2’-o-甲基-胞苷(2’-ome-cac)、6-n-苯甲酰-2’-o-甲基-腺苷(2’-ome-abz)和2-n-异丁基鸟苷(2’-ome-gibu)的(4,4’-二甲氧三苯甲基)-3’-o-(2-cyanoethyl-n,n-二异丙基)亚磷酰胺单体用于构建寡聚体序列。使用携带与2’-omerna构件相同的核碱基保护基团的相应亚磷酰胺引入2’-氟修饰。所有亚磷酰胺(在乙腈中为70mm)的偶联时间为3分钟,其使用5-乙硫基-1h-四唑(ett,在乙腈中为0.5m)作为活化剂。使用吡啶和乙腈的1:1(v/v)混合物中的50mm3-((二甲基氨基-亚甲基)氨基)-3h-1,2,4-二噻唑-3-硫酮(ddtt,amchemicals,oceanside,california,usa)引入硫代磷酸连接。在完成包括去除dmt基团的固相合成(“dmt去除合成”)后,将寡核苷酸从固体支持物上切下,并根据公开的方法(wincott,f.etal:synthesis,deprotection,analysisandpurificationofrnaandribozymes.nucleicacidsres,23:2677-2684(1995),使用由甲胺水溶液(41%)和浓缩的氨水(32%)组成的1:1混合物在25℃下脱保护3小时。随后,使用填充有sourceq15(gehealthcare)的柱和aktaexplorer系统(gehealthcare)通过阴离子交换hplc来纯化粗制寡聚物。缓冲液a是在20%乙腈水溶液中的10mm高氯酸钠、20mmtris、1mmedta,ph7.4(fluka,buchs,switzerland),并且缓冲液b与缓冲液a相同,具有500mm高氯酸钠。采用32个柱体积(cv)内22%b至42%b的梯度。记录280nm处的uv轨迹。合并适当的级分并用3mnaoac(ph=5.2)和70%乙醇沉淀。通过离心收集沉淀物。或者,根据制造商的建议使用sephadexhiprep柱(gehealthcare)进行脱盐。寡核苷酸在水中重建,并通过电喷雾电离质谱(esi-ms)证实寡核苷酸。通过分析型阴离子交换hplc评估纯度。一般程序:脂质纳米粒子制剂1,2-二硬脂酰-3-磷脂酰胆碱(dspc)购自avantipolarlipids(alabaster,alabama,usa)。从nof(bouwelven,belgium)获得α-[3’-(1,2-二肉豆蔻酰基-3-丙氧基)-氨甲酰-丙基]-ω-甲氧基-聚氧乙烯(peg-c-domg)。胆固醇购自sigma-aldrich(taufkirchen,germany)。在专利文献(constienetal.“novellipidsandcompositionsforintracellulardeliveryofbiologicallyactivecompounds”us2012/0295832a1)中公开了专有氨基脂kl22和kl52。在乙醇中以50mm的浓度制备kl52和kl22脂质、dspc、胆固醇和peg-c-domg的储备溶液并储存在-20℃。将脂质组合以产生多种摩尔比(参见下面的各个实施例)并用乙醇稀释至最终25mm的脂质浓度。在50mm柠檬酸钠缓冲液(ph3)中稀释在h2o中浓度为10mg/ml的sirna储备溶液。在下面的实施例中,kl22和kl52有时分别被称为xl7和xl10。通过将脂质溶液与sirna溶液以7:1的总脂质与sirna重量比组合来制备脂质纳米颗粒(lnp)制剂。将脂质乙醇溶液快速注射到sirna水溶液中以提供含有33%乙醇的悬浮液。通过注射器泵(harvardpump33dualsyringepumpharvardapparatusholliston,ma)注射溶液。随后,使用slide-a-lyzer盒(thermofisherscientificinc.rockford,il),利用10kd的mwco(rc膜)将制剂针对初级产品的200倍体积的磷酸盐缓冲盐溶液(pbs,ph7.4)透析2次以去除乙醇并实现缓冲液交换。第一次透析在室温下进行3小时,然后将制剂在4℃透析过夜。得到的纳米颗粒悬浮液通过0.2μm无菌过滤器(sarstedt,nümbrecht,germany)过滤到玻璃瓶中并用卷边封口进行密封。一般程序:lnp表征使用zetasizernanozs(malverninstrumentsltd,malvern,worcestershire,uk)分别在1xpbs和15mmpbs中测定制剂的颗粒大小和ζ电位。通过uv-vis测量脂质体制剂中的sirna浓度。简而言之,将100μl在1xpbs中的稀释的制剂加入到900μl的甲醇和氯仿的4:1(v/v)混合物中。混合后,在du800分光光度计(beckmancoulter,beckmancoulter,inc.,brea,ca)上记录溶液在230nm和330nm之间的吸收光谱。基于制剂中使用的sirna的消光系数和260nm波长处的吸光度与330nm波长处的基线值之间的差异来计算脂质体制剂中的sirna浓度。通过quant-ittmrna测定(invitrogencorporationcarlsbad,ca)评估纳米颗粒对sirna的包封。简而言之,将样品在te缓冲液(10mmtris-hcl,1mmedta,ph7.5)中稀释至约5μg/ml的浓度。将50μl稀释的样品转移至聚苯乙烯96孔板,然后加入50μl的te缓冲液或50μl的2%tritonx-100溶液。平板在37℃的温度下温育15分钟。将ribogreen试剂在te缓冲液中1:100稀释,将100μl该溶液加入到每个孔中。使用荧光板读数器(wallacvictor1420multilabelcounter;perkinelmer,waltham,ma)在~480nm的激发波长和~520nm的发射波长下测量荧光强度。从每个样品的荧光值减去试剂空白的荧光值,并通过将完整样品(不添加tritonx-100)的荧光强度除以断裂的样品(因添加了tritonx-100引起)的荧光值来测定游离sirna的百分比。一般程序:动物实验小鼠品系c57bl/6n用于所有体内实验。动物从charlesriver(sulzfeld,germany)获得,并且在实验时为6-8周龄。通过将200μl输注到尾静脉来注射静脉内施用的lnp制剂。以100-200μl的体积注射皮下施用的化合物。在注射前一天(“预采血”)和在注射后的实验期间,在指示的时间通过颌下静脉放血来收集血液。用血清分离管(greinerbio-one,frickenhausen,germany)分离血清并保持冷冻直至分析。化合物施用后7天,通过co2吸入麻醉小鼠并通过颈椎脱臼杀死小鼠。如上所述通过心脏穿刺收集血液并分离血清。收集用于mrna定量的组织并立即在液氮中快速冷冻。一般程序:基因敲低的测量使用以下方法实现对血清蛋白质水平的测定:使用显色酶活性测定法biophenfvii(#221304,hyphenbiomed,mariaenzersdorf,austria)按照制造商的建议分析因子vii。分析前将小鼠血清以1:3000稀释。使用victor3多标记计数器(perkinelmer,wiesbaden,germany)测量405nm处的比色显色的吸光度。通过elisa(cloudclonecorp./hoelzeldiagnostics,cologne,germany,#sec003mu)测量血清中的apob蛋白。根据制造商的说明处理小鼠血清的1:5000稀释液,并使用victor3多标记计数器(perkinelmer,wiesbaden,germany)测量450nm处的吸光度。通过elisa(#ka2070,novusbiologicals,/biotechne,wiesbaden,germany)测量血清中的转甲状腺素蛋白(transthyretin)(ttr,也称为前白蛋白)蛋白。根据制造商的说明处理小鼠血清的1:4000稀释液,并使用victor3多标记计数器(perkinelmer,wiesbaden,germany)测量450nm处的吸光度。为了定量mrna水平,将冰冻的组织块(30-50mg)转移到冷冻的1.5ml反应管中。加入含有3,3μl/μl蛋白酶k(50μg/μl)(epicentrebiotechnologies,madison,usa)的1ml裂解混合物(epicentrebiotechnologies,madison,usa),并使用超声波破碎仪(hd2070,bandelin,berlin,germany)通过超声裂解组织数秒,并在65℃下在thermomixer(thermomixercomfort,eppendorf,hamburg,germany)中用蛋白酶k消化30分钟。将裂解物储存在-80℃直到分析。对于mrna分析,将裂解物解冻并且使用quantigene1.0(fvii、apob和gapdh)或quantigene2.0(ttr)分支dna(bdna)测定试剂盒(panomics,fremont,ca,usa,目录号:qg0004)根据制造商的建议定量mrna水平。作为测定读出,化学发光信号在victor2light发光计数器(perkinelmer,wiesbaden,germany)中以相对光单位(rlu)测量。将相应mrna的信号除以来自相同裂解物的gapdhmrna的信号。将值报告为针对gapdh归一化的mrna表达。实施例1:巯基封端的sirna的产生如果需要,通过1-o-二甲氧基三苯甲基-己基-二硫化物,1’-[(2-氰乙基)-(n,n-二异丙基)]-亚磷酰胺接头(nucleosyn,olivetcedex,france)引入3’-或5’-末端巯基。在完成固相合成并最终除去dmt基团(“dmt脱落合成”)后,将寡核苷酸从固体支持物上切下,并使用由甲胺水溶液(41%)和浓缩的氨水(32%)组成的1:1混合物在10℃下脱保护6小时。随后,在aktaexplorer系统(gehealthcare,freiburg,germany)上通过阴离子交换高效液相色谱(hplc)纯化粗制寡核苷酸。通过加入乙醇沉淀纯化的(c6ssc6)-寡核苷酸并在冰箱中过夜储存。通过离心收集沉淀。在水中重构寡核苷酸并且通过电喷雾电离质谱(esi-ms)证实寡核苷酸的身份。通过分析型阴离子交换和rphplc评估纯度。然后使用100mmdl-二硫苏糖醇(dtt)溶液还原每个含二硫化物的寡聚物。用三乙基碳酸氢铵缓冲液(teabc,1m,ph8.5,sigma,#90360)和水稀释1.0mdtt储备溶液(sigma-aldrichchemiegmbh,munich,germany,#646563)以得到各自在dtt和teabc中100mm的溶液。将寡核苷酸溶解于teabc缓冲液(100mm,ph8.5)中,以得到1mm溶液。为了完成二硫键还原,将50-100倍摩尔dtt过量添加到寡核苷酸溶液中。在从thermofisher获得的dionexdnapac200柱(4×250mm)上通过分析型aexhplc监测还原的进展。还原的材料即对应的巯基(c6sh)在起始材料之前洗脱。反应完成后,使用gehealthcare的hiprep柱和水作为洗脱剂,通过尺寸排阻色谱除去过量的试剂。随后,使用3mnaoac(ph5.2)和乙醇使寡核苷酸沉淀,并在-20℃下储存。实施例2:用于制备单-dtme寡聚物的一般程序将巯基修饰的寡核苷酸溶于含有25%乙腈的300mmnaoac(ph5.2)中,以得到20od/ml溶液。将40当量二硫代双马来酰亚胺乙烷(dtme,thermofisher,#22335)溶于乙腈中以提供15.6mm的溶液。将dtme溶液加入到含有寡核苷酸的溶液中,并在thermomixer(eppendorf,hamburg,germany)上于25℃搅拌。通过使用dionexdnapac200柱(4×250mm)的分析型aexhplc监测反应的进展。根据所需的纯度水平,使用hiprep柱(gehealthcare)通过尺寸排阻hplc除去过量的dtme,或使用可从gehealthcare购买的填充有source15q树脂的柱通过制备型aexhplc纯化粗制反应混合物。实施例3:通过dtme功能性制备二聚体的一般程序将根据实施例2中的程序制备的dtme修饰的寡核苷酸与另一个装配有巯基接头的寡核苷酸反应。该反应既可以在单链序列上进行,也可以在反应配偶体之一的互补寡核苷酸的预先退火之后进行。因此,如果需要,dtme修饰的寡核苷酸直接与巯基修饰的寡核苷酸反应,或与其互补链退火,并且所得双链体与巯基修饰的寡核苷酸反应。或者,巯基修饰的寡核苷酸与其互补链退火,并且该双链体与dtme修饰的单链反应。在所有情况下,反应均在300mmnaoac(ph5.2)存在下在水溶液中进行。实施例4:用于退火单链rna(ssrna)以形成双链rna(dsrna)的一般程序通过混合等摩尔量的互补有义链和反义链并在20mmnacl/4mm磷酸钠ph6.8缓冲液中退火,从rna单链产生dsrna。使用来自gehealthcare的superdex75柱(10×300mm)通过天然尺寸排阻hplc证实成功的双链体形成。将样品冷冻储存直至使用。实施例5:制备3’或5’-nh2衍生的寡核苷酸的一般程序使用oligopilot100(gehealthcare,freiburg,germany)和可控多孔玻璃(cpg)作为固相支持物(primesynthesis,aston,pa,usa)以140μmol的规模通过标准的亚磷酰胺化学在固相上产生在有义链的5′末端装配有c-6-氨基接头的rna。使用相应的2’-ome-亚磷酰胺,2’-f-甲基亚磷酰胺产生含有2’-o-甲基和2’-f核苷酸的寡聚物。使用tfa-保护的己基氨基接头亚磷酰胺(sigma-aldrich,safc,hamburg,germany)引入有义链5′末端的5’-氨基己基接头。在3’-位需要己基氨基-接头的情况下,使用固定在cpg(primesynthesis,aston,pa,usa)上的phtalimido保护的己基氨基-接头。使用41%甲胺的水溶液和浓缩的氨水的混合物(1:1v/v)完成切割和脱保护。使用阴离子交换hplc和从gehealthcare获得的填充有source15q树脂的柱(2.5x18cm)纯化粗制寡核苷酸。实施例6:galnac配体偶联的一般方法如hadwigeretal.专利申请us2012/0157509a1中概述制备三价galnac配体。根据以下程序使用nhs化学活化相应的羧酸衍生物:将3galnac-cooh(90μmol,206mg)溶于2.06mldmf中。在0℃向该溶液中加入n-羟基琥珀酰亚胺(nhs,14.3mg(99μmol,1.1当量)和二异丙基碳化二亚胺(dic,18.29μl,1.05当量,94μmol)。在环境温度下将该溶液搅拌过夜。通过tlc(dcm:meoh=9:1)监测反应的完成。将装配有氨基己基接头的前体寡核苷酸溶于碳酸钠缓冲液(ph9.6):dmso2:3v/v中以得到4.4mm溶液。向该溶液中加入nhs活化的galnac溶液(1.25eq,116μl)的等分试样。在25℃振荡1小时后,加入nhs活化的galnac的另一等分试样(116μl)。一旦rphplc分析显示至少超过85%的偶联物质,通过加入乙醇使粗制偶联物沉淀并在冷冻机中储存过夜。通过离心收集沉淀物。将沉淀物溶解在1ml浓缩的氨水中,并在室温下搅拌4小时,以从galnac糖残基除去o-乙酸酯。通过rphplcesims证实o-乙酸酯的定量去除后,将材料用100mm乙酸三乙基铵(teaa)稀释,并在explorerhplc系统上使用xbridgeprepc18)柱(5μm,10×50mm,waters在60℃下通过rphplc纯化粗制反应混合物。溶剂a是100mmteaa水溶液,溶剂b是95%can中的100mmteaa,均通过缓冲预热器加热到60℃。采用60分钟内从5%至25%b的梯度,流速为3.5ml/分钟。在260和280nm处观察化合物的洗脱。收集具有1.0ml体积的级分并通过分析型rphplc/esi-ms分析。将含有纯度超过85%的目标偶联物的级分合并。通过esi/ms证实正确的分子量实施例7:寡核苷酸前体使用上述实施例中描述的方法,制备以下单链单体、二聚体和galnac标记的单体和二聚体:表1:寡核苷酸前体-单链(“x”)表2:寡核苷酸单链有义和反义对;和退火后所得的双链体(“xd”)表3:衍生的寡核苷酸单链有义和反义对;和退火后所得的双链体。表4:通过dtme连接的单链寡核苷酸二聚体表5:单链dtme二聚体和相应的单体;和退火后所得的双链体表6:化学合成的二硫键连接的二聚体和三聚体说明:在上述表1-6的序列部分(以及下面的那些)中:大写字母“a”、“c”、“g”和“u”代表rna核苷酸。小写字母“c”、“g”、“a”和“u”代表2’-o-甲基修饰的核苷酸;“s”代表硫代磷酸酯;和“dt”代表脱氧胸苷残基。大写字母a、c、g、u后面加上“f”表示2’-氟代核苷酸。“(shc6)”代表硫代己基接头。“(dtme)”代表可切割的同双官能交联剂二硫代双马来酰亚胺乙烷。“(bmpeg2)”代表不可切割的同双功能交联剂1,8-双马来酰亚胺基-二甘醇。“c6nh2”和“c6nh”可互换使用以代表氨己基接头。“c6ssc6”代表二己基二硫键接头。“galnac3”和“galnac”可互换使用以代表三触角n-乙酰半乳糖胺配体,其化学结构如图1所示。“spdp”代表琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯与氨基接头装配的rna反应的反应产物。“invdt”是指反向胸苷。通常,序列从5’到3’末端从左到右书写。然而,包含dtme或bmpeg2交联剂的序列通过3’末端连接,并且在这些序列中,后半部分需要从右向左读取(以维持5’到3’的取向);或者如果后半部分从左到右读取,则方向是3’到5’。在图表的靶标/链部分中:“f7”或“fvii”表示靶向因子vii转录物(或mrna)(也称为因子vii)的sirna序列。“apob”表示靶向载脂蛋白b转录物的sirna序列。“ttr”表示靶向转甲状腺素蛋白转录物的sirna序列。有义链被指定为“s”;反义链被指定为“as”。实施例8:通过连续退火产生二聚体、三聚体和四聚体sirna的一般程序为了制备二聚体、三聚体和四聚体sirna,进行逐步退火程序。退火在水中进行并利用互补链的逐步添加。不需要加热/冷却溶液。每次添加后,取出退火溶液的等分试样,并在天然条件下(20℃)使用分析型rphplc监测双链体形成。基于由最近邻法计算的单个单链的消光系数计算组合等摩尔量互补单链的所需量。如果分析型rphplc迹线显示过量的单链,则加入额外量的相应的互补链以迫使双链体形成(“双链体滴定”)。使用装配有平衡至20℃的xbridec18oligobeh柱(2.5μm;2.1x50mm,waters)的dionexultimate3000hplc系统监测双链体滴定。诊断波长是260nm。缓冲液a是100mm六氟异丙醇(hfip),含有1%甲醇的16.3mm三乙胺(tea),缓冲液b具有相同组成,除了meoh是95%。以250μl/分钟的流速施加30分钟内从5%至70%缓冲液b的梯度。两条互补链独立运行以建立保留时间。然后分析含有双链体溶液的等分试样,并与组成单链的保留时间进行比较。在双链体溶液显示显著量的单链的情况下,则将相应的互补链添加到双链体溶液中。实施例9:制备fvii-dtme-apob异源二聚体(xd-05311)通过使用实施例8中描述的方法和图2中描述的方法依次组合下列单链来制备高纯度的fvii-apob异源二聚体(xd-05311)。在装配有从gehealthcare获得的resourceq柱的explorer100(gehealthcare)上纯化单链异源二聚体x15049。缓冲液a是在20%乙腈水溶液的10mm高氯酸钠、20mmtris、1mmedta,ph7.4(fluka,buchs,switzerland)并且缓冲液b与缓冲液a相同,但含有500mm高氯酸钠。使用柱温箱将该柱保持在60℃。流速是4ml/分钟。使用仪器的样品泵将粗制材料装载到柱上。在280nm记录elutuin,并使用在45分钟内从15%b到45%b的梯度。合并合适的级分并通过加入3m乙酸钠(naoac,ph5.2)/乙醇1/32(v/v)沉淀,并在-20℃下储存过夜。通过离心收集沉淀物并将该物质在水中重构。使用分析型aexhplc分析材料的纯度。使用dionexdnapac200柱(4×250mm),材料纯度为92.8%的面积。另外,在来自waters的xbridgec18oligobeh柱(2.5μm;2.1x50mm)上通过rphplc对材料进行分析。使用这种技术,该材料具有96.5%的面积。实施例10:lnp配制的fvii-apob异源二聚体(xd-05311)的体内分析(动物实验mausrna-tv30)根据一般程序:脂质纳米颗粒制剂(上述)并使用由kl52/dspc/胆固醇/peg-c-dmog50:10:38.5/1.5摩尔%組成的标准kl52(xl10)制剂将靶向因子vii和apob的异源二聚体sirna(xd-05311)配制成lnp。将apob的典型sirna(xd-01078)和fvii的典型sirna(xd-00030)各自配制在相同的lnp(xl10)中,并且将另外的用于fvii的典型sirna(xd-00030)配制在标准kl22(xl7)制剂中,其由kl22/dspc/胆固醇/peg-c-dmog50:10:38.5/1.5摩尔%组成。根据一般程序:lnp表征(上文)来表征下表7中总结的lnp制剂,并且如一般程序:动物实验(上文)中所述在动物实验中测试体内功效。对于治疗组,组大小为n=3只小鼠,对于盐水对照,组n=6。以0.35mg/kg的剂量静脉内注射所有化合物。在注射之前以及在注射后24小时、69小时和7天后上述时间点收集血液,并根据一般程序:基因敲低的测量(上文)分析fvii酶活性。结果显示在图3中。在注射后第7天测量肝裂解物中fvii和apob的mrna水平,并显示在图4中。表7:在动物实验mausrnai-tv30中使用的lnp制剂实施例11:5’-galnac-fvii典型对照(xd-06328)的制备通过实施例4中描述的方法使ssrna链x18790和x18795退火来制备5’-galnac-fvii典型对照(xd-06328)(参见图5)。如通过hplc分析确定,获得的产物纯度为91.6%。实施例12:具有连接3’反义链和偶联至有义链外部3’末端的galnac的可切割接头的3’-galnac-fvii-dtme-fvii同源二聚体(xd-06330)的制备根据实施例8中描述的双链体滴定方法,通过逐步将单链二聚体x19819与x18788和x19571组合来制备靶向fvii的galnac-偶联的同源二聚体sirnaxd-06330(10mg,323nmol)(图6)。分离的物质通过hplc分析是基本纯的。表8:用于合成galnac-fvii-dtme-fvii同源二聚体(xd-06330)的寡聚物的化学计量实施例13:具有连接5’有义链和偶联至有义链外部3’末端的galnac的可切割接头的3’-galnac-fvii-dtme-fvii同源二聚体(xd-06360)的制备通过使用图7中描述的合成策略和实施例8中描述的方法逐步组合单链来制备靶向fvii的galnac-偶联的同源二聚体sirnaxd-06360(11mg,323nmol)。所有反应步骤产生高质量的材料,其中分别通过离子交换和反相色谱确定低聚物x19575分别为91.7%和93.4%纯,并且通过非变性反相hplc确定分离出低聚物xd-06360为86.8%纯。表9中显示了用于合成的各种低聚物的化学计量。表9:用于合成galnac-fvii-fvii同源二聚体(xd-06360)的寡聚体的化学计量实施例14:具有连接3’反义链和偶联至有义链内部5’末端的galnac的可切割接头的5’-galnac-fvii-dtme-fvii同源二聚体(xd-06329)的制备如图8所示,通过将1150nmol的x18788和1150nmol的x18798退火来制备靶向fvii的galnac-偶联的同源二聚sirnaxd-06329[seqid51]。各个链的od总和为450od并且由于增色性,组合溶液即双链体具有394od(394od=1150nmol双链体)。该dtme修饰的双链体与1150nmolx18797(3’-sh修饰的fvii反义)(224od)反应。hplc纯化后,分离出364od“半-二聚体”sirna。然后使“半二聚体”fviisirna(10mg,323nmol,174od)与5’galnac-fvii有义(x18790)(323nmol,62.3od)退火以产生最终产物xd-06329。实施例15:确定通过fvii同源二聚galnac偶联物(xd-06329、xd-06330和xd-06360)的体内fvii基因敲低。在如上所述的动物实验(一般程序:动物实验)中,测试靶向因子vii同源二聚体的galnac-偶联的sirna的三种不同变体(xd-06329、xd-06330和xd-06360)和单体galnac-偶联的fvii-sirna(xd-06328)的体内功效。对于治疗组,组大小为n=4只小鼠,对于盐水对照组,n=5。以0.2ml体积的不同剂量(25mg/kg或50mg/kg)皮下注射所有化合物。治疗前1天和治疗后1、3和7天收集血液,并分析fvii酶活性。在图9中显示了结果。同源二聚体galnac-偶联物(xd-06329、xd-06330和xd-06360)的沉默活性、作用起效和效能在每单位重量敲低的基础上与单体的典型对照(xd-06328)相当。没有观察到毒性迹象(例如体重减轻,异常行为)。然而,在对galnac含量进行归一化后,同源二聚galnac偶联物在fvii敲低方面均比galnac单体更有效,由此证明每配体/受体结合事件更有效的sirna摄取。在图10a和10b和10c中显示了这些结果。图10a。在皮下施用galnac偶联物或pbs后的因子vii血清活性。将每个时间点上的因子vii血清值归一化到用1xpbs注射的对照小鼠。在这种情况下,注射到动物中的galnac的量几乎保持恒定。在注射前三天(-3)或注射后1、3或7天测量因子vii血清活性。将数据绘制为平均值±s.e.m.,并且n=3只小鼠/组。每个数据点(第-3、1、3和7天)上的标尺从左到右分别对应于x06328、x06329、x06330和x06360。图10b。在皮下施用galnac偶联物或pbs后的因子vii血清活性。将每个时间点上的因子vii血清值归一化到注射前3天获得的对照因子vii值。在这种情况下,注射到动物中的galnac的量几乎保持恒定。在注射前三天(-3)或注射后1、3或7天测量因子vii血清活性。将数据绘制为平均值+/-s.e.m.,并且n=3只小鼠/组。每个数据点(第-3、1、3和7天)的标尺从左到右分别对应于x06328、x06329、x06330和x06360。实施例16:独立靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386)的典型galnac-sirna的制备。通过固相合成独立地制备独立地靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386)的三种典型sirna(参见图11)。用5’-己胺接头独立地制备三种有义链(分别为x18790、x20124、x20216)。在寡核苷酸的切割和去保护以及粗物质的hplc纯化之后,使用nhs化学实现每个乙酰化的galnac簇与每个寡聚物的偶联。通过皂化除去o-乙酸酯是由氨水介导的。通过上文提供的标准程序合成互补的反义链(分别为x18795、x19583和x19584),随后与galnac偶联的单链退火来分别以99.7%、93.1%和93.8%的纯度产生靶向fvii(xd-06328)、apob(xd-06728)和ttr(xd-06386)的sirna。表10:galnac-sirna偶联物实施例17:在有义链上具有可切割的连接的galnac-fvii-apob-ttr三聚体(xd06726)的制备如图13所示,使用固相和溶液相的混合策略合成与galnac偶联的靶向fvii、apob和ttr的异源三聚体(参见图12)。图13:galnac偶联的异源三聚体(xd06726)的合成策略使用相应的市售tfa保护的亚磷酰胺(safcproligo,hamburg,germany)利用5’-末端上的氨基己基接头,使用固相化学法制备二聚体x19581。根据上述条件将序列从固体支持物上切下、脱保护并纯化。为了安装另外的二硫化物接头,将寡核苷酸的5’-氨基己基接头与可从sigma(#p3415)获得的spdp(琥珀酰亚胺基3-(2-吡啶二硫代)丙酸酯)反应。将928nmol(400od)寡核苷酸溶于4.7ml含有20%二甲基甲酰胺(dmf)的100mmteab,ph8.5中。向该溶液中加入100μldmf中的1.4mg(4.6μmol,5当量)spdp的溶液。一旦分析型rphplc指示起始材料的消耗,则将粗反应混合物在购自waters的c18xbridge柱(10x50mm)上纯化。rp纯化在explorerhplc系统上进行。溶剂a是100mmteaa水溶液,且溶剂b是95%acn中100mmteaa。通过缓冲液预热器将溶剂加热至60℃,并将柱在炉中保持在相同温度下。采用45分钟内从0%至35%b的梯度,其中流速为4ml/min。在260和280nm处观察化合物的洗脱。收集1.5ml体积的级分,并通过分析型rphplc/esi-ms分析。合并合适的级分,加入乙醇和3mnaoac(ph5.2)后,在-20℃下将寡核苷酸x19582沉淀。通过rp-hplcesi-ms确认身份。为了制备单链三聚体,将上述寡核苷酸x19582(255nmol)溶于1.3ml水中。向该溶液中加入306nmol(1.2当量)巯基修饰的寡核苷酸x18793。反应混合物含有200mmteaa和20%乙腈。反应的进展随后是rphplc。一旦起始材料被消耗,则使用与前段中所述相同的条件进行纯化反应混合物,除了在45分钟内梯度从0%b到30%b进行。单链异源三聚体x20256(含有连接的sifvii、siapob和sittr的有义链)以高纯度获得。x20256的序列如表11所示。表11:注意:原则上,以上序列可通过单一固相合成来获得。在这种情况下,spdp和c6nh2将被c6ssc6亚磷酰胺取代。但是,由于整个构建体的序列长度,这样的合成将是具有挑战性的。此后,通过根据实施例8所述的双链体滴定方法将反义单链逐步加入到有义链异源三聚体中间体(x20256)中来制备7mg(150nmol)的同时靶向fvii、apob和ttr的异源三聚体双链构建体(xd-06726)。通过hplc获得实质上纯的7mg物质。表12:用于合成galnac-fvii-apob-ttr三聚体(xd-06726)的寡聚物的化学计量学。实施例18:在交替的有义链和反义链上具有可切割的连接的galnac-fvii-apob-ttr三聚体(xd06727)的制备。使用实施例8中描述的方法,通过如图15所示逐步组合单链来以高纯度制备9mg(192nmol)同时靶向fvii、apob和ttr的三聚体sirnaxd-06727(参见图14)。表13:用于合成galnac-sifvii-siapob-sittr三聚体(xd-06727)的寡聚物的化学计量学产生异源三聚体(xd-06727)的合成是高效的。在该实施例中,在每个步骤中实现反应物接近100%的转化率。参见图16、17和18。实施例19:制备单独靶向fvii、apob和ttr的合并的sirna的lnp制剂使用一般程序:脂质纳米颗粒制剂和一般程序:lnp表征中所述的方法,在脂质纳米颗粒中配制靶向fvii(xd-00030)、apob(xd-01078)和ttr(xd-06729)的单体sirna并表征。脂质组成是xl10:dspc:胆固醇:peg-domg/50:10:38.5:1.5摩尔百分比。实现了88%的包封,且得到的颗粒尺寸为83nm,具有2.2mv的zeta电位和0.04的pdi。实施例20:评估galnac-偶联的异源三聚体sirna的mrna敲低为了确定异源三聚体galnac-偶联的sirna(靶向fvii、apob和ttr)的体内功效,如上所述(一般程序:动物实验)使用组大小为治疗组n=4只小鼠且盐水对照n=5只进行动物实验。将异源三聚体xd-06726和xd-06727以及3种单体galnac-偶联的sirna(靶向fvii的xd-06328;靶向ttr的xd-06386和靶向apob的xd-06728)的合并物皮下注射(0.1ml体积),且三聚体的浓度为50mg/kg总rna,每种单体缀合物的浓度为17mg/kg。为了比较,针对相同靶标(fvii(xd-00030)、apob(xd-01078)和ttr(xd-06729))的lnp-配制的sirna合并物(npa-741-1)以每sirna0.5mg/kg静脉内注射。如上所述(一般程序:动物实验)在治疗前1天和治疗后1、3和7天收集血液,按照一般程序:基因敲低的测量来测量fvii、apob和ttr的血清水平。结果如图19a和19b、20a和20b、以及21a和21b中所示。在注射后第7天测量肝裂解物中的mrna水平(图22a和22b)。a组中的一只动物(xd-06726)没有显示对ttr血清水平的任何作用。两个ttr蛋白质图中的第二个显示省略了不响应动物的值的数据。为了比较,来自显示差的ttr响应的动物的值已从第二fvii图中省略。在一组动物内和盐水对照的不同时间点之间,apob血清水平均显示出高变化。还根据以上一般程序:基因敲低的测量,使用bdna测定对来自肝组织的mrna测量所有三种基因的敲低。目标基因水平相对于看家基因gapdh进行归一化。实施例21:制备galnac-fvii-apob-ttr-fvii四聚体(xd-07140)通过如图24所示逐步合并单链并根据实施例8中描述的双链体滴定方法制备12.4nmol的同时靶向fvii、apob和ttr的四聚体sirnaxd-07140(参见图23)。hplc分析显示产物以高纯度获得。表14:用于合成galnac-fvii-apob-ttr-fvii四聚体(xd-07140)的寡聚物的化学计量学实施例22:多聚化sirna的混合物的产生动态平衡的多聚sirna的混合物及其制备方法描述于mok等人的“multimericsmallinterferingribonucleicacidforhighlyefficientsequence-specificgenesilencing”,naturematerials,vol.9,march2010。如其中所述,所述混合物包含化学连接的sirna的线性链,其中所述链具有不同的长度。在该实施例中,进行了一系列实验来研究不同的退火条件对mok等人合成反应效率以及最终产物特性的影响。表15:多聚sirna混合物的起始材料说明:在图表的描述部分中:“f7”意指靶向因子vii基因(也称为因子vii)的sirna序列。有义链被指定为“s”;反义链被指定为“as”。连接链的化学接头被指定为“c”代表可切割的和“nc”代表不可切割的。在该图表的序列部分(以及后面的那些)中:大写字母“a”、“c”、“g”和“u”代表rna核苷酸。小写字母“s”代表硫代磷酸酯,“dt”代表脱氧胸苷残基。后面为“f”的大写字母a、c、g、u表示2'-氟代核苷酸。“(shc6)”代表硫代己基接头,“(dtme)”代表可切割的同双功能交联接头二硫代双马来酰亚胺乙烷。“(bmpeg2)”代表不可切割的同双功能交联接头1,8-双马来酰亚胺-二甘醇。通常,从5’到3’末端写入序列;然而,包含dtme或bmpeg2交联接头的序列经由3’端连接,并且在这些序列中,后半部分需要从右向左即3’至5’读取。表15中所示的序列是按照上文在一般程序:单链寡核苷酸合成中所述的合成方法制备的。在序列的固相装配、脱保护和有义和反义寡核苷酸的制备型aexhplc纯化之后,通过组合3’-巯基修饰的单链寡核苷酸和相应的同双官能交联接头(dtme或bmpeg2,均购自pierce)形成单链同源二聚体。为此,将寡核苷酸溶于100mm三乙基乙酸铵(ph7)中,得到1.4mm溶液。在含有寡核苷酸的溶液中加入新制备的乙腈中的同双功能交联接头(5mg/ml)的溶液。将反应混合物在热振荡器上在25℃下搅拌。通过使用dionexdnapac200柱(4×250mm)的分析型aexhplc监测反应。一旦起始物质被消耗,通过加入乙酸钠(3m,ph5.2)和乙醇1:32(v/v)的混合物使反应淬灭。粗物质在冰箱中沉淀过夜。将沉淀溶解于水中,并使用填充有源15q树脂(gehealthcare)的柱通过aexhplc进行纯化。将合适纯度的级分合并并再次沉淀。将沉淀溶于水中并通过测量260nm处的吸光度来定量。图26显示了使用bmpeg2作为接头合成同源二聚体的一般描述。上表15中所示序列的分析数据列于表16中,如下所示:表16:起始物质的分析数据表17显示退火以产生双链多聚体sirna混合物xd-05305(具有不可切割的连接)和xd-05306(具有可切割连接)的单链同源二聚体。最初,使用通用退火条件:将互补的单链在1xpbs中组合,并置于保持在70℃的水浴中10分钟。然后,在3小时的周期将水浴冷却至25℃。表17:用于生产双链多聚体sirna混合物的序列为了建立与现有技术(mok等人,naturematerials,vol.9,2010年3月)中显示的条件相比潜在改善的退火条件的基线,使用不可切割的同源二聚体x12712和x12713。进行mok等人发表的退火条件(以下简称“park”)和一套专有的标准退火条件(以下称“axolabs”条件)的比较。park条件为:1xpbs,1小时,37℃。axolabs条件为:1xpbs,70℃10分钟,在3小时的周期冷却至25℃。图27证明了sechplc从多聚体sirna中分离出单链二聚体。nc-有义二聚体对应于中间峰,nc-反义二聚体对应于右侧峰,而多聚体sirna对应于左侧峰。此外,图28显示多聚体sirna的积分似乎与退火条件无关;而短dsrna的部分则不是。在t=15.0分钟附近的圆圈区域中较高的峰对应于“park条件”,且圆圈出区域中较低的峰对应于“axolabs条件”。axolabs退火条件将更多物质转移到多聚体sirna级分中。如图29所示,一系列不同天然hplc条件(缓冲液、温度、乙腈含量)的探索导致部分分离多聚体sirnas的能力。最高峰对应于nc-有义二聚体,最左边的峰对应于nc-反义二聚体,在t=9-11分钟附近的“多聚体sirna”区域中的最高峰对应于“axolabs”退火条件,并且“多聚sirna”区域中的第二高的峰对应于“park的退火条件”。此外,该分析证实,在较高温度下退火最小化较短的多聚体并有利于较长的多聚体。此外,我们发现使用sec和iexhplc分析,无法确定所分析的混合物中x聚体sirna的分布。如图30所示,通过sechplc分析实现多聚体sirna混合物的各种sirna组分的基线分离。多聚体sirna是左手峰;二聚体sirna是中间的峰;而典型sirna是右手峰。使用基于hplc的方法和superdex20010/300gl柱,研究了另外的退火条件,旨在将很少寡聚化的物质级分降至最低。具体而言,表18显示了分析的参数和使用不可切割的f7同源二聚体获得的结果。表18:退火条件和结果基于这些结果,确定优化的退火条件包括高rna浓度(≥250μm),低盐浓度反应温度在70-80℃左右(约10分钟)和缓慢冷却至室温(2小时)。图31显示了盐浓度和反应温度对多聚体sirna混合物的影响。接下来选择的优化退火条件,并进行两个另外的实验以确定是否有可能控制反应以便在最终的混合物中将极高分子量的多聚体种类的量降至最低(理论上,较低分子量的种类将在体内更有活性,并且如果将lnp用作递送载体的话,较低分子量的种类潜在地更容易配制入lnp中)。在这些的第一个中,优化的退火条件在存在0.1、0.3和0.9当量的单链单体(缺乏任何接头)作为终止链的情况下重复。如图32(下文)所示的结果表明,终止链的浓度越高(在这种情况下,反义链被用作终止子),多聚化的sirna级分越小。在第二个实验中,使用亚化学计量的量的不可切割的有义同源二聚体x12712进行优化的退火条件;具体地说,在退火反应中使用了90摩尔%、75摩尔%和60摩尔%的有义同源二聚体相对于100摩尔%的反义同源二聚体x12711。图33中显示的结果显示有义同源二聚体的浓度越小,多聚化的sirna级分越小。退火之后,使用140ma在tae缓冲液中在2%琼脂糖凝胶上分析各种“终止子”样品和“亚化学计量”样品2小时。使用gelred染色使条带可见。图34a呈现样品编号1-15的凝胶。图34b表示样品编号1'-10'的凝胶。表19列出了凝胶中存在的样品及其特征:摩尔比反应条件样品#+0.5x_无接头的_as70c_250μm_0.2xpbs1+1.5x_无接头的_as70c_250μm_0.2xpbs2+4.5x_无接头的_as70c_250μm_0.2xpbs34.5_s+5_as70c_250μm_0.2xpbs43.75_s+5_as70c_250μm_0.2xpbs53.0_s+5_as70c_250μm_0.2xpbs65_s+5_as70c_250μm_1xpbs75_s+5_as80c_250μm_1xpbs85_s+5_as90c_250μm_1xpbs95_s+5_as70c_250μm_10xpbs105_s+5_as80c_250μm_10xpbs115_s+5_as90c_250μm_10xpbs125_s+5_as70c_250μm_0.2xpbs135_s+5_as80c_250μm_0.2xpbs145_s+5_as90c_250μm_0.2xpbs155_s+5_as70c_25μm_1xpbs1'5_s+5_as80c_25μm_1xpbs2'5_s+5_as90c_25μm_1xpbs3'5_s+5_as70c_25μm_10xpbs4'5_s+5_as80c_25μm_10xpbs5'5_s+5_as90c_25μm_10xpbs6'5_s+5_as70c_25μm_0.2xpbs7'5_s+5_as80c_25μm_0.2xpbs8'5_s+5_as90c_25μm_0.2xpbs9'5_s+5_as37c_250μm_1xpbs10'说明:左栏:“+0.5x_无接头的_as”是指样本(#1)用10%过量的未连接的反义链x00549(作为终止子)制备;“+1.5x_无接头的_as”是指样品(#2)用30%过量的未连接的反义链x00549(作为终止子)制备;“+4.5x_无接头的_as”是指样品(#3)用90%过量的未连接的反义链x00549(作为终止子)制备;对于其余的样品#4-10’,x_s+y_as是指用xnmol有义连接的同源二聚体和ynmol连接的反义同源二聚体制备(例如,样品#4,用4.5nmol连接的有义同源二聚体和5nmol连接的反义同源二聚体制备)。序列x00549:5’-gufaagacfufufgagaufgaufcfcfdtsdt-3’。中间栏:按照温度(℃)、rna浓度(μm)和盐浓度(作为pbs)提供反应条件。总之,这些实验证明,由于混合物内多聚化的sirna单元的大尺寸,多聚体sirna混合物的分析是具有挑战性的。sechplc分析非常适合确定多聚化(高达5聚体或6聚体)相对于二聚化sirna单元的比率,但无法提供关于给定样品中多聚化程度的分析。天然琼脂糖凝胶有助于显现多聚化的程度。此外,退火条件对最终混合物中的多聚化程度有深远的影响。例如,当进行等摩尔退火时,可以观察到非常高分子量的多聚体sirna形成(例如,超过6000bp的等同物)。通常,退火应在高rna浓度(>250μm)、低盐浓度(例如)和70-80℃左右的反应温度下进行。通过进行非等摩尔退火可以降低多聚化的程度。集中在200-500dnabp等同物(例如图34a中的凝胶泳道3和6)范围内的多聚化可以通过加入终止子单链或通过显著减少一条链的量来进行。在配制入lnp后,选择来自图34a中的凝胶泳道6和图34b中的凝胶泳道10’的样品在小鼠中进行测试。样品#10’具有250μm的rna浓度,其由相等部分的有义同源二聚体和反义同源二聚体组成,并且在37℃下在1xpbs中退火1小时。样品#6,rna浓度为250μm,由3(有义同源二聚体)比5(反义同源二聚体)的摩尔比和0.2×pbs组成,置于70℃的水浴中并经3小时的时期冷却。根据一般程序:脂质纳米颗粒制剂将所得多聚体sirna混合物配制入lnp,并根据一般程序:lnp表征进行分析。lnp实验的组成和分析数据列于表20、21和22中。[表20]制剂-idsirna制剂组成摩尔%大小(nm)pdizeta(mv)conc[mg/ml]entrap%npa-624-1fvii(xd-00030)kl22/dspc/胆固醇/peg-c-domg50∶10∶38.5∶1.569,730,05-0,40,7163%npa-194-3fvii(xd-00030)kl52/dspc/胆固醇/peg-c-domg50∶10∶38.5∶1.591,020,07-2,60,5183%npa-625-1多聚体泳道6(xd-05305)(x12712k1+x12713k1)kl52/dope/胆固醇/peg-c-domg40∶10∶48.5∶1.5113,20,10-4,40,1176%npa-626-1多聚体泳道6(xd-05305)(x12712k1+x12713k1)kl52/dope/胆固醇/peg-c-domg40∶30∶28.5∶1.5106,20,05-4,60,1475%npa-627-1多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶10∶48.5∶1.5129,60,100,00,1392%npa-628-1多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶15∶43.5∶1.5116,40,07-5,30,1489%npa-629-2多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶20∶38.5∶1.5142,20,09-6,70,1599%npa-630-1多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶25∶33.5∶1.5118,90,04-5,60,1586%npa-631-1多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶30∶28.5∶1.5102,80,03-3,70,1690%npa-632-1多聚体可切割的(xd-05306)(x12710k1+x12711k1)kl52/dope/胆固醇/peg-c-domg40∶40∶18.5∶1.590,880,06-1,80,1683%npa-623-2多聚体泳道6(xd-05305)(x12712k1+x12713k1)kl52/dope/胆固醇/peg-c-domg40∶20∶38.5∶1.5129,10,06-4,90,1595%[表21]制剂-idsirna制剂组成摩尔%大小(nm)pdizeta(mv)conc[mg/ml]entrap%npa-642-1多聚体可切割的泳道6(xd-05306)(x12710k1+x12711k1)kl22/dope/胆固醇/peg-c-domg40∶20∶38.5∶1.562,450,07-2,40,1993%npa-643-1多聚体可切割的泳道10′(xd-05306)(x12710k1+x12711k1)kl22/dope/胆固醇/peg-c-domg40∶20∶38.5∶1.561,670,08-2,50,1992%npa-644-1多聚体可切割的泳道6(xd-05306)(x12710k1+x12711k1)invivofectamine2.069,520,021,20,4297%npa-645-1多聚体可切割的泳道10′(xd-05306)(x12710k1+x12711k1)invivofectamine2.087,710,111,20,44100%npa-646-1fvii(xd-00376)invivofectamine2.067,040,072,20,46100%表22:确定长度二聚体(2-聚体)sirna双链体。确定的二聚体sirna:实施例23:lnp配制的fvii混合物的分析多聚体sirna(动物实验mausrnai-tv29/30)为了确定在不同脂质组合物(列于表23中)的lnp中配制的多聚体sirna(靶向fvii)的混合物的体内功效,如上所述进行动物实验(一般程序:动物实验)。静脉注射化合物,剂量为0.35mg/kgsirna。用invivofectamine2.0配制的多聚体sirna以1mg/kg和3mg/kg的剂量注射。包括lnp配制的典型fviisirna(xd-00030)作为阳性对照。组大小为治疗组n=3只小鼠和盐水对照组n=6。在下面的图表中记录的时间点收集血液并分析fvii酶活性。结果如图35所示。表23:用于动物实验mausrnai-tv29的lnp制剂[表23]制剂-id脂质sirnanpa-625-1xl10dope10多聚体可切割的泳道6(xd-05305)(x12712k1+x12713k1)npa-626-1xl10dope30多聚体可切割的泳道6(xd-05305)(x12712k1+x12713k1)npa-627-1xl10dope10多聚体可切割的(xd-05306)(x12710k1+x12711k1)npa-628-1xl10dope15多聚体可切割的(xd-05306)(x12710k1+x12711k1)npa-630-1xl10dope25多聚体可切割的(xd-05306)(x12710k1+x12711k1)npa-631-1xl10dope30多聚体可切割的(xd-05306)(x12710k1+x12711k1)npa-632-1xl10dope40多聚体可切割的(x0-05306)(x12710k1+x12711k1)npa-623-2xl10dope20多聚体可切割的泳道6(xd-05305)(x12712k1+x12713k1)npa-629-2xl10dope20多聚体可切割的(xd-05306)(x12710k1+x12711k1)npa-194-3xl10stdxd-00030(fvii单体)npa-624-1xl7stdxd-00030(fvii单体)当比较相同制剂中的不同的有效载荷(具有可切割接头的有效载荷相对于具有不可切割的接头的有效载荷)时,我们观察到可切割的有效载荷比不可切割的有效载荷表现更好(例如,npa-625-1相对于npa-62701;npa-626-1相对于npa-631-1;和npa-629-1相对于npa-623)。表24:在动物实验mausrnai-tv30中使用的lnp制剂[表24]制剂-idsirna脂质npa-642-1多聚体可切割的泳道6(xd-05306)(x12710k1+x12711k1)xl7dope20npa-643-1多聚体可切割的泳道10'(xd-05306)(x12710k1+x12711k1)xl7dope20npa-644-1多聚体可切割的泳道6(xd-05306)(x12710k1+x12711k1)invivofectamine2.0npa-645-1多聚体可切割的泳道10′(xd-05306)(x12710k1+x12711k1)invivofectamine2.0npa-646-1fvii(xd-00376)invivofectamine2.0实施例24:fvii有义:fvii反义的fvii异源二聚体(x12714)的制备和所得的多聚体的混合物(xd-05312)如图37中所示,通过将sif7有义链化学连接到sif7反义链以形成靶向f7的单链异源二聚体f7来制备实施例9的f7-apob异源二聚体的变体。异源二聚体x12714出现在图38所示的凝胶的泳道12中。凝胶分析条件为:1.5μg/泳道;1×tae中的2%琼脂糖凝胶;140ma;130分钟;凝胶红染色(1:10000)。实施例25:apob筛选的序列选择在本发明之前不知晓合适的针对鼠apob的sirna。因此,进行dsrna设计以鉴定靶向小鼠apob的特异性dsrna。首先,从ncbi参考序列数据库(发布版本73)下载小鼠(小家鼠)apob的已知mrna序列(列为seqidno:62的nm_009693.2和列为seqidno:63的xm_006515078.1)。从这组起始序列中排除如ncbidbsnp(版本146)所示的小鼠apobmrna(seqidno.64)中其相应的靶位点序列(19聚体的第2-18位)处携带有snp(单核苷酸多态性)的那些序列。在鉴定rnai试剂时,选择限于19聚体有义和反义序列,其分别与小鼠ncbirefseq数据库(发布版本73)中的任何其他序列具有至少1或2个错配,我们假定其代表全面的小鼠转录组。通过消除携带与如mirbase(universityofmanchester,发布版本21)中所列的已知小鼠mirna种子序列(5’末端的核苷酸2-7)相同的种子序列(5’末端的核苷酸2-7)的19聚体有义链和反义链,进一步限制了候选者的选择。另外,将包含五个或更多个连续的g’s(多聚-g序列)的所有有义和反义序列被排除在选择之外。表25中呈现了鉴定的序列。表25:靶向小鼠apobmrna的双链rna(dsrna)的核心序列。表25的所选序列用表26a和26b中所示的化学修饰合成。表26a:seqid双链体-idseqidss-id序列(5'--3')91xd-0596289x18815caafccfagfugfuafccfcufuafaafdtsdt94xd-0596392x18817cugfugfuafcgfaafgufacfaafaafdtsdt97xd-0596495x18819caafccfuafugfaafcufccfuafaafdtsdt100xd-0596598x18821gcufuafcgfgcfucfaafcafaufuufdtsdt103xd-05966101x18823gcafcgfugfaufggfacfuafucfaafdtsdt106xd-05967104x18825cuafuufugfgafgafgafaafucfgafdtsdt109xd-05968107x18827gagfaufuafuufgafucfgafaufcafdtsdt112xd-05969110x18829ccgfugfuafaafucfuafgcfaafaafdtsdt115xd-05970113x18831gcafuufuafgafucfaafuufgafgafdtsdt118xd-05971116x18833ggufuufuafaufggfaufaafaufcafdtsdt121xd-05972119x18835gacfuufugfcafgafgcfaafuafuufdtsdt124xd-05973122x18837cuufacfggfgufcafucfcafaafaafdtsdt表26b:其中小写字母“c”、“g”、“a”和“u”代表2’-o-甲基修饰的核苷酸,“s”代表硫代磷酸酯,且“dt”代表脱氧胸苷残基。后接“f”的大写字母a、c、g、u表示2’-氟代核苷酸。表26a和26b中所示的修饰的dsrna对应于表25中所示的未修饰的dsrna,如下:seqidno:89-124是对应于seqidno:65-88所示未修饰序列的修饰序列。实施例26:靶向apob的sirna的体外评估在鼠肝细胞系nmuli中测试表x中针对小鼠apobmrna的sirna的活性。apobmrna含量通过从与apob特异性sirna孵育的细胞中分离的总mrna中的支化(branched)dna定量。细胞从美国典型培养物保藏中心(rockville,md,目录号ccl-1638)获得。nmuli细胞在补充有10%胎牛血清(fcs,biochromag,berlin,germany,目录号s0115)和青霉素100u/ml、链霉素100mg/ml(biochromag,berlin,germany,目录号a2213)的dulbeccos改良eagle培养基(dmem,biochrom#f0435)中培养。在96孔板上接种15,000nmuli细胞/孔后直接进行sirna的转染,并如制造商所述用转染试剂rnaimax(invitrogengmbh,karlsruhe,germany,目录号13778-150)进行。在一式四份进行的剂量响应实验中,sirna浓度从50nm开始,并且以5倍稀释步骤降低至16pm。转染后,将细胞在37℃和5%co2下在加湿培养箱(heraeusgmbh,hanau,germany)中孵育24小时。将仅转染试剂(“模拟”)处理的细胞作为阴性对照。使用quantigeneexplorekitqg1.0(panomics,fremont,calif.,usa,目录号qg0004)定量apobmrna水平。收集细胞并按照制造商推荐的程序在53℃裂解。在孵育和裂解之后,将细胞裂解物与对小鼠apob和小鼠gapdh(作为看家基因用于归一化)特异性的探针组孵育。根据制造商的方案进行测定。化学发光是在victor2-light(perkinelmer,wiesbaden,germany)中作为rlu(相对光单位)测量的,并且用apob探针组获得的值对于各个孔的相应gapdh值进行归一化。对于图示,相对于设定为1的模拟处理细胞的水平,显示10nm和0.4nm的apobmrna水平(图39)。使用xlfit软件(idbs,guildford,uk)测定ic50(靶mrna减少50%)和ic80(靶mrna减少80%)值,并显示于表27。选择sirnaxd-05967作为多聚体实验的最佳候选者,因为它具有最低的ic80值,并且由于最佳的ic50值而将xd-05970作为备选候选者。表27:apob靶向的sirna的ic50和ic80值sirnaic50(nm)ic80(nm)xd‐059621.77n.a.xd‐05963n.a.n.a.xd‐05964n.a.n.a.xd‐059651.34n.a.xd‐059661.84n.a.xd‐059670.299.12xd‐05968n.a.n.a.xd‐059690.54n.a.xd‐059700.1744.63xd‐05971n.a.n.a.xd‐05972n.a.n.a.xd‐05973n.a.n.a.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1