水稻稻瘟病抗性基因Pi2‑1的分子标记方法及应用与流程
本发明涉及分子生物技术领域,具体来说是一种水稻稻瘟病抗性基因Pi2-1的分子标记方法及应用。
背景技术:
水稻是一种重要的单子叶作物,是全世界最重要的粮食作物之一,也是世界上一半人口的主粮。但是,各种病虫害的发生,严重制约了水稻的产量,其中,由稻瘟病菌Magnaporthe oryzae引起的稻瘟病,是水稻最具威胁性的病害之一。稻瘟病威胁着几乎所有水稻种植地区的生产安全,它是由子囊菌引起的病害,每年由于这种真菌性病害而造成的水稻产量损失,约占全球水稻总产量的10~30%。目前,稻瘟病危害的防治措施,主要采取施用农药的化学药剂防治方式,但农药施用即造成环境污染,又增加水稻生产成本。仅在日本,每年抗稻瘟病杀菌剂的销售额就达26亿日元(约2亿人民币)。同时,由于稻瘟病菌群体结构复杂、易变,往往造成含单个抗性基因的水稻新品种在种植3~5年后,就很容易丧失抗性,这在大面积种植的水稻品种中特别明显,所以,选育广谱持久水稻稻瘟病抗性新品种,是实现水稻高产、稳产、优质的基础,也是解决人口增长和粮食产量矛盾的重要途径。因此,发掘和定位更多新的抗性基因(QTLs),利用分子标记技术,将多个稻瘟病抗性基因(QTLs)聚合到高产的水稻品种中,培育出广谱持久的抗病水稻新品种,是防治稻瘟病最有效的措施。
天津野生稻(TY)是在对38000份国内外不同的稻种资源进行稻瘟病抗性鉴定过程中,筛选出的具有广谱持久抗性的抗源材料。因此,通过SSR等分子标记,鉴定TY的广谱持久抗性基因,对水稻抗病育种十分必要。在前期的研究中,利用TY与稻瘟病高感品种CO39杂交,构建的F2群体为研究对象,利用稻瘟病菌株CHL1743、110-2和318-2进行室内接种鉴定,F2群体的抗感单株分离比符合3∶1,表明其对3个稻瘟病菌株的抗性均由1个主效基因控制,命名为Pi2-1。利用群体分离分析法和隐性群体分离法进行初步定位分析,将Pi2-1基因定位在水稻第6号染色体着丝粒附近的SSR标记AP5659-5到RM7213之间,与2个标记的遗传距离分别为0.9cM和1.4cM【天津野生稻稻瘟病抗性的遗传分析与抗瘟基因Pi2-1的初步定位,王悦等,2013,39(1),湖南农业大学学报(自然科学版)】。因此,进一步对Pi2-1基因进行精细定位,将为抗病基因分子标记辅助选择奠定基础,同时也为抗病育种提供丰富的抗源材料。
技术实现要素:
本发明的目的是针对上述技术存在的问题,提供一种水稻稻瘟病抗性基因Pi2-1的分子标记方法及应用。
为实现上述目的,本发明采用的技术方案是:一种水稻稻瘟病抗性基因Pi2-1的分子标记方法,提取水稻样品基因组DNA,利用与稻瘟病抗性基因Pi2-1紧密连锁的分子标记WY6-8和T6,对育种群体的DNA进行PCR扩增,PCR扩增产物在8%非变性聚丙烯酰胺凝胶上进行电泳检测,如扩增出对应大小的DNA片段,则标志着Pi2-1基因的存在;
所述分子标记WY6-8上游引物序列如SEQ ID No.1所示,下游引物序列为SEQ ID No.2所示;所述分子标记T6上游引物序列为SEQ ID No.3所示,下游引物序列为SEQ ID No.4所示。
进一步的:所述PCR扩增反应体系为:20ng/μL的DNA模板1μL,2pmol/μL所述分子标记引物1μL,10×Buffer 1μL,2.5mM dNTPs 0.2μL,5U/μL的rTaq 0.1μL,ddH2O 6.7μL;反应程序为:95℃预变性5min;95℃变性30s,55~58℃退火30s,72℃延伸1min,35个循环;最后72℃再延伸7min。
本发明所要解决的另一个技术问题是提供所述的一种水稻稻瘟病抗性基因Pi2-1的分子标记方法在选育水稻抗稻瘟病品种中应用。
本发明的有益技术效果是:本发明采用水稻稻瘟病抗性基因Pi2-1的分子标记方法,该方法是应用筛选到的与水稻广谱持久抗性品种TY第6号染色体上定位到的稻瘟病抗性基因Pi2-1紧密连锁的2个分子标记,它们能有效预测水稻育种群体的稻瘟病抗性,加快抗病品种的选育速度。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1是本发明Pi2-1基因连锁图谱;
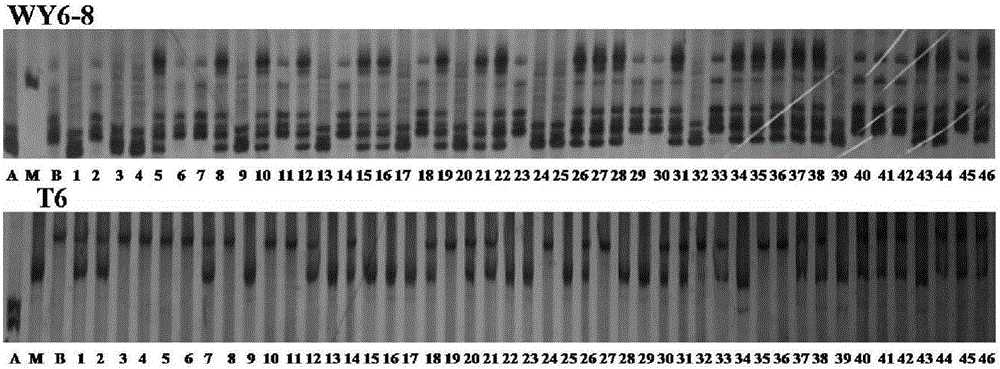
图2是本发明WY6-8和T6电泳图;A:TY;B:R006;1…46:TY/R006BC1F2株系;M:Low ladder。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
供试材料
本实施例的水稻材料为:以湖南农业大学水稻基因组学实验室所提供的TY和高感病品种CO39及其两者杂交的F2群体为试验材料。
本实施例的稻瘟病菌菌株:318-2,由湖南农业大学水稻基因组学实验室保存提供。
育苗
试验于4月20日播种,将TY、CO39和TY/CO39F2群体种子于37℃浸种(两干两湿),露白后间隔播种于育秧盘中,温室育苗,育苗土为购买的营养土。当幼苗在接种前一周(二叶期)时,施少量氮肥(2g/盘)。
稻瘟病菌菌株的培养
菌丝体生长:将已纯化的稻瘟病菌株分别接种于燕麦-西红柿平板培养基(燕麦-西红柿培养基的配制方法:称取燕麦片30g,放入搅拌机中,加600mL蒸馏水,将其搅碎,纱布过滤去掉残渣,再加入200mL西红柿汁,最后加入琼脂粉20g,蒸馏水定容至1L,分装到3个三角烧瓶中,灭菌后倒成平板培养基备用)上培养,将接种后的平板培养基放入26℃恒温箱中,黑暗培养7~10天,至菌丝覆盖整个平板培养基时,加入3~5mL的灭菌水,用棉签将菌丝轻轻刮掉,使其从营养生长变成生殖生长。
稻瘟病孢子培养:将菌丝刮掉后的平板培养基放置在智能光照培养箱中,24h光照培养,温度控制在26~28℃,4~7天之后等到产孢充分,每个平板培养基用20mL含有0.02%Tween20的无菌水洗下孢子,过滤到盛有灭菌水的烧杯中,经搅拌制成接种悬浮液,其浓度为每毫升20~30万个孢子。用血小球计数板观察稻瘟病菌孢子的数量,接种浓度为在100倍显微镜下,平均每个视野的孢子数量20~30个孢子。
稻瘟病菌株的接种
当幼苗生长至三叶一心时,将育秧盘放入塑料保湿箱中,然后将保湿箱移至专用接种室内进行接种,接种室内设有空调、加湿器、植物生长灯等设备以保证室内有适宜的温度(26~28℃)和湿度(80~95%)。用喷雾器将适宜浓度的接种悬浮液,以气雾的形式均匀喷洒在秧苗上,使每个叶片都布满均匀的雾点。接种完后,将保湿箱放置在专用接种室内,黑暗保湿24h(秧苗以26~28℃和保持叶片上有水珠的湿度条件为佳),而后移出室外,正常光照周期进行培养,并注意保温、保湿,确保病斑的正常扩展。
稻瘟病抗性调查
一般接种7天后即可进行病情鉴定,或当感病对照品种达到高度发病时调查。以国际水稻所0~9级评判标准为依据,逐株鉴定和记载,分级标准:0级,无病斑;1级,仅有小的针尖大小的褐点;2级,较大褐点;3级,直径1~2mm圆形稍大灰色病斑,边缘褐色;4级,1~2mm灰色纺锤形病斑,通常局限于2条叶脉之间;5级,灰色梭形病斑,受害面积为叶面积的4%~10%;6级,灰色梭形病斑,受害面积为叶面积的11%~25%;7级,灰色梭形病斑,受害面积为叶面积的26%~50%;8级,灰色梭形病斑,受害面积为叶面积的51%~75%;9级,灰色梭形病斑,受害面积大于叶面积的75%或叶片全部枯死。统计分析时,0~3级为抗病类型(R),4~9级为感病类型(S)。通过抗性调查,总共获得极端感病群体1019株。
稻瘟病抗性基因Pi2-1的精细定位
为了精细定位稻瘟病抗性基因Pi2-1,将初步定位目的区间的9311和NPB基因组序列进行Alignment比对,重新设计了7对分子标记,其中,分子标记WY6-3、WY6-5、WY6-8和T6在TY和高感品种CO39两个亲本之间存在多态性(表1)。分别利用这4对多态标记和初步定位采用的5对多态标记【天津野生稻稻瘟病抗性的遗传分析与抗瘟基因Pi2-1的初步定位,王悦等,2013,39(1),湖南农业大学学报(自然科学版)】,对1019个感病单株进行基因型分析,最终将Pi2-1基因定位在WY6-8和T6之间,前者有2个重组子,后者发现1个重组子,两个标记之间的遗传距离为0.2cM(图1)。
表1水稻稻瘟病抗性基因Pi2-1位点引物信息
实施例2
供试材料
本实施例的供试材料为:TY与水稻恢复系品种R006回交构建近等基因系,获得BC1F1,BC1F1套袋自交获得BC1F2。
供试的TY、R006和46个TY/R006BC1F2株系的种子,预先在37℃浸种(两干两湿),露白后,播种于塑料育秧盘中。育苗土采用市面上购买的营养土,温室育苗。当幼苗在三叶一心时,两亲本及BC1F2各株系分别取1g的嫩叶,采用CTAB方法提取基因组DNA。
用上述与稻瘟病抗性基因Pi2-1紧密连锁的分子标记WY6-8(正向引物:5,-TCGAAAATTGGTGAGGAGGA-3,,反向引物:5,-GTGCCCGACGCATGATGACT-3,)和T6(正向引物:5,-GATCGGTCACGCATAGAGG-3,,反向引物:5,-CCACCCATCCCAACAACAC-3,)扩增两个亲本和46个BC1F2株系的基因组DNA检测BC1F2各株系的稻瘟病抗性。
PCR反应体系为:PCR扩增总体积为10μL,其中,DNA模板(20ng/μL)1μL,引物(2pmol/μL)1μL,10×Buffer 1μL,10mM dNTPs(2.5mM)0.2μL,rTaq(5U/μL)0.1μL,ddH2O 6.7μL。
PCR扩增程序:95℃预变性5min;接下来35个循环:95℃变性30s,55~58℃退火30s,72℃延伸1min;最后72℃再延伸7min,4℃保存。
结果表明:与稻瘟病抗性基因Pi2-1紧密连锁的分子标记WY6-8(正向引物:5,-TCGAAAATTGGTGAGGAGGA-3,,反向引物:5,-GTGCCCGACGCATGATGACT-3,)和T6(正向引物:5,-GATCGGTCACGCATAGAGG-3,,反向引物:5,-CCACCCATCCCAACAACAC-3,)在9、13、17、25、39等5个BC1F2株系中均能用电泳检测到与水稻品种TY相同的带型,即含有稻瘟病抗性基因Pi2-1,是水稻抗稻瘟病株系。
实施例3
将上述实施例2中的TY和R006两个亲本和46个TY/R006BC1F2株系分别种植于湖南农业大学水稻基因组学实验室和湖南省国家稻瘟病抗性鉴定中心(桃江),分别进行室内稻瘟病人工接种抗性鉴定和田间自然诱发抗性鉴定。
人工接种抗性鉴定方法参照【天津野生稻稻瘟病抗性的遗传分析与抗瘟基因Pi2-1的初步定位,王悦等,2013,39(1),湖南农业大学学报(自然科学版)】,田间自然诱发抗性鉴定方法参照【湘资3150微效抗瘟性基因鉴定,黄红梅等,2011,41(5),植物病理学报】
利用与稻瘟病抗性基因Pi2-1紧密连锁的分子标记WY6-8和T6检测抗稻瘟病育种群体的方法与室内人工接种鉴定和田间自然诱发鉴定的结果一致,说明本发明利用稻瘟病抗性基因Pi2-1的分子标记方法准确性高。
表2利用分子标记改良水稻恢复系R006稻瘟病抗性鉴定结果
A:基因型与TY相同的带型;B:基因型与R006相同的带型;H:TY/R006的杂合子带型。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
SEQUENCE LISTING
<110> 湖南农业大学
<120> 水稻稻瘟病抗性基因Pi2-1的分子标记方法及应用
<130> 权利要求书、说明书
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> WY6-8正向引物
<400> 1
tcgaaaattg gtgaggagga 20
<210> 2
<211> 20
<212> DNA
<213> WY6-8反向引物
<400> 2
gtgcccgacg catgatgact 20
<210> 3
<211> 19
<212> DNA
<213> T6正向引物
<400> 3
gatcggtcac gcatagagg 19
<210> 4
<211> 19
<212> DNA
<213> T6反向引物
<400> 4
ccacccatcc caacaacac 19
- 还没有人留言评论。精彩留言会获得点赞!
- 水稻稻瘟病抗性基因Pi2‑1的分子标记方法及应用与流程
- 一种稻瘟病抗性基因Piz‑t功能特异性分子标记及其检测方法和应用与流程
- 一种接种架及稻瘟病菌接种系统的制作方法与工艺
- 谷梅4号抗稻瘟病基因Pigm的分子标记及其应用的制作方法与工艺
- 水稻稻瘟病抗性基因Pita、Pib分子标记方法与流程
- 一种基于猪非典型瘟病毒E2基因的荧光定量RT‑PCR检测试剂盒的制作方法与工艺
- 稻瘟病菌LAMP检测引物组及应用的制造方法与工艺
- 一种制备稻瘟病菌促分裂原活化蛋白激酶MoMps1晶体的方法与流程
- 水稻抗稻瘟病Pi9基因的共显性功能分子标记Pi9InDel1及其应用的制造方法与工艺
- 水稻抗稻瘟病Pi9基因的共显性功能分子标记Pi9InDel2及其应用的制造方法与工艺
- 小麦白粉病抗性基因PmR2及其克隆与应用的制造方法与工艺
- 一种受茉莉酸甲酯和白叶枯病菌诱导的启动子、其制备方法和重组表达载体与流程
- MALDI‑TOFMS技术鉴定临床感染猪肠球菌的方法与流程
- 一种稻瘟病抗性基因Pi2的功能性分子标记及其应用的制造方法与工艺
- 一种与白叶枯病抗性基因Xa7紧密连锁的SNP分子标记及其应用的制造方法与工艺
- 一种与白叶枯病抗性基因Xa7紧密连锁的SNP分子标记及其应用的制造方法与工艺
- 一种水稻穗瘟抗性基因的分子标记方法与制造工艺
- OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种硫链丝菌素‑庆大霉素抗性基因体系及还有其的抗性表达盒和重组质粒的制造方法与工艺
- 含抗PD‑1基因和聚亚精胺的复合物及其在治疗肿瘤中的应用的制造方法与工艺