具染料协同降解作用的毛栓孔菌漆酶的培养制备法及用途的制作方法
本发明涉及微生物酶学领域,具体涉及一种具有染料降解协同作用的毛栓孔菌漆酶的培养及其制备方法。
背景技术:
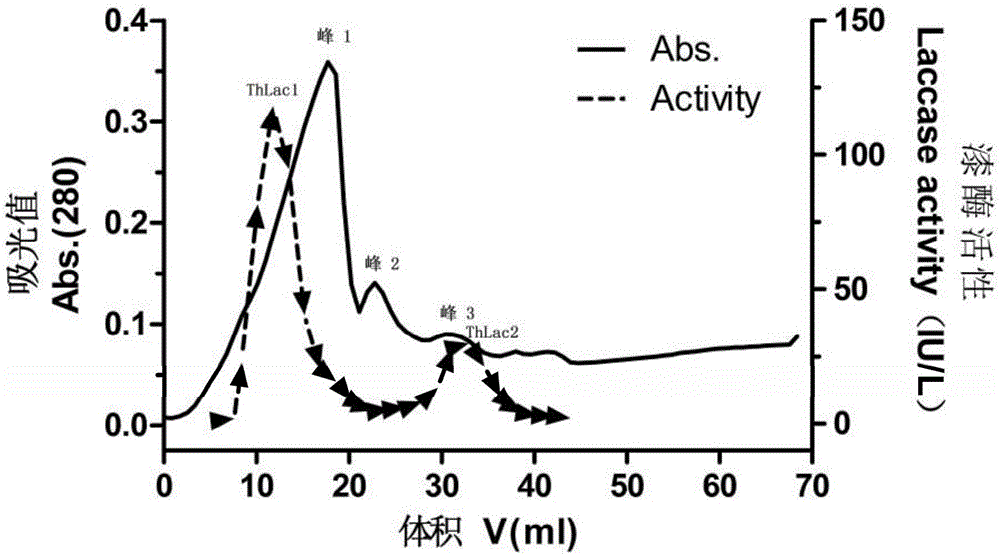
:漆酶(laccase,EC1.10.3.2)是一种含铜的多酚氧化酶,与植物中的抗坏血酸氧化酶、哺乳动物血浆中的铜蓝蛋白一起同属于铜蓝氧化酶家族。漆酶能从底物或介体中获得电子,然后再把电子传递给分子氧,最后形成水。由于漆酶催化机理的特殊性,使得其作用底物非常广泛。据统计漆酶能催化氧化6大类250余种化合物,包括酚类及其衍生物、芳胺类及其衍生物、羧酸及其衍生物、甾体激素和生物色素、金属有机化合物、以及其他的非酚类物质等。漆酶底物的广泛性及其在环境中的稳定性,所以它在造纸工业、染料脱色、食品和饮料工业、生物传感器和环境污染物的治理等方面具有较大的应用价值。染料工业中的废水处理是目前漆酶应用具有较大前景的领域之一。当前,世界染料年产量约为9×105吨,其中约有10%-15%的染料随着废水排入环境中,造成水体透光率低,导致水体生态系统的破坏。国内外常用的处理方法包括物理化学法和生物法。物理化学法包括絮凝沉降法、吸附法、化学氧化法、离子交换法和电解技术等,但是处理费用高,可能造成二次污染的问题。生物法是利用生物体或者酶来降解废水中的染料。相比之下,生物法是一种经济有效的处理方法。其中,漆酶被认为是一种非常有效环保的方法,因为漆酶可在有氧条件下,降解不同结构的多种染料,并最终将它们转化为CO2和H2O。真菌(特别是白腐真菌)是漆酶的主要生产者,是目前研究漆酶最广泛和深入的生物体,主要集中在革盖菌(Coriolus)、栓菌(Trametes)、原毛平革菌属(Phanerochaete)和密孔菌(Pycnoporus)等各属中。目前对于真菌漆酶的研究主要表现在漆酶活性诱导、漆酶理化性质研究、漆酶的固定化、以及漆酶在污染物降解、生物质转化、生物传感器等方面。对于同种真菌中漆酶同工酶的诱导培养研究较少,特别是同种真菌菌株中不同漆酶蛋白相互间的协同脱色能力未有报道。技术实现要素:本发明要解决的技术问题是提供一种具有染料降解协同作用的毛栓孔菌漆酶的培养制备法,其属于诱导毛栓孔菌产生多种漆酶同工酶的培养方法以及对于染料降解具有协同作用的漆酶制备技术。为了解决上述技术问题,本发明提供一种具染料协同降解作用的毛栓孔菌漆酶的培养制备法,包括如下步骤:1)、毛栓孔菌TrameteshirsutaMX2先在固体培养基上于28±0.5℃恒温培养7±1天,从而实现活化;将活化后的毛栓孔菌放入发酵培养基中,于150±10r/min、28±0.5℃下恒温振荡培养13±1天,所得的发酵液离心(4000±200rpm/min离心30±5min),离心后所得上清液为粗酶液;2)、将上述粗酶液分离纯化,得到两种漆酶同工酶,分别记为ThLac1和ThLac2;所述分离纯化包括超滤浓缩、硫酸铵沉淀透析、离子交换层析和凝胶层析;①、所述超滤浓缩为:将所述粗酶液放入滤膜孔径为10kDa的超滤管中,离心(4℃、4000±200rpm/min离心30±5分钟),得超滤液;②、所述硫酸铵沉淀透析为:在超滤液中加入(缓慢加入)硫酸铵,使溶液中硫酸铵的质量浓度达到80±2%,4℃过夜(即,12小时),离心(4000±200rpm/min离心30±5分钟),将沉淀用少量(即,为只需使沉淀溶解的量)0.05mol/L醋酸钠缓冲液(pH4.8)溶解,得酶液;将酶液装入孔径为12~14kDa的透析袋中,用50±5体积倍于酶液的0.05mol/L醋酸钠缓冲液(pH4.8)透析24±1h,透析过程中更换相同体积量的醋酸钠缓冲液2~4次(较佳为3次);得透析液;③、所述离子交换层析为:将上述透析液上层析柱(例如以0.4mL/min的流速),所述层析柱为DEAE-SepharoseFF层析柱(25×16mm);用0~0.5mol/LNaCl溶液和0.05mol/L醋酸钠缓冲液(pH4.8)进行洗脱(梯度洗脱),流速0.8mL/min,将具有相同活性的组分进行合并;收集由5.8%体积含量的NaCl溶液和94.2%体积含量的醋酸钠缓冲液组成的洗脱液对应的所得物,超滤浓缩,得ThLac1离子交换液;收集由13.3%体积含量的NaCl溶液和86.7%体积含量的醋酸钠缓冲液组成的洗脱液对应的所得物,超滤浓缩,得ThLac2离子交换液;④、所述凝胶层析为:将ThLac1离子交换液、ThLac2离子交换液分别进行以下操作:将其(离子交换液)加入层析柱,所述层析柱为SephacrylS-200层析柱(90×1.6cm);用0.05mol/L醋酸钠缓冲液(pH4.8)以0.15mL/min的流速洗脱,将有活性的组分合并后超滤浓缩;ThLac1离子交换液对应所得的为纯化漆酶ThLac1;ThLac2离子交换液对应所得的为纯化漆酶ThLac2。作为本发明的具染料协同降解作用的毛栓孔菌漆酶的培养制备法的改进:步骤1)中的发酵培养基为:碳源20克,酵母提取物10克,磷酸二氢钾2克,硫酸铵2克,七水硫酸镁0.5克,氯化钙0.1克,蒸馏水1000ml。备注说明:该发酵培养基pH自然。需常规灭菌(即,1.0×105Pa、121℃灭菌30min灭菌)。作为本发明的具染料协同降解作用的毛栓孔菌漆酶的培养制备法的进一步改进:碳源为白杨、毛竹、或者木质素磺酸钠。具体而言:上述白杨、毛竹为过60目筛的木屑或竹屑。作为本发明的具染料协同降解作用的毛栓孔菌漆酶的培养制备法的进一步改进:所述步骤1)的固体培养基为马铃薯葡萄糖培养基。配方为:马铃薯(去皮)200克,葡萄糖20克,琼脂15克,蒸馏水1000ml,pH自然。1.0×105Pa、121℃灭菌30min灭菌即可。该配方属于常规配方。作为本发明的具染料协同降解作用的毛栓孔菌漆酶的培养制备法的进一步改进:所述步骤2)的步骤③和步骤④中的超滤浓缩均为:放入10kDa的超滤管中,离心(4℃、4000±200rpm/min离心30±5分钟)。作为本发明的具染料协同降解作用的毛栓孔菌漆酶的培养制备法的进一步改进:所述步骤1)中:取1×1cm大小的活化后毛栓孔菌的菌饼放入至100mL发酵培养基中进行培养。在本发明的培养制备法中,步骤③的离子交换层析具体为:将DEAE-SepharoseFF层析柱(25×16mm)接入AKTApurifier蛋白纯化系统,以5mL/min流速的0.05mol/L醋酸钠缓冲液(pH4.8)平衡,使记录仪上的UV信号与基线重合;再将上述透析液以0.4mL/min的流速上层析柱,待UV信号返回基线后,用0-0.5mol/LNaCl溶液和0.05mol/L醋酸钠缓冲液(pH4.8)进行洗脱(梯度洗脱),流速0.8mL/min,FractionCollectorFrac-920收集器收集70管,每管1mL;测定每管的漆酶活性,将具有相同活性的组分进行合并,即,将第6~11管合并(对应的洗脱液中,NaCl溶液的体积含量为5.8%,醋酸钠缓冲液的体积含量为94.2%),将第19~23管合并(对应的洗脱液中,NaCl溶液的体积含量为13.3%,醋酸钠缓冲液的体积含量为86.7%);将2种合并后的所得物分别进行超滤浓缩,从而分别对应的获得ThLac1离子交换液和ThLac2离子交换液;步骤④的凝胶层析具体为:将SephacrylS-200层析柱(90×1.6cm)接入AKTApurifier蛋白纯化系统,以1mL/min流速的0.05mol/L醋酸钠缓冲液(pH4.8)平衡,使记录仪上的UV信号与基线重合;将上述离子交换液加入层析柱,然后用0.05mol/L醋酸钠缓冲液(pH4.8)以0.15mL/min的流速洗脱,FractionCollectorFrac-920收集器收集120管,每管1mL;测定每管的漆酶活性,将有活性的组分合并,具体为:ThLac1离子交换液凝胶层析收集第59~64管,ThLac2离子交换液凝胶层析收集第57~62管,将2种合并后的所得物分别进行超滤浓缩,从而分别得纯化漆酶ThLac1、纯化漆酶ThLac2。即,ThLac1离子交换液凝胶层析超滤浓缩后的为ThLac1,ThLac2离子交换液凝胶层析超滤浓缩后的为ThLac2。本发明中是以ABTS作为底物来测定漆酶活性。本发明还同时提供了利用方法制备所得的毛栓孔菌漆酶进行的染料脱色法:将ThLac1与ThLac2混合,所述ThLac1占混合酶总酶活的50~80%,然后混合酶放入染料中直至含量为50IU/L,然后进行脱色;脱色时间为≥3小时。本发明所用的毛栓孔菌为毛栓孔菌TrameteshirsutaMX2(骆静怡,傅威锐,潘程远.2015.木腐真菌的鉴定及对不同木材的腐朽能力.浙江农林大学学报,32(1):1-10)是一种白腐真菌,于2012年12月采自浙江临安马溪木材厂,现保存于浙江农林大学植物保护学科微生物实验室。在本发明中,步骤③对两种漆酶同工酶进行了分离,步骤④对两种漆酶同工酶进一步纯化,剔除杂蛋白。本发明利用不同碳源对毛栓孔菌TrameteshirsutaMX2漆酶进行诱导培养,产生两个漆酶蛋白,通过分离纯化,发现两个漆酶蛋白的理化性质不同以及对染料具有协同脱色作用。本发明所得的ThLac1漆酶具有如下一种或多种特性:①蛋白分子量61.4kDa,②以2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)为底物的最适pH值为2.0,最适温度为60℃,③以2,6-二甲氧基苯酚(DMP)为底物的最适pH值为4.0,最适温度为40℃,④对ABTS的Km值为0.0224mM,对DMP的Km值为0.7417mM,⑤以ABTS为底物,在pH6.0环境中,保温72h后的酶活保持在80%以上。本发明所得的ThLac2漆酶具有如下一种或多种特性:①蛋白分子量59.1kDa,②以ABTS为底物的最适pH值为2.5,最适温度为50℃,③以DMP为底物的最适pH值为4.0,最适温度为70℃,④对ABTS的Km值为0.0234mM,对DMP的Km值为0.6130mM,⑤最适pH条件下,以ABTS作为底物,在60℃中保温300min后的酶活保持在30%左右,其半衰期为3.12h。本发明具有如下技术优势:(1)以白杨木屑或竹屑为碳源比直接用葡萄糖为碳源诱导漆酶的活性要高出18.6-20.8倍,而且白杨木屑或竹屑多为废弃物,方便易得,可以降低发酵成本。(2)以白杨木屑或竹屑为碳源可以诱导毛栓孔菌TrameteshirsutaMX2产生两种理化性质各异的漆酶同工酶,ThLac1和ThLac2。ThLac1具有耐偏中性pH环境的能力(pH6.0下,保持72小时,残余活性达80%以上),而ThLac2具有较好的热稳定性。(3)ThLac1和ThLac2按一定比例混合使用对染料的降解脱色率显著的高于单独使用的脱色率。附图说明下面结合附图对本发明的具体实施方式作进一步详细说明。图1为不同碳源对毛栓孔菌(TrameteshirsutaMX2)漆酶活性的影响对比图;图2是毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2离子交换层析后的吸光值和漆酶活性图;图3是含漆酶活性离子交换液的凝胶层析后的吸光值和漆酶活性图;A:离子交换柱峰1(ThLac1)漆酶活性收集液;B:离子交换柱峰3(ThLac2)漆酶活性收集液;图4是native-PAGE(A)和SDS-PAGE(B)测定毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2的分子量及酶谱的电泳图;其中,M为蛋白质分子量Marker,泳道1为粗酶液,泳道2为超滤液,泳道3为经硫酸铵沉淀透析后的透析液,泳道4为经DEAE-SepharoseFF离子交换层以及SephacrylS-200层析后纯化的漆酶ThLac1,泳道5为经DEAE-SepharoseFF离子交换层以及SephacrylS-200层析后纯化的漆酶ThLac2;图5为pH对漆酶ThLac1(A)和ThLac2(B)活性的影响对比图;图6为pH对漆酶ThLac1(A)和ThLac2(B)稳定性的影响对比图;图7为温度对漆酶ThLac1(A)和ThLac2(B)活性的影响对比图;图8为温度对漆酶ThLac1(A)和ThLac2(B)稳定性的影响对比图;图9为蒽醌类染料AB129化学式图。具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:实施例1、毛栓孔菌(TrameteshirsutaMX2)漆酶的诱导培养将马铃薯葡萄糖(PDA)斜面培养基保存的毛栓孔菌(TrameteshirsutaMX2)接种到固体培养基上活化,28℃恒温培养箱培养7d,然后取1块1*1cm的正方菌饼到含100mL发酵培养基的250mL锥形瓶中,在150r/min、28℃下恒温振荡培养,每隔1天取1mL培养液到离心管中,4℃低温10000r/min离心5min,得到上清液作为粗酶液测定漆酶活性。以ABTS作为底物来测定漆酶活性。活性测定在3mL反应体系中:2.8mL浓度为0.5mmol/LABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)的0.05mol/L醋酸钠缓冲液(pH4.8),加入200μL粗酶液。25℃启动反应,测定反应3min内420nm处吸光度的变化,已知420nm处ABTS摩尔消光系数ε420=3.6×104L/(mol·cm)。以1min转化1μmolABTS所需的酶量为一个酶活力单位(IU)。活化用的固体培养基配方为:马铃薯(去皮)200克,葡萄糖20克,琼脂15克,蒸馏水1000ml,pH自然。1.0×105Pa、121℃灭菌30min灭菌即可。发酵培养基,配方为:碳源20克,酵母提取物10克,磷酸二氢钾2克,硫酸铵2克,七水硫酸镁0.5克,氯化钙0.1克,蒸馏水1000ml,pH自然。1.0×105Pa、121℃灭菌30min灭菌即可。本漆酶诱导培养是通过改变发酵培养基中的碳源种类来实现,碳源类型分别为:过60目筛子的白杨木屑、过60目筛子的毛竹屑、木质素磺酸钠、葡萄糖、蔗糖和淀粉。各种碳源在14天连续发酵培养下对漆酶活性的影响如图1所示。根据图1,我们得知:当蔗糖和淀粉作为碳源时,毛栓孔菌产漆酶活力在第3、4d达到高峰,酶活27.40和40.51IU/L,之后逐步下降,葡萄糖作为碳源时,毛栓孔菌产漆酶活力在第11天达到高峰,酶活为15.3IU/L。白杨、毛竹和木质素磺酸钠作为碳源时,毛栓孔菌产漆酶活明显优于葡萄糖、蔗糖和淀粉,其中,白杨在第13天达到高峰,漆酶活性为318.70IU/L。毛竹、木质素磺酸钠作为碳源时,毛栓孔菌产漆酶活力较白杨效果次之。实施例2-1、毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和ThLac2的分离纯化以白杨木屑作为发酵培养基的碳源,在150r/min、28℃下恒温振荡培养13天,将发酵液在4000rpm/min离心30min,离心后上清液即为粗酶液。将粗酶液经过超滤浓缩、硫酸铵沉淀透析、离子交换层析和凝胶层析等步骤进行分离纯化,具体过程如下:①、超滤浓缩:将粗酶液放入滤膜孔径为10kDa的超滤管中,在4℃、4000rpm/min离心30分钟,即为超滤液。②、硫酸铵沉淀透析:在超滤液中缓慢加入硫酸铵,使溶液中硫酸铵的最终浓度达到80%,4℃过夜,4000rpm/min离心30min,将沉淀用少量0.05mol/L醋酸钠缓冲液(pH4.8)溶解;将溶解的酶液装入透析袋(孔径为12-14kDa)中,用50倍于酶液的0.05mol/L醋酸钠缓冲液(pH4.8)透析24h,中间缓冲液更换3次,之后即为透析液。③、离子交换层析:将透析液以0.4mL/min的流速上样到已平衡过的DEAE-SepharoseFF层析柱(25*16mm)中,在AKTApurifier蛋白纯化系统用0.5mol/LNaCl和0.05mol/L醋酸钠缓冲液(pH4.8)梯度洗脱,流速0.8mL/min,用FractionCollectorFrac-920收集器每1mL收集1管,同时测定每管漆酶活性,洗脱曲线如图2共出现3个峰,用ABTS分别检测各峰值处洗脱液,发现峰1和峰3处具有很高的漆酶活性,分别记为ThLac1和ThLac2,并对ThLac1和ThLac2分别超滤浓缩,即为离子交换液。上述梯度洗脱时,0.5mol/LNaCl、0.05mol/L醋酸钠缓冲液(pH4.8)的体积含量如下表1所示。表1具体为:将第6~11管洗脱液合并(对应的洗脱液中,NaCl溶液的体积含量为5.8%,醋酸钠缓冲液的体积含量为94.2%),放入10kDa的超滤管中,离心(4℃、4000rpm/min离心30分钟),得ThLac1的离子交换液。将第19~23管洗脱液合并(对应的洗脱液中,NaCl溶液的体积含量为13.3%,醋酸钠缓冲液的体积含量为86.7%),放入10kDa的超滤管中,离心(4℃、4000rpm/min离心30分钟),得ThLac2的离子交换液。④凝胶层析为:分别对ThLac1和ThLac2的离子交换液上样已平衡的SephacrylS-200层析柱(90×1.6cm),用0.05mol/L醋酸钠缓冲液(pH4.8)以0.15mL/min的流速洗脱,用FractionCollectorFrac-920收集器每1mL收集1管,同时测定每管漆酶活性。ThLac1离子交换液洗脱后在59~64管仅有一个漆酶活性峰(见图3A),将之合并,放入10kDa的超滤管中,离心(4℃、4000rpm/min离心30分钟),成为最终的纯化漆酶ThLac1。ThLac2离子交换液洗脱后在57~62管也仅有一个漆酶活性峰(见图3B),将之合并,放入10kDa的超滤管中,离心(4℃、4000rpm/min离心30分钟),成为最终的纯化漆酶ThLac2。在本发明中,针对粗酶液、超滤浓缩、硫酸铵沉淀透析、离子交换层析和凝胶层析等各步骤收集一定样品进行总蛋白含量测定及漆酶活性测定,蛋白质含量测定使用Bradford原理,通过蛋白质定量检测试剂盒(上海生工)测定,漆酶活性使用ABTS为底物来测定。最终的纯化漆酶ThLac1的比活力为29.80IU/mg,活性回收率为4.26%,纯化倍数为22.25;漆酶ThLac2的比活力为12.22IU/mg,活性回收率为1.35%,纯化倍数为9.12,见表2。表2、毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2的分离纯化实施例2-2、将实施例2-1中的碳源由白杨木屑改成毛竹屑(过60目筛),其余类同于实施例2-1;结果如下:最终的纯化漆酶ThLac1的比活力为27.5IU/mg,活性回收率为4.02%,纯化倍数为21.2;漆酶ThLac2的比活力为11.5IU/mg,活性回收率为1.02%,纯化倍数为8.17。实施例2-3、将实施例2-1中的碳源由白杨木屑改成木质素磺酸钠,其余类同于实施例2-1;结果如下:最终的纯化漆酶ThLac1的比活力为2.64IU/mg,活性回收率为0.57%,纯化倍数为3.41;漆酶ThLac2的比活力为1.47IU/mg,活性回收率为0.15%,纯化倍数为1.24。实施例2-4、将实施例2-1中的碳源由白杨木屑分别改成葡萄糖、蔗糖、淀粉;其余类同于实施例2-1;结果如下:当碳源为葡萄糖时,所得结果为:仅能获得ThLac1,而不能获得ThLac2;当碳源为蔗糖时,所得结果为:仅能获得ThLac1,而不能获得ThLac2;当碳源为淀粉时,所得结果为:仅能获得ThLac1,而不能获得ThLac2。实施例3、漆酶ThLac1和ThLac2分子量测定及酶谱分析纯化漆酶ThLac1和ThLac2的分子量测定采用10%分离胶(w/v)和5%浓缩胶(w/v)的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行测算。凝胶电泳后经考马斯亮蓝R-250染色并显示拍照保存,再根据胶中标准蛋白质Marker估算分子量。纯化漆酶ThLac1和ThLac2的酶谱分析采用10%分离胶(w/v)和5%浓缩胶(w/v)的非变性聚丙烯酰胺凝胶电泳(native-PAGE)进行,其中,凝胶配制中不添加SDS,而且酶液不经过加热变性直接上样进行电泳,电泳之后,取出凝胶放入含有0.5mmol/LABTS的染色液中活性染色,并显示拍照保存。图4(A)显示的是毛栓孔菌(TrameteshirsutaMX2)漆酶的native-PAGE酶谱图,其中第1,2,3泳道中分别是粗酶液、浓缩液(即,超滤液)、透析液的酶谱图,因为没经过分离,所以各泳道中都显示出了ThLac1和ThLac2的图谱(上为ThLac1,下为ThLac2),第4,5泳道是经凝胶层析过柱后最终的纯化漆酶ThLac1和ThLac2的酶谱图;图4(B)显示的是毛栓孔菌(TrameteshirsutaMX2)漆酶的SDS-PAGE电泳图,其中第1,2,3泳道中分别是粗酶液、浓缩液(即,超滤液)、透析液的电泳图,第4,5泳道是经凝胶层析过柱后最终的纯化漆酶ThLac1和ThLac2的电泳图。实施例4、pH和温度对漆酶ThLac1和ThLac2活性及稳定性的影响1.pH对漆酶ThLac1和ThLac2活性及稳定性的影响在25℃条件下,将纯化漆酶ThLac1和ThLac2分别加入不同pH2.0-7.0的0.1mol/L柠檬酸-磷酸盐缓冲液中,测定不同pH下对ABTS和DMP的相对酶活性;pH对漆酶稳定性的影响通过漆酶与不同pH2.0-7.0的0.1mol/L柠檬酸-磷酸盐缓冲液混合保温放置0~72h后,分别测定其对ABTS和DMP的残余酶活性。以ABTS作为底物来测定漆酶活性。活性测定在3mL反应体系中:2.8mL1mmol/LABTS和相应pH的0.1mol/L柠檬酸-磷酸盐缓冲液,加入200μL粗酶液。25℃启动反应,测定反应3min内420nm处吸光度的变化,已知420nm处ABTS摩尔消光系数ε420=3.6×104L/(mol·cm)。以1min转化1μmolABTS所需的酶量为一个酶活力单位(IU)。以DMP为底物,反应体系和步骤同ABTS,不同处在于,测定470nm处吸光度的变化以及470nm处DMP摩尔消光系数ε470=1.48×104L/(mol·cm)。pH对漆酶ThLac1和ThLac2活性影响如图5所示。在25℃条件下,在酸性环境中(pH2.0-4.0),ThLac1和ThLac2表现出较好的活性。以ABTS作为底物,ThLac1的最适反应pH值为2.0,ThLac2的最适反应pH值为2.5;以DMP作为底物,ThLac1和ThLac2的最适反应pH值均为4.0。图5中也可以发现,ABTS作为底物时,ThLac1在pH2-3.5范围内酶活受pH影响不大,相对酶活力保持在90%以上,而ThLac2酶活受pH值影响较大,当pH大于2.5时,酶活随pH上升酶活力不断下降。pH对漆酶ThLac1和ThLac2稳定性影响如图6所示。在偏中性环境中(pH6.0),ThLac1和ThLac2均表现出较好的pH稳定性。以ABTS作为底物,在pH6.00.1mol/L柠檬酸-磷酸盐缓冲液中保温72h后,ThLac2的残余活性保持在55%左右,而ThLac1表现出更稳定的特性,残余活性保持在80%以上,说明在偏中性环境中,ThLac1的稳定性优于ThLac2的稳定性。2.温度对漆酶ThLac1和ThLac2活性及稳定性的影响在最适pH条件下,将纯化漆酶ThLac1和ThLac2分别加入不同温度10~85℃的缓冲液中,测定ABTS和DMP为底物的酶活性;温度对漆酶热稳定性的影响通过漆酶在不同温度50~80℃的缓冲液中,混合保温放置0~300min后,然后迅速冷却至室温,分别测定其对ABTS和DMP的残余酶活性。漆酶对ABTS和DMP的活性测定同上所述。温度对漆酶ThLac1和ThLac2活性影响如图7所示。最适pH条件下,ThLac1和ThLac2的活性先随着温度的升高而增加,基本上高于50℃达到最适反应温度,然后漆酶活性随着温度的升高开始下降。以ABTS作为底物,ThLac1的最适反应温度为60℃,ThLac2的最适反应温度为50℃;以DMP作为底物,ThLac1的最适反应温度为40℃,ThLac2的最适反应温度为70℃。图7中也可以发现,ABTS作为底物时,ThLac1在60-85℃范围内酶活受温度影响较大,相对酶活力快速下降,而ThLac2酶活受高温影响不大,在85℃时,相对酶活力仍有65%左右,远高于Lac1的16.4%。以DMP作为底物时,在高温条件下,ThLac2同样表现出优于ThLac1的活性。温度对漆酶ThLac1和ThLac2稳定性影响如图8所示。最适pH条件下,以ABTS作为底物,在60℃0.1mol/L柠檬酸-磷酸盐缓冲液中保温300min后,ThLac2的残余活性保持在30%左右,而ThLac1的残余活性只有1.9%,说明ThLac2表现出优于ThLac1的热稳定性。表3显示了不同温度下,ThLac1和ThLac2的半衰期。在50℃和60℃条件下,ThLac1的半衰期是4.19h和0.88h,而ThLac2在相同温度下表现出更好的热稳定性,半衰期是9.58h和3.12h。表3、不同温度下漆酶ThLac1和ThLac2的失活常数和半衰期实施例5、漆酶ThLac1和ThLac2对ABTS和DMP米氏常数Km的测定在最适pH和最适温度下,测定纯化漆酶ThLac1和ThLac2对底物ABTS和DMP的米氏常数。底物的浓度范围在0.01~1.0mmol/L之间,酶活测定方法同实施例4,然后作Lineweaver-Burk双倒数图求Km值。与其他真菌漆酶一样,ThLac1和ThLac2能催化氧化不同的漆酶底物,并对底物表现出相似的特异性。表4显示了漆酶ThLac1和ThLac2分别催化非酚类底物ABTS和酚类底物DMP时的动力学参数。ABTS的米氏常数较小,分别为0.0224mmol/L和0.0234mmol/L,而DMP的米氏常数达到0.7417mmol/L和0.613mmol/L,表明ThLac1和ThLac2与ABTS的亲和性较好。另外,两种漆酶对ABTS的催化效率也较高,达到4092.86S-1mM-1和1547.72S-1mM-1。表4、漆酶ThLac1和ThLac2对ABTS和DMP的酶动力学常数实施例6、漆酶ThLac1和ThLac2对染料的协同脱色作用本实施例中所用染料为蒽醌类的AcidBlue129(AB129),化学式见图9。该染料的最大吸收波长为629nm,在吸光度OD629为1时的浓度为208.3mg/L。脱色反应步骤为:在1mL的含有208.3mg/LAB129的醋酸钠缓冲液(0.05mol/L,pH4.8)中加入50IU/L按一定比例配制的ThLac1和ThLac2混合酶量,启动脱色反应,3小时后,分别测定反应前后吸光度OD629,计算漆酶对染料的脱色率D%。A0是反应前吸光值,A是反应后吸光值。脱色率计算公式为:D%=(A0-A)/A0×100。其中,ThLac1和ThLac2的比例(在总酶活为0.05IU中的酶活比例)配制为:0:10、1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1、10:0。漆酶ThLac1和ThLac不同比例下对AB129染料3小时后的降解脱色率见表5。当单独用漆酶ThLac1和ThLac2时对AB129的脱色率分别为44.6%和10.1%,显然,ThLac1的脱色效果要好于ThLac2。但是当两种漆酶以不同比例混合后,其脱色率都要高于两种漆酶单独使用时脱色率之和。特别是,当ThLac1和ThLac2比例在5:5-8:2之间时,混合脱色率都在80%以上,明显高于两种漆酶单独使用时脱色率之和的54.7%,表现出了两种漆酶对AB129脱色的协同增效作用,这为以后染料脱色工业或者染料废水处理提供了一条新的思路。表5、漆酶ThLac1和ThLac不同比例下对AB129染料3小时后的降解脱色率(平均值±标准差)ThLac1:ThLac2比例降解脱色率(%)0:1010.1±2.41:961.6±2.22:868.4±3.83:770.6±3.64:675.6±2.85:580.5±1.96:485.3±3.37:386.8±2.68:285.4±4.29:172.3±1.810:044.6±3.2对比例1-1、将实施例2-1“离子交换层析”步骤中的洗脱流速工艺参数由0.8mL/min改成1.6mL/min或者更快的流速,其余等同于实施例2-1。所得结果为:两种漆酶同工酶会一起脱洗下来,达不到分离效果,具体表现为:脱洗液中只产生一个漆酶活性波峰,或者两个漆酶活性波峰紧密相连,不易分离。对比例1-2、将实施例2-1“离子交换层析”步骤中的脱洗液中醋酸钠缓冲液的pH值工艺参数由4.8改成4.3或者更低,其余等同于实施例2-1。所得结果为:漆酶蛋白不能有效的结合到离子交换层析柱中,具体表现为:离子交换层析后漆酶的回收率偏低,由目前的(当醋酸钠缓冲液pH为4.8时)8.25%(ThLac1)和6.16%(ThLac2)减少到1.34%(ThLac1)和0.67%(ThLac2)或者更低。对比例2-1、将实施例2-1“凝胶层析”步骤中的醋酸钠缓冲液的脱洗流速工艺参数由0.15mL/min改成0.4mL/min或者更快的流速,其余等同于实施例2-1。所得结果为:漆酶中的杂蛋白不能有效分离,达不到凝胶层析的目的,具体表现为:脱洗液中蛋白质吸收峰仅表现为一个,或者波峰紧密相连。对比例2-2、将实施例2-1“凝胶层析”步骤中的醋酸钠缓冲液的脱洗流速工艺参数由0.15mL/min改成0.05mL/min或者更慢的流速,其余等同于实施例2-1。所得结果为:凝胶层析时间过长,更加费时;具体表现为:当流速为0.05mL/min或者更慢时,由目前0.15mL/min流速下7.7小时就可以分离出的ThLac1或者ThLac2,则需要23.3小时左右才能分离出ThLac1或者ThLac2,层析用时要增加2倍。最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1