呋喃妥因代谢物AHD衍生化半抗原、人工抗原的制备方法及其应用与流程
本发明涉及免疫化学技术领域,尤其涉及一种呋喃妥因代谢物ahd衍生化半抗原、人工抗原的制备方法及其应用。
背景技术:
呋喃类是人工合成的一类共有5-硝基呋喃环结构的抗生素,对革兰氏阳性菌、革兰氏阴性菌、部分真菌都具有抗菌效果。因价格低廉,被广泛地应用在畜禽和鱼类养殖中,用于治疗由沙门氏杆菌、大肠杆菌引起的肠炎,球虫病等,并且常作为畜牧动物以及水产鱼虾类的生长促进剂被添入饲料中。硝基呋喃类主要包括:呋喃它酮、呋喃西林、呋喃妥因和呋喃唑酮。但在食品安全中,呋喃妥因的大量或连续使用不仅对养殖动物有毒性作用,而且具有致癌、致畸、致突变作用,其代谢物还对人类健康有恶性影响。因此,许多国家已经明令禁止在饲养动物源性食品过程中使用呋喃妥因,并规定了在动物源性食品中的检验检疫标准。
目前用于检测呋喃妥因及其代谢物的方法主要有传统的检测方法,如分光光度法、高效液相色谱法及其联用技术等,以上方法虽然可以精确定量,但由于设备仪器昂贵,检测时间长,且需专业人员操作,因此无法实现真正意义上的现场检测;以及免疫学检测技术,此方法具有高特异性和高选择性的特点,非常适用于复杂基质痕量组分的分离或检测,随着学科间的相互渗透,其检测方法层出不穷,应用范围亦日益扩大。与传统检测方法相比,免疫学检测技术具有经济、快速、技术要点低、操作简便等特点。免疫分析检测技术是近年来在环境及食品检测等领域开发出来的一种新型快速准确检测方法,现已逐渐成为世界各国有毒有害残留物快速筛选检测的主要方法之一,也为呋喃妥因的检测提供了新的途径。
虽然呋喃妥因代谢物本身具有活性基团,但由于其分子量较小,空间结构不突出,直接制备的人工抗原存在灵敏度低的重大不足,无法满足现有市场的需求。因此需先通过化学方法设计出其半抗原,再进一步与载体蛋白结合获得具有免疫原性的完全抗原。
在专利公告号为“cn200910085648.2”的专利文件中,其检测的目标物为呋喃唑酮原料药,但由于呋喃唑酮进入动物体内后会代谢为ahd,而ahd又对人体有巨大的伤害,因此只检测呋喃唑酮原料药存在重大缺陷,无法满足市场要求。
在专利公告号为“cn200810019047.7,cn201210049810.7,cn201210098138.0”的专利文件中,其设计的半抗原结构为传统的4-cp衍生物结构,均无法保留其待测目标物的硝基端,使得半抗原、抗原制备获得的抗体均存在特异性差、亲和力低等不足。
在专利公告号为“cn201410593519.5”的专利文件中,其设计的半抗原结构无法保留硝基端,而且半抗原与ahd之间是通过磺酰胺键连接,与苯环不共轭,使半抗原的电子云密度与检测的目标物差异大,降低了灵敏度。
技术实现要素:
本发明要解决的技术问题是克服传统的ahd半抗原无法完整保留竞争物特征结构的缺陷,提供一种呋喃妥因代谢物ahd衍生化半抗原、人工抗原的制备方法及其应用,其可保留竞争物硝基端的半抗原,人工抗原,提高竞争物的特异性。
为达到上述目的,本发明提供技术如下:一种呋喃妥因代谢物的半抗原,为如下结构式ⅲ:
本发明解决该技术问题所采用的另一技术方案是,一种呋喃妥因代谢物的半抗原的制作方法,步骤如下:
(a)将化合物ⅰ溶解于乙醇中,所得溶液通过添加6mol/l的氢氧化锂溶液将ph值调至10-11,反应获得化合物ⅱ;
所述化合物ⅰ的结构式如下:
所述化合物ⅱ的结构式如下:
(b)将所述化合物ⅱ与呋喃妥因代谢物在甲醇条件下反应,既得所述呋喃妥因代谢物的半抗原;其为如下结构式ⅲ:
本发明解决该技术问题所采用的另一技术方案是,一种呋喃妥因代谢物的半抗原的制作方法,步骤如下:
(a’)将化合物ⅰ溶于乙醇中,所得溶液通过加入6mol/l的氢氧化锂溶液将ph值调至10-12,室温反应15~26h,加入纯化水,所得溶液通过1m的稀盐酸调将ph值调至4-5,过滤得到化合物ⅱ,所述化合物ⅰ反应生成所述化合物ⅱ的过程如下:
(b’)将所述化合物ⅱ溶解于甲醇中,加1.2-1.5摩尔当量的呋喃妥因代谢物ahd,于60~70℃反应2h,反应完毕,过滤,既得所述呋喃妥因代谢物的半抗原,所述半抗原的结构式ⅲ及合成路线如下:
本发明解决该技术问题所采用的另一技术方案是,一种呋喃妥因代谢物的人工抗原,是载体蛋白和所述的呋喃妥因代谢物的半抗原偶联得到的偶联物,其结构式iv为:
本发明解决该技术问题所采用的另一技术方案是,一种呋喃妥因代谢物的人工抗原的制备方法,步骤如下:
(1)取所述呋喃妥因代谢物的半抗原,溶解于二甲基甲酰胺(dmf)中,搅拌充分后,加入碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs),所述半抗原、碳二亚胺和n-羟基琥珀酰亚胺的重量比为5:4:3,室温下搅拌4-8h,即得半抗原活化酯;
(2)称取载体蛋白,所述载体蛋白与所述半抗原的摩尔当量比为30:1,使所述载体蛋白充分溶解在0.01mol/l的pbs溶液中,形成载体蛋白溶液,在搅拌下将所述半抗原活化酯逐滴缓慢滴加至所述载蛋白溶液中,并在室温下搅拌16-24h;
(3)将步骤(2)所得溶液在0.01mol/l的pbs溶液室温透析3天,每天换3次透析液;
(4)分装,于4℃保存备用。
其中,所述载体蛋白为牛血清白蛋白(bsa),卵清蛋白(ova),人血清白蛋白(has)或血蓝蛋白(klh)中的任意一种。
本发明解决该技术问题所采用的另一技术方案是,一致呋喃妥因代谢物的单克隆抗体的制备方法,步骤如下:
(i)以呋喃妥因代谢物的人工抗原为免疫原,与等体积弗氏佐剂乳化后,免疫balb/c小鼠,每只鼠免疫剂量为50~100μg,免疫间隔3周,免疫3次;
(ii)采步骤(i)处理后的小鼠尾部静脉血检测血清效价,如抗体效价不达60000,需加强免疫,待抗体效价不再升高后,以100μg免疫原进行皮下加强免疫,5天后取小鼠的脾细胞与sp20细胞融合;
(iii)融合后的细胞在hat培养基中筛选,5天后以完全培养基替换成hat培养基进行培养;
(iv)用elisa对步骤(iii)处理后的细胞上清进行检测,将检测结果为强阳性的孔内细胞进行有限稀释法克隆培养,经3次克隆培养检测后,均呈阳性的孔内细胞即为分泌单克隆抗体的杂交瘤细胞;
(v)将所述杂交瘤细胞放大培养后,接种至小鼠腹腔,产生含抗体的腹水,用辛酸-硫酸铵沉淀法纯化腹水,即得。
所述制备方法可得到高纯度、高特异性的单克隆抗体,所述单克隆抗体在检测水产品中呋喃妥因代谢物残留分析中应用。
本发明解决该技术问题所采用的另一技术方案是,呋喃妥因代谢物的人工抗原和呋喃妥因代谢物的单克隆抗体在检测呋喃妥因代谢物ahd中的应用,将所述的呋喃妥因代谢物的人工抗原作为包被原包被在酶标板上,将所述的呋喃妥因代谢物的单克隆抗体加入微孔板中;采用竞争法检测待检样本中呋喃妥因代谢物ahd的含量。
与现有技术相比,具有如下积极效果:传统方案的ahd半抗原结构均无法保留待测物的硝基端,使得半抗原、抗原制备获得的抗体均存在特异性差、亲和力低等不足。本发明中提供了一种新型ahd衍生物半抗原,以及基于该半抗原制备的一种人工抗原,阐述了两者的制备方法与应用。其思路是将ahd衍生化,获得具有活性基团和双键刚性支撑手臂的衍生物,同时还完整的保留了ahd衍生物的特征结构,对其电子云密度无影响,同时为了增强半抗原的免疫原性制备出高质量的抗体,该抗体可以特异性识别ahd衍生物。
该思路的有益效果体现在:(1)引入具有刚性支撑作用的双键手臂,使得ahd的结构特征明显增强,利于决定簇的良好呈现;(2)制备的半抗原完整的保留了ahd衍生物的特征结构,对其电子云密度无影响,使得小分子半抗原的免疫原性明显增强,有利于刺激动物免疫应答产生特异性更强、灵敏度更高的抗体;(3)本发明提供的ahd的快速检测方法最低检测限可达0.05ng/g。
下面结合附图和实施例对本发明作进一步说明。
附图说明
图1是本发明的呋喃妥因代谢物的半抗原的合成路线。
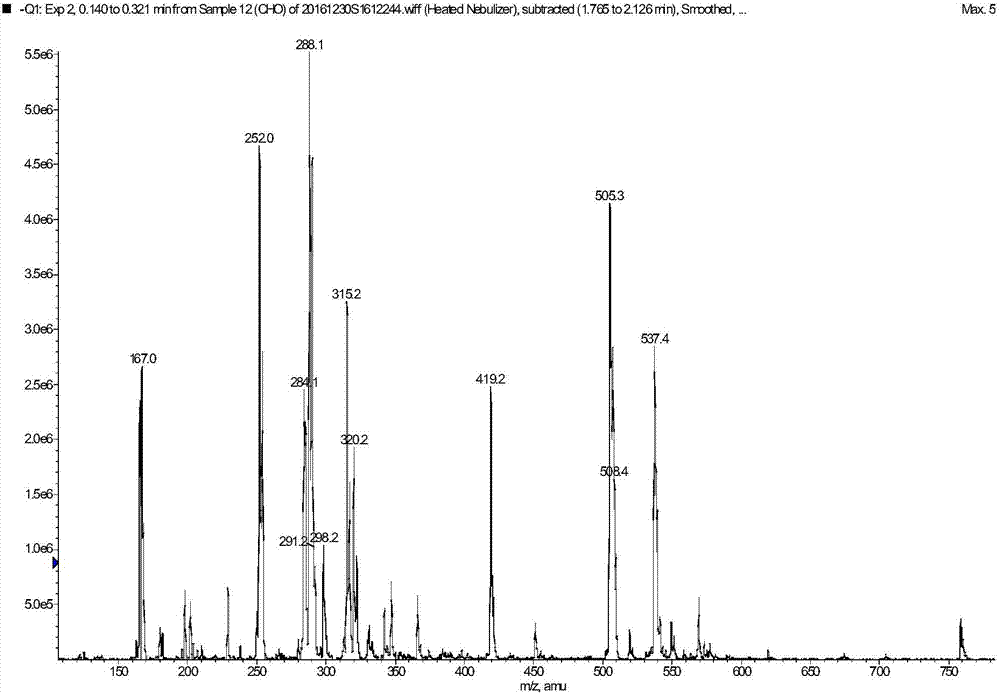
图2是本实施例1中化合物ⅱ的esi-ms图谱。
图3是本实施例1中化合物ⅱ的核磁共振氢谱图谱。
图4是本实施例1中呋喃妥因代谢物的半抗原的esi-ms图谱。
图5是本实施例1中呋喃妥因代谢物的半抗原的核磁共振氢谱图谱。
图6是本实施例4中呋喃妥因代谢物的人工抗原为免疫原制备的抗体建立的对ahd衍生物的抑制曲线。
具体实施方式
实施例1
如图1-5所示,本实施例1的呋喃妥因代谢物ahd衍生化半抗原通过以下方法制备,步骤如下:
(a’)将2.0g(即7.1mmol)的化合物ⅰ溶于10ml的乙醇中,加入6mol/l的氢氧化锂溶液,将化合物ⅰ的乙醇溶液调至ph值为10-12,室温反应15~26h,加入40ml纯化水,所得溶液用1m的稀盐酸调ph值至4~5,过滤,烘干得到1.1g的化合物ⅱ。
esi-ms:167[m-ch2ch2ch2cooh-1],252[m-1],288[m+2h2o-1],315[2×167-h2o-1],505[2m-1],537[2m+meoh-1];
1hnmr(600mhz,cdcl3,tms):δ10.50(s,1h),8.20(d,1h),7.35(d,1h),7.15-7.19(dd,1h),4.23(t,2h),2.66(t,2h),2.26(m,2h)。
(b’)将0.5g(即2.0mmol)的化合物ⅱ溶解于10ml甲醇中,加入0.27g(即2.4mmol)的呋喃妥因代谢物ahd,于60~70℃反应2h,反应完毕,冷却至室温,过滤,得0.26g的呋喃妥因代谢物的半抗原,所述半抗原的结构式ⅲ及其合成路线见图1。
esi-ms:351[m+1];
1hnmr(600mhz,dmso,tms):δ11.39(s,1h),8.16(t,2h),7.40(d,1h),7.22(dd,1h),4.37(s,2h),4.19(t,2h),2.42(t,2h),2.04(m,2h)。
实施例2
本实施例2是呋喃妥因代谢物的人工抗原,所述人工抗原包括免疫原与包被原,两者的不同之处在于制备过程中偶联的载体蛋白种类不同,所述免疫原采用实施例1制备的半抗原,载体蛋白采用牛血清蛋白(bsa);所述包被原采用实施例1制备的半抗原,载体蛋白采用卵清蛋白(ova)。
本实施例2的呋喃妥因代谢物的包被原,通过以下方法制备,其步骤依次如下:
(1)取10.0mg实施例1的半抗原,溶解于0.5ml二甲基甲酰胺(dmf)中,搅拌充分后,加入8.0mg碳二亚胺(edc)和6.0mg的n-羟基琥珀酰亚胺(nhs),室温下搅拌4h,即可得到半抗原活化酯;
(2)称取38.1mg的卵清蛋白(ova),使其充分溶解在4ml的浓度为0.01mol/l的pbs溶液中,形成载体蛋白溶液,在搅拌下将半抗原活化酯逐滴缓慢滴加至载体蛋白溶液中,并在室温下搅拌24h;
(3)步骤(2)制得的溶液用0.01mol/l的pbs溶液室温透析3天,每天换3次透析液,以除去未反应的小分子物质;
(4)分装,于4℃保存备用。
其中,实施例1的半抗原与卵清蛋白(ova)的摩尔比为30:1。
本实施例2的呋喃妥因代谢物的免疫原,通过以下方法制备,其步骤依次如下:
(1’)取10.0mg实施例1的半抗原,溶解于0.5ml二甲基甲酰胺(dmf)中,搅拌充分后,加入8.0mg碳二亚胺(edc)和6.0mg的n-羟基琥珀酰亚胺(nhs),室温下搅拌4h,即可得到半抗原活化酯;
(2’)称取62.8mg的牛血清白蛋白(bsa),使其充分溶解在4ml的浓度为0.01mol/l的pbs溶液中,形成载体蛋白溶液,在搅拌下将半抗原活化酯逐滴缓慢滴加至载体蛋白溶液中,并在室温下搅拌24h;
(3’)步骤(2’)制得的溶液用0.01mol/l的pbs溶液室温透析3天,每天换3次透析液,以除去未反应的小分子物质;
(4’)分装,于4℃保存备用。
其中,实施例1的半抗原与牛血清白蛋白(bsa)的摩尔比为30:1。
其中,以下提及的免疫原式(ⅲ)-bsa即为本实施例2的呋喃妥因代谢物,包被原式(ⅲ)-ova即为本实施例2的呋喃妥因代谢物。
实施例3
本实施例3的呋喃妥因代谢物的单克隆抗体,通过以下方法制备,其步骤为:
将实施例2制备的免疫原式(ⅲ)-bsa,与等体积弗氏佐剂乳化后,免疫balb/c小鼠。每只鼠免疫剂量为50~100μg,免疫间隔3周,免疫3次后,采小鼠尾部静脉血检测血清效价。如抗体效价不达60000,需加强免疫,待抗体效价不再升高后,以100μg免疫原进行皮下加强免疫,5天后取小鼠的脾细胞与sp20细胞融合。融合后的细胞在hat培养基中筛选,5天后以完全培养基替换成hat培养基进行培养。用elisa对细胞上清进行检测,将检测结果为强阳性的孔内细胞进行有限稀释法克隆培养,经3次克隆培养检测后,均呈阳性的孔内细胞即为分泌单克隆抗体的杂交瘤细胞。将杂交瘤细胞放大培养后,接种至小鼠腹腔,产生含抗体的腹水。用辛酸-硫酸铵沉淀法纯化腹水,即可得到高纯度、高特异性的单克隆抗体。
elisa间接竞争法测定抗体阳性滴度以3倍于阴性血清的测定值为准,结果表明包被原式(ⅲ)-ova对应的抗血清(ab-式(ⅲ))效价为1:72000。
实施例4
单克隆抗体的特异性及灵敏度。
4.1酶标板的制备方法
用ph9.6的碳酸盐缓冲液作包被稀释液,将实施例2制备的式(ⅲ)-ova稀释至0.2μg/ml,按100μl/孔加入聚苯乙烯微孔板中,4℃包被过夜,甩干,按250μl/孔加入含1%bsa,磷酸盐缓冲液中37℃封闭1h,甩干,干燥后真空包装保存。
4.2抗体的配制
用含0.05%叠氮钠,ph7.4的磷酸盐缓冲液,将实施例3制备的单克隆抗体稀释至0.05μg/ml,4℃保存。
4.3标准溶液的配制
呋喃妥因代谢物ahd的衍生物标准溶液为精确称量呋喃妥因代谢物ahd的衍生物标准品10mg,先用dmf和纯化水各1ml溶解,再用ph7.4的磷酸盐缓冲液配制系列浓度为0μg/l,0.05μg/l,0.15μg/l,0.45μg/l,1.35μg/l,以及4.05μg/l的呋喃妥因代谢物ahd的衍生物标准溶液。
4.4评价结果
向包被有(ⅲ)-ova的微孔酶标板中加入呋喃妥因代谢物ahd的衍生物标准溶液50μl/孔,再加入配制好的单克隆抗体溶液50μl/孔,37℃反应0.5h;甩干后,加入洗液300μl/孔,洗涤3次后拍干;再加入酶标二抗100μl/孔,37℃反应0.5h;再次洗涤3次后拍干,分别加入50μl/孔的显色液a和显色液b,37℃反应15min;加入2m硫酸50μl/孔终止,设定酶标仪于450nm波长测定每孔的od值。结果如表1和图6。
表1:elisa测试不同浓度呋喃妥因代谢物ahd的衍生物标准品od值
其中,b/b0是指不同浓度的标准品测试孔od值与含量为0的标准品测试孔od值的比值。从表1中可看出,当呋喃妥因代谢物ahd的衍生物含量为0.05μg/l时,其b/b0值为74.54%,说明其检测od与含0μg/l浓度的呋喃妥因代谢物ahd的衍生物测试孔od值有明显差异,故elisa对呋喃妥因代谢物ahd的衍生物检测灵敏度均可达0.05μg/l。
本发明采用的试剂和仪器及其它术语参见现有技术及公知常识。
本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变型。
- 还没有人留言评论。精彩留言会获得点赞!