病毒培养方法与流程
本发明涉及生物技术领域中,病毒培养方法。
背景技术:
病毒感染是导致全球儿童呼吸道疾病高发病率和高死亡率的重要原因之一,其中许多病毒具有感染力强、传播快、潜伏期短、发病急、病后免疫力不能持久等特点,极易造成疾病大流行。然而,病毒研究的发展常常与病毒培养有密切的关系。目前,部分新发呼吸道病毒(如人冠状病毒和人偏肺病毒等)的体外培养分离率(增殖效率)非常低,还有部分新发呼吸道病毒(如人博卡病毒和C组鼻病毒等)则缺乏体外细胞培养模型。这极大地阻碍了新发呼吸道病毒的研究工作。因此,迫切需要建立新一代细胞技术平台来解决这些病毒体外难于培养的问题。体外组织细胞培养是开展新病毒分离鉴定、致病机理及疫苗研发等工作不可或缺的技术平台。
在病毒学的发展史中,利用体外培养的动物组织、胚胎或细胞,分离或培养病毒是突破性的成就。动物组织、胚胎等主要是选取易感动物如家兔、小白鼠、大白鼠、豚鼠、仓鼠等选择对目的病毒敏感的试验动物品种、品系,以适宜的接种途径和剂量接种病毒,分离病毒,并借助感染范围试验鉴定病毒。动物模型可以观察病毒对机体的侵害,造成的病理变化部位,也不需要复杂的仪器设备,操作简单,但实验动物个体差异大,且价格昂贵,还需准备畜舍,实验中受环境因素影响大,不可控因素多。
三维(3D)细胞培养技术是指利用各种方法及支持材料,模拟有机体内生长模式,使培养细胞在体外呈现空间立体方式生长,形成类似有机体内组织结构。
技术实现要素:
本发明所要解决的技术问题是如何培养病毒,尤其是在传统的体外细胞培养中不能或不易培养的病毒,在利用本发明的病毒培养方法成功培养该类不易培养的病毒后,可以得知该类病毒的特点是在二维细胞中不能培养、或在二维细胞中能培养但不能或不易分离或分离效率低。所述二维细胞是指单个细胞或由单个细胞组成的细胞群,所述细胞群不具有类似于或同于所述单个细胞来源的动物组织的结构。
为解决上述技术问题,本发明首先提供了病毒培养方法。
本发明所提供的病毒培养方法,包括利用三维细胞培养方法培养动物细胞,得到三维培养的细胞;用病毒接种所述三维培养的细胞进行所述病毒的培养。
所述三维培养的细胞具有类似于或同于所述动物细胞来源的动物组织的结构。所述三维培养的细胞均能形成三维立体细胞,而且细胞表面多突触。所述三维培养的细胞具体可为含有所述动物组织特异型蛋白质的细胞。
上述病毒培养方法中,所述病毒可以以所述动物为宿主。所述动物可为哺乳动物。所述哺乳动物具体可为人。
上述病毒培养方法中,所述病毒可为在现有的病毒培养方法中不能培养、或能培养但不能或不易分离或分离效率低的病毒。所述现有的病毒培养方法可为以下A1-A3这三种中的任一种:
A1.动物接种;
A2.鸡胚接种;
A3.组织培养;所述组织培养是指对动物细胞或组织或器官进行培养后再接种病毒培养病毒。所述对动物细胞进行培养是指对动物细胞进行二维的培养。所述二维的培养可为培养得到所述二维细胞的培养。
上述病毒培养方法中,所述病毒可为下述1)或2):
1)在二维细胞中不能培养的病毒;
2)在二维细胞中能培养但培养效率低的病毒。
上述病毒培养方法中,所述呼吸道病毒可为下述b1)或b2):
b1)呼吸道病毒;
b2)博卡病毒或C组鼻病毒。
所述博卡病毒可为人博卡病毒。所述C组鼻病毒可为人C组鼻病毒。
在本发明的一个实施例中,用本发明的病毒培养方法培养的病毒为C组鼻病毒(HRVc),在二维细胞中培养C组鼻病毒时,该病毒不能复制扩增。
在本发明的另一个实施例中,用本发明的病毒培养方法培养的病毒为博卡病毒(HBoV),在二维细胞中培养博卡病毒时,该病毒不能复制扩增。
上述病毒培养方法中,所述动物细胞可为哺乳动物细胞。所述哺乳动物细胞可为人细胞。所述人细胞具体可为人呼吸道上皮细胞。所述人呼吸道上皮细胞可为人呼吸道上皮细胞或人支气管上皮细胞。所述动物细胞可为原代细胞亦可为传代细胞。
在本发明的实施例中得到的所述三维培养的细胞特异性表达上皮组织特异性蛋白质细胞角蛋白5(CK5)、胞质紧密粘连蛋白1(ZO-1)和泛细胞角质蛋白(PCK)。
上述病毒培养方法中,所述三维细胞培养方法可为利用现有技术中的方法培养所述动物细胞得到所述三维培养的细胞。所述三维细胞培养方法具体可包括利用3D培养基和/或基质胶培养所述动物细胞,得到所述三维培养的细胞。
所述利用3D培养基和/或基质胶培养所述动物细胞可将所述动物细胞在基质胶内部和/或外部进行培养。所述培养所述动物细胞的温度可为34-37℃。所述培养所述动物细胞具体可在CO2培养箱中进行培养。所述3D培养基具体可为BEGM BulletKit(CC-3171&CC-4175,美国Lonza公司)培养基。所述基质胶具体可为Corning Matrigel Growth Factor Reduced(GFR)Basement Membrane Matrix(356231,美国Corning公司)。
所述病毒培养的温度可为34-37℃。所述病毒的培养具体可在CO2培养箱中进行。
为解决上述技术问题,本发明还提供了下述任一应用:
X1)三维细胞培养方法在培养和/或分离病毒中的应用;
X2)三维细胞培养方法所用物质在培养和/或分离病毒中的应用;
X3)三维细胞培养方法所用物质在制备培养和/或分离病毒产品中的应用;
X4)三维细胞培养方法在构建培养和/或分离病毒的细胞培养模型中的应用;
X5)三维细胞培养方法所用物质在构建培养和/或分离病毒的细胞培养模型中的应用;
X6)三维细胞培养方法所用物质在制备构建培养和/或分离病毒的细胞培养模型产品中的应用;
X7)三维细胞培养方法在制备抗病毒疫苗和/或药物中的应用。
上述应用中,所述三维细胞培养方法为上述病毒培养方法中所述三维细胞培养方法。所述病毒可为所述三维细胞培养方法中所述病毒。
实验证明,本发明的病毒培养方法可以成功培养在体外二维细胞中不能培养或能培养但培养效率低的病毒:在体外三维培养细胞中培养的病毒含量起初基本保持一个浓度不变,之后有上升趋势,并达到最高浓度,然后有所下降,下降趋势比较缓慢,而相同的病毒在二维细胞中进行培养时,病毒含量极低,几乎检测不到,并且在后续培养中没有增加现象。本发明不需特殊的3D细胞培养装置,极大地降低了成本,易于操作,适合小规模3D细胞培养及小规模难培养病毒的培养。本发明的病毒培养方法培养病毒时,相比较有机体,易于实验室操作,加快实验进程;可以更换接种细胞类型,培养出不同类型的组织器官模型;并可避开了直接以人作为初始实验研究对象的伦理道德担忧。本发明成功实现呼吸道病毒的体外细胞培养,形成具有我国自主知识产权的难培养病毒的病毒培养技术。
附图说明
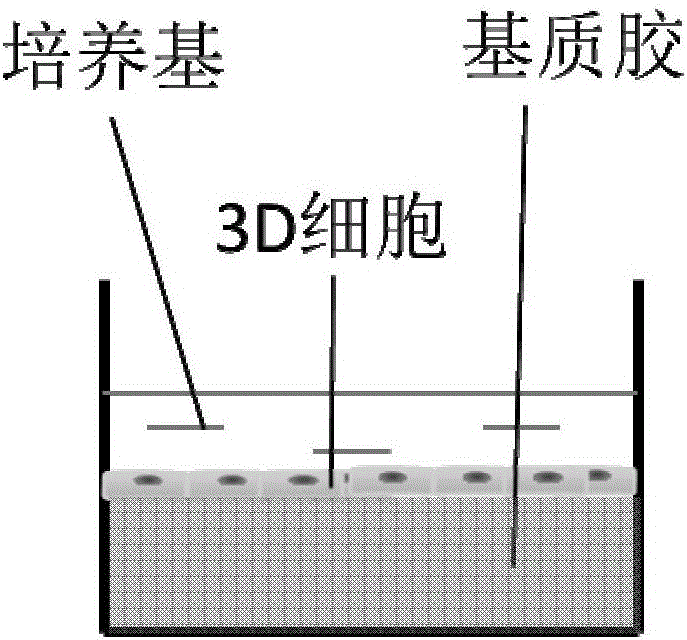
图1为呼吸道上皮细胞基质胶内培养示意图。
图2为呼吸道上皮细胞基质胶表面培养示意图。
图3为呼吸道上皮细胞基质胶内/外共培养示意图。
图4为细胞光学显微图像(20X),左图为2D细胞,右图为3D细胞。
图5为细胞透射电镜图像(9700X),左图为2D细胞,右图为3D细胞。其中箭头所指为细胞表面突触。
图6为细胞的组织特异性蛋白表达,左图为2D细胞,右图为3D细胞。
图7为HRVc的扩增曲线。纵坐标单位为拷贝数/200μL。
图8为HBoV的扩增曲线。纵坐标单位为拷贝数/200μL。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明所提供的病毒培养方法,包括利用三维细胞培养方法培养动物细胞,得到三维培养的细胞;用病毒接种三维培养的细胞培养所述病毒。下面以在呼吸道上皮细胞的三维培养的细胞中培养人C组鼻病毒和博卡病毒为例,具体阐述在二维细胞中难培养的病毒的培养方法。
下述实施例中的人原代呼吸道上皮细胞HAE(朱娜等,人原代呼吸道上皮细胞体系分离人冠状病毒HKU1的方法及其复制特点.中华实验和临床病毒学杂志,2015.29(1):第80-82页)常规培养可用三维培养基BEGM培养基培养,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的传代人支气管上皮样细胞BEAS-2B(Xie,G.C.,et al.,Gene Knockdown in Human Rhinovirus 1B Using 2'-OMe-modified siRNAs Results in the Reactivation of the Interferon Response.Biomed Environ Sci,2016.29(2):p.137-42.)常规培养用加入10%血清(10099-141-FBS,美国Gibco|Thermo Fisher Scientific公司)和1%双抗(15140163,美国Gibco|Thermo Fisher Scientific公司)的RPMI-1640(11875093,美国Gibco|Thermo Fisher Scientific公司)培养基进行培养,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的C组鼻病毒为人C组鼻病毒(Human enterovirus C,HRVc)(Zeng,S.Z.,et al.,Prevalence of human rhinovirus in children admitted to hospital with acute lower respiratory tract infections in Changsha,China.J Med Virol,2014.86(11):p.1983-9.)公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的博卡病毒(HBoV)为人博卡病毒(肖霓光等,1165例急性下呼吸道感染住院儿童的病毒病原学分析.中国当代儿科杂志,2012.14(1):第28-32页.),公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的3D培养基为BEGM BulletKit(CC-3171&CC-4175,瑞士Lonza公司)培养基产品,基质胶具体为Growth Factor Reduced(GFR)Basement Membrane Matrix(356231,美国Corning公司)。
实施例1、病毒的培养
1、准备细胞:
复苏冻存的原代或传代呼吸道上皮细胞(人原代呼吸道上皮细胞HAE和传代人支气管上皮样细胞BEAS-2B),于37℃、5.0%(体积百分比)的CO2培养箱进行培养,然后按照下述步骤2的方法分别对人原代呼吸道上皮细胞HAE和传代人支气管上皮样细胞BEAS-2B进行三维细胞培养。
2、三维细胞的培养:
分别采取下述方案一、方案二和方案三进行三维细胞的培养:
方案一:基质胶内培养体系培养三维细胞,培养过程如图1所示,具体步骤如下:
A.挑选状态良好的原代或传代呼吸道上皮细胞进行普通二维培养,待细胞状态良好,即满度达到70%-80%时用于后续实验;
B.将步骤A二维培养得到的呼吸道上皮细胞用0.25%的胰酶-EDTA(25300-054,美国Gibco|Thermo Fisher Scientific公司)消化并离心,洗去血清,用3D培养基重悬细胞,得到细胞悬液;按250μL细胞悬液:750μL基质胶(Matrigel)的比例混合,得到基质胶和细胞混合液;将该混合液接种到24孔板中,每孔200μL,105个细胞/孔,置于37℃、5.0%(体积百分比)的CO2培养箱孵育45min,使混合液固化,得到细胞混合固态基质胶;
C.向步骤B得到的细胞混合固态基质胶上加入新鲜的3D细胞培养基,置于37℃、5.0%(体积百分比)CO2培养箱中培养,每隔2天换一次3D细胞培养基;
D.培养7天后,得到三维培养的细胞(3D细胞),将该三维培养的细胞命名为三维培养的细胞1。
方案二:基质胶表面培养体系培养三维细胞,培养过程如图2所示,具体步骤如下:
A.按呼吸道上皮细胞的常规方法培养原代或传代呼吸道上皮细胞;
B.将基质胶铺到多孔板中,置37℃、5.0%(体积百分比)CO2培养箱45min,使基质胶固化;
C.将步骤A培养得到的呼吸道上皮细胞用0.25%的胰酶-EDTA消化,离心,然后用3D细胞培养基重悬细胞,得到细胞悬液,将细胞悬液按照0.5×106个/mL,200μL/孔的体积接种于已凝固的基质胶表面,置于37℃、5.0%(体积百分比)CO2培养箱中培养,每隔2天换一次3D细胞培养基;
D.培养7天后,得到三维培养的细胞(3D细胞),将该三维培养的细胞命名为三维培养的细胞2。
方案三:基质胶内/外共培养体系培养三维细胞,培养过程如图3所示,具体步骤如下:
A.挑选状态良好的原代或传代呼吸道上皮细胞进行普通二维培养,待细胞状态良好,即满度达到70%-80%时用于后续实验;
B.将步骤A二维培养得到的呼吸道上皮细胞用0.25%的胰酶-EDTA消化并离心,洗去血清,利用3D培养基重悬细胞,得到细胞悬液;将细胞悬液与基质胶按250μL细胞悬液:750μL基质胶的比例混合,得到基质胶和细胞混合液;将该混合液接种到24孔板中,每孔200μL,105个细胞/孔,置于37℃、5.0%(体积百分比)的CO2培养箱孵育45min,使基质胶和呼吸道上皮细胞混合液固化,得到细胞混合固态基质胶;
C.在步骤B得到的细胞混合固态基质胶上再加入终浓度为105个细胞/mL细胞悬液200μL,置于37℃、5.0%(体积百分比)CO2培养箱中培养,每隔2天换一次3D细胞培养基;
D.培养7天后,得到三维培养的细胞(3D细胞),将该三维培养的细胞命名为三维培养的细胞3。
二维细胞的培养:用1640培养基、于37℃、5.0%(体积百分比)CO2培养箱中培养原代或传代呼吸道上皮细胞7天,每隔2天换一次培养基,得到二维培养的细胞(2D细胞)。
细胞的鉴定:
通过光学显微镜(CKX31,奥林巴斯)与电镜(通过投射电镜(TECNAI 12,美国FEI公司)观察,用CCD相机(Erlangshen Model 1785,美国Gatan公司)拍照)观察人原代呼吸道上皮细胞HAE和传代人支气管上皮样细胞BEAS-2B按照方案一至三得到的三维培养的细胞与经二维细胞的培养得到的二维细胞的细胞组织形态,人原代呼吸道上皮细胞HAE三维培养的细胞的结果如图4和图5所示。结果显示,人原代呼吸道上皮细胞HAE和传代人支气管上皮样细胞BEAS-2B按照方案一至三培养后得到的细胞均能形成三维立体细胞,而且细胞表面多突触;而二维细胞则均不具有这些特征。
利用免疫荧光技术检测上皮组织特异性蛋白(细胞角蛋白5(CK5)、胞质紧密粘连蛋白1(ZO-1)和泛细胞角质蛋白(PCK)),检测CK5用到的抗体为Cytokeratin 5Antibody(Santa Cruz Biotechnology公司出产,sc-32721),检测ZO-1用到的抗体为ZO-1Antibody(美国Santa Cruz Biotechnology公司出产,sc-10804),检测PCK用到的抗体为pan-Cytokeratin Antibody(Santa Cruz Biotechnology公司出产,sc-15367);小鼠抗兔TIRTC、小鼠抗兔FITC、羊抗小鼠TIRTC和羊抗小鼠FITC均为北京全式金生物技术有限公司产品,用β-tublin作为对照,共聚焦显微镜(FV1000,日本奥林巴斯公司)观察拍照。人原代呼吸道上皮细胞HAE得到的三维培养的细胞1的鉴定结果如图6所示。结果显示,人原代呼吸道上皮细胞HAE和传代人支气管上皮样细胞BEAS-2B按照方案一至三培养后均有CK5、ZO-1和PCK表达;而二维细胞则均无CK5、ZO-1和PCK表达。图6中,DAPI染色显为细胞核结果,Merge表示免疫组化叠加图。
以上结果表明,三维培养的细胞1-3具表达人体呼吸道上皮组织特异性蛋白,表明三维培养的细胞1-3均形成了与人体呼吸道上皮组织类似的特点,而二维细胞并不具有该结果。
4、病毒培养
4.1C组鼻病毒(HRVc)的培养
选取原代人支气管上皮细胞HAE,按照方案三进行培养,得到三维培养的HAE;按照二维培养的方法培养原代人支气管上皮细胞HAE,得到二维培养的HAE,然后利用三维培养的HAE和二维培养的HAE按照如下方法培养病毒:首先,分别用PBS洗细胞一次,接种C组鼻病毒(HRVc)(病毒核酸浓度为1.86E6拷贝/200μL)50μL/每孔,于34℃,5.0%的CO2培养箱中孵育两个小时,然后用PBS小心地洗三次,每次5min,加入新鲜培养基(三维培养的HAE中加入3D培养基,二维培养的HAE中加入2%的1640培养基)200μL,34℃,5.0%的CO2培养箱中进行培养,每天收取一次样品(细胞样品和上清),其余时间点细胞样品每两天换一次新鲜培养基。
检测三维细胞培养时细胞内及细胞外(上清)HRVc的含量及二维细胞培养液中HRVc含量:提取核酸,并用qRT-PCR(7500型实时荧光定量PCR系统,美国ABI公司)进行检测病毒扩增情况:探针:FAM-CCG GCC CCT GAA T-MGB,HRVc引物(5’到3’):上游引物:5’-AAA GAT TGG ACA GGG TGT GAA GA-3’,下游引物:5’-GAA ACA CGG ACA CCC AAA GTA GT-3’。
结果如表1所示,HRVc感染三维细胞后的病毒核酸扩增曲线如图7所示。
表1、细胞培养过程中的HRVc核酸含量(病毒基因组拷贝数/200μL)
检测发现,三维细胞样本中培养的病毒核酸含量开始有下降趋势,到第三天达到最低,这可能是因为病毒感染三维细胞之后,有一个潜伏期,为合成病毒复制前期。此外,还有部分进入细胞的病毒排出细胞外。然后升高,到第五天达到最高浓度,然后又慢慢下降。
每天收集的三维培养细胞上清中检测到病毒核酸含量起初基本保持一个浓度不变,到第三天后有上升趋势,到第五天达到最高浓度,然后有所下降,下降趋势比较缓慢。而二维细胞中的病毒含量极其微弱,几乎检测不到,并且在后续几天中没有增加现象。综上所述,利用三维培养的细胞可以成功扩增C组鼻病毒(HRVc),而培养的二维细胞不可以扩增该病毒。
4.2博卡病毒(HBoV)的培养
选取传代人支气管上皮样细胞BEAS-2B(2B细胞),按照方案三进行培养,得到三维培养的BEAS-2B;按照二维培养的方法培养原代人支气管上皮细胞BEAS-2B,得到二维培养的BEAS-2B,然后利用三维培养的BEAS-2B和二维培养的BEAS-2B按照如下方法培养病毒:分别用PBS洗细胞一遍后,接种博卡病毒(HBoV)(病毒核酸浓度为3.51E5拷贝/200μL)50μL/每孔,于34℃,5.0%的CO2培养箱中孵育两个小时,然后用PBS小心地洗三次,每次5min,加入新鲜培养基(三维培养的BEAS-2B中加入3D培养基,二维培养的BEAS-2B中加入2%的1640培养基)200μL,34℃,5.0%的CO2培养箱中进行培养,每收取一次样品(细胞样品和上清),其余时间点的细胞样品每两天换一次新鲜培养基。
检测三维细胞和二维培养时细胞内HBoV的核酸含量:提取核酸,并利用qRT-PCR进行检测病毒扩增情况:HBoV引物(5’到3’):上游引物:5’-CCT ATA TAA GCT GCT GCA CTT CCT G-3’,下游引物:5’-AAG CCA TAG TAG ACT CAC CAC AAG-3’)。
结果如表2所示,HBoV感染三维细胞后的病毒核酸扩增曲线如图8所示。
表2、细胞培养过程中的HBoV核酸含量(病毒基因组拷贝数/200微升)
经检测,发现三维细胞中培养的病毒核酸含量开始有下降趋势,1-3天达到最低,且达到一个平稳期,这可能是因为病毒感染三维细胞之后,有一个潜伏期,为合成病毒复制前期,此外,还有部分进入细胞的病毒排出细胞外。然后升高,第七天达到最高浓度,然后又慢慢下降。而二维细胞中的病毒含量呈现下降趋势,到第三天达到最低,几乎检测不到,并且在后续几天中一直没有增加现象。综上所述,利用三维培养的细胞可以成功扩增博卡病毒(HBoV),而利用二维培养的细胞不可以扩增该病毒。
- 还没有人留言评论。精彩留言会获得点赞!