一种遗传毒性物质检测载体及检测方法与流程
本发明涉及对环境中的遗传毒性物质检测的技术领域,具体为利用携带报告基因的重组大肠杆菌检测环境中的遗传毒性物质。
背景技术:
遗传毒性物质的检测方法分为长期测试和短期测试。长期测试方法由于费时,费力,对实验动物长期维护费用高昂,已逐渐被快速、成本低廉的短期筛选方法所取代。短期测试是以细胞遗传学指标来筛选化学诱变因子,通常利用植物、哺乳动物、微生物等生物细胞监测残留物的遗传毒性。目前发展有彗星试验、姐妹染色单体交换试验,SOS显色试验、程序外DNA合成试验、细菌回复突变、原噬菌体诱导试验等。这些检测方法通常具有操作繁杂、检测时间长、需要严格的无菌操作等不利于推广的因素。并且由于专利保护等原因,个别检测方法并不利于国内推广,限制了其广泛使用。
遗传毒性试验是指用于检测通过不同机制直接或间接诱导遗传学损伤的受试物的体外和体内试验,这些试验能检出DNA损伤。这种DNA损伤是恶性肿瘤发展过程的环节之一。近年来建立了一些短期快速的体外遗传毒性试验方法来检测DNA的损伤。传统的用于遗传毒性物质的检测方法有气相色谱-质谱,液相色谱-质谱或者高压液相色谱-质谱联用技术。这些技术能够准确地、定量地检测几百种上述化学物质,准确度可达到痕量水平。然而,这些方法均需要大型精密仪器进行检测,且这些方法存在检测周期长、操作繁琐、费用高和要求分析人员必须具有较高的分析能力等问题,无法满足现场检测的需求。因此,发展一种简便、快速和经济的检测手段才能满足现场检测的需求。目前已建立的遗传毒性短期检测法已超过200种。其中研究和应用较多的遗传毒性试验方法有:彗星试验(Coment assay),又称单细胞凝胶电泳试验(Single cell gel electrophoresis,SCGE)、姐妹染色单体交换试验(Sister chromatid exchange,SCE)、程序外DNA合成(又称DNA修复合成,Unscheduled DNA synthesis,UDS)、鼠伤寒沙门氏菌回复突变试验(The reverse mutationtest of salmonella typhi munine,又称Ames试验)、SOS显色试验(SOS chromotest)、原噬菌体诱导试验方法(Prophage induction assay)等。上述方法中,Ames试验是遗传毒性分析中最常规的方法。McCann用Ames试验检测300种化学物的结果表明,大多数致癌剂是诱变剂,相关性在80%以上。Ames试验的优点是方法灵敏,检出率高;加之方法比较简便、易行,不需特殊器材,容易推广。其缺点是:(1)微生物的DNA修复系统比哺乳动物简单,基因不如哺乳动物多,不能完全代表哺乳动物的实际情况;(2)不能检测含组氨酸、甘氨酸或乳糖的样品;(3)工作量大,检出时间长,菌株不易保存。尽管如此,由于存在上述的优势,故目前在致突变试验中占重要位置,成为首选的试验方法。加拿大、美国、日本等许多国家都在诱变试验系统中将Ames试验列在首选位置,与细胞遗传学体外试验或体内试验组合,可作为第一阶段初筛的手段。
SOS显色试验,是基于遗传毒性物质诱导生物的SOS修复启动,表达umuC基因而设计的(G.Reifferscheid,J.Heil,Y.Oda and R.K.Zahn,et al.A microplate version of the SOS/umu-test for rapid detection of genotoxins and genotoxic potentials of environmental samples.Mutation Research,253(1991)215-222)。1982年,Quillardet等首次利用SOS反应原理来检测遗传毒物,他们构建的是含sifA-LacA融合基因的质粒Quillardet,P.,Huisman,O.,D’Ari,R.et al.SOS chromotest,a direct assay of induction of an SOS function in Escherichia coli K-12to measure genotoxicity.Proceedings of the National Academy of Sciences of the United States of America 79,5971-5975,1982)。1985年,研究者根据对83种不同化合物的测试结果,认为绝大多数Ames试验呈阳性反应的物质,SOS试验也呈阳性反应。1985年,Oda等用umuC和LacA融合,umu试验正式被提出来(Oda,Y.Induction of SOS responses in Escherichia coli by 5-fluorouracil.Mutation research 183,103-108,1987)。1986年,IARC第83号出版物将该法列为致癌物短筛系统的系列方法之一(Long-term and short-term assays for carcinogens:a critical appraisal.Reports of an ad-hoc working group.Lyons,2-6December 1985.IARC scientific publications,1-564,1986.)。1991年,Reifferscheid等对umu试验做了进一步改进,使用96孔的微培养板代替试管,并结合计算机技术,使该方法能自动化、高通量的筛选遗传毒物。在德国,umu试验是第一个标准化的用于检测废水遗传毒性的试验(DIN 38415-3)(Reifferscheid,G.,Heil,J.,Oda,Y.et al.A microplate version of the SOS/umu-test for rapid detection of genotoxins and genotoxic potentials of environmental samples.Mutation research 253,215-222,1991.)。现有的基于SOS/umu的遗传毒性检测检测系统,检测时间过长,步骤繁琐。即使在检测菌已经活化好的基础上,整个检测过程仍然需要6小时左右,且需要菌体裂解以释放beta-半乳糖苷酶,通过酶活测定beta-半乳糖苷酶酶活。
遗传毒性污染物在我国环境中分布较广,种类及数量较大,在环境污染物中有一定代表性,对人体危害较大,建立快速,有效,便利并利于推广的检测方法十分重要。
技术实现要素:
本发明是针对现有技术的不足,提供一种操作便利、灵敏度高、生物安全性好、无需外加试剂裂解细胞、不受色素干扰、耗时短、成本低,易于实现高通量筛查的环境遗传毒性物质快速检测方法。
微生物DNA受到损伤(如紫外照射、遗传毒性物质刺激)时,会引起一系列修复基因的大量表达。而这些基因的大量表达依赖于recA蛋白在损伤作用下激活,水解阻遏蛋白LexA,促使阻遏蛋白下游的修复基因大量表达。这些修复反应被称之为SOS反应。SOS反应广泛存在于原核生物和真核生物中,是生物在不利环境中自我保护的本能。其中LexA与修复基因上游的结合区域称为SOS box,该段编码基因位于修复基因的启动子-35到-10区域内。本研究就是利用SOS box响应区域,调控下游报告蛋白表达,实现对环境中遗传毒性物质的定性、定量检测。
大肠杆菌的λ噬菌体是目前研究最清楚、应用最广泛的噬菌体之一。噬菌体中导致细胞裂解的基因包括S、R和Rz三个基因,其中R基因编码的是一种可溶于水的转糖基酶(transglycosylase),可以引起肽键的水解,分解细胞壁的肽聚糖。Rz基因的产物可能是一种肽链内切酶(endopepidase),它可以切割肽聚糖和寡糖之间和/或者肽聚糖与细胞壁外膜之间的连接。R和Rz基因产物的功能都是降解细胞壁,而S基因产物的作用是改变细胞质膜的通透性,在细胞质膜上形成多孔的结构,以使R和Rz基因的产物穿过细胞质膜,并作用于细胞壁,使细胞壁破碎,释放胞内物质。
本发明利用重组大肠杆菌作为遗传毒性物质检测菌。该菌株是将特定的遗传毒性物质响应的启动子序列与噬菌体裂解基蛋白SRRz基因序列连接,与质粒载体连接后导入大肠杆菌,形成携带噬菌体裂解蛋白SRRz的大肠杆菌,即为本发明中所用的重组大肠杆菌。当重组菌遇到遗传毒性物质,导致DNA损伤,则启动裂解基因SRRz的表达,最终导致大肠杆菌破裂。通过检测菌体裂解效率,在一定范围内即可定量检测污染物含量。
本发明的目的是提供一种遗传毒性物质检测载体,该载体是自5’到3’端顺次连接有遗传毒性响应启动子,噬菌体裂解基因和大肠杆菌终止子的大肠杆菌表达载体。
所述的遗传毒性物质响应元件,可为SOS响应的任意元件,优选为序列表中SEQ ID No.1核苷酸序列。
所述的噬菌体裂解基因,可为任意一种噬菌体裂解基因,优选为lambda噬菌体的裂解基因SRRz,具有序列表中SEQ ID No.2的核苷酸序列。
所述的大肠杆菌终止子可为任意一种大肠杆菌终止子,优选为T7终止子。
用于构建所述载体的出发载体可为任意一种大肠杆菌载体,优选pBluescript,pUC18,pUC19,pET系列载体。以pUC18为出发载体,构建的大肠杆菌裂解载体为pUST。
本发明的第二个目的是提供一种遗传毒性物质的检测方法。
本发明所提供的遗传毒性物质检测方法,是将上述遗传毒性物质响应载体导入大肠杆菌中,得到重组菌,再将重组菌与遗传毒性物质孵育,大肠杆菌细胞裂解。所述大肠杆菌重组菌携带有遗传毒性响应载体,重组菌在接触遗传毒性化学物质时,会引发自身细胞裂解,通过裂解效率对遗传毒性物质定量的检测方法。
所述大肠杆菌优选E.coli BL21,E.coli DH5a,E.coli XL1-blue或E.coli HB101。
上述的遗传毒性物质检测方法,包括以下步骤:
(1)制备大肠杆菌检测液;
(2)将待测样品与大肠杆菌检测液混合,同时添加同体积纯溶剂的大肠杆菌检测液作对照;两组样品均继续培养0.3-1h;
(3)将与待测样品混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得OD600;
(4)计算裂解效率,根据裂解效率标准曲线计算待测样品中遗传毒性物质浓度。
所述大肠杆菌检测液的制备:
a)将重组大肠杆菌储藏物用LB固体培养基进行培养,使其复苏活化;
b)将得到的活化大肠杆菌单菌落接入到LB液体培养基中进行震荡培养至对数生长期后期;
c)将得到的饱和菌液以1:100体积比接种到新鲜的LB培养基中,培养至菌液OD600为0.15-0.25,得到大肠杆菌检测液。
所述的遗传毒性物质包括甲磺酸甲酯(MMS)、4-硝基喹啉1-氧化物(4-NQO)、丝裂霉素C(MMC)、2-氨基蒽(2-AA)和苯并芘(BaP)。
所述裂解效率标准曲线如下:
4-NQO,Y=-1.78+10.95X,R2=0.99(1<X<5)
MMS,Y=-16.98+0.57X,R2=0.98(40<X<100)
MMC,Y=-19.04+4.11X,R2=0.98(5<X<20)
2-AA,Y=-8.32+86.24X,R2=0.99(0.2<X<0.8)
BaP,Y=4.03+89.10X,R2=0.98(0.1<X<0.8)
其中,X表示遗传毒性化合物浓度(mg/L),Y表示裂解率(%),R2表示拟合曲线相关系数。
含有所述大肠杆菌遗传毒性物质响应载体的重组大肠杆菌也属于本发明的保护范围。
与现有技术相比,本发明的有益效果如下:
1、操作对象为大肠杆菌,无致病风险,操作简便易行。
2、测试周期短,3h内可检测完成(2h检测菌液准备,0.5小时菌液与待测样品接触培养,0.5h测定菌液OD600值),大大缩短了以往遗传毒性物质检测所需时间。
3、检测过程无需添加额外试剂(如酶底物等),成本低廉。
4、检测灵敏度高,对4-NQO、MMS、MMC、2-AA和BaP的敏感浓度范围分别为在1-5、40-100、5-20、0.2-0.8、0.1-0.8mg/L条件下敏感。
5、检测的水样遗传毒性物质含量,可以换算成4-NQO的当量浓度,使结果更加直观、统一。
6、该方法可为突发水质污染和水厂水质常规检测提供技术支持。
附图说明
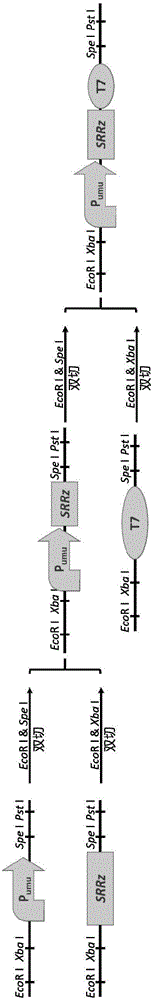
图1为载体构建示意图。
图2为野生型大肠杆菌(E.coli BL21/pUC18)和重组菌(E.coli BL21/pUST)与不同遗传毒性物质接触培养0.5h的裂解效率图。
具体实施方式
下面结合具体实施例对本发明作进一步具体详细描述,但本发明的实施方式不限于此,对于未特别注明的工艺参数,可参照常规技术进行。
实施例1
遗传毒性响应载体的构建
以pUC18为出发载体,构建遗传毒性响应载体pUST。具体构建方法如下:
a)合成遗传响应启动子Pumu(SEQ ID No.1)和T7终止子序列,分别在启动子和T7终止子上游添加EcoRI和XbaI位点,下游添加SpeI和PstI酶切位点。
b)以lambda噬菌体基因组DNA为模板,扩增SRRz基因。在SRRz基因的上下游也分别添加EcoRI和XbaI、SpeI和PstI酶切位点。
c)采用生物积木(Biobricks)方法,采用酶切、连接方法将各元件按照启动子-裂解基因-终止子顺序连接,插入到pUC18载体中,得到遗传毒性响应载体pUST。
d)将载体pUST转入到E.coli BL21感受态细胞,获得遗传毒性物质检测用的重组大肠杆菌E.coli BL21/pUST。
实施例2
裂解效率计算
大肠杆菌检测液接触待测样品后0.5h,分别测定各测试菌液在600nm处的光吸收值(OD600)。
裂解率(%)=(A-B)/A*100%
其中,A—添加甲醇的菌液OD600
B—添加测试样的菌液OD600。
实施例3
遗传毒性物质检测
1.重组大肠杆菌的复苏活化
(1)将野生型大肠杆菌(E.coli BL21/pUC18)和重组菌(E.coli BL21/pUST)分别从-80°冰箱中划线于LB平板培养基中,在37℃条件下恢复培养14h。
(2)挑取单菌落,分别接种至LB培养基中,在37℃、250rpm条件下培养12-16h。
2.大肠杆菌检测液制备
将复苏活化的菌液以1:100体积比接种至新鲜LB培养基,以190μl体积量加入到96孔培养板中,在35-37℃,800rpm条件下培养至OD600到0.15-0.25。
3.与受试样品接触
取甲醇和不同浓度的4-NQO、MMS、MMC、2-AA和BaP各10μl分别加入到96孔板内,在35-37℃,800rpm条件下继续培养0.5h,设置3个平行组。
4.实验结果表明(图2),在测试浓度范围内,原始菌株E.coli BL21/pUC18菌体生长正常,未观测到菌体裂解。而含遗传毒性响应载体的重组菌E.coli BL21/pUST,存在不同程度的裂解。
根据检测图2,相应遗传毒性物质的检测标准曲线分别为:
4-NQO,Y=-1.78+10.95X,R2=0.99(1<X<5)
MMS,Y=-16.98+0.57X,R2=0.98(40<X<100)
MMC,Y=-19.04+4.11X,R2=0.98(5<X<20)
2-AA,Y=-8.32+86.24X,R2=0.99(0.2<X<0.8)
BaP,Y=4.03+89.10X,R2=0.98(0.1<X<0.8)
其中,X表示遗传毒性化合物浓度(mg/L),Y表示裂解率(%),R2表示拟合曲线相关系数。
实施例4
水样中遗传毒性物质检测
本实施例遗传毒性物质的快速检测方法,以4-NQO为标准毒性物质。根据文献报道,健康成人日摄入的饮用水中4-NQO浓度不应超过80ng/L(以2L/日饮用水量计)(Martijn,B.J.;Van Rompay,A.R.et al.,Development of a 4-NQO toxic equivalency factor(TEF)approach to enable a preliminary risk assessment of unknown genotoxic compounds detected by the Ames II test in UV/H2O2water treatment samples.Chemosphere 2016,144,338-345.)。
本实施例包括以下步骤:
(1)按照实施例3的方法制备大肠杆菌检测液。
(2)取待测水样,以40mL/min的速度用活化的树脂吸附,然后乙酸乙酯洗脱。洗脱液采用离心冻干方法去除乙酸乙酯,再以一定体积的蒸馏水溶解样品至所需体积。将待测水样与大肠杆菌检测液混合,同时添加同体积纯溶剂的大肠杆菌检测液做对照;两组样品均继续培养1h。所述待测水样分别取日常城市用水(实验室水龙头放出)、城市水厂水源、某化工厂废水A和某化工厂废水B。
(3)将与待测水样混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得OD600。
(4)计算裂解效率,根据裂解效率标准曲线计算待测样品中遗传毒性物质4-NQO当量浓度。所得结果如表1所示。
表1结果表明,日常城市用水和城市水厂水源的遗传毒性物质4-NQO的当量浓度低于25ng/L,而化工厂废水A水样4-NQO当量浓度约为460-470ng/L,化工厂废水B水样4-NQO当量浓度约为290-300ng/L。
上述检测结果表明,本发明的遗传毒性响应的重组大肠杆菌,可以在响应浓度范围内对待测物的具有遗传毒性的化合物进行检测。该方法耗时短、检测简便易行、易于推广。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种遗传毒性物质检测载体及检测方法
<130> 1
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 82
<212> DNA
<213> Artificial Sequence
<220>
<223> 1
<400> 1
gaattctacg tctagagctt attgacatgc tggcaagaac agactactgt atataaaaac 60
agtataacta gttacgctgc ag 82
<210> 2
<211> 1549
<212> DNA
<213> Artificial Sequence
<220>
<223> 1
<400> 2
gccactgtct gtcctgaatt cattagtaat agttacgctg cggcctttta cacatgacct 60
tcgtgaaagc gggtggcagg aggtcgcgct aacaacctcc tgccgttttg cccgtgcata 120
tcggtcacga acaaatctga ttactaaaca cagtagcctg gatttgttct atcagtaatc 180
gaccttattc ctaattaaat agagcaaatc cccttattgg gggtaagaca tgaagatgcc 240
agaaaaacat gacctgttgg ccgccattct cgcggcaaag gaacaaggca tcggggcaat 300
ccttgcgttt gcaatggcgt accttcgcgg cagatataat ggcggtgcgt ttacaaaaac 360
agtaatcgac gcaacgatgt gcgccattat cgcctggttc attcgtgacc ttctcgactt 420
cgccggacta agtagcaatc tcgcttatat aacgagcgtg tttatcggct acatcggtac 480
tgactcgatt ggttcgctta tcaaacgctt cgctgctaaa aaagccggag tagaagatgg 540
tagaaatcaa taatcaacgt aaggcgttcc tcgatatgct ggcgtggtcg gagggaactg 600
ataacggacg tcagaaaacc agaaatcatg gttatgacgt cattgtaggc ggagagctat 660
ttactgatta ctccgatcac cctcgcaaac ttgtcacgct aaacccaaaa ctcaaatcaa 720
caggcgccgg acgctaccag cttctttccc gttggtggga tgcctaccgc aagcagcttg 780
gcctgaaaga cttctctccg aaaagtcagg acgctgtggc attgcagcag attaaggagc 840
gtggcgcttt acctatgatt gatcgtggtg atatccgtca ggcaatcgac cgttgcagca 900
atatctgggc ttcactgccg ggcgctggtt atggtcagtt cgagcataag gctgacagcc 960
tgattgcaaa attcaaagaa gcgggcggaa cggtcagaga gattgatgta tgagcagagt 1020
caccgcgatt atctccgctc tggttatctg catcatcgtc tgcctgtcat gggctgttaa 1080
tcattaccgt gataacgcca ttacctacaa agcccagcgc gacaaaaatg ccagagaact 1140
gaagctggcg aacgcggcaa ttactgacat gcagatgcgt cagcgtgatg ttgctgcgct 1200
cgatgcaaaa tacacgaagg agttagctga tgctaaagct gaaaatgatg ctctgcgtga 1260
tgatgttgcc gctggtcgtc gtcggttgca catcaaagca gtctgtcagt cagtgcgtga 1320
agccaccacc gcctccggcg tggataatgc agcctccccc cgactggcag acaccgctga 1380
acgggattat ttcaccctca gagagaggct gatcactatg caaaaacaac tggaaggaac 1440
ccagaagtat attaatgagc agtgcagata gagttgccca tatcgatggg caactcatgc 1500
aattattgtg agcaatacac acgcgcttcc agcggagtat aaatgccta 1549
- 还没有人留言评论。精彩留言会获得点赞!