一种用于病毒荧光标记与活体成像的化合物及其制备方法与流程
本发明具体涉及用于病毒荧光标记与活体成像的化合物及其制备方法。
背景技术:
荧光成像作为在亚细胞结构水平理解生命过程的重要工具,广泛应用于生命科学的各个领域。选择合适的荧光标记方法是得到理想荧光图像的重要因素。目前,在生命科学研究过程中普遍采用荧光蛋白、染料及小分子标记等方法。但现有方法都存在一定的缺陷,例如:在生物分子的基因组中插入绿色荧光蛋白GFP或红色荧光蛋白RFP的基因,来表达带标签的融合蛋白,该方法通常适用于较大的生物分子,由于GFP或RFP蛋白较大可能会对所要标记的生物分子活性造成一定的影响(Schaferling,M.,The art of fluorescence imaging with chemical sensors.Angew Chem Int Ed Engl,2012.51(15):p.3532-54);各种荧光染料是生命科学中最常用的成像方法,然而荧光染料在成像过程中淬灭严重,容易发生光漂白现象,不适合长时间观察,并且染料只适用于标记特定的细胞部位,不具有普遍适用性(Lakadamyali,M.,et al.,Visualizing infection of individual influenza viruses.Proc Natl Acad Sci U S A,2003.100(16)∶p.9280-5);还有一些化学小分子的标记方法,可以实现对生物体的糖类、脂类和蛋白质进行特定修饰,但是该方法普遍存在的问题在于反应效率不高,稳定性差,因此需要很高的化合物浓度,容易引起细胞毒性,并且标记过程会影响生物分子的产率(Spokoyny,A.M.,et al.,A perfluoroaryl-cysteine S(N)Ar chemistry approach to unprotected peptide stapling.J Am Chem Soc,2013.135(16)∶p.5946-9;Kung,K.K.,et al.,Cyclometalated gold(II)complexes for chemoselective cysteine modification via ligand controled C-S bond-forming reductive elimination.Chem Commun(Camb),2014.50(80)∶p.11899-902)。病毒作为重要的生物分子,是人们长期以来的重要研究对象。病毒是引起人类众多疾病的元凶,对人类健康造成严重威胁,例如,流感病毒、肝炎病毒和艾滋病毒等在世界范围内广泛传播,每年引起大量死亡。对病毒进行荧光标记研究其动态生命周期是一种常见的生物学方法,传统插入GFP或RFP等荧光标签及荧光小分子标记等方法可能引起病毒结构及感染能力的下降,还有一些亲脂性染料可以特异的与病毒表面的囊膜结合,但不适用于无囊膜病毒。
技术实现要素:
本发明的目的之一是提供式I所示化合物:
上述式I中,i-Pr表示异丙基,Cy表示环己基。
上述式I所示化合物是按照包括下述步骤的方法制备得到的:
在惰性气体保护下,将式4所示化合物与RuPhos和式6所示化合物进行反应,得到含式I所示化合物的体系。
上述式6中,TMS表示三甲基硅烷基。
其中,RuPhos为2-双环已基膦-2',6'-二异丙氧基联苯。
所述反应在搅拌下进行。
所述反应的反应温度为室温,反应时间为16-20小时,具体可为18小时。
所述反应在有机溶剂中进行。
所述有机溶剂具体可为THF。
上述方法还可进一步包括从所述含式I所示化合物的体系中分离得到式I所示化合物的步骤。具体操作为:向所述体系中加入正戊烷,冷冻,将所得混悬液过滤,收集固体,即得式I所示化合物。其中,所述冷冻温度-25--15℃,具体可为-20℃,所述冷冻的时间可为2.5-4小时,具体可为3小时。
上述式I所示化合物在荧光标记表面含有半胱氨酸的生物分子中的应用,或式I所示化合物在制备荧光标记表面含有半胱氨酸的生物分子的产品中的应用。
其中,所述半胱氨酸可以是生物分子自身含有的半胱氨酸,或是通过人工手段引入到生物分子中的半胱氨酸。
其中,所述生物分子可以是任何想用荧光标记的生物分子,具体可以是多肽、蛋白或病毒。
所述多肽为含有半胱氨酸的多肽,或者无半胱氨酸但可引入半胱氨酸的多肽。
所述蛋白为表面有至少一个半胱氨酸的蛋白,或者表面没有半胱氨酸,但可引入半胱氨酸的蛋白。
所述病毒为表面具有半胱氨酸的病毒,或者表面没有半胱氨酸,但可在其表面引入半胱氨酸的病毒。
所述病毒包括无囊膜病毒、囊膜病毒。
所述病毒具体可为肠道病毒71。
本发明的另一目的是提供一种多肽、蛋白或病毒的荧光标记方法。
本发明所提供的多肽、蛋白或病毒的荧光标记方法,包括下述步骤:
将具有半胱氨酸的多肽、蛋白或病毒与式I所示化合物进行反应,反应结束后,加入3’-巯基丙酸终止反应,即可;或在不含半胱氨酸的多肽、蛋白或病毒的表面引入半胱氨酸,将所述引入了半胱氨酸的多肽、蛋白或病毒与式I所示化合物进行反应,反应结束后,加入3’-巯基丙酸终止反应,即可。
所述病毒包括无囊膜病毒、囊膜病毒。
所述病毒具体可为肠道病毒71。
本发明开发了一种可以对多肽、蛋白及病毒进行荧光标记的方法,该方法可以实现在30分钟内对生物分子的标记,效率接近100%,并且不影响病毒的产率和感染能力。
本发明选择肠道病毒71型(Enterovirus 71,EV71)为模型,应用式I所示化合物实现了病毒的荧光成像。EV71是引起近年来在亚州-太平洋地区广泛流行的手足口病(Hand-Foot-and-Mouth Di sease,HFMD)的主要病原体。其感染对象主要为3岁以下免疫功能尚未成熟的儿童。EV71病毒可以引起无菌性脑膜炎、病毒性脑炎、心肌炎、驰缓性麻痹和肺水肿等,致死率较高。由于EV71病毒具有较强的嗜神经性,从2008年在中国安徽阜阳爆发至今,已造成接近3,000人死亡[7]。该病毒为无囊膜的单股正链RNA病毒,由四个结构蛋白VP1、2、3、4组成的外壳和内部的一条RNA组成。
式I所示化合物可以对病毒表面的半胱氨酸进行特异高效的修饰,将荧光分子标记到表面蛋白的半胱氨酸上,即使病毒表面无半胱氨酸也可以选择不影响其生物活性的位点进行突变引入半胱氨酸,再用式I所示化合物进行修饰,从而将荧光分子标记到半胱氨酸上。该方法可广泛适用于各种大小的病毒,而且不影响标记后病毒的感染能力。
附图说明
图1为式I所示化合物的合成路线图。
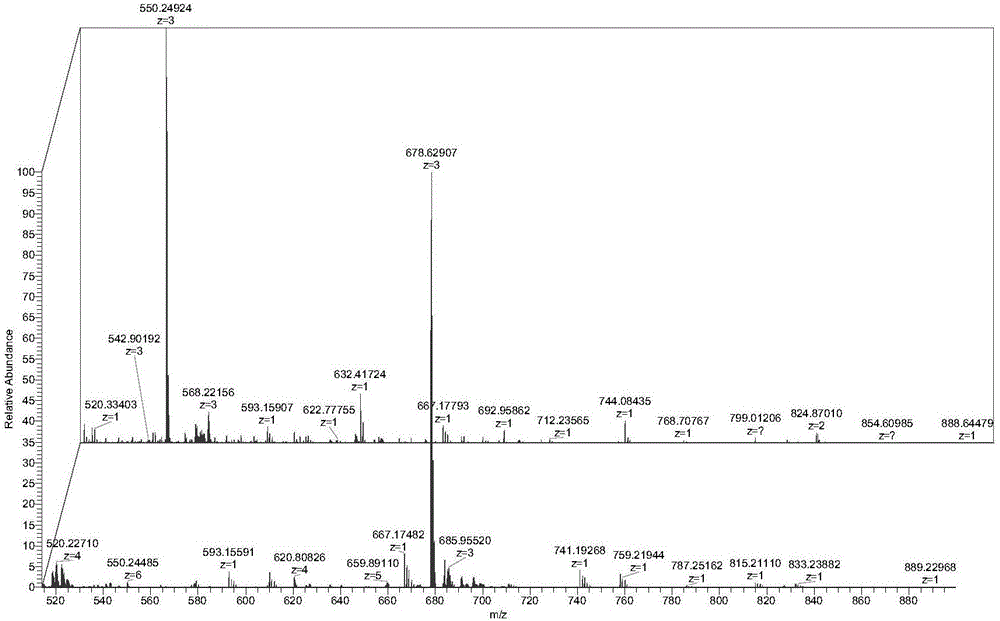
图2为多肽与式I所示化合物反应前后的质谱图。
图3为UBXD7与式I所示化合物反应前的质谱图。
图4为UBXD7与式I所示化合物反应后的质谱图。
图5为实心和空心病毒与式I所示化合物反应前后的滴度。
图6为用罗丹明标记后的病毒感染细胞,红点代表标记的病毒。
图7为病毒随时间推移进入细胞直到消失的过程。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
实施例1、式I所示化合物的制备
参照图1所示的合成路线图制备式I所示化合物。
步骤1:
在1个25mL的圆底烧瓶中加入213mg化合物1,然后将其溶于4mL无水四氯化碳中,在搅拌的情况下加入16mg的AIBN(偶氮二异丁腈),然后196mg的NBS(N-溴代丁二酰亚胺)缓慢加入到上述溶液中去。然后将反应体系升温至回流,使用TLC(薄层色谱法)对反应体系进行监测。当反应完全之后,将反应体系降至室温,过滤,所得滤液减压旋蒸,残余物通过硅胶柱色谱进行分离纯化(洗脱剂:石油醚/乙酸乙酯=5/1),得到白色固体240mg(化合物2),产率为82%。
1H NMR(400MHz,Chloroform-d)δ7.83–7.72(m,3H),7.35(s,1H).
13C NMR(101MHz,CDCl3)δ166.44,150.57,134.71,130.62,127.26,127.11,123.12,73.39.
步骤2:
在1个25mL圆底烧瓶中加入145mg化合物2,然后向圆底烧瓶中加入2mL去离子水。将反应体系升温至回流,使用TLC(薄层色谱法)对反应体系进行监测。待反应完全之后,将反应体系降至室温,过滤,所得白色固体用乙醚洗3次,干燥即可得到目标产物139mg(化合物3),产率为90%。
1H NMR(400MHz,DMSO-d6)δ8.28(s,1H),7.93(s,1H),7.86(d,J=8.1Hz,1H),7.77(d,J=8.2Hz,1H),6.66(s,1H).
13C NMR(101MHz,DMSO)δ167.57,149.42,133.76,128.46,126.98,126.43,125.82,97.68
步骤3
在1个25mL圆底烧瓶中依次加入274mgN,N-二甲基间羟基苯胺、229mg化合物3、35mg对甲苯磺酸一水合物,然后向圆底烧瓶中加入4mL丙酸作为溶剂。在避光、氩气保护的条件下将反应体系升温至90℃并反应18个小时,使用TLC(薄层色谱法)对反应体系进行监测。待反应完全之后,通过旋转蒸发仪将溶剂除去,残余物通过硅胶柱色谱进行分离纯化(洗脱剂:二氯甲烷/甲醇=8/1,并在洗脱剂中添加0.5%的乙酸),得到玫瑰红色固体209mg(化合物4),产率为45%。
1H NMR(400MHz,Chloroform-d)δ7.86(d,J=8.0Hz,1H),7.70(d,J=8.3Hz,1H),7.32(s,1H),6.63(d,J=8.7Hz,2H),6.51–6.39(m,4H),3.00(s,12H).
13C NMR(101MHz,CDCl3)δ168.98,168.98,153.13,152.47,133.02,129.74,129.74,128.91,127.66,126.46,109.07,106.42,98.65,40.39.
步骤4:
在手套箱中,将315mg化合物5装入放有磁子的25mLSchlenk瓶中,然后加入5mL乙醚。将反应体系用橡胶塞封闭好之后,拿出手套箱,将反应体系用Ar保护。将反应体系置于-40℃(干冰-乙腈)中,向反应体系中缓慢加入2.5mL的TMSCH2MgCl溶液(1M乙醚溶液),待滴加完毕,反应体系在-40℃中反应1小时,然后将反应体系转移至0℃(冰水混合物)中,再反应0.5小时。然后在0℃的条件下向反应体系中加入0.15mL丙酮,再反应5分钟。之后,在反应体系保持0℃的条件下,用一个待外接冷肼的油泵将反应体系中的易挥发溶剂抽干,将橡胶塞打开,向Schlenk瓶中加入10mL正戊烷,所得到的混悬物通过一小段硅藻土进行过滤,滤饼再用正戊烷洗3次。(注意,承接滤液的圆底烧瓶也要置于0℃的冰水混合物中)。通过0℃的旋转蒸发仪将所得滤液抽干,所得到的灰白色固体在油泵上抽干(此时圆底烧瓶也应置于0℃的冰水混合物中),得到目标产物(化合物6)300mg,产率为70%。
1H NMR(400MHz,Benzene-d6)δ5.14(s,1H),2.92–1.49(m,2H),0.76(s,1H),0.33(s,4H).
13C NMR(101MHz,C6D6)δ112.17,29.23,11.77,3.94.
步骤5:
在手套箱中,将65mg化合物4,66mg的RuPhos和50mg的化合物6依次加入10mL的Schlenk瓶中,然后向Schlenk瓶中加入1.5mLTHF。将反应体系用橡胶塞封好,拿出手套箱。将Schlenk瓶用Ar保护,在室温下搅拌18小时。然后,向反应体系中加入3mL正戊烷,再将反应体系置于-20℃下冷冻3小时,打开塞子,将所得混悬液过滤,将所得固体用正戊烷洗3次,在油泵下抽干,得到65mg目标产物(式I所示化合物),为灰红色固体,产率65%。
1H NMR(400MHz,Methylene Chloride-d2)δ7.67(dt,J=13.3,7.7Hz,2H),7.43(dt,J=22.4,7.5Hz,2H),7.25(d,J=33.9Hz,2H),7.11(s,2H),6.94–6.82(m,2H),6.69(dd,J=25.8,8.4Hz,2H),6.52(d,J=4.7Hz,2H),4.70–4.56(m,2H),2.23(q,J=11.4Hz,2H),1.92–1.82(m,2H),1.66–1.40(m,29H),1.40–1.26(m,6H),1.23–1.06(m,8H),1.00(d,J=6.1Hz,3H),0.92(t,J=6.9Hz,2H).
31P NMR(162MHz,CD2Cl2)δ28.33.
ESI-MS:阳离子模式
Exact mass:m/z=957.36
Found:m/z=957.3634
实施例2、式I所示化合物在多肽上的荧光标记
首先将该化合物在含有半胱氨酸的多肽上进行实验,反应过程如下:
在Ep管中加入47μl H2O,4μl 150μM的多肽,多肽序列为:GTSWCYNQKRHDGP,加入1μl乙腈和6μl 1M Tris-HCl pH 7.5,混匀;
加入2μl 600μM的式I所示化合物,混匀;
室温反应30min;
加入6.3μl,0.05μl/ml的3’-巯基丙酸,室温终止反应5min;
质谱鉴定反应产物。
图2为多肽与式I所示化合物反应前后的质谱图。
质谱图中550.24924的峰为反应前的多肽,计算出的分子量为:1647.75,678.62907的峰为反应后的产物,分子量为:2032.88,两者分子量相差385.14,正好是荧光分子罗丹明的分子量。
由此可见通过式I所示化合物在所述多肽上成功的标记上了荧光分子罗丹明。
实施例3、式I所示化合物在蛋白上的荧光标记
我们选取了表面有一个半胱氨酸的蛋白UBXD7进行标记,如果蛋白表面没有半胱氨酸,也可以对表面位点进行突变,反应过程如下:
在离心管中加入5ml 20mM Tris-HCl,150mM NaCl,pH 7.5,加入0.5μM的UBXD7蛋白,加入25μl 2mM的化合物,混匀;
室温反应30min;
加入250μl,2mM的3’-巯基丙酸,室温终止反应5min;
浓缩后,质谱鉴定反应产物。
图3为UBXD7与式I所示化合物反应前的质谱图,UBXD7的分子量为:9507.07。
图4为UBXD7与式I所示化合物反应后的质谱图,反应后分子量为:9891.23,两者相差385.15,正好是罗丹明的分子量。
由此可见通过式I所示化合物在所述蛋白上成功的标记上了荧光分子罗丹明。
实施例4、病毒的荧光成像
该病毒进入宿主细胞的分子机制还不甚清楚,我们发展的荧光标记方法可以很好的观察到病毒吸附到宿主细胞表面,随后进入细胞的过程。
实验过程如下:
RD细胞在37℃培养箱中培养至满度为70%时,加入感染剂量为MOI=0.5的EV71病毒,感染1h后,移走培养基,换成含2%FBS的DMEM培养基,培养36h后收集病毒。
病毒上清经过12000rpm离心20min,去除细胞碎片后,用0.2μm滤器抽滤。
在离心管底部垫8ml 30%蔗糖,将病毒液加到离心管中,160,000g离心4h。
收集病毒沉淀,用缓冲液重悬后用15%-45%的蔗糖连续梯度,进行密度梯度离心,3,6000rpm,离心4h。
离心后可以观察到病毒分为上下两层,上层为感染性低的空心病毒,下层为感染性强的实心病毒。
分别收集两个层的病毒,浓缩换液至20mM Tris-HCl,150mM NaCl,pH 7.5。
将实心和空心病毒分别与式I所示化合物反应,测定反应前后病毒的滴度。
图5为实心和空心病毒与式I所示化合物反应前后的滴度。
图5表明空心和实心病毒反应前后病毒仍保持感染活性。
用标记后的实心病毒感染RD细胞,实验过程如下:
RD细胞在平皿中37℃培养过夜。
将培养基换成PBS,加入100μl标记后病毒,冰上孵育1h,使病毒吸附在细胞表面。
用4%多聚甲醛固定细胞10min。
在confocal下观察。
从图6中我们可以看到标记的病毒吸附在RD细胞膜上。
我们将标记的病毒在冰上处理使其吸附到细胞表面,随后将细胞转移到37℃,病毒会进入细胞直到外壳解聚,confocal下观察这一动态过程如图7所示。
图7为病毒随时间推移进入细胞直到消失的过程。
- 还没有人留言评论。精彩留言会获得点赞!