射线修饰脐带成体干细胞3D微球活制剂及其制备与应用的制作方法
背景技术:
脐带成体干细胞是指存在于新生儿脐带组织中的一种多能干细胞,既不同于脐带血干细胞(造血干细胞,应用之前必需配型)也不同于胎盘来源干细胞(胎盘壁蜕膜干细胞,来源于胚胎发育中胚层的亚全能干细胞)。脐带由胚胎羊膜包卷着卵黄囊的伸长部共同形成,包含了较为幼稚及趋于成熟的成体干细胞成分。脐带作为胚胎发育过程中维系母体和胎儿氧气及营养物质交换的暂时性通道,在胎儿出生后即完成使命,成为“废弃”物,对其研究不会涉及伦理学争议问题。脐带成体干细胞能分化成许多种组织细胞,应用无需配型,具备通用性潜能,具有广阔的临床应用前景。脐带作为干细胞来源的优点:1.采集过程简单、取材使用方便,不影响母子健康,无痛苦;2.基因变异的可能性小,数量丰富,分化能力较强;3.具有较高的分化潜能,可向多个方向进行分化,同时不产生肿瘤,在骨、软骨、肌肉、肌腱、韧带、神经、肝、内皮和心肌等组织工程方面应用广阔;4.增殖能力优于骨髓干细胞和胎盘干细胞,且免疫原性比骨髓干细胞低,比胎盘干细胞更具通用性。因此越来越受到研究工作者们的关注。
肿瘤特别是恶性肿瘤发病率日益增高,且传统治疗如手术、放疗、化疗难以彻底清除残存的肿瘤细胞,特别是肿瘤干细胞,导致其治愈率低,复发率和病死率高,成为当今严重危害人类健康的最大敌人。肿瘤的防治就显得极为迫切。肿瘤由大量普通肿瘤细胞与少量的肿瘤干细胞构成,肿瘤干细胞的运动和迁徙能力又使肿瘤细胞的转移成为可能;抗癌剂及放射治疗容易杀灭普通肿瘤细胞,但是对于杀灭肿瘤干细胞效果欠佳。况且越来越多研究表明肿瘤干细胞(cancer stem cells,CSCs)才是肿瘤形成的起始细胞与肿瘤转移的先锋细胞,同时也为肿瘤复发的根源。肿瘤干细胞通过不断的自我更新和适应性进化维持着肿瘤细胞群无限增殖的生命力。且容易诱导病人对肿瘤产生多重免疫麻痹,促使宿主自身免疫系统不能有效地清除肿瘤干细胞。当今肿瘤防治技术方法并不少,且均有一定的作用,但远期效果都欠佳,究其根本原因就在于这些方法只能够消灭普通肿瘤细胞,却难以彻底清除肿瘤干细胞。因此,肿瘤往往在常 规抗肿瘤疗法消灭大部分普通肿瘤细胞后一段时间复发或者转移。因而,很有必要设计一些定向清除肿瘤干细胞的新技术来防治发病率与日俱增的人类肿瘤,尤其是能刺激宿主打破对肿瘤干细胞多重免疫麻痹的新策略。
技术实现要素:
本发明正是为了克服上述现有技术中的不足,打破在肿瘤形成过程中与肿瘤建立后宿主对肿瘤干细胞产生多重免疫麻痹以及肿瘤对放化疗的耐受,从而阻止肿瘤的发展与演进,设计出定向肿瘤干细胞的新策略:X射线辐照修饰脐带成体干细胞3D微球活制剂及制备与应用。
脐带成体干细胞介于较为幼稚的胚胎及趋于成熟的成体干细胞之间,是比骨髓干细胞更为原始的祖细胞。研究表明脐带成体干细胞和肿瘤干细胞在抗原表达、分化潜能等生物学特性具有极大的相似性:(1)高表达肿瘤胚胎发生抗原,包括免疫原性与反应原性,二者之间可能具有交叉免疫性,(2)无限增殖潜能,(3)自我分化潜能(4)逃逸免疫系统的识别,(5)诱导血管生长因子的产生。特别是X射线辐照的脐带成体干细胞3D微球制剂。
本发明的任务是这样实现的:射线辐照修饰脐带成体干细胞3D微球活制剂,是在2ml的冻存管中保存有培养5代后的160Gy X射线辐照修饰的脐带成体干细胞3D微球活制剂,干细胞3D微球为8×103个,球直径为100-120μm,冻存液为人的AB血浆,总体积为1ml,于-196℃液氮中保存待用。
上述射线辐照修饰脐带成体干细胞3D微球活制剂的制备方法:其操作是在无菌条件下分为以下六个步骤制备:1.处理脐带组织,2.分离脐带成体干细胞,3.脐带成体干细胞的贴壁扩大培养,4.脐带成体干细胞在悬浮培养体系中转化成3D微球,球直径为100-120μm,5.3D微球接受160Gy X射线辐照修饰,6.射线辐照修饰脐带成体干细胞3D微球活制剂的制备。
本发明的射线辐照修饰脐带成体干细胞3D微球活制剂在制备药物中的应用,制备对肿瘤干细胞产生直接作用而达到抑制肿瘤的发生、发展与演进,作为一种广谱抗肿瘤制剂药物的应用。
本发明的射线辐照修饰脐带成体干细胞3D微球制剂的使用选择在肿瘤发生之后,选择最常见的肿瘤:肺癌、乳腺癌、肝癌、结肠癌为治疗模型,注射部位选择肿瘤对侧方皮下,为打破肿瘤免疫逃逸机制,首次免疫治疗10天后再进行一次加强免疫治疗。
本发明与现有技术相比具有以下优点:
1.该抗肿瘤制剂采用射线辐照修饰脐带成体干细胞3D微球制作,一方面提 高了干细胞的免疫原性使宿主对肿瘤干细胞产生有效的致敏淋巴细胞与免疫抗体,诱导机体对肿瘤产生特异性杀伤作用,产生特异性抗肿瘤的体液与细胞免疫;另一方面还激活了NK和CD8+T细胞,分泌TNF-α、IFN-γ等多种细胞因子,以非特异性杀伤肿瘤细胞,发挥非特异性的抗肿瘤作用,两条抗肿瘤途径相辅相成,从根源上抑制肿瘤干细胞在体内的增殖成瘤、发展与转移。治疗上采用10天间断性方案,首次治疗10天后进行一次加强免疫治疗,最大限度打破机体对肿瘤的免疫耐受,起到促使肿瘤消退的作用;
2.具有广谱的抗肿瘤效果,抑制多种肿瘤的发生、演进和转移,延长荷瘤宿主的生存期;
3.X射线辐照对脐带成体干细胞3D微球的免疫原性起到持久的保护作用,长效刺激机体,防止宿主产生免疫麻痹,激发更强的抗肿瘤免疫反应;
4.脐带成体干细胞3D微球来自正常细胞,作为细胞治疗制剂,经反复验证不存在体内成瘤的安全问题;
5.脐带取材方便,无痛苦,少污染,不涉及伦理道德问题。
6.该生物制剂来自脐带,资源丰富,制备简便,成本低廉,具有大规模工程化培养的可能,为肿瘤干细胞精准生物治疗提供潜在的理想资源。
附图说明 以下是本发明说明书附图的图面说明:
图1是本发明(A)肿瘤干细胞(CSCs,CD133+),(B)骨髓干细胞(BSCs),(C)单纯脐带成体干细胞(USCs),(D)脐带成体干细胞3D微球,(E)脐带成体干细胞3D微球接受射线辐照与(F)射线辐照修饰后脐带成体干细胞3D微球(R-USC-Sph)显微相差比较。
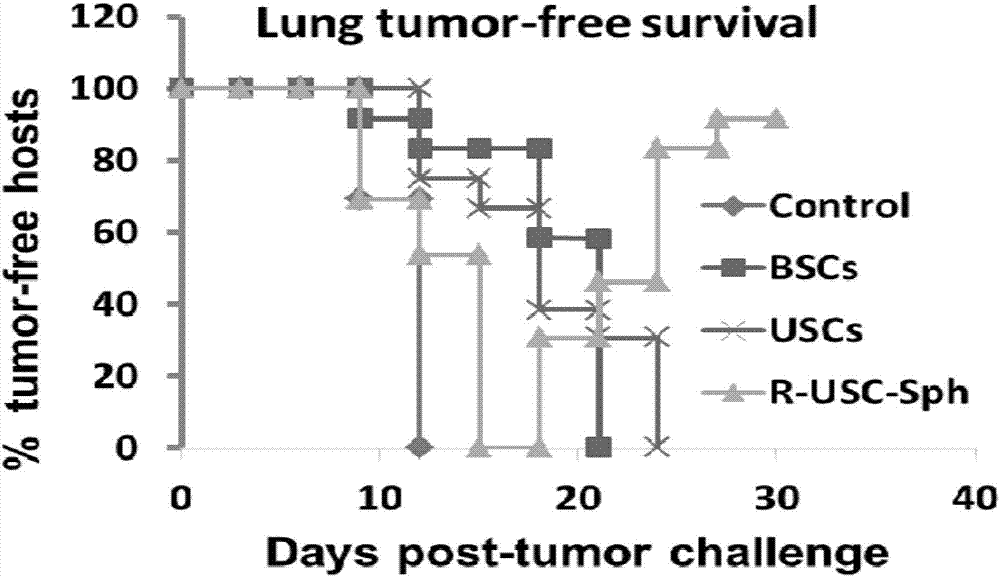
图2是本发明对肺癌的脐带成体干细胞3D微球治疗模型疗效比较,实验组应用脐带成体干细胞治疗后部分肿瘤发展受抑制,尤其是射线辐照修饰脐带成体干细胞3D微球活制剂(R-USC-Sph,即本发明制剂)治疗组大部分宿主的肿瘤明显趋向消退,最终无瘤生存率显著高于对照组。
图3是本发明对乳腺癌的脐带成体干细胞3D微球治疗模型疗效比较,实验组应用脐带成体干细胞治疗后肿瘤发展明显慢于对照组,尤其是本发明制剂治疗组(R-USC-Sph)大部分宿主的肿瘤明显缩小至完全消退。
图4是本发明对肝癌的脐带成体干细胞3D微球治疗模型疗效比较,实验组应用脐带成体干细胞治疗后肿瘤发展明显延缓,尤其是本发明制剂治疗组(R-USC-Sph)大部分荷瘤宿主的肿瘤基本完全消退。
图5是本发明对结肠癌的脐带成体干细胞3D微球治疗模型疗效比较,实验组应用脐带成体干细胞治疗后肿瘤体积明显小于对照组,尤其是本发明制剂治疗组(R-USC-Sph)大部分荷瘤宿主的肿瘤完全消退。
图6是本发明对肿瘤转移指数的作用比较,实验组应用脐带成体干细胞治疗后肿瘤转移明显少于对照组,尤其是本发明制剂治疗组(R-USC-Sph)大部分荷瘤宿主的肿瘤转移指数趋向0%。
图7是本发明制剂注射后抑制肿瘤干细胞的增殖:与对照组(Control)、骨髓干细胞组(BSCs)及单纯脐带成体干细胞组(USCs)相比,免疫荧光显示射线辐照修饰脐带成体干细胞3D微球(R-USC-Sph,本发明制剂)治疗组的肿瘤组织中活化NK细胞(NK-1+)明显增多,同时肿瘤干细胞(MUC-1+)明显凋亡(A),本发明制剂治疗组(R-USC-Sph)活化NK细胞明显多于其它各组(B),结果有统计学意义(*P<0.05)。同时肿瘤组织内肿瘤干细胞明显少于其它各组(C),结果有统计学意义(*P<0.05)。
图8是本发明制剂注射后增加细胞和体液免疫活性:与对照组(Control)、骨髓干细胞组(BSCs),及单纯脐带成体干细胞组(USCs)相比,本发明制剂(R-USC-Sph)注射后增加淋巴细胞分泌干扰素与白介素-4。Elispot分析显示本发明制剂治疗组体内淋巴细胞分泌的干扰素-γ(IFN-γ,介导抗肿瘤细胞免疫)及白介素-4(IL-4,介导抗肿瘤体液免疫)高于对照组,尤其是IFN-γ显著增高,结果有统计学意义(*P<0.05)。
具体实施方式 本发明以下将结合实施例和说明书附图作进一步详述:
实施例1.一种射线辐照修饰脐带成体干细胞3D微球活制剂是在2ml的冻存管中保存有培养5代后的160Gy X射线辐照修饰的脐带成体干细胞3D微球活制剂(参见说明书附图1),干细胞3D微球为8×103个,球直径为100-120μm,冻存液为人的AB血浆,总体积为1ml,于-196℃液氮中保存待用。
实施例2.射线辐照修饰脐带成体干细胞3D微球活制剂的制备:于无菌条件下制备上述干细胞活制剂,共分为以下六个步骤:(1)处理脐带组织,(2)分离脐带成体干细胞,(3)脐带成体干细胞的贴壁扩大培养,(4)脐带成体干细胞在悬浮培养体系中转化成3D微球,球直径为100-120μm,(5)3D微球接受160Gy X射线辐照修饰,(6)射线辐照修饰脐带成体干细胞3D微球活制剂的制备,详述如下:
(1)处理脐带组织:足月生产的脐带组织,捐献者均签署知情同意书,并 经过医院伦理委员会同意,将脐带组织剪碎成1cm×1cm×1cm大小,5倍于脐带组织体积的D-Hank’s平衡盐液冲洗3次后收集脐带组织小块;
(2)分离脐带成体干细胞:将脐带组织小块以比例每1ml脐带组织小块加入5ml 0.2%胶原酶液,37℃消化50min,消化终止后用200目滤网过滤,收集单细胞,在收集到的单细胞中以比例1ml细胞体积加入3~5ml红细胞裂解液,4℃水浴5min以去除红细胞,再以5倍于脐带细胞体积的D-Hank’s平衡盐液洗一遍,以50倍于脐带细胞的体积加入配好的低糖DMEM培养基,培养基含10%FBS、5ng/ml bFGF、100U/ml青霉素、100μg/ml链霉素和25mmol/L谷氨酰胺,调整培养细胞密度为1×105个/ml,接种于75cm2的培养瓶,置于37℃,5%CO2,饱和湿度95%的培养箱培养,每3~4天进行换液;单纯脐带成体干细胞连续传代5次;
(3)脐带成体干细胞的扩大培养:培养5代后,该细胞具有很好的贴壁稳定性(参见说明书附图1C);之后,使用滚瓶贴壁培养模式进行扩大化培养;
(4)脐带成体干细胞在悬浮培养体系中转化成3D微球:扩大化培养后干细胞转至摇瓶悬浮培养体系以每分30转速度悬浮培养,转化脐带成体干细胞成为3D微球(参见说明书附图1D);
(5)脐带成体干细胞3D微球的射线辐照修饰:通过160Gy X射线辐照脐带成体干细胞3D微球,建立高稳定型的射线辐照修饰化脐带成体干细胞3D微球活制剂,稳定生存率高于95%(参见说明书附图1E);
(6)脐带成体干细胞3D微球活制剂的制备:收集上述辐照后脐带成体干细胞3D微球,球直径100-120μm(参见说明书附图1F),装入2ml冻存小管,每支8×103个射线辐照修饰的脐带成体干细胞3D微球,冻存液为人的AB血浆,总体积为1ml,于-196℃液氮中贮存,解冻后直接使用。
实施例3.射线辐照修饰脐带成体干细胞3D微球活制剂治疗肿瘤的动物模型构建:采用6-8周龄、18-24g的C57BL/6小鼠建立肺癌模型。采用6-8周龄、18-24g的Balb/C小鼠建立乳腺癌、肝癌、结肠癌模型。每只右侧胁部皮下接种活肿瘤细胞8×105个(0.1ml),种瘤后第9天肿瘤可摸及约3mm3大小,开始采用实施例1的制剂进行治疗。
实施例4.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射诱发肿瘤消退:实施例1制剂的使用,选择在肿瘤发生之后,首先选择最常见的肿瘤:男性肺癌、女性乳腺癌作为治疗模型,注射部位选择肿瘤对侧方皮下,剂量为8×103个干细胞3D微球活制剂,10天后进行一次同剂量加强免疫治疗。多种肿瘤包括肺癌、乳腺癌、肝癌与结肠癌模型治疗结果显示实验组应用实施例1的制剂治疗后肿瘤体积明显小于对照组,尤其是射线辐照修饰脐带成体干细胞3D微球治疗组大部分肿瘤明显至完全消退(参见说明书附图2-5)。
实施例5.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射抑制肿瘤干细胞的转移:肿瘤转移指数分析发现实施例1制剂治疗组(R-USC-Sph)的肿瘤肿瘤转移明显下降,大部分宿主的肿瘤转移指数趋向0%,(参见说明书附图6)。与对照组相比,结果有统计学意义(*P<0.05)。
实施例6.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射抑制肿瘤干细胞的增殖:与对照组相比,肿瘤组织的CD133/MUC-1免疫组化染色显示,实施例1制剂治疗组(R-USC-Sph)的肿瘤组织中肿瘤干细胞明显减少。(参见说明书附图7A),同对照组相比结果有统计学意义(*P<0.05)。
实施例7.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射增加NK细胞活性:与对照组相比,肿瘤组织的NK细胞免疫组化染色显示,实施例1制剂治疗组(R-USC-Sph)的肿瘤组织中活化NK细胞明显多于对照组(参见说明书附图7B),结果有统计学意义(*P<0.05)。
实施例8.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射肿瘤干细胞凋亡:与对照比较,肿瘤组织免疫荧光染色显示实施例1制剂治疗组(R-USC-Sph)肿瘤组织中肿瘤干细胞明显凋亡(参见说明书附图7C),与对照组比较,结果有统计学意义(*P<0.05)。
实施例9.射线辐照修饰脐带成体干细胞3D微球活制剂体内注射增加淋巴细胞分泌干扰素和白介素-4:与对照比较,Elispot分析显示实施例1制剂治疗组(R-USC-Sph)淋巴细胞分泌的干扰素-γ(介导抗肿瘤细胞免疫)和白介素-4(介导抗肿瘤体液免疫)明显高于对照组(参见说明书附图8),结果有统计学意义(*P<0.05)。
- 还没有人留言评论。精彩留言会获得点赞!