同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂及试剂盒的制作方法
本发明涉及诊断
技术领域:
,特别是涉及一种同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂及试剂盒。
背景技术:
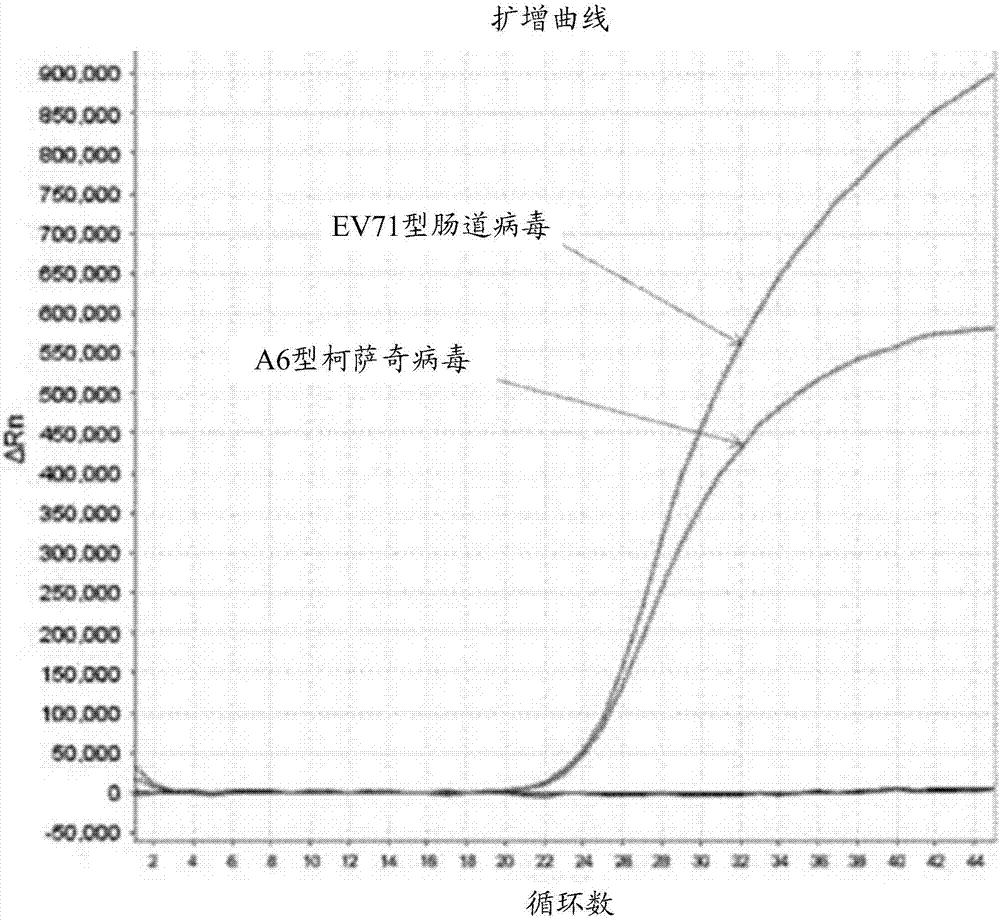
:手足口病是由肠道病毒引起的传染病,引发手足口病的肠道病毒有20多种(型),其中以EV71型肠道病毒(EV71)和A16型柯萨奇病毒(CoxA16,CA16)最为常见。但随着流行趋势的变化,有数据表明在2014年到2015年广东省爆发的手足口病中,A6型的柯萨奇病毒(CoxA6,CA6)已经取代了A16型的柯萨奇病毒(CoxA16,CA16),成为了柯萨奇病毒最为常见的病原体。近年来我国北京市、上海市、广东省、福建省、台湾省等地均有规模爆发EV71型肠道病毒和A6型的柯萨奇病毒引起的手足口病,所以这两种肠道病毒的早期检测十分重要。然而,目前暂未报道有同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂及试剂盒。技术实现要素:基于此,有必要提供一种检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂及试剂盒。一种同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂,包括:用于扩增EV71型肠道病毒的上游引物EV71F1,所述上游引物EV71F1的序列为SEQIDNo.1所示的序列;用于扩增EV71型肠道病毒的下游引物EV71R1,所述下游引物EV71R1的序列为SEQIDNo.2所示的序列;用于检测EV71型肠道病毒的探针EV71P1,所述探针EV71P1的两端分别结合有第一荧光报告基团和第一荧光淬灭基团;用于扩增A6型柯萨奇病毒的上游引物CA6F2,所述上游引物CA6F2的序列为SEQIDNo.3所示的序列;用于扩增A6型柯萨奇病毒的下游引物CA6R2,所述下游引物CA6R2的序列为SEQIDNo.4所示的序列;以及用于检测A6型柯萨奇病毒的探针CA6P2,所述探针CA6P2的两端分别结合有第二荧光报告基团和第二荧光淬灭基团,所述第一荧光报告基团与所述第二荧光报告基团不同。在一个实施方式中,所述探针EV71P1的序列为SEQIDNo.5所示的序列。在一个实施方式中,所述探针CA6P2的序列为SEQIDNo.6所示的序列。在一个实施方式中,所述第一荧光报告基团和所述第二荧光报告基团均选自FAM荧光基团、ROX荧光基团、VIC荧光基团、JOE荧光基团、TET荧光基团、CY3荧光基团、CY5荧光基团、TexasRed荧光基团和LCRED640荧光基团中的一种;所述第一荧光淬灭基团和所述第二荧光淬灭基团均选自BHQ1淬灭基团、BHQ2淬灭基团、BHQ3淬灭基团、Dabcy1淬灭基团和Tamra淬灭基团中的一种。在一个实施方式中,所述探针EV71P1的5’端结合有第一荧光报告基团,所述探针EV71P1的3’端结合有第一荧光淬灭基团,所述第一荧光报告基团为FAM荧光基团,所述第一荧光淬灭基团为BHQ1淬灭基团。在一个实施方式中,所述探针CA6P2的5’端结合有第二荧光报告基团,所述探针CA6P2的3’端结合有第二荧光淬灭基团,所述第二荧光报告基团为VIC荧光基团,所述第二荧光淬灭基团为BHQ1淬灭基团。在一个实施方式中,所述上游引物EV71F1、所述下游引物EV71R1、所述探针EV71P1的摩尔比为1:1:1,所述上游引物CA6F2、所述下游引物CA6R2、所述探针CA6P2的摩尔比为3:3:2,所述探针EV71P1与所述探针CA6P2的摩尔比为1:1。一种同时检测EV71型肠道病毒和A6型柯萨奇病毒的试剂盒,包括上述的检测试剂。在一个实施方式中,还包括PCR反应液、酶混合液、阳性对照品以及阴性对照品。在一个实施方式中,所述PCR反应液包括终浓度为20mmol/L~30mmol/L的MgCl2和终浓度为5mmol/L~15mmol/L的dNTPs;所述酶混合液包括热启动Taq酶和MMLV逆转录酶;所述阳性对照品为灭活的EV71型肠道病毒及A6型柯萨奇病毒的病毒培养液;所述阴性对照品为去RNA酶的无菌水。用上述检测试剂对样本进行处理后,上游引物EV71F1、下游引物EV71R1、探针EV71P1、上游引物CA6F2、下游引物CA6R2以及探针CA6P2相互配合,能够实现同时对样本中EV71型肠道病毒和A6型柯萨奇病毒扩增。然后通过荧光PCR分别检测第一荧光报告基团的信号以及第二荧光报告基团的信号的强度,判定样本中是否含有EV71型肠道病毒和A6型柯萨奇病毒,实现同一个样本同时检测是否感染EV71型肠道病毒和A6型柯萨奇病毒。该检测试剂能够对一管标本同时检测EV71型肠道病毒和A6型柯萨奇病毒两个项目,节省一半的时间,而且只需操作一次,减少了污染产生的机会。用上述检测试剂检测的灵敏度高、特异性好、可重复性强、检测结果快速客观,在临床诊断、疾病预防检测领域具有极大的应用前景。附图说明图1为实施例2中双重荧光定量PCR反应的原理图;图2为实施例2中样本1的PCR扩增曲线图。具体实施方式下面主要结合附图及具体实施例对本发明做进一步的解释说明。一实施方式的同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂,包括用于扩增EV71型肠道病毒的上游引物EV71F1、用于扩增EV71型肠道病毒的下游引物EV71R1、用于检测EV71型肠道病毒的探针EV71P1、用于扩增A6型柯萨奇病毒的上游引物CA6F2、用于扩增A6型柯萨奇病毒的下游引物CA6R2以及用于检测A6型柯萨奇病毒的探针CA6P2。其中,用于扩增EV71型肠道病毒的上游引物EV71F1的序列为SEQIDNo.1所示的序列,下游引物EV71R1的序列为SEQIDNo.2所示的序列。检测EV71型肠道病毒的探针EV71P1的两端分别结合有第一荧光报告基团和第一荧光淬灭基团。用于扩增A6型柯萨奇病毒的上游引物CA6F2的序列为SEQIDNo.3所示的序列,下游引物CA6R2的序列为SEQIDNo.4所示的序列。检测A6型柯萨奇病毒的探针CA6P2的两端分别结合有第二荧光报告基团和第二荧光淬灭基团,第一荧光报告基团与所述第二荧光报告基团不同。在其中一个实施例中,探针EV71P1的序列为SEQIDNo.5所示的序列。可以理解,在其他实施例中,探针EV71P1的序列不仅限于SEQIDNo.5所示的序列,只要能够检测EV71型肠道病毒即可。在其中一个实施例中,探针CA6P2的序列为SEQIDNo.6所示的序列。可以理解,在其他实施例中,探针CA6P2的序列不仅限于SEQIDNo.6所示的序列,只要能够检测A6型柯萨奇病毒即可。具体地,上游引物EV71F1、下游引物EV71R1、探针EV71P1、上游引物CA6F2、下游引物CA6R2以及探针CA6P2可以采用primer5.0专用软件设计,将设计的引物和探针预先在NCBI的GeneBank进行比对,检测引物和探针的特异性。引物和探针在专业合成公司合成,采用紫外分光光度计测定光密度值(A260nm/A280nm在1.8~2.0之间为合格)。用检测试剂对样本进行处理后,可通过双重荧光定量PCR技术,由于检测试剂中含有针对EV71病毒和柯萨奇A6型病毒的特异性引物和探针,因此能够实现了在同一反应体系中同时检测EV71病毒和柯萨奇A6型病毒的目的。其中,第一荧光报告基团和第二荧光报告基团均可选自FAM荧光基团、ROX荧光基团、VIC荧光基团、JOE荧光基团、TET荧光基团、CY3荧光基团、CY5荧光基团、TexasRed荧光基团和LCRED640荧光基团中的任意一种。第一荧光淬灭基团和第二荧光淬灭基团均可选自BHQ1淬灭基团、BHQ2淬灭基团、BHQ3淬灭基团、Dabcy1淬灭基团和Tamra淬灭基团中的任意一种。第一荧光报告基团与所述第二荧光报告基团不同,便于在荧光PCR中通过不同的荧光信号通道分别检测判定样本中是否含有EV71型肠道病毒和A6型柯萨奇病毒。如果能够检测到第一荧光报告基团的信号,而没有第二荧光报告基团的信号,则说明样本中含有EV71型肠道病毒并且不含有A6型柯萨奇病毒。如果能够检测到第二荧光报告基团的信号,而没有第一荧光报告基团的信号,则说明样本中含有A6型柯萨奇病毒并且不含有EV71型肠道病毒。如果能够检测到第一荧光报告基团和第二荧光报告基团的信号,则说明样本中同时含有有EV71型肠道病毒和A6型柯萨奇病毒;如果能够同时没有检测到第一荧光报告基团和第二荧光报告基团的信号,则说明样本中不含有有EV71型肠道病毒并且不含有A6型柯萨奇病毒。第一荧光淬灭基团和第二荧光淬灭基团可以相同,也可以不同,本实施例中,二者相同。本实施例中,探针EV71P1的5’端结合有第一荧光报告基团,探针EV71P1的3’端结合有第一荧光淬灭基团,第一荧光报告基团为FAM荧光基团,第一荧光淬灭基团为BHQ1淬灭基团。探针CA6P2的5’端结合有第二荧光报告基团,探针CA6P2的3’端结合有第二荧光淬灭基团,第二荧光报告基团为VIC荧光基团,第二荧光淬灭基团为BHQ1淬灭基团。在其中一个实施例中,检测试剂为混合均匀的混合物,上游引物EV71F1、下游引物EV71R1、探针EV71P1的摩尔比为1:1:1。上游引物CA6F2、下游引物CA6R2、探针CA6P2的摩尔比为3:3:2,探针EV71P1与探针CA6P2的摩尔比为1:1。该混合配比的检测试剂灵敏度高,特异性好。采用检测试剂对样本进行处理后,若检测样本中含有EV71型肠道病毒和A6型柯萨奇病毒,能够实现对EV71型肠道病毒和A6型柯萨奇病毒迅速扩增,实现在同一个样本同时检测EV71型肠道病毒和A6型柯萨奇病毒。上述检测试剂,上游引物EV71F1、下游引物EV71R1、探针EV71P1、上游引物CA6F2、下游引物CA6R2以及探针CA6P2相互配合,能够实现同时对样本中EV71型肠道病毒和A6型柯萨奇病毒扩增。然后通过荧光PCR分别检测第一荧光报告基团的信号以及第二荧光报告基团的信号的强度,判定样本中是否含有EV71型肠道病毒和A6型柯萨奇病毒,实现同一个样本同时检测EV71型肠道病毒和A6型柯萨奇病毒。灵敏度高、特异性好、可重复性强、检测结果快速客观。此外,本发明还提供一实施方式的同时检测EV71型肠道病毒和A6型柯萨奇病毒的试剂盒,该试剂盒中含有上述的检测试剂。在其中一个实施例中,试剂盒中还包括PCR反应液、酶混合液、阳性对照品以及阴性对照品。在其中一个实施例中,PCR反应液为RT-PCR反应液,PCR反应液中包括终浓度为20mmol/L~30mmol/L的MgCl2和终浓度为5mmol/L~15mmol/L的dNTPs。当然,PCR反应液还可以含有反应缓冲液,例如为Tris-HCl缓冲液等。PCR反应液为样本的扩增提供需要的原料以及扩增条件。酶混合液可以包括热启动Taq酶和MMLV逆转录酶,提高扩增的效率。阳性对照品为灭活的EV71型肠道病毒及A6型柯萨奇病毒的病毒培养液,阴性对照品为去RNA酶的无菌水。使用时,提取样本中的RNA,将PCR反应液、酶混合液、检测试剂以及按一定比例与提取的RNA混合,通过实时荧光定量PCR扩增,根据荧光曲线判断是否感染EV71型肠道病毒或者A6型柯萨奇病毒。实现同一个样本同时检测EV71型肠道病毒和A6型柯萨奇病毒。一管标本同时检测EV71型肠道病毒和A6型柯萨奇病毒两个项目,节省一半的时间,而且只需操作一次,减少了污染产生的机会。上述试剂盒检测的灵敏度高、特异性好、可重复性强、检测结果快速客观,在临床诊断、疾病预防检测领域具有极大的应用前景。下面为具体实施例部分。以下实施例中,如无特别说明,未注明具体条件的实验方法,通常按照常规条件,例如参见萨姆布鲁克、EF弗里奇、T曼尼阿蒂斯等(金冬雁,黎孟枫等译)所著的的分子克隆实验指南[M](北京:科学出版社,1992)中所述的条件或者试剂盒生产厂家推荐的方法实现。实施例中所使用的试剂均为市售。实施例1提供一种同时检测EV71型肠道病毒和A6型柯萨奇病毒的试剂盒,所述试剂盒包括RT-PCR反应液、检测试剂、酶混合液、阳性对照和阴性对照。其中,RT-PCR反应液包括10×缓冲液、终浓度为25mmol/L的MgCl2和终浓度为10mmol/L的dNTPs。检测试剂包括用于扩增EV71型肠道病毒的上游引物EV71F1、用于扩增EV71型肠道病毒的下游引物EV71R1、用于检测EV71型肠道病毒的探针EV71P1、用于扩增A6型柯萨奇病毒的上游引物CA6F2、用于扩增A6型柯萨奇病毒的下游引物CA6R2以及用于检测A6型柯萨奇病毒的探针CA6P2。上游引物EV71F1的序列为SEQIDNo.1所示的序列,下游引物EV71R1的序列为SEQIDNo.2所示的序列。上游引物CA6F2的序列为SEQIDNo.3所示的序列,下游引物CA6R2的序列为SEQIDNo.4所示的序列。探针EV71P1的5’端结合有第一荧光报告基团,探针EV71P1的3’端结合有第一荧光淬灭基团,第一荧光报告基团为FAM荧光基团,第一荧光淬灭基团为BHQ1淬灭基团。探针CA6P2的5’端结合有第二荧光报告基团,探针CA6P2的3’端结合有第二荧光淬灭基团,第二荧光报告基团为VIC荧光基团,第二荧光淬灭基团为BHQ1淬灭基团。上游引物EV71F1的浓度为为400nmol/L,下游引物EV71R1的浓度为400nmol/L,探针EV71P1的浓度为为400nmol/L。上游引物CA6F2的浓度为600nmol/L,下游引物CA6R2的浓度为600nmol/L,探针CA6P2的浓度为400nmol/L。酶混合液包括Taq酶和逆转入酶,其中,Taq酶为热启动Taq酶,逆转入酶为MMLV逆转入酶。阳性对照品为灭活的EV71型肠道病毒及A6型柯萨奇病毒的病毒培养液,阴性对照品为去RNA酶的无菌水。实施例2采用实施例1的试剂盒检测样本中的EV71型肠道病毒及A6型柯萨奇病毒1、提取样本RNA,例如可采用商品化核酸RNA提取试剂盒OMEGAE.Z.N.A.TotalRNAKitI(OMEGA,R6834-01)从病毒分离培养物中提取病毒RNA。具体步骤如下:1.1取200ul临床样品,加入400ulBindingbuffersupplementedwithpoly(A),充分混匀后转入高纯化过滤管,8000rmp离心15s,弃去过滤管中的废液。1.2加入500ulInhibitorRemovalBuffer至过滤管,8000rmp离心1min,弃去过滤管中的废液。1.3加入450ulWashingbuffer至过滤管,8000rmp离心1min,弃去过滤管中的废液;1.4重复步骤1.3,然后高速离心10s,此步骤务必将废液去除干净;1.5加入50ulElutionbuffer至过滤管中,室温静置2min,8000rmp离心1min,离心所得溶液即为纯化的RNA。2、在每个PCR反应管放入组分如表1中所示的EV71/A6型柯萨奇病毒检测试剂(实施例1制备)和RNA样本。表1:反应液组分反应液组分加样(ul)/人份RT-PCR反应液7酶混合液4.5检测试剂5去RNA酶的无菌水(阴性参考品)3.5RNA样本5总体积253、在荧光定量PCR扩增仪中扩增,按照下列程序进行PCR扩增:4、扩增结束后,根据荧光曲线判断是否感染EV71型肠道病毒及A6型柯萨奇病毒如图1所示,由于针对EV71型肠道病毒的探针EV71P1上标记FAM,针对A6型柯萨奇病毒的探针CA6P2上标记VIC。PCR反应过程中,若待检样本包含EV71型肠道病毒,则标记FAM的探针产生荧光信号。若待检样本包含A6型柯萨奇病毒,则标记VIC的探针产生荧光信号。这样,同一管反应则可确定两个靶基因。结果判定:在FAM通道内荧光曲线呈“S”型且CT≤35.0,判断为EV71型肠道病毒阳性;无典型“S”型扩增或CT>35.0,判断为EV71型肠道病毒阴性;在VIC通道内荧光曲线呈“S”型曲线且CT≤35.0,判断为A6型柯萨奇病毒阳性,无典型“S”型扩增或CT>35.0,判断为A6型柯萨奇病毒阴性。5个临床样本具体检测结果见表2。其中样本1的扩增曲线如图2所示。表2:检测结果从表2中的结果表明,样本1感染EV71型肠道病毒和A6型柯萨奇病毒。样本2感染EV71型肠道病毒,但未感染A6型柯萨奇病毒。样本3未感染EV71型肠道病毒,也未感染A6型柯萨奇病毒。样本4未感染EV71型肠道病毒,但感染A6型柯萨奇病毒。样本5未感染EV71型肠道病毒,也未感染A6型柯萨奇病毒。以上结果表明实施例1提供的该试剂盒能够在一管标本同时检测EV71型肠道病毒和A6型柯萨奇病毒两个项目,节省一半的时间,而且只需操作一次,减少了污染产生的机会。检测的灵敏度高、特异性好、可重复性强、检测结果快速客观,在临床诊断、疾病预防检测领域具有极大的应用前景。以上所述实施例仅表达了本发明的一种或几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。SEQUENCELISTING<110>深圳市艾伟迪生物科技有限公司<120>同时检测EV71型肠道病毒和A6型柯萨奇病毒的检测试剂及试剂盒<160>6<170>PatentInversion3.3<210>1<211>21<212>DNA<213>上游引物EV71F1<400>1gcgggattagttggagagata21<210>2<211>21<212>DNA<213>下游引物EV71R1<400>2ttgcgcgtaacctgttatatc21<210>3<211>21<212>DNA<213>上游引物CA6F2<400>3taagccggatagcaggaaatc21<210>4<211>22<212>DNA<213>下游引物CA6R2<400>4tgtagggtaaccatcataaaac22<210>5<211>25<212>DNA<213>探针EV71P1<400>5accatttgggttagttgtgccttca25<210>6<211>27<212>DNA<213>探针CA6P2<400>6caggtgtctgtcccgttcatgtcgcca27当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1