一种铜绿假单胞菌噬菌体及其应用的制作方法
本发明属于生物技术领域,更具体地说,涉及一种铜绿假单胞菌噬菌体及其应用。
背景技术:
铜绿假单胞菌(p.aeruginosa)也称绿脓杆菌是一种在环境中广泛存在的革兰氏阴性致病菌,能够引起人的囊肿性纤维症、以及严重烧伤和某些癌症患者危及生命的急性感染和免疫抑制患者的慢性感染。在动物,铜绿假单胞菌主要引起马的子宫内膜炎,牛和其他反刍动物的乳腺炎,毛丝鼠的中耳炎、内耳炎,水貂的出血性肺炎等,给养殖业带来了巨大的损失。治疗铜绿假单胞菌感染的传统的方法是抗生素,然而由于多重耐药铜绿假单胞菌菌株的出现和新的治疗制剂的短缺,使得该菌引起感染的治疗变得越来越困难。
铜绿假单胞菌的耐药机制很多,而生物被膜(biofilm,bf)的形成是一个很重要的耐药机制,也是引起临床治疗失败的很重要原因。细菌生物膜是细菌在生长过程中为适应生存环境而吸附于机体或物体表面形成的一种与浮游细菌相对应的生长方式,由细菌和它所分泌的细胞外基质组成,主要组成分为胞外多糖(exopolysaccharide,eps)。bf细菌有极强的耐药性,且bf可以保护细菌逃避机体的免疫作用,导致病原菌难以彻底清除。现已证实约有90%的微生物生活在微生物被膜(bacterialbiofilm,bf)系统中,80%的细菌性疾病与细菌生物膜有关。近年来,临床上细菌生物膜引起的顽固性感染日益增多,给临床治疗增加难度。
目前国际上对绿脓杆菌bf抑制作用主要致力于抗生素的研究,目前已发现十四、十五元环大环内酯类抗生素(如红霉素、克拉霉素、阿奇霉素)、利福平等在体外能抑制绿脓杆菌形成bf,但效果一般。噬菌体作为特异性感染和裂解细菌的病毒,在20年代早期,噬菌体疗法已被认为是一种用于细菌感染性疾病治疗的有效药物。近年来,全世界范围内持续增加出现的耐药性菌株,噬菌体疗法可能会是常规抗生素治疗的替代方法之一,许多实验表明噬菌体疗法是有效的,并且在某种程度上,噬菌体疗法优于抗生素治疗方法:第一,噬菌体更具有特异性;第二,噬菌体可以在感染部位复制和大量聚集,从而提高了杀菌效率。
技术实现要素:
本发明的目的在于提供一种新型铜绿假单胞菌噬菌体及其制剂,用于铜绿假单胞菌生物被膜抑制,高效降解铜绿假单胞菌生物被膜。
为了达到上述目的,本发明提供了一种铜绿假单胞菌噬菌体,该铜绿假单胞菌噬菌体菌株名为vb_paem_qkl1,保藏号cgmccno.13381,分类命名为铜绿假单胞菌噬菌体,于2016年12月08日保藏于“中国微生物菌种保藏管理委员会普通微生物中心”,简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101。
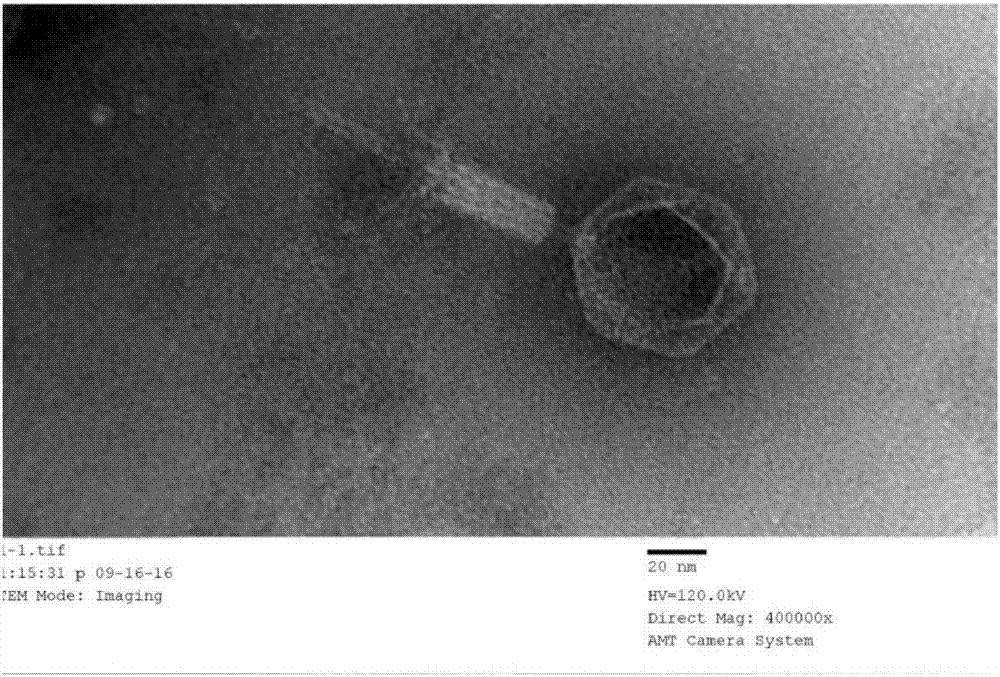
本发明提供的铜绿假单胞菌噬菌体以水貂来源的铜绿假单胞菌为宿主,分离得到铜绿假单胞菌强裂解性噬菌体,通过一步生长曲线表征,其潜伏期、裂解期分别约为20min、35min,裂解量为120pfu/感染细胞,裂解能力较强。本发明噬菌体属于肌尾病毒科(myoviridae),头部为二十面体,直径约为50nm,尾长约为65nm。
本发明还提供了上述铜绿假单胞菌噬菌体的应用,用于降解铜绿假单胞菌生物被膜。
优选方式下,所述铜绿假单胞菌噬菌体用于以下方面:
(1)制备抑制铜绿假单胞菌生物被膜形成的产品;
(2)制备裂解铜绿假单胞菌生物被膜的产品;
(3)制备降低铜绿假单胞菌生物被膜形成总量的产品;
(4)制备与抗生素共同作用提高对铜绿假单胞菌的杀伤效率的产品;
(5)制备用与化学清洁剂联合应用的消毒的产品。
优选方式下,上述铜绿假单胞菌噬菌体的应用还包括制备含有铜绿假单胞菌噬菌体的制剂,所述制剂活性成分包括铜绿假单胞菌噬菌体cgmccno.13381。
进一步优化,所述含有铜绿假单胞菌噬菌体的制剂应用于以下方面:
(1)制备抑制铜绿假单胞菌生物被膜形成的产品;
(2)制备裂解铜绿假单胞菌生物被膜的产品;
(3)制备降低铜绿假单胞菌生物被膜形成总量的产品;
(4)制备与抗生素共同作用提高对铜绿假单胞菌的杀伤效率的产品;
(5)制备用与化学清洁剂联合应用的消毒的产品。
本发明相对于现有技术具有如下优势:
1、本发明铜绿假单胞菌噬菌体尾刺(tailspike)中有胞外聚合物(eps)的降解酶类,这些酶类具有裂解细胞被膜进而裂解生物被膜产生菌的潜力,从而彻底去除细菌生物被膜。
2、本发明铜绿假单胞菌噬菌体对铜绿假单胞菌生物被膜的抑制效果明显,加入moi大于1的噬菌体即可达到很好抑制效果;本发明铜绿假单胞菌噬菌体能够破坏铜绿假单胞菌生物被膜,对铜绿假单胞菌(pseudomonasaeruginosa)生物被膜具有明显的清除作用;本发明噬菌体和抗生素的联合应用对生物被膜的清除作用增强;本发明噬菌体与常用化学清洁剂联合应用对于生物被膜的降解具有良好效果。
附图说明
图1为不同培养时间下的噬菌斑形态;
图2为所述噬菌体(cgmccno.13381)的透射电镜图;
图3为噬菌体(cgmccno.13381)对铜绿假单胞杆菌生物被膜的抑制效果;
图4为噬菌体(cgmccno.13381)对铜绿假单胞杆菌生物被膜的破坏效果;
图5为噬菌体(cgmccno.13381)联合抗生素对生物被膜的清除作用;
图6为噬菌体(cgmccno.13381)联合化学清洁剂对生物被膜的降解作用。
保藏信息
本发明所提供的铜绿假单胞菌噬菌体该菌株已于2016年12月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101),保藏登记号为cgmccno.13381。
具体实施方式
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
本发明铜绿假单胞菌噬菌体通过透射电镜观察,属于肌尾病毒科(myoviridae),头部直径约为50nm,尾长约为65nm,透射电镜图片见图2。
实施例1噬菌体的分离和鉴定
一噬菌体的分离
取医院处理前的污水1l,加入cacl2至1mmol/l,4℃,5000rpm离心10min,去除污水中的沉淀颗粒,取上清用0.22μm滤膜滤过除菌;取滤液20ml与20ml2×lb培养基混合,按1%的接种量,接种400μl的绿脓杆菌,37℃富集培养12h。取5ml的上述菌液4℃、5000rpm离心10min,取上清用0.22μm的滤膜滤过除菌,得噬菌体原液。把得到的噬菌体原液10倍梯度稀释,分别取300μl的稀释液与相应的对数生长期的绿脓杆菌1:1混合,37℃培养15min,与4ml55℃液体lb培养基混合,均匀倾入固体lb琼脂平板上,冷却15min倒置37℃过夜培养。次日,得到单个噬菌斑。
在噬菌斑形成的平板上用枪头挑取较大的、独立的噬菌斑放入1mlsm液的ep管中,室温放置1h后4℃过夜,次日取0.1ml经过适当稀释后(10-1-10-8),与相应的培养至对数生长期的宿主菌1:1混合做双层平板进行纯化,次日得到大小均匀的噬菌斑。得到均匀大小的噬菌斑后,对此噬菌体再次做双层平板实验(步骤如上),分别在37℃条件下培养24h,48h后观察噬菌斑的形态,噬菌斑形态如图1。发现在噬菌斑的透明区域外面有一圈半透明的晕环,说明该噬菌体尾刺中有胞外聚合物的降解酶,该酶类能降解生物被膜胞外聚合物。随时间增加噬菌体扩散出噬菌斑的透明区而裂解周围的细菌,所以晕环会随着时间的增加而增大。
用灭菌枪头挑取上述纯化好的噬菌斑加入培养至对数生长期的宿主菌中,37℃,140rpm培养6h左右,培养液变的相对澄清,将培养液4℃、8000rpm离心5min,取上清用0.22μm的滤膜过滤,除去少量的细菌及细菌碎片,即得高效价的噬菌体原液。
二噬菌体的鉴定
从形态学和噬菌体裂解谱两个方面对该噬菌体进行鉴定。
1形态学鉴定
具体方法为:将350目的铜网浸入噬菌体纯化液中,10min后取出铜网,用滤纸吸取多余的液体;将铜网放在5%(w/v)的乙酸铀酰液滴上,染色后取出放在滤纸上待测;待全部样品处理好后,使用加速电压为80kv的tem观察噬菌体形态。电镜图显示属于肌尾病毒科(myoviridae),头部直径约为50nm,尾长约为65nm。噬菌体形态如图2.
2噬菌体裂解谱测定
分别向制备好的lb琼脂培养基平板上加入2ml的待测菌株对数期菌液,摇动平板使菌液均匀分布在平板上,吸取多余的菌液,安全柜中静置15min;每个平板上的不同区域分别滴加5μl不同的噬菌体粗制液,安全柜中再次静置15min,待噬菌体液体被琼脂平板完全吸收,37℃倒置过夜培养,次日观察是否有噬菌斑出现。选用的细菌包括本实验室分离的貂源铜绿假单胞菌(p.aeruginosa)pa-dlut-1、p.aeruginosa0212、p.aeruginosa0205、p.aeruginosa0206、p.aeruginosa10104、p.aeruginosaatcc27853、klebsiella6*-1(克雷伯氏)、p.mirabilisg1(变形杆菌)、eteco57:h7atcc35150(产肠毒素大肠杆菌)、s.areusatcc29213(金黄色葡萄球菌)、s.typhimurimcmcc20115(沙门氏菌)。
采用单层琼脂平板法分析噬菌体的宿主谱。结果显示该噬菌体能裂解6株绿脓杆菌中的5株,形成的噬菌斑比较大且较透亮,但噬菌体不能裂解克雷伯氏菌、变形杆菌、大肠杆菌、金黄色葡萄球菌、沙门氏菌的代表菌株,宿主谱如表一。
通过形态学和宿主谱鉴定该噬菌体为铜绿假单胞菌噬菌体,为肌尾噬菌体科,且宿主谱较宽。
表一铜绿假单胞菌噬菌体(cgmccno.13381)的宿主谱
实施例2铜绿假单胞菌噬菌体(cgmccno.13381)抑制铜绿假单胞菌生物被膜的检测
1噬菌体(cgmccno.13381)的扩增和纯化
挑取宿主菌单个菌落,接种于100ml液体lb培养基,37℃,140rpm培养6h至对数生长早期,然后用灭菌枪头挑取上述纯化好的噬菌斑加入培养至对数生长期的宿主菌中,37℃,140rpm培养6h左右,观察到有白色絮状物时;取出培养物8000rpm,离心5min,取上清液10ml加入50ml培养至对数生长期的宿主菌种,37℃,140rpm培养,观察培养液的状态,待培养液变的相对澄清,并且有白色絮状沉淀后(约5-7h),将培养液4℃、8000rpm离心5min,取上清用0.22μm的滤膜过滤,4℃备用。
2铜绿假单胞菌(pseudomonasaeruginosa)的活化
从-80℃的冰箱中取出保种的铜绿假单胞菌(pseudomonasaeruginosa),室温解冻后加入20mllb液体培养基中37℃,140rpm过夜培养。取过夜培养菌液100倍稀释后取1ml稀释后的菌液加入100mllb液体培养基中37℃,140rpm培养6h至对数生长期,4℃备用。
3检测该噬菌体(cgmccno.13381)对铜绿假单胞菌(pseudomonasaeruginosa)生物被膜的抑制效果
(1)生物被膜的培养。将培养至对数生长期(约为108pfu/ml)的铜绿假单胞菌接种到24孔细胞培养板中,每孔20μl菌液和2mltsb培养基,实验组按照moi为0.1,1,10分别加入噬菌体,阳性对照组不加噬菌体记moi为0,每组做三个重复孔。置37℃恒温箱中培养24小时后,更换一次培养基,加入2mltsb培养基继续培养48小时。只含tsb培养基的孔作为对照孔。培养72小时后取出细胞培养板,弃去游离培养基并用灭菌的pbs(ph7.2)轻轻洗涤两次以去除游离菌。
(2)铜绿假单胞菌生物被膜的固定及染色。培养好的细菌生物被膜用甲醇(500μl)固定半小时。弃去固定液,37℃温箱干燥,用1%的结晶紫染色(500μl)半小时后弃去染色液,蒸馏水清洗两次。将24孔细胞培养板放置于70℃烘箱中烘干,取出后每孔加入33%乙酸溶液(500μl),置于摇床30min以释放生物被膜中的结晶紫。每孔取200μl释放液加入96孔酶标板中,测定其在od600。吸光度越大,说明溶解产物的浓度越大,生物被膜的生物量也就越大。反之,则表明微生物被膜的生物量变小,生物被膜形成受到抑制。
(3)检测结果如图3所示,从图中可以看出,与阳性对照组相比,加入了moi为1和10的噬菌体各组,对铜绿假单胞菌(pseudomonasaeruginosa)生物被膜的形成均具有明显的抑制作用(p<0.01,差异极显著)。实验结果表明,加入moi大于1的噬菌体即可达到很好抑制效果,且这种抑制作用随着加入的噬菌体浓度的增大而增强。
实施例3铜绿假单胞菌噬菌体cgmccno.13381破坏铜绿假单胞菌生物被膜的检测
1噬菌体(cgmccno.13381)的扩增和纯化
如实施例2所述
2铜绿假单胞菌(pseudomonasaeruginosa)的活化
如实施例2所述
3生物被膜的培养和噬菌体对其的作用
将培养至对数生长期(约为108pfu/ml)的铜绿假单胞菌接种到含有细胞爬片的24孔细胞培养板中,每孔20μl菌液和2mltsb培养基,置37℃恒温箱中培养24小时后,更换一次培养基,加入2mltsb培养基继续培养48小时。培养72小时后取出细胞爬片,用灭菌的pbs(ph7.2)轻轻洗涤两次以去除游离菌,然后把细胞爬片置换到新的24孔板里加入噬菌体(moi=0.1,1和10),阳性对照组记为moi=0,37℃温箱培养12小时后固定、染色、观察。
4结晶紫半定量测定细菌生物被膜的消除情况
24孔板中的细胞爬片用甲醇(500μl)固定半小时。弃去固定液,37℃温箱干燥,用1%的结晶紫染色(500μl)半小时后弃去染色液,蒸馏水清洗两次。将24孔细胞培养板放置于70℃烘箱中烘干,取出后每孔加入33%乙酸溶液(500μl),置于摇床30min以释放生物被膜中的结晶紫。每孔取200μl释放液加入96孔酶标板中,测定其在od600。根据od值的大小确定生物被膜的残留量。
生物被膜的降解效果如图4。从图中可以看出,与对照组(moi=0)相比,加入了噬菌体(cgmccno.13381)的组,对铜绿假单胞菌(pseudomonasaeruginosa)生物被膜的具有明显的清除作用,且这种降解作用随着加入的噬菌体浓度的增大而增强。
实施例4噬菌体(cgmccno.13381)联合抗生素对生物被膜的清除作用
1噬菌体(cgmccno.13381)的扩增和纯化
如实施例2所述
2铜绿假单胞菌(pseudomonasaeruginosa)的活化和生物被膜的培养
如实施例2所述
3噬菌体(cgmccno.13381)联合抗生素对生物被膜的清除作用
培养到成熟的载有生物被膜的细胞爬片取出,用灭菌的pbs(ph7.2)轻轻洗涤两次以去除游离菌,然后把细胞爬片置换到新的24孔板里分别加入噬菌体组(moi=10),噬菌体(moi=0.1,1和10)+卡那霉素组(100μg/ml),卡那霉素组(100μg/ml),37℃温箱培养12小时后,取出细胞培养板,弃去游离培养基并用灭菌的pbs(ph7.2)轻轻洗涤两次以去除游离菌,取漂洗后的细胞爬片放入加入含有20ml0.9%生理盐水离心管中,然后放入超声波震荡仪中震荡22%功率10min,取超声震荡后的菌液经适当的稀释后取0.1ml加入lb平板中,37℃培养20-24h后观察菌落数量,根据存活的细菌数量判断噬菌体和抗生素清除生物被膜的效果。
生物被膜的降解效果如图5。从图中可以看出与对照组相比,加入了噬菌体(cgmccno.13381)的组,噬菌体(cgmccno.13381)+卡那霉素组和卡那霉素组对铜绿假单胞菌(pseudomonasaeruginosa)生物被膜都具有清除作用;而噬菌体(cgmccno.13381)后,特别是加入与对照组相同浓度的噬菌体时,噬菌体(cgmccno.13381)和抗生素的联合应用对生物被膜的清除作用更加明显,且这种清除作用随着加入噬菌体浓度的增加增强。
实施例5制备用与常用化学清洁剂联合应用的消毒的产品
1噬菌体(cgmccno.13381)的扩增和纯化
如实施例2所述
2铜绿假单胞菌(pseudomonasaeruginosa)的活化
如实施例2所述
3噬菌体(cgmccno.13381)和常用化学清洁剂主要成分联合应用效果
噬菌体(cgmccno.13381)用sm缓冲液稀释后得到效价为108pfu/ml。将噬菌体(cgmccno.13381)、1%tritonx-100(非离子清洁剂)、及二者混合物(体积比1:1)加到生物被膜上,每孔各100μl。sm液作为对照。将处理后的生物被膜置于37℃培养箱中分别培养4、8、12、24小时后,弃去废液并用灭菌pbs(ph7.2)轻轻洗涤两次以去除游离菌。按照常规方法固定、染色。测定在600nm波长处的吸光度。根据od值的大小确定生物被膜的残留量。
生物被膜的降解效果如图6。从图中可以看出,噬菌体(cgmccno.13381)和1%tritonx-100联合应用效果最好;12小时内生物被膜基本清除干净,清除效果优于单独使用噬菌体(cgmccno.13381);1%tritonx-100单独处理24小时后,效果不明显。从实例2,3,4,5的结果可以得出噬菌体(cgmccno.13381)可以制作降低铜绿假单胞菌生物被膜形成总量的产品。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 检测水中铜绿假单胞菌和toxA的引物、试剂盒和方法与流程
- 一株可裂解多重耐药铜绿假单胞菌的噬菌体及其治疗感染的应用的制作方法与工艺
- 芪类化合物在抑制铜绿假单胞菌群体感应系统中的应用的制作方法与工艺
- 利用群体感应调控铜绿假单胞菌好氧反硝化以除废水中硝酸盐的方法与流程
- 适用于广泛耐药铜绿假单胞菌的筛查培养基及制备方法与流程
- 一株用于细菌病害防治的假单胞菌及应用的制造方法与工艺
- 一种利用高产鼠李糖脂的铜绿假单胞菌降解石油的方法与流程
- D‑色氨酸在抑制铜绿假单胞菌产弹性蛋白酶中的应用的制造方法与工艺
- 用于RPA快速检测携带喹诺酮类耐药基因的铜绿假单胞菌的引物及其应用的制造方法与工艺
- 铜绿假单胞菌噬菌体裂解酶及应用的制造方法与工艺