一种3,3‑二氟‑4‑吡咯啉‑2‑酮化合物的合成方法与流程
本发明属于化学有机合成技术领域,具体涉及一种以炔烃和溴代二氟乙酰胺类化合物为原料催化合成3,3-二氟-4-吡咯啉-2-酮化合物的方法。
背景技术:
:
含氟杂环化合物广泛应用于医药、农用化学品和材料领域,杂环中氟原子的引入可以提高其生物活性,改善生物分子的稳定性((a)Uneyama, K.; Sasaki, K. Pharmaceuticals containing fluorinated heterocyclic compounds. In Fluorinated Heterocyclic Compounds: Synthesis, Chemistry and Application;Petrov, V. A., Ed.; John Wiley & Sons: Hoboken. 2009, 419. (b) Kwiatkowski, P.; Beeson, T. D.; Conrad, J. C.; MacMillan, D. W. C.J.Am.Chem.Soc.2011, 133, 1738. (c) Silvester, M. J. Aldrichimica Acta. 1991, 24, 31.)。目前,一些含氟的杂环化合物已经在工业、农业和医药上有所应用(Filler R, Kobayashi Y, Yagupolskii L M. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications. Amsterdam: Elsever, 1993.),其中,以吡咯啉为母核结构的化合物在医药中有广泛的应用,并且由于分子中有C=C不饱和键存在,可以作为医药或者有机合成中间体,进一步发生官能团化反应,对具有消炎、抗老年痴呆、抗肿瘤及抗HIV等药理活性的吡咯烷酮的修饰有重要的作用。在吡咯啉分子中引入氟原子必将进一步改善药品的生理活性,因此,发展绿色环保、新型高效的合成3,3-二氟-4-吡咯啉-2-酮化合物的方法是相当重要且具有重要药用研究价值。
到目前为止,合成3,3-二氟-4-吡咯啉-2-酮化合物的方法鲜有报道。近年来,炔烃的双官能团化反应由于可以同时在分子中引入两个不同的基团,所用原料简单易得,原子经济性高,在合成复杂的有机分子中得到了迅速的发展。并且,反应后的产物有C=C不饱和键存在,可以进一步的发生官能团化反应,有利于对产物进行修饰。因此,发展高效、廉价、环保的利用炔烃的双官能团化反应来合成3,3-二氟-4-吡咯啉-2-酮化合物极其重要。
技术实现要素:
:
本发明目的在于提供一种以炔烃和溴代二氟乙酰胺类化合物为原料催化合成3,3-二氟-4-吡咯啉-2-酮化合物的方法,该方法具有原子经济性高、反应步骤简单、原料廉价易得、底物适用范围广泛等优点。
一种3,3-二氟-4-吡咯啉-2-酮化合物的合成方法,其包括以下步骤:
将溴代二氟乙酰胺类化合物用溶剂溶解,并加入炔烃混合均匀,然后加入配体邻菲罗啉(Phen)、催化剂CuI和碱K2CO3,在密闭条件下升温至110±10℃搅拌反应1-3小时,反应结束经后处理即得。反应方程式如下所示:
式中,化合物1为炔烃,可以是芳环带有各种取代基的苯乙炔类化合物、或乙炔基噻吩化合物等,具体的如苯乙炔、对氟苯乙炔、对溴苯乙炔等苯乙炔类化合物或3-乙炔基噻吩杂芳炔类化合物。化合物2为溴代二氟乙酰胺类化合物,可以是取代芳基、苄基或苯乙基的溴代二氟乙酰胺等,具体的如溴代二氟乙酰对甲苯胺、溴代二氟乙酰-3,4-二甲氧基苯胺或溴代二氟乙酰苯乙胺等。所用溶剂可以是乙腈(CH3CN)等,1mmol溴代二氟乙酰胺类化合物添加8-15ml溶剂为宜。
具体的,所述溴代二氟乙酰胺类化合物与炔烃的摩尔比为1:1.2—1:2.0。
具体的,所述配体邻菲罗啉与溴代二氟乙酰胺类化合物的摩尔比为5—15:100,催化剂CuI与溴代二氟乙酰胺类化合物的摩尔比为5—15:100,碱K2CO3与溴代二氟乙酰胺类化合物的摩尔比为1.5—2.5:1。
本发明方法以CuI为催化剂、邻菲罗啉(Phen)为配体,K2CO3为碱在乙腈溶剂中进行反应,由炔烃和溴代二氟乙酰胺类化合物经催化加成一步法得到3,3-二氟-4-吡咯啉-2-酮化合物。和现有技术相比,本发明的优点和创新性在于:1)填补了有效合成3,3-二氟-4-吡咯啉-2-酮化合物方法的空白,为其进一步在医药、材料及有机合成中的拓展应用提供了简单实用的合成方法,且反应操作简单,产率较高。2)该反应所用的原料易从工业产品中获得,试剂廉价,底物范围宽泛,适用于工业生产。3)合成产物3,3-二氟-4-吡咯啉-2-酮化合物为烯烃类化合物,结构式中有C=C不饱和键存在,可以作为医药或者有机合成中间体,进一步发生官能团化反应,合成具有重要医用价值的多取代吡咯烷酮类化合物。
附图说明
图1为实施例1产物3,3-二氟-4-吡咯啉-2-酮3a的1H NMR谱图;
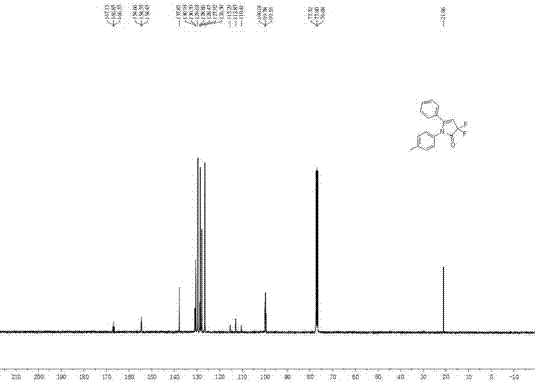
图2为实施例1产物3,3-二氟-4-吡咯啉-2-酮3a的13C NMR谱图;
图3为实施例1产物3,3-二氟-4-吡咯啉-2-酮3a的19F NMR谱图;
图4为实施例6产物3,3-二氟-4-吡咯啉-2-酮3f的1H NMR谱图;
图5为实施例6产物3,3-二氟-4-吡咯啉-2-酮3f的13C NMR谱图;
图6为实施例6产物3,3-二氟-4-吡咯啉-2-酮3f的19F NMR谱图。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
实施例1:
首先,在35 mL的密封管中放入搅拌子,并依次加入79.2 mg(0.3 mmol)溴代二氟乙酰对甲苯胺、3.0 ml乙腈,49 μL苯乙炔(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=50:1)分离得78.7 mg白色固体产物3a,产率92%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 2.32 (s, 3H), 5.63 (t, J = 1.2 Hz, 1H), 6.91 (d, J = 8.4 Hz, 2H), 7.11 (d, J = 8.0 Hz, 2H), 7.18 (d, J = 7.6 Hz, 2H), 7.29 (t, J = 7.6 Hz, 2H), 7.38 (t, J = 7.6 Hz, 1H); 13C NMR (100 MHz, CDCl3): δ = 21.1, 99.8 (t, J = 23.0 Hz), 112.9 (t, J = 244.0 Hz), 126.5, 127.9, 128.5, 128.8, 129.6, 130.6, 130.9, 137.9, 154.6 (t, J = 11.0 Hz), 166.9 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -110.1. HRMS(ESI-TOF)Calcd for C17H14F2NO, [M+H]+m/z 286.1043, Found 286.1042。
实施例2:
首先,在35 mL的密封管中放入搅拌子,并依次加入79.2 mg(0.3 mmol)溴代二氟乙酰对甲苯胺、3.0 ml乙腈,52 μL对氟苯乙炔(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=50:1)分离得82.9 mg白色固体产物3b,产率91%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 2.33 (s, 3H), 5.61 (d, J = 1.6 Hz, 1H), 6.90 (d, J = 8.4 Hz, 2H), 6.98 (t, J = 8.4 Hz, 2H), 7.13 (d, J = 8.0 Hz, 2H), 7.16-7.20 (m, 2H); 13C NMR (100 MHz, CDCl3): δ = 21.1, 99.7 (t, J = 23.0 Hz), 112.8 (t, J = 244.0 Hz), 115.8 (d, J = 22.0 Hz), 124.9 (d, J = 3.0 Hz), 126.6, 129.8, 130.1 (d, J = 8.0 Hz), 130.8, 138.1, 153.5 (t, J = 11.0 Hz), 163.8 (d, J = 251.0 Hz), 166.7 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -110.0, -108.3. HRMS(ESI-TOF)Calcd for C17H13F3NO, [M+H]+m/z 304,0949, Found 304,0944。
实施例3:
首先,在35 mL的密封管中放入搅拌子,并依次加入79.2 mg(0.3 mmol)溴代二氟乙酰对甲苯胺、3.0 ml乙腈,81.5 mg 对溴苯乙炔(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=50:1)分离得89.6 mg白色固体产物3c,产率82%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 2.33 (s, 3H), 5.64 (s, 1H), 6.90 (d, J = 8.0 Hz, 2H), 7.05 (d, J = 8.0 Hz, 2H), 7.13 (d, J = 8.0 Hz, 2H), 7.43 (d, J = 8.4 Hz, 2H); 13C NMR (100 MHz, CDCl3): δ = 21.1, 100.1 (t, J = 23.0 Hz), 112.6 (t, J = 244.0 Hz), 125.2, 126.5, 127.7, 129.4, 129.8, 130.7, 131.9, 138.2, 153.5 (t, J = 11.0 Hz), 166.7 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -110.2. HRMS(ESI-TOF)Calcd for C17H13BrF2NO, [M+H]+m/z 364.0149, Found 364.0156。
实施例4:
首先,在35 mL的密封管中放入搅拌子,并依次加入79.2 mg(0.3 mmol)溴代二氟乙酰对甲苯胺、3.0 ml乙腈,45 μL 3-乙炔基噻吩(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=40:1)分离得62.9 mg白色固体产物3d,产率72%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 2.39 (s, 3H), 5.66 (s, 1H), 6.95 (d, J = 5.2 Hz, 1H), 6.99 (s, 1H), 7.04 (d, J = 8.0 Hz, 2H), 7.21 (d, J = 8.0 Hz, 2H), 7.28 (d, J = 2.4 Hz, 1H); 13C NMR (100 MHz, CDCl3): δ = 21.2, 98.0 (t, J = 23.0 Hz), 113.0 (t, J = 244.0 Hz), 126.4, 126.6, 127.3, 127.5, 129.4, 129.9, 131.1, 138.7, 149.2 (t, J = 11.0 Hz), 166.9 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -109.6. HRMS(ESI-TOF)Calcd for C15H12F2NOS, [M+H]+m/z 292.0608, Found 292.0610。
实施例5:
首先,在35 mL的密封管中放入搅拌子,并依次加入93.0 mg(0.3 mmol)溴代二氟乙酰-3,4-二甲氧基苯胺、3.0 ml乙腈,49 μL苯乙炔(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=40:1)分离得88.3 mg白色固体产物3e,产率89%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 3.68 (s, 3H), 3.84 (s, 3H), 5.63 (d,J = 2.0 Hz, 1H), 6.51 (d,J = 2.4 Hz, 1H), 6.61 (dd,J1 = 2.4 Hz,J2 = 8.8 Hz, 1H), 6.77 (d,J = 8.4 Hz, 1H), 7.19 (t,J = 7.2 Hz, 2H), 7.29 (t,J = 7.6 Hz, 2H), 7.38 (t,J = 7.6 Hz, 1H); 13C NMR (100 MHz, CDCl3): δ = 55.9, 55.9, 99.5 (t, J= 23.0 Hz), 110.4, 110.9, 112.8 (t, J = 244.0 Hz), 119.3, 126.3, 127.9, 128.4, 128.8, 130.5, 148.5, 149.0, 154.6 (t, J = 11.0 Hz), 166.8 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -110.2. HRMS(ESI-TOF)Calcd for C18H16F2NO3, [M+H]+m/z 332.1098, Found 332.1096。
实施例6:
首先,在35 mL的密封管中放入搅拌子,并依次加入83.4 mg(0.3 mmol)溴代二氟乙酰苯乙胺、3.0 ml乙腈,49 μL苯乙炔(0.45 mmol)混合均匀。其次,向混合均匀的溶液中依次加入5.4 mg Phen(0.03 mmol)、5.7 mg CuI(0.03 mmol)和82.9 mg K2CO3(0. 6 mmol),用旋塞密封紧管口,加热至110℃搅拌反应2小时。反应结束后,体系冷却到室温,向反应混合物中加入3 ml蒸馏水,乙酸乙酯萃取(5 ml×3),合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,剩余物经硅胶柱层析(V石油醚:V乙酸乙酯=40:1)分离得56.5 mg白色固体产物3f,产率63%。反应见下式:
谱图解析数据
1H NMR (400 MHz, CDCl3): δ = 2.68 (t,J = 7.2 Hz, 2H), 3.70 (t,J = 7.2 Hz, 2H), 5.33 (s, 1H), 6.91-6.93 (m, 2H), 7.20-7.26 (m, 5H), 7.43-7.53 (m, 3H); 13C NMR (100 MHz, CDCl3): δ = 34.3, 42.3, 99.7 (t, J = 23.0 Hz), 112.8 (t, J = 244.0 Hz), 126.7, 127.7, 128.6, 128.8, 128.9, 129.0, 130.6, 137.3, 154.9 (t, J = 11.0 Hz), 167.9 (t, J = 30.0 Hz); 19F NMR(376 MHz, CDCl3): δ = -112.8. HRMS(ESI-TOF)Calcd for C18H16F2NO, [M+H]+m/z 300.1200, Found 300.1204。
- 还没有人留言评论。精彩留言会获得点赞!