菲律宾蛤仔高活性抗肿瘤肽的制备方法及应用与流程
本发明涉及水产加工利用
技术领域:
,尤其是涉及一种菲律宾蛤仔抗肿瘤肽的制备方法及应用。
背景技术:
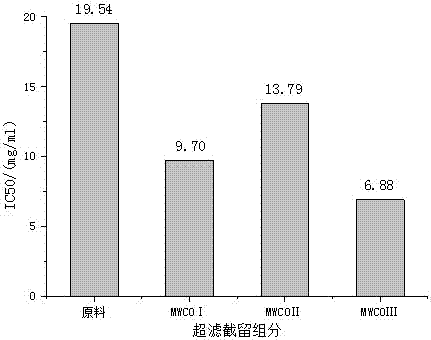
:生物活性肽是蛋白序列内不活动的特定蛋白质片段,这个特定蛋白质片段可通过胃肠消化或食品加工从亲本蛋白中释放出来,并表现出多种生物功能活性,在机体生命活动中起着重要作用。生物活性肽是由两个或两个以上氨基酸缩合而成的,一般具有2~20个氨基酸残基,分子量一般小于6KDa。生物活性肽的结构特性(氨基酸组成及序列)影响活性肽的活性,使得生物活性肽表现出多种生物活性,例如抗氧化、抗肿瘤、抗高血压、抑菌和抗凝血等。我国海洋贝类种类丰富,产量居世界之首,2014年产量达1341.67×104t。海洋贝类肉质肥嫩,鲜美可口,含有大量的蛋白质、氨基酸、多糖等营养物质,是一种经济价值极高的海洋生物。大多数情况下,海洋贝类仅仅被加工成食品,品种单一,产品附加值低。运用酶解技术从海洋贝类或其加工副产物中提取具有生物功能活性的多肽,高值化利用海洋贝类资源,可获得更好的经济效益。近年来,从海洋贝类中获取生物活性肽的研究受到了广泛关注。菲律宾蛤仔(Ruditapesphilippinarum),俗称杂色蛤,广泛分布于我国沿海地区,是我国四大养殖贝类之一,富含蛋白质、脂肪、多糖和人体必需的微量元素,是一种经济价值极高的海洋贝类。已有研究表明,菲律宾蛤仔提取物具有多种生物活性。近年来有关菲律宾蛤仔提取物的研究主要集中于抗氧化、增强免疫力和降血压等方面,而对抗肿瘤的研究较少。我所于2016年10月公开了“利用酶法制备菲律宾蛤仔抗肿瘤肽的研究”(《渔业现代化》第43卷第5期),通过研究采用酶解技术获取菲律宾蛤仔多肽,获取得到的多肽产物仅在体外对A549的抑制率高,但是纯度及活性不高,而只有活性的肽才能对人体体内产生很好的效果,因此有必要进行进一步的研究开发,提高菲律宾蛤仔抗肿瘤肽的活性。技术实现要素:本发明的目的在于提供一种菲律宾蛤仔抗肿瘤肽的制备方法,以获取高活性多肽。为实现上述目的,本发明采用以下技术方案:菲律宾蛤仔高活性抗肿瘤肽的制备方法,包括以下步骤:S1.酶解,取新鲜菲律宾蛤仔,海水吐沙后,放入冰箱冷冻后,开壳取肉,匀浆,料液比1:1,调节pH值2.0,添加胃蛋白酶,加酶量为500~3000U/g,酶解温度31~43℃,酶解时间2~12h,灭酶后离心,取上层清液;S2.超滤,将步骤S1得到的上层清液进行超滤截留,收集分子量5KDa以下的截留液,纳滤浓缩脱盐,冷冻干燥;S3.强阳离子交换柱色谱分离,步骤S2中冷冻干燥的产物通过强阳离子交换柱,缓冲液线性洗脱后,在紫外-可见分光光度计280nm处进行检测,分别收集各洗脱峰,透析除盐,冷冻干燥;将干燥后的各组分进行抗肿瘤活性分析,进一步确定目标肽所在的洗脱峰,并对该洗脱组分大量收集,冷冻干燥;S4.凝胶柱色谱分离,将步骤S3中冷冻干燥后的产物过凝胶柱洗脱,然后在紫外-可见分光光度计280nm处进行检测,分别收集各洗脱峰,透析除盐,冷冻干燥,将干燥后的各组分进行抗肿瘤活性分析,进一步确定目标肽所在的洗脱峰,并对该洗脱组分大量收集,冷冻干燥即得菲律宾蛤仔高活性抗肿瘤肽。其中,步骤S3中采用SPSephadexC-25强阳离子交换柱,缓冲液为含浓度小于等于1mol/LNaCl的乙酸纳-乙酸缓冲液进行线性洗脱,洗脱速度为0.5~1.5mL/min。其中,步骤S4中采用SephadexG-25凝胶柱,流动相为超纯水进行洗脱,洗脱速度为0.5~1.5mL/min。优选地,步骤S3及S4中抗肿瘤活性分析采用CCK-8法。优选地,步骤S1中胃蛋白酶的加酶量为1000U/g,酶解温度为37℃,酶解时间为6h。本发明还公开了上述菲律宾蛤仔高活性抗肿瘤肽的制备方法得到的菲律宾蛤仔抗肿瘤肽在抑制A549非小肺癌上的应用。本发明具有如下有益效果:采用最佳酶解与纯化工艺制备菲律宾蛤仔抗肿瘤肽,超滤获得分子量小于5KDa的组分并经两步分离纯化,获取可得到高活性多肽。将所得的目标肽应用于A549非小肺癌细胞上产生了很强的细胞增殖抑制作用,并验证了分子量5KDa以下的超滤截留组分在A549荷瘤小鼠上产生了很强的肿瘤抑制作用,为菲律宾蛤仔抗肿瘤肽制备研究提供试验依据;本发明整体工艺简单,投入较少,易于推广应用。附图说明图1为五种蛋白酶的酶解产物对A549非小肺癌细胞增殖抑制率的柱状图。图2为胃蛋白酶不同分子量酶解产物对A549非小肺癌细胞增殖抑制率的柱状图。图3为胃蛋白酶酶解产物分子量5k以下的组分的SPSephadexC-25层析图谱。图4为SPSephadexC-25强阳离子交换柱分离组分对A549非小肺癌细胞增殖半抑制浓度(IC50)的柱状图。图5为图3中峰Ⅳ的SephadexG-25凝胶层析图谱。图6为SephadexG-25凝胶柱分离组分对A549非小肺癌细胞增殖半抑制浓度(IC50)的柱状图。图7为各组小鼠的抑瘤率柱状图。具体实施方式为了使本领域的技术人员更好地理解本发明的技术方案,下面结合附图及具体实施例对本发明作进一步详细的描述。本实施例公开了菲律宾蛤仔高活性抗肿瘤肽的制备分析过程,及将制备得到的产物进行小鼠动物实验的过程,具体如下:1、材料准备(1)动物:菲律宾蛤仔购自某超市,吐沙1d,洗净、去壳、取肉、匀浆,-20℃保存备用;SPF级Balb/c-nu级裸小鼠,雌雄各半,12~15g,4~5周龄,40只,广东省医学试验动物中心提供。(2)细胞株:A549非小肺癌细胞购于中国医学科学院基础医学研究所基础医学细胞中心。(3)主要试剂:胃蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶、碱性蛋白酶均购自南宁庞博生物工程有限公司;SPSephadexC-25强阳离子交换柱与葡聚糖凝胶SephadexG-25均购自美国GE公司;McCoys5A培养基、胎牛血清均购自美国Gibco公司;青霉素-链霉素溶液购自美国Hyclone公司;CCK-8试剂盒购自日本同仁化学研究所;其余试剂均为分析纯。(4)主要仪器:5804R高速冷冻离心机,德国Eppendorf公司;HH-6数显恒温水浴锅,常州国华电器有限公司;PB-10pH计、电子分析天平,德国Sartorius公司;Gl54-DWS高压灭菌锅,美国Zealway公司;ClassIITypeB2型生物安全柜,德国ESCO公司;BPN-80CRH二氧化碳培养箱,昆山一恒仪器有限公司;InfiniteM200RQ酶标仪,瑞士NanoQuant公司;XDS-IA倒置生物显微镜,上海精密仪器仪表有限公司。2、制备试验过程(1)酶解工艺流程:选用胃蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶、碱性蛋白酶5种蛋白酶分别对菲律宾蛤仔肉进行酶解,各种蛋白酶的酶解条件见表1,酶解过程依次如下:称取一定量的菲律宾蛤仔匀浆液,加入等体积的蒸馏水(料液比1:1),0.5mol/LNaOH或0.5mol/LHCl溶液调pH值,加酶在各自最适温度及pH条件下水解,沸水浴灭酶10min,离心(8000r/min,5min),取上清液,冷冻干燥,CCK-8法初步测定酶解产物的抗肿瘤活性。表1几种蛋白酶的酶解条件酶种类PH温度/℃加酶量/(U/g)酶解时间/h胃蛋白酶(Pepsin)2.03710006中性蛋白酶Neutral7.05010006风味白酶Flavor7.05010006胰蛋白酶Trypsin8.03710006碱性蛋白酶Alcalase10.05010006(2)细胞培养:A549非小肺癌细胞用含10%胎牛血清和0.1%青霉素-链霉素的McCoy’s5A培养基于37℃,5%CO2培养箱中培养至对数生长期。(3)细胞增殖抑制率的测定:采用CCK-8法检测药物对A549非小肺癌细胞增殖抑制作用。选用处于对数生长期的A549非小肺癌细胞,按照2.5×104cells/mL密度接种于96孔板,每孔100μL,5%CO2,37℃条件下培养24h后弃培养基,加入100μL无血清培养基,培养17h后弃培养基。设置对照组(无血清培养基+细胞)、加药组(20mg/mL药物+细胞)和空白组(无血清培养基,无细胞),每孔100μL,5%CO2,37℃条件下培养24h。弃96孔板中液体,加入PBS清洗两次,弃PBS,加入100μLCCK-8溶液(CCK-8原液:无血清培养基=1:10),5%CO2,37℃条件下孵育3h,采用酶标仪在450nm处测定吸光度(OD值),计算药物对A549非小肺癌细胞增殖抑制率(简称A549抑制率),每组试验设6个平行复孔。B=(A1-A2)/(A1-A3)×100式中:B—A549抑制率/%;A1—对照组的OD值;A2—加药组的OD值;A3—空白组的OD值。(4)菲律宾蛤仔抗肿瘤肽初步分离:选用分子截留量为5KDa和10KDa的超滤膜对胃蛋白酶酶解液进行截留,获得MWCOⅠ(分子量大于10KDa)、MWCOⅡ(分子量介于5KDa与10KDa之间)与MWCOⅢ(分子量小于5KDa)三个超滤组分,并考察原料、MWCOⅠ、MWCOⅡ与MWCOⅢ对A549非小肺癌细胞的增殖抑制作用,初步确定具有较强抗肿瘤活性多肽的分子量范围,大量收集该分子量范围的菲律宾蛤仔抗肿瘤肽,冷冻干燥。(5)强阳离子交换柱色谱分离:将上述步骤中的高抗肿瘤活性产物经透析后冷冻干燥,将冷冻干燥后的产物通过SPSephadexC-25强阳离子交换柱,0~1mol/LNaCl的乙酸钠-乙酸缓冲液线性洗脱,洗脱速度为1mL/min,紫外-可见分光光度计280nm进行检测,分别收集各洗脱峰,透析除盐,冷冻干燥,将干燥后的各组分采用CCK-8法进行抗肿瘤活性分析,进一步确定目标肽所在的洗脱峰,并对该洗脱组分大量收集,透析除盐,冷冻干燥。(6)凝胶柱色谱分离:将上述步骤中冷冻干燥后的目标肽过SephadexG-25凝胶柱,流动相为超纯水,洗脱速度0.5~1.5mL/min,紫外-可见分光光度计280nm进行检测,分别收集各洗脱峰,冷冻干燥,将干燥后的各组分采用CCK-8法进行抗肿瘤活性分析,进一步确定目标肽所在的洗脱峰,并对该洗脱组分大量收集,冷冻干燥。(7)考察MWCOⅢ对A549荷瘤小鼠的影响:①建立A549荷瘤小鼠模型,接种前每天称量一次裸小鼠体重,待平均体重达到20g左右时进行造模,采用裸鼠皮下移植法。首先,取对数期生长的A549非小肺癌细胞,胰酶消化后,采用无血清培养基重悬制备成单细胞悬液,调整细胞数为1×107cells/mL,1mL注射器吸取0.2mLA549非小肺癌细胞悬液接种于小鼠后肢背侧部。②分组及给药,造模五天后,若这些小鼠后肢背侧部皮下可捫及到米粒大小的皮下肿瘤,即为造模成功。待肿瘤平均直径达5mm时,随机分成5组,每组8只,组别为:模型组,低、中、高剂量组(MWCOⅢ,100、200、400mg/kg)与氟尿嘧啶组(2mg/kg)。给药方式:腹腔注射,0.2mL/只/d,连续16d。将小鼠脱颈处死,剥离瘤体,分析天平称重,记录瘤重,并按以下公式计算抑瘤率/%。抑瘤率=(模型组瘤重-加药组瘤重)/模型组瘤重×100%。3、结果(1)最佳蛋白酶确定如图1所示,5种蛋白酶所获得的酶解产物对A549非小肺癌细胞增殖均具有抑制作用,其中胃蛋白酶酶解产物对A549非小肺癌细胞的增殖抑制活性最强,浓度为20mg/mL时,作用24h,抑制率为99.22%。如图2所示,胃蛋白酶酶解液经超滤膜截留获得的三个组分、原料作用24h后,MWCOⅢ对A549非小肺癌细胞的增殖抑制活性最强,其IC50为6.88mg/mL。(2)菲律宾蛤仔抗肿瘤肽的分离纯化如图3所示,MWCOⅢ经SPSephadexC-25强阳离子柱洗脱后,共得到6个组分(I~Ⅵ)。如图4所示,峰Ⅳ抗肿瘤活性最高,对A549非小肺癌细胞作用24h后,其IC50为6.65mg/mL。如图5所示,峰Ⅳ经SephadexG-25凝胶柱洗脱后得到3个组分(A~C)。如图6所示,峰A抗肿瘤活性最高,对A549非小肺癌细胞作用24h后,其IC50为4.82mg/mL。(3)A549荷瘤小鼠体内活性试验如图7所示,低、中、高剂量的MWCOⅢ均具有抑瘤效果,其中高剂量MWCOⅢ抑瘤效果最佳,抑瘤率为49.01%。对高剂量MWCOⅢ进行检测,其含有15种氨基酸,其中谷氨酸、亮氨酸和天冬氨酸等酸性氨基酸含量较高,分别占其总氨基酸的25.43%、9.16%和8.51%,见表2。表2MWCOIII氨基酸组成分析氨基酸含量/%天冬氨酸8.51谷氨酸25.43丝氨酸5.50甘氨酸5.39精氨酸3.45苏氨酸4.74丙氨酸7.33脯氨酸3.23酪氨酸3.99缬氨酸5.28蛋氨酸4.20异亮氨酸3.77亮氨酸9.16苯丙氨酸4.74赖氨酸5.28本试验首先选取5种蛋白酶对菲律宾蛤仔肉进行酶解,比较同浓度条件下各个蛋白酶酶解产物对A549非小肺癌细胞的增殖抑制活性,发现同浓度条件下不同蛋白酶酶解产物对A549非小肺癌细胞的增殖抑制活性不同,这应该与酶解产物的组成和结构有关。据此推测,利用酶解方法获取抗肿瘤活性肽时,酶的选择性至关重要,在条件允许的条件下,应尽量多选几种蛋白酶进行活性筛选。其次,在分离纯化获取目标肽的过程中,检测到不同分子量和不同洗脱峰的组分,其抗肿瘤活性也有很大区别,在超滤截留组分中,分子量小于5KDa的组分抗肿瘤活性最高,而在这一范围内的多肽中,起到活性作用的主要是某个峰的多肽组分,随着分离纯化的进行,多肽的抗肿瘤活性逐渐增强,其IC50值由6.883mg/mL降低至4.82mg/mL,可见,在分离纯化在获取高活性多肽过程中是非常必要的。最后,考察了MWCOⅢ对A549荷瘤小鼠的影响,试验结果表明,高剂量的MWCOⅢ在A549荷瘤小鼠体内具有很好的抑瘤效果。综上,本发明制备得到的菲律宾蛤仔抗肿瘤肽高剂量超滤组分对A549荷瘤小鼠瘤体的抑制率高,通过本发明的分离纯化工艺获得了高活性多肽,具有极大的应用价值。以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1