一种生产槐糖酯化合物的方法与流程
本发明是申请号为2013800373462,发明名称:“作为基因表达诱导剂的糖酯”的分案申请,母案的申请日是2013年07月18日。
本发明的母案要求了2012年7月20日申请的美国临时申请案序列号61/673,997和2012年12月27日申请的61/746,120的权益,所述临时申请案的内容全文并入。
本发明涉及在细胞培养中用作基因表达诱导剂的化合物及其制备方法。更确切地说,本发明涉及对于酶制造商来说能显著降低制造成本的低成本而且高效的蛋白质诱导剂的开发。
背景技术:
便宜而且容易获得的工业酶是工业生物技术革命背后的关键推动因素,其中越来越多地使用可再生资源以生物学方式产生化学物质和能量燃料。与用于治疗和诊断目的的高利润酶或其它蛋白质相反,工业酶典型地具有较低利润,并且在发酵后利用有限的下游加工大量制造。对于工业酶市场来说,生产成本对商业上的成功是至关重要的。为了满足可再生化学物质和能源工业对较便宜而且容易获得的酶的日益增加的需求,急需更有效而且成本有效的生产工艺。
主要工业酶制造商都把大量产能投入到真菌发酵,特别是使用丝状真菌,例如曲霉属(aspergillusspp)、青霉属(penicilliumspp)、木霉属(trichodermaspp.)、拉克淖金孢菌(chrysosporiumlucknowense)(c1)和嗜热毁丝霉(myceliophthorathermophila)(重新分类),以制造纺织品、洗涤剂、食品和饲料以及新兴生物燃料工业中所使用的众多酶产品(沙玛(sharma)等人,世界微生物学与生物技术杂志(worldj.ofmicrobiol.andbiotech.),25(12):2083-2094(2009);维瑟(visser)等人,工业生物技术(industrialbiotech.),7(3):214-223(2011))。
在曲霉属和木霉属中大批生产相关蛋白质通常需要能在强天然启动子下活化转录开关从而驱动相关基因表达靶酶或蛋白质的诱导剂化合物。例如淀粉和纤维素等不溶性底物通常用于实验室规模下以便分别诱导曲霉属和木霉属中的蛋白质表达。然而,其在工业规模下的实施因不良底物连贯性和材料和在大规模下所遭遇的例如灭菌、馈料、混合和粘度问题等处理问题而受阻。因此,在大批生产酶和其它蛋白质时,高效可溶性诱导剂是更优选的。
麦芽糖、异麦芽糖和麦芽糊精通常用作可溶性诱导剂以用于在曲霉属中诱导α-淀粉酶和葡糖淀粉酶(巴顿(barton)等人,细菌学杂志(j.bacteriol.,b(3):771-777(1972)),而槐糖、纤维二糖和乳糖是广泛用于木霉属中的酶生产工业的三种有效的可溶性诱导剂(库比切克(kubicek)等人,生物燃料生物技术(biotech.biofuels),2:19(2009))。槐糖,即一种β1,2-二糖,被视为里氏木霉(trichodermareesei)中的纤维素酶基因启动子的最强诱导剂,活性是纤维二糖的2500倍(曼德尔斯(mandels)等人,细菌学杂志(j.bacteriol.),83(2):400-408(1962))。这些相应的可溶性诱导剂都在诱导之前、期间或之后由曲霉属或木霉属代谢。因此,它们被视为无偿诱导剂,因而需要在发酵期间不断供应它们以便实现最佳诱导。
在通过深层发酵进行的工业酶生产中,可溶性诱导剂通常呈单独或补充有例如葡萄糖等替代性碳源的馈入批料形式以碳受限方式供应至发酵器。由于诱导剂是有偿的,故诱导过程如果未经充分优化则通常将导致会显著降低生产率的分解代谢物阻遏以及会显著降低产率的非必需生长。因而,所属领域中需要更强的无偿或接近无偿的诱导剂,其能消除诱导受非意料抑制、生长或其它生理功能影响,从而允许进行更严格的过程优化,以便与当前可能达到的相比显著提高生产率和产率。更强的诱导剂还能容易地用于满足对更便宜而且非诱导性原料的诱导需要以及增强例如乳糖、纤维素、麦芽糊精等常规诱导剂或例如淀粉和纤维素水解物等更便宜替代物以及例如固相发酵等替代生产过程中的诱导。
因为基于糖的诱导剂对于蛋白质表达来说既是诱导剂又是阻遏剂,所以通过对诱导剂进行改性以减缓其吸收或新陈代谢来增强诱导力的方法是已知的。尽管未加以表征,但已知八乙酸纤维二糖酯水解产物的诱导力优于纤维二糖(曼德尔斯和里斯(reese),细菌学杂志(j.bacteriol.),79(6):816-826(1960))。在产糖芽霉菌(pullulariapullulans)中,单棕榈酸蔗糖酯所诱导的蔗糖酶产率是蔗糖的80倍(里斯等人,细菌学杂志,100(3):1151-1154(1969))。类似地,乙酰基纤维二糖在产紫青霉菌(penicilliumpurpurogenum)中诱导纤维素酶时比葡萄糖或纤维二糖更有效,其中单-o-乙酰基纤维二糖是所测试的最具活性的诱导剂(苏乔(suto)等人,发酵与生物工程杂志(j.ferment.bioengin.),72(5):352-357(1991))。本发明人的最近申请(国际申请第wo2013/003291号)公开了由对天然槐糖脂进行稀酸处理而得到的一类新颖槐糖酯,天然槐糖脂的诱导力为槐糖本身的至少30倍。
技术实现要素:
在一个方面,本发明提供了一种用于产生相关蛋白质的方法,其包含提供发酵宿主和将所述发酵宿主与碳源和一或多种选自由以下各项组成的群组的化合物一起培养:
1)式i
2)式ii
3)式iii
4)式iv
5)式v
6)式vi
7)式vii
其中ra是h或c(o)r;
rb是h或c(o)r;
rc是h或c(o)r;
rd是h或c(o)ch3;
re是h或c(o)ch3;
rf是h或c(o)ch3;
rg是h或c(o)ch3;且
r是脂肪族部分,其限制条件是在式(ii)中,当ra是h或c(o)ch3且rb是h或c(o)ch3时,rc是h,
其中所述发酵宿主是在足以产生相关蛋白质的条件下加以培养。在一个实施例中,所述相关蛋白质是纤维素酶或淀粉酶。在另一个实施例中,所述相关蛋白质是同源或异源蛋白质。在另一个实施例中,所述同源或异源蛋白质是酶、激素、生长因子、细胞因子或抗体。在一个实施例中,所述发酵宿主能够产生纤维素酶或淀粉酶。在另一个实施例中,所述发酵宿主是丝状真菌或细菌或选自由以下各项组成的菌属群组的其它宿主:木霉属(trichoderma)、腐殖菌属(humicola)、侧耳菌属(pleurotus)、镰刀菌属(fusarium)、曲霉属(aspergillus)、链霉属(streptomyces)、嗜热单孢霉属(thermomonospora)、牙胞杆菌属(bacillus)、纤维杆菌属(cellulomonas)、青霉属(penicillium)、担子菌属(basidiomycete)、金孢属(chrysoporium)、拟盘多毛孢属(pestalotiopsis)、脉孢菌属(neurospora)、头孢霉属(cephalosporium)、绵霉属(achlya)、柄孢壳菌属(podospora)、内座壳属(endothia)、毛霉属(mucor)、旋孢腔菌属(cochliobolus)、毁丝霉属(myceliophthora)、篮状菌属(talaromyces)和梨孢菌属(pyricularia)。在另一个实施例中,所述发酵宿主是丝状真菌里氏木霉或黑曲霉(aspergillusniger)。在一个实施例中,使所述发酵宿主在液体培养基中或在无自由流动液体的固体底物上生长。在另一个实施例中,所述发酵宿主具有与编码相关蛋白质的基因可操作地连接的启动子。在另一个实施例中,所述启动子是纤维素酶基因启动子或淀粉酶基因启动子。在另一个实施例中,所述启动子是cbh1启动子或glaa启动子或amya启动子。在一个实施例中,所述碳源是生物质。在另一个实施例中,所述生物质是葡萄糖、蔗糖、果糖、甘油、乳糖、纤维素、纤维素水解物、淀粉、淀粉水解物、麦芽糖或麦芽糊精。
在另一个方面,所述式(i)、(ii)、(iii)、(iv)和(v)的化合物是从得自于化学催化或酶催化的转酯化反应的粗产物混合物中分离。在一个实施例中,所述式(vi)化合物是从天然内酯型槐糖脂的甲酸处理过程分离。在另一个实施例中,所述式(vii)化合物是从酵母假丝酵母菌(candidabombicola)的培养物分离。在另一个实施例中,r是选自未经取代的c1-c24烷基、经取代的c1-c24烷基、未经取代的c2-c24烯基和经取代的c2-c24烯基的脂肪族部分。在另一个实施例中,r是选自经羟基取代的c1-c24烷基和经羟基取代的c2-c24烯基的脂肪族部分。在又另一个实施例中,r是选自经羧基取代的c1-c24烷基和经羧基取代的c2-c24烯基的脂肪族部分。在另一个实施例中,r是选自经芳香族基团取代的c1-c24烷基和经芳香族基团取代的c2-c24烯基的脂肪族部分。在另一个实施例中,所述式(i)、(ii)、(iii)、(iv)、(v)、(vi)和(vii)化合物包含:
其中rd是h或c(o)ch3;
re是h或c(o)ch3;
rf是h或c(o)ch3;
且rg是h或c(o)ch3。
在另一个方面,本发明提供了一种用于产生一或多种式(i)、式(ii)、式(iii)、式(iv)或式(v)化合物的方法,所述方法包含提供二糖;和使所述二糖与乙烯酯在脂肪酶存在下在溶剂系统中接触。在一个实施例中,所述二糖包含乳糖、槐糖、纤维二糖、麦芽糖或异麦芽糖。在另一个实施例中,所述脂肪酶包含novozyme435、lipozymetl、lipozymerm或amano脂肪酶ps。在另一个实施例中,所述乙烯酯包含乙酸乙烯酯、丙酸乙烯酯、丁酸乙烯酯、肉桂酸乙烯酯、甲基丙烯酸乙烯酯、油酸乙烯酯、亚油酸乙烯酯、棕榈酸乙烯酯或硬脂酸乙烯酯。在另一个实施例中,所述溶剂系统包含与叔戊醇、叔丁醇、四氢呋喃、丙酮、甲醇或乙腈混合的极性溶剂。在另一个实施例中,所述极性溶剂包含二甲亚砜(dmso)、吡啶或二甲基甲酰胺(dmf)。在另一个实施例中,所述方法还包含加热到40℃至100℃之间的温度。在又另一个实施例中,所述方法还包含进行真空蒸馏以去除所述溶剂系统和分离相关产物。
在另一个方面,本发明提供了一种用于产生一或多种式(i)、式(ii)、式(iii)、式(iv)或式(v)化合物的方法,其是通过适当的二糖与合适的乙烯酯在溶剂系统中进行酸或碱催化的转酯化反应来进行。在一个实施例中,所述碱是碳酸钾(k2co3)、氢氧化钠(naoh)或氢氧化钾(koh)。在另一个实施例中,所述酸是硫酸(h2so4)或盐酸(hcl)。在另一个实施例中,所述乙烯酯包含乙酸乙烯酯、丙酸乙烯酯、丁酸乙烯酯、肉桂酸乙烯酯、甲基丙烯酸乙烯酯、油酸乙烯酯、亚油酸乙烯酯、棕榈酸乙烯酯或硬脂酸乙烯酯。在另一个实施例中,所述溶剂系统包含例如二甲亚砜(dmso)、吡啶或二甲基甲酰胺(dmf)等极性溶剂。
在另一个方面,本发明提供了一种用于产生一或多种式(vi)化合物的方法,其包含在实质上非水性条件下使天然内酯型槐糖脂与甲酸或乙酸反应;和部分或完全去除所形成的甲酸酯或乙酸酯。在一个实施例中,所述第二种酸催化天然槐糖脂与甲酸或乙酸的反应。在另一个实施例中,所述第二种酸包含硫酸(h2so4)或盐酸(hcl)。在另一个实施例中,所述天然槐糖脂是由发酵宿主产生。在另一个实施例中,所述发酵宿主是假丝酵母菌。在一个实施例中,所述实质上非水性条件包含水含量不超过约10%的反应混合物。另一个实施例还包含在所述部分或完全去除所形成的甲酸酯或乙酸酯步骤之前在40℃至120℃之间的温度下进行加热的步骤。在另一个实施例中,所述去除甲酸酯包含在乙酸和甲醇中回流。在另一个实施例中,所述去除乙酸酯包含用酸或碱进行处理。
在另一个方面,本发明提供了一种用于由发酵宿主产生一或多种式(vii)化合物的方法。在一个实施例中,所述发酵宿主是假丝酵母菌。在另一个实施例中,所述式(vii)和(viia)化合物是从得自于假丝酵母菌培养物的粗混合物分离。
在另一个方面,本发明提供了一种用于产生槐糖的方法,其包含使天然槐糖苷与甲酸在实质上非水性条件下反应和完全去除所形成的甲酸酯,其中获得了经过纯化的槐糖。在一个实施例中,所述天然槐糖苷是甜菊苷、槐糖脂和类黄酮槐糖苷。在另一个实施例中,所述使天然槐糖苷与甲酸反应步骤是由第二种酸催化。在一个实施例中,所述第二种酸包含硫酸(h2so4)或盐酸(hcl)。在另一个实施例中,所述实质上非水性条件包含水含量不超过约10%的反应混合物。在另一个实施例中,所述方法还包含在所述完全去除甲酸酯步骤之前在40℃至120℃之间的温度下进行加热的步骤。在另一个实施例中,所述完全去除甲酸酯步骤包含在溶剂中用碱进行处理。在一个实施例中,所述碱是甲醇钠(ch3nao)或氨(nh3),且所述溶剂是甲醇或乙醇。
在另一个方面,本发明提供了一种具有式(ii)结构的化合物:
其中:
ra是h或c(o)r;
rb是h或c(o)r;
rc是h或c(o)r;且
r是脂肪族部分,其限制条件是当ra是h或c(o)ch3且rb是h或c(o)ch3时,rc是h。在一个实施例中,r是选自由以下各项组成的群组:未经取代的c1-c24烷基;经羟基、羧基或芳香族基团取代的c1-c24烷基;未经取代的c2-c24烯基;和经羟基、羧基或芳香族基团取代的c2-c24烯基。在另一个实施例中,r是选自未经取代的c1-c24烷基、经取代的c1-c24烷基、未经取代的c2-c24烯基和经取代的c2-c24烯基的脂肪族部分。在另一个实施例中,r是选自经羟基取代的c1-c24烷基和经羟基取代的c2-c24烯基的脂肪族部分。在另一个实施例中,r是选自经羧基取代的c1-c24烷基和经羧基取代的c2-c24烯基的脂肪族部分。在另一个实施例中,r是选自经芳香族基团取代的c1-c24烷基和经芳香族基团取代的c2-c24烯基的脂肪族部分。
附图说明
已经阐述了本发明的新颖特征,特别是在所附权利要求书中。通过参考利用本发明原理和所附图式阐述说明性实施例的以下详细描述,将能更好地理解本发明的特征和优势,其中:
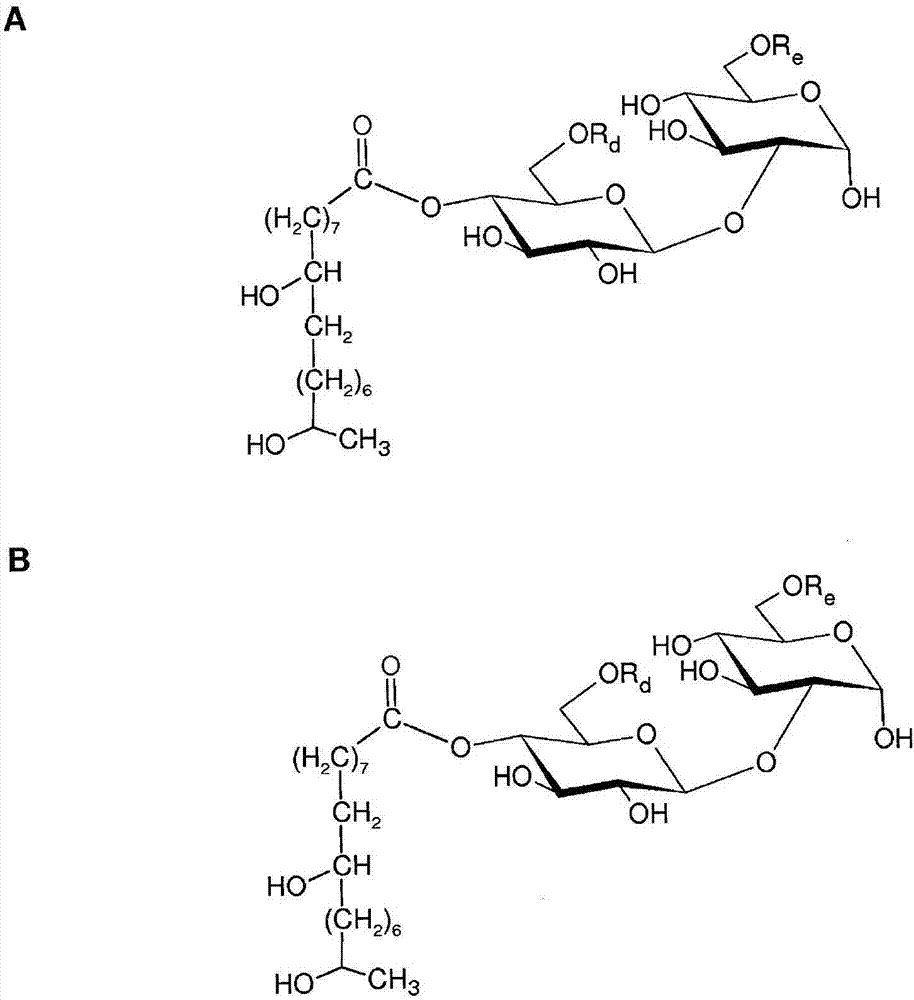
图1显示用作基因表达诱导剂的糖酯的实例:(a)6"乙酰化乳糖单酯;(b)6'和6"乙酰化α-槐糖二酯;(c)6'和6"乙酰化麦芽糖二酯;(d)在c-4"位置上经18碳单不饱和脂肪醇酯化的脱乙酰化或6'和/或6"乙酰化α-槐糖酯,所述脂肪醇在脂肪醇链的c-17位置上被羟基化;和(e)脱乙酰化或6'和/或6"乙酰化二聚槐糖脂酯。在这个图中,rd=h或c(o)ch3;re=h或c(o)ch3;rf=h或c(o)ch3;且rg=h或c(o)ch3。
图2显示由对含有单不饱和脂肪酰基部分的内酯型槐糖脂进行甲酸处理而产生的两种其它化合物的实例:(a)在9位和(b)在10位具有经额外羟基取代的17-羟基脂肪酰基的槐糖酯。在这个图中,rd=h或c(o)ch3;re=h或c(o)ch3;rf=h或c(o)ch3;且rg=h或c(o)ch3。
图3描绘了用于制备糖酯的合成途径:(a)通过化学催化或酶催化的转酯化来制备乳糖、纤维二糖、麦芽糖和槐糖酯;和(b)通过假丝酵母菌(c.bombicola)发酵制备槐糖脂和二聚槐糖脂酯,和通过对槐糖脂进行甲酸处理,随后分别进行完全和部分脱脂来制备槐糖和槐糖酯。在这个图中,ra=h或c(o)r;rb=h或c(o)r;rc=h或c(o)r;rd=h或c(o)ch3;re=h或c(o)ch3;rf=h或c(o)ch3;且rg=h或c(o)ch3;且r是脂肪族部分。
具体实施方式
本发明涉及用成本有效的方式对例如乳糖、槐糖和麦芽糖等已知糖诱导剂进行化学或生物学改性以增强其在生产工业上合乎需要的蛋白质时的诱导力。通过对二糖酯,特别是呈可溶性单酯、二酯和三酯形式的二糖酯进行改性,将乳糖、槐糖和麦芽糖的诱导力增强若干倍。可以比当前可能的产率更高的产率诱导在合适的启动子的控制下得以显著改良的纤维素酶、淀粉酶或其它蛋白质的产率。本发明有可能通过改良制造工厂的生产率和操作逻辑而显著影响当前的酶生产经济学。
本发明还涉及一种用于由天然内酯型槐糖脂并且使用新颖槐糖脂二聚物酯化合物作为高效诱导剂来生产新颖而且具有高度诱导性的槐糖酯的更有效方法。由于这类新化合物容易制备,故可以生产容易使用且工业水适用的诱导剂,所述诱导剂也是高效而且成本有效的。此外,还描述了由例如甜菊苷和槐糖脂等天然槐糖苷生产槐糖的更有效方法。
糖酯
通过根据本发明方法进行未改性二糖与乙烯酯的转酯化反应来生产乳糖、槐糖、纤维二糖、麦芽糖或异麦芽糖单酯或二酯化合物。图1a至1c描绘了可由根据本发明方法进行二糖与乙酸乙烯酯的转酯化反应以化学或酶方式产生的三种例示性二糖单乙酸酯或二乙酸酯。图1a显示了乳糖单乙酸酯,而图1b描绘了槐糖二乙酸酯。图1c显示了麦芽糖二乙酸酯。所有三种化合物都在6'和/或6"位置上被酯化。
在另一个实施例中,通过甲酸或乙酸与天然内酯型槐糖脂在非水性条件下反应,产生甲酰或乙酰受保护而且c-1'环开放的槐糖脂来产生槐糖酯。在这之后由经过处理的槐糖脂部分或完全裂解甲酸酯或乙酸酯。还可能存在例如未改性槐糖脂和高级酯(ds>3的酯)等其它副产物。图1d描绘了在c-4"位置上经18碳单不饱和脂肪醇酯化的脱乙酰化或6'和/或6"乙酰化α-槐糖酯,所述脂肪醇在脂肪醇链的c-17位置上被羟基化。通过以硫酸催化天然二乙酰化内酯型槐糖脂(获自假丝酵母菌培养物)的甲酸反应,随后通过在乙酸和甲醇混合物中对底物进行加热或回流而由经过处理的母体化合物裂解甲酸酯来产生所述化合物。硫酸是廉价而且容易获得的催化剂。甲酸还可以参与跟在脂肪酰基部分上含有不饱和度的内酯型槐糖脂的加成反应,且可能在甲酸酯裂解后在不饱和位置上形成羟基。图2中提供了由对9位置上含有单不饱和18碳脂肪酰基部分的内酯型槐糖脂进行甲酸处理产生的两种例示性产物。图2a和图2b分别描绘了具有在9位置和10位置上经额外羟基取代的17-羟基脂肪酸的槐糖脂酯。
在另一个方面,通过使用本发明方法,由酵母假丝酵母菌产生槐糖二聚物。所述化合物可以从假丝酵母菌粗培养物分离,其中其它副产物可由天然乙酰化内酯型槐糖脂或酸性槐糖脂组成。图1e描绘了在c-4"位置上以18碳单不饱和脂肪链酯化的脱乙酰化或6'和/或6"乙酰化槐糖脂二聚物酯。通过使用葡萄糖和芥花籽油作为原料对假丝酵母菌进行发酵来产生所述化合物。
由本发明方法产生的乳糖、槐糖、纤维二糖、麦芽糖、异麦芽糖酯、槐糖酯(获自天然内酯型槐糖脂的甲酸处理)和槐糖脂二聚物分别具有由式(i)、(ii)、(iii)、(iv)、(v)、(vi)和(vii)所描绘的结构:
其中ra是h或c(o)r;
rb是h或c(o)r;
rc是h或c(o)r;
rd是h或c(o)ch3;
re是h或c(o)ch3;
rf是h或c(o)ch3;
rg是h或c(o)ch3;且
r是脂肪族部分,其限制条件是在式(ii)中,当ra是h或c(o)ch3且rb是h或c(o)ch3时,rc是h。
在一些实施例中,r是选自未经取代的c1-c24烷基、经取代的c1-c24烷基、未经取代的c2-c24烯基和经取代的c2-c24烯基的脂肪族部分。
在其它实施例中,r是选自经羟基取代的c1-c24烷基和经羟基取代的c2-c24烯基的脂肪族部分。
在其它实施例中,r是选自经羧基取代的c1-c24烷基和经羧基取代的c2-c24烯基的脂肪族部分。
在某些实施例中,r是选自经芳香族基团取代的c1-c24烷基和经芳香族基团取代的c2-c24烯基的脂肪族部分。
在一些实施例中,由本发明方法产生的酯具有式(ia)、(iia)、(iiia)、(iva)、(va)、(via)或(viia)化合物所描绘的结构:
其中rd是h或c(o)ch3;re是h或c(o)ch3;rf是h或c(o)ch3;且rg是h或c(o)ch3。
在另一个实施例中,所述槐糖酯是具有式(ii)结构的新颖化合物:
其中:
ra是h或c(o)r;
rb是h或c(o)r;
rc是h或c(o)r;且
r是脂肪族部分,其限制条件是当ra是h或c(o)ch3且rb是h或c(o)ch3时,rc是h。
如本文中所使用,“脂肪族部分”是非芳香族碳部分。在一些实施例中,脂肪族部分可以包括直链、分支链或环状碳部分。在某些实施例中,脂肪族部分可以包括饱和或不饱和的部分,包括单价和二价部分。在一些实施例中,所述脂肪族部分是脂肪族烷基、脂肪族烯基、脂肪族炔基、脂肪族环烷基、脂肪族环烯基、脂肪族环炔基或其任何二价基团。
“烷基”包括当未经取代时仅含有碳和氢原子的饱和直链或分支链烃结构和这些结构的组合。在一些实施例中,烷基具有1至24个碳原子(即,c1-c24烷基)、5至24个碳原子(即,c5-c24烷基)或15至18个碳原子(即,c15-c18烷基)。当命名具有特定碳原子数的烷基残基时,可涵盖具有所述碳原子数的所有几何异构体。举例来说,在一些实施例中,“丁基”可包括正丁基、仲丁基、异丁基和叔丁基;在一些实施例中,“丙基”可包括正-丙基和异丙基。在一些实施例中,烷基可能经取代。在一个实施例中,经取代的烷基可以具有羟基取代基。经羟基取代的烷基可以包括例如-(ch2)2oh和-(ch2)4oh。在另一个实施例中,经取代的烷基可以具有羧基取代基。经羧基取代的烷基可以包括例如-(ch2)2cooh。在另一个实施例中,经取代的烷基可以具有芳香族取代基。经芳香族取代的烷基可以包括例如-ch2(苯基)。
“环烷基”是指环状烷基,并且可具有一个环(例如环己基)或多个环(例如金刚烷基)。
“亚烷基”是指与烷基相同但具有二价的残基。亚烷基的实例包括亚甲基(-ch2-)、亚乙基(-ch2ch2-)、亚丙基(-ch2ch2ch2-)、亚丁基(-ch2ch2ch2ch2-),以及更长的链,包括-(ch2)17-。
“烯基”是指具有至少一个烯系不饱和位点(即,具有至少一个式-c=c-的部分)的不饱和烃基。当烯基具有一个烯系不饱和位点时,烯基是单不饱和型。当烯基具有两个或两个以上烯系不饱和位点时,烯基是多不饱和型。在一些实施例中,烯基具有2至24个碳原子(即,c2-c24烯基)、5至24个碳原子(即,c5-c24烯基)或15至18个碳原子(即,c15-c18烯基)。烯基可以包括例如-ch2-ch=ch-ch3和-(ch2)7-ch=ch-(ch2)7-ch3。在一些实施例中,烯基可能经取代。在一个实施例中,经取代的烯基可以具有羟基取代基。经羟基取代的烯基可以包括例如-(ch2)2oh和-(ch2)4oh。在另一个实施例中,经取代的烯基可以具有羧基取代基。经羧基取代的烯基可以包括例如-(ch2)2cooh。在另一个实施例中,经取代的烯基可以具有芳香族取代基。经芳香族取代的烯基可以包括例如-ch2(苯基)。
“环烯基”是指环状烯基,并且可具有一个环(例如环己烯基、-ch2-ch2-环己烯基)或多个环(例如降冰片烯基)。
“亚烯基”是指与烯基相同但具有二价的残基。亚烯基的实例包括亚乙基(-ch=ch-)、亚丙基(-ch2-ch=ch-)、亚丁基(-ch2-ch=ch-ch2-),以及更长的链,包括-(ch2)7-ch=ch-(ch2)8-和-(ch2)7-ch=ch-(ch2)6-ch=ch-。
除非另有规定,否则以具有式(i)至(vii)和(ia)至(viia)的结构描绘的本发明糖酯具有以下糖苷键:式(i)、(ia),乳糖(gal(β1,4)glc);式(ii)、(iia),槐糖(glc(β1,2)glc);式(iii)、(iiia),纤维二糖(glc(β1,4)glc);式(iv)、(iva),麦芽糖(glc(α1,4)glc);式(v)、(va),异麦芽糖(glc(α1,6)glc);式(vi)、(via),槐糖(glc(β1,2)glc);和式(vii)、(viia),槐糖(glc(β1,2)glc)。
糖酯的用途
可以使用由本文中所描述的方法产生的一或多种糖酯或其任何组合物作为诱导剂,与细胞在不存在所述诱导剂时将会产生的相比,所述诱导剂引起细胞产生大量的酶或其它物质。可以使用由本发明方法产生的经过分离和纯化的糖酯作为诱导剂,或可以使用含有糖酯的粗反应混合物作为诱导剂而不进行进一步纯化。
在一个方面,可以使用由本文中所描述的本发明方法产生的一或多种糖酯或其任何组合物以便在含有适当碳源的液体培养基中在能够产生纤维素酶或淀粉酶的发酵宿主生物体中诱导蛋白质产生(例如,纤维素酶或淀粉酶产生)。举例来说,在某些实施例中,可以使用一或多种具有式(i)至(vii)的结构的糖酯或其任何组合物来诱导蛋白质产生。这种生物体的实例包括丝状真菌,其能够通过产生能水解纤维素的β-(1,4)-连接糖苷键或淀粉的α-(1,4)-连接糖苷键以产生葡萄糖的纤维素酶或淀粉酶来代谢纤维素或淀粉。
合适的丝状真菌可包括亚门真菌门的所有丝状形式。(参见阿历斯波尔c.j.(alexopoulos,c.j.)(1962),菌物学概论(introductorymycology),威立出版社(wiley),纽约(newyork))。这些真菌通常以营养菌丝体为特征,其中细胞壁由甲壳素、纤维素和其它复合多糖构成。用于与本发明的糖酯诱导剂一起使用的丝状真菌或细菌或其它宿主的合适物种包括例如选自以下各属的宿主:木霉属、腐殖菌属、侧耳菌属、镰刀菌属、曲霉属、链霉属、嗜热单孢霉属、牙胞杆菌属、纤维杆菌属、青霉属、担子菌属、金孢属、拟盘多毛孢属、脉孢菌属、头孢霉属、绵霉属、柄孢壳菌属、内座壳属、毛霉属、旋孢腔菌属、毁丝霉属、篮状菌属和梨孢菌属。具体的宿主可以包括例如里氏木霉(qm9414、mcg77、mcg80、rut-c30、cl-847、vtt-d、svg和rl-p37)(参见艾斯特鲍尔(esterbauer)等人,bioresourcetech.,36(1):51-65,(1991))、黑曲霉、米曲霉(aspergillusoryzae)、枯草杆菌(bacillussubtilis)、斜卧青霉(penicilliumdecumbens)、绳状青霉(penicilliumfuniculosum)、产紫青霉、金孢子菌属lucknowense、嗜热毁丝霉和埃默森篮状菌(talaromycesemersonii)。
在一些实施例中,使用由本发明方法产生的糖酯中的一或多种或其任何组合物在宿主细胞中诱导蛋白质产生(例如纤维素酶或淀粉酶产生),所述宿主细胞是木霉属、青霉属、金孢子菌属、腐殖菌属、侧耳属、镰刀菌属、曲霉属、链霉属、嗜热单孢霉属、毁丝霉属、篮状菌属、牙胞杆菌属或纤维杆菌属的成员。在某些实施例中,使用一或多种糖酯或其任何组合物在宿主细胞中诱导蛋白质产生(例如纤维素酶或淀粉酶产生),所述宿主细胞是木霉属或曲霉属的成员。在一个实施例中,使用一或多种糖酯或其任何组合物在里氏木霉、绿色木霉(trichodermaviride)、黑曲霉或米曲霉中诱导蛋白质产生。术语“木霉属”是指先前或当前被分类为木霉属的任何真菌属。在某些实施例中,糖酯是一或多种具有式(i)至(vii)的结构或优选地具有式(ia)至(viia)的结构的酯。
对于工业酶生产来说,典型地使用例如乳糖、纤维二糖、纤维素、纤维素水解物、淀粉水解物和槐糖等得自于葡萄糖逆化的常规诱导剂在里氏木霉中诱导蛋白质表达,而麦芽糖、麦芽糊精、淀粉和淀粉水解物是选择用于曲霉属的诱导剂。在一些情况下,这些诱导剂由于量不足或无意中受杂质或代谢物阻遏而不能表现得最佳。相对于单独常规诱导剂可达成的蛋白质表达,用本文中所公开的诱导剂补充常规诱导剂可增加蛋白质表达。因此,使用本发明的诱导剂可单独或者与彼此或与常规诱导剂组合使用。
在一个实施例中,通过加入具有图1d和图2a和2b中所示的结构的槐糖酯来加强乳糖对木霉属的诱导作用。在另一个实施例中,通过加入具有图1d和图2a和2b中所示的结构的槐糖酯来加强含有槐糖的葡萄糖逆化混合物对木霉属的诱导作用。在又另一个实施例中,通过加入具有图1d和图2a和2b中所示的结构的槐糖酯来加强生物质水解物(例如纤维素、淀粉)对木霉属的诱导作用。在另一个实施例中,通过用具有式iv和图1c所描绘的结构的麦芽糖酯补充诱导剂混合物来增强麦芽糖或麦芽糊精对曲霉属蛋白质表达的诱导作用。
在另一个实施例中,可使用具有式ii、vi和vii的结构的槐糖酯在固相发酵中诱导增强的蛋白质产生。使用固相发酵生产酶和其它蛋白质产物依赖于微生物(特别是丝状真菌)在无自由流动液体的潮湿固体底物上的生长。与液体深层发酵相反,固相发酵在一些情形下在性能和生产成本两方面都可提供显著优势。合适的固体底物包括容易获得而且廉价的基于例如麦麸或玉米芯或其混合物等农业残余物的碳源。用于本实施例的合适的丝状真菌已描述于上文中,并且包括里氏木霉和黑曲霉。
用适当的营养培养基润湿固体底物直到达到40%、50%、60%或70%的起始水分含量,以允许真菌在底物上生长。在使用前,可通过用蒸汽和所属领域的技术人员已知的化学物质进行预处理来活化这些固体底物。将粗制的或经过纯化的槐糖酯混入固体底物中,并且通过接种含合适丝状真菌的适当制备的培养物的混合物来起始发酵。然后利用所属领域中已知的方法从所述混合物分离所得产物,例如酶,例如纤维素酶。典型分离涉及用液体洗涤固态发酵培养基。在一些情况下,可以压制固体底物和/或可以向洗涤液中加入洗涤剂以提高效率。在一些应用(例如动物饲料)中,不分离酶且将其依照产生原样与固体底物一起使用。
还应理解,本文中所描述的糖酯或其任何组合物可与经过基因工程改造的宿主细胞一起使用。为了用重组dna技术产生蛋白质,可以构筑包括编码指定蛋白质的氨基酸序列的核酸的dna构筑体,并且转移到例如里氏木霉、黑曲霉或米曲霉宿主细胞中。载体可以是所属领域中已知的任何载体,当被引入到宿主细胞中时,其可以被并入宿主细胞基因组中并且可以被复制。编码蛋白质的核酸可以可操作地连接到合适的启动子,所述启动子在木霉属或曲霉属宿主细胞中显示转录活性。合适的启动子可以包括例如纤维二糖水解酶1(cbh1)、内切葡聚糖酶、木聚糖酶、葡糖淀粉酶a(glaa)和高峰淀粉酶(amya)。在一个例示性实施例中,本文中所描述的具有式(i)、(ii)、(iii)、(vi)、(vii)的结构的糖酯或其任何组合物可以是木霉属中的cbh1启动子的强力诱导剂,与其它已知纤维素酶诱导剂相比,其可以使纤维素酶产生增加若干倍。在另一个例示性实施例中,本文中所描述的具有式(iv)或(v)的结构的糖酯或其任何组合物可以是曲霉属中的glaa或amya启动子的强力诱导剂,与其它已知淀粉酶诱导剂相比,其可以使淀粉酶产生增加若干倍。
然而,应理解,本文中所描述的糖酯或其任何组合物可以在例如cbh1或glaa等天然或经工程改造启动子的控制下诱导蛋白质产生。所述启动子可以源自于编码可与宿主细胞同源或异源的蛋白质的基因。所属领域技术人员应认识到,启动子可以经工程改造以增强其功能,并且这种新诱导剂的适用性不会因其变化而受限制。在这种启动子控制下的同源或异源蛋白质表达可以使用所属领域中已知的重组分子生物学技术用常规方式进行,这可能依赖于编码相关蛋白质的基因的成功重组。相关同源和异源蛋白质的实例包括例如酶、激素、生长因子、细胞因子、疫苗、抗体和多肽。在一些实施例中,本文中所描述的糖酯可诱导酶产生,所述酶包括例如纤维素酶、淀粉酶、蛋白酶、木聚糖酶、脂肪酶、酯酶、植酸酶、果胶酶、过氧化氢酶、支链淀粉酶、漆酶、氧化酶、葡萄糖异构酶、裂解酶、酰化酶和转移酶。
用于产生蛋白质的发酵程序对于所属领域的技术人员一般是已知的。一般来说,在含有生理盐和营养的培养基中培养细胞。(参见例如普尔基耶j.(pourquie,j.)等人,纤维素降解的生物化学与基因学(biochemistryandgeneticsofcellulosedegradation),奥伯特j.p.(aubert,j.p.)等人编,学术出版社(academicpress),第71-86页,1988;和伊尔门m.(ilmen,m.)等人,应用与环境微生物学(appl.environ.microbiol.),63:1298-1306(1997)。举例来说,可以分别如英格兰(england)等人(美国公开专利申请案第2010/0009408号)和巴顿等人(细菌学杂志),111(3):771-777(1972))所描述在培养基中培养木霉属和曲霉属细胞。培养条件(例如温度、ph值、持续时间)在所属领域中一般也是已知的。举例来说,可以在振荡培养物或发酵器中的适当培养基中在大约28℃下培育培养物,直到达到所需要的纤维素酶表达水平。在已经确定真菌生长之后,将细胞暴露于能有效引起或允许蛋白质表达的条件。还在培养基中提供适当的碳源。适当碳源生物质的实例包括但不限于葡萄糖、蔗糖、果糖、甘油、乳糖、纤维素、纤维素水解物、淀粉、淀粉水解物、麦芽糖或麦芽糊精。
可以能有效诱导蛋白质产生(例如纤维素酶或淀粉酶产生)的浓度向培养基中加入本文中所描述的糖酯中的一或多者或其任何组合物。还可以向培养基中加入呈不溶或可溶形式的酯。在某些实施例中,可在引入发酵培养物中作为培养基组分或作为诱导进料之前在水或一或多种溶剂(例如乙醇或二甲亚砜)中将糖酯复原。在工业分批进料发酵过程中,溶解诱导剂允许其作为浓缩进料用于蛋白质产生。此外,应理解,糖酯诱导剂可以用于分批、分批进料或连续发酵过程。
已经发现,与例如乳糖、槐糖、麦芽糖或天然槐糖脂等未改性起始材料相比,使用一或多种本文中所描述的糖酯令人惊讶地使纤维素酶或淀粉酶产生增加若干倍。在某些实施例中,使用一或多种糖酯或其任何组合物可以使木霉属宿主(例如里氏木霉)中的纤维素酶产生或曲霉属宿主(例如黑曲霉)中的淀粉酶产生增加为未改性乳糖或槐糖的至少三倍、至少四倍、至少五倍、至少十倍、至少二十倍或至少三十倍。在某些实施例中,糖酯是一或多种具有式(i)至(vii)的结构或优选地具有式(ia)至(viia)的结构的酯。
尽管由本发明方法产生的糖酯可以呈含有其它副产物的粗反应混合物形式直接用于诱导蛋白质表达,但也应该理解,可以个别地分离或离析粗混合物的活性糖酯组分并且任选地进行进一步纯化。举例来说,在一些实施例中,可以分离一或多种具有式(i)至(vii)的结构或优选地具有式(ia)至(viia)的结构的酯以用于蛋白质产生。在一些实施例中,使用从粗酯混合物中分离的经过纯化的乳糖单酯或槐糖二酯可以使木霉属中的纤维素酶产生与使用未纯化粗混合物相比增加至少一倍、至少两倍或至少三倍。应理解,未改性乳糖或槐糖是制备乳糖酯和槐糖酯的乳糖或槐糖。
选择本说明书中的实施例以便最好地解释本发明的原理和其在所描述条件下的实际使用(可能未经优化)。所属领域的技术人员应认识到,可以通过方法条件变化和对产生宿主进行的变化来增强这些新颖诱导剂的诱导力。本发明的适用性不会因这些变化而受限制。
制备糖酯的方法
本文中提供了通过未改性二糖与乙烯酯的酶催化或化学催化转酯化来产生乳糖、槐糖、纤维二糖、麦芽糖和异麦芽糖酯的方法。所属领域中已知若干种用于酯化糖类的方法,包括例如化学或酶促合成蔗糖酯(波拉特(polat)和林哈特(linhardt),表面活性剂与洗涤剂杂志(j.surfact.deterg.),4(4):415-421(2001))、酶促合成麦芽糖单月桂酸酯(普卢(plou)等人,生物技术杂志(j.biotech.),96:55-66(2002))和乳糖单月桂酸酯(美国专利申请公开案第2011/0257108号)和化学合成麦芽糖单硬脂酸酯(艾伦(allen)和陶(tao),表面活性剂与洗涤剂杂志,5(3):245-255(2002))。
通过以下方式制备一或多种式(i)至(v)化合物:a)提供优选无水且优选具有高纯度的二糖,例如乳糖、槐糖、纤维二糖、麦芽糖或异麦芽糖;和b)使所述二糖与乙烯酯和酶或化学催化剂在合适的溶剂系统中接触以产生所述组合物。在一些实施例中,将反应混合物加热到40℃至100℃的温度。在其它实施例中,酸水解可以在至少40℃、至少50℃、至少60℃、至少70℃、至少80℃、至少90℃或至少100℃温度下进行。在又另一个实施例中,所述用于产生包括一或多种式(i)至(v)化合物的组合物的方法还包括进行真空蒸馏以去除溶剂;和从所述组合物分离相关产物。
乙烯酯可以是脂肪酸乙烯酯或芳香族乙烯酯。合适的脂肪酸乙烯酯包括乙酸乙烯酯、丙酸乙烯酯、丁酸乙烯酯、甲基丙烯酸乙烯酯、油酸乙烯酯、亚油酸乙烯酯、棕榈酸乙烯酯和硬脂酸乙烯酯。芳香族乙烯酯的实例包括肉桂酸乙烯酯和咖啡酸乙烯酯。
用于本发明方法中的合适的脂肪酶包括novozyme435(经过固定的南极假丝酵母(candidaantarctica)脂肪酶b)、
在一些实施例中,可以用化学催化剂(例如碳酸钾(k2co3)、氢氧化钠(naoh)、硫酸(h2so4)和盐酸(hcl))置换酶催化剂,并且可以用酰氯(例如乙酰氯或棕榈酰氯)置换乙烯酯。
合适的溶剂包括二甲亚砜(dmso)、吡啶、二甲基甲酰胺(dmf)、甲基乙基酮、异丁醇、叔戊醇、叔丁醇、四氢呋喃、丙酮或其混合物。
在一个方面,本文中所描述的方法涉及通过与乙烯酯进行转酯化反应对二糖进行酶改性或化学改性。这些经改性二糖酯对丝状真菌宿主细胞(例如木霉属或曲霉属)中的蛋白质产生(例如纤维素酶或淀粉酶产生)具有高度诱导性,超过了未改性起始材料的诱导能力若干倍。
本文中所描述的方法典型地产生由作为组分的活性糖酯组成的粗混合物。所属领域中已知的任何分离技术都可以用于分离活性酯,例如真空蒸馏、沉淀、结晶、溶剂提取或柱色谱法。
所属领域的技术人员应认识到,可以按照本发明的精神进行许多变化。在某些实施例中,可以使用与本发明中所公开的原理相同的原理将其它二糖和可溶性多糖改性成有效诱导剂。其它二糖的实例包括蔗糖、海藻糖、龙胆二糖、昆布二糖和木二糖。多糖的实例包括纤维糊精和麦芽糊精。
本文中还提供了用于产生具有式(vi)的结构的新颖而且具有高度有效性的槐糖酯的方法,所述方法是通过与天然内酯型槐糖脂在实质上非水性条件下进行甲酸或乙酸反应,随后从受甲酰或乙酰保护且c-1'内酯环开放的槐糖脂上部分或完全裂解甲酸酯或乙酸酯。为了获得具有式(vi)结构的化合物,需要通过选择性裂解c-1'(端基碳)位置上的醚样键,随后再生出羟基脂肪酸的羟基(保持由酯键连接至c-4")来对天然内酯型槐糖脂进行开环(如图1d中所示)。先前描述的用于这种转化的方法因所获得的产率较低而受限制。发明人公开了使用0.1n盐酸与天然槐糖脂在水性条件下产生这些化合物(国际申请案第wo2013/003291号)。本发明包含高产率方法,其涉及在非水性条件下进行甲酸或乙酸与天然内酯型槐糖脂的反应。这种新方法促进天然内酯型槐糖脂的醚样键(c-1')优先于酯键(c-4")裂解,因而获得高产率。可以在对槐糖脂进行甲酸或乙酸处理期间与开放羟基形成非所要甲酸酯和乙酸酯,这需要裂解以便产生由式(vi)描述的化合物。
甲酸或乙酸反应可以由另一种酸来催化。合适的酸催化剂的实例包括例如硫酸(h2so4)或盐酸(hcl),或酸催化剂混合物,其浓度(重量%)在约0.05%至约1%之间。适当的浓度包括0.05%、0.10%、0.15%、0.20%、0.30%、0.50%、0.75%和1%。天然内酯型槐糖脂可以由发酵宿主产生,包括但不限于假丝酵母菌。实质上非水性条件可以包含以重量计不超过约10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或小于1%的水含量。
在一些实施例中,酸处理是在高温下进行。甲酸和乙酸处理可以分别以甲酰分解和乙酰分解反应为特征。在某些实施例中,甲酰分解和乙酰分解可以在至少40℃的温度下进行。在其它实施例中,甲酰分解或乙酰分解可以在至少80℃、至少90℃、至少100℃、至少110℃或至少120℃的温度下进行。在其它实施例中,甲酰分解或乙酰分解可以在40℃与120℃之间或100℃与120℃之间的温度下进行。可以在高温下使天然槐糖脂混合物与酸接触,持续一定范围的时间,例如从数分钟到数小时。
在一个实施例中,甲酸酯从内酯开环槐糖脂上裂解涉及在乙酸与甲醇混合物中加热或回流起始材料。举例来说,乙酸与甲醇的比率可以是3:2(v/v)。在另一个实施例中,乙酸酯的裂解涉及用酸(例如hcl)或碱(例如氨)或酶(例如酯酶)处理起始材料。甲酸酯或乙酸酯从经过处理的槐糖脂裂解可以是部分的。脂肪酰基和乙酰基酰基迁移可以在裂解期间发生。此外,在其脂肪酸酰基部分上含有单个或多个不饱和度的内酯型槐糖脂可参与在不饱和位置上与甲酸的加成反应,且在槐糖酯含有单不饱和或多不饱和脂肪酸部分的情况下,例如在图2中所描述的化合物中,甲酸酯的裂解可以导致在不饱和位置上形成羟基。所属领域的技术人员应认识到,甲酸酯和乙酸酯的部分裂解、酰基迁移和不饱和度羟基化可产生诱导性可能等于或高于具有由(vi)描绘的结构的化合物的新化合物。这种方法的适用性不因这些变化而受限制。
在另一个实施例中,首先可以用甲酸酐或乙酸酐预处理天然内酯型槐糖脂,以产生在所有开放羟基上受甲酸酯和/或乙酸酯保护的化合物。然后,在这之后进行甲酸和乙酸处理,以便在c-1'端基位置上选择性地裂解槐糖脂内酯环,且随后从羟基上部分或完全裂解甲酸酯和乙酸酯。所属领域的技术人员应认识到,这种预处理可因c-1'端基位置上的选择性有所改良而显著增加产率。
在又另一个实施例中,可以首先利用氢化反应对天然内酯型槐糖脂进行预处理,以去除其脂肪酰基上的潜在不饱和度(例如单不饱和17-羟基油酸、二不饱和17-二羟基亚油酸)。所属领域的技术人员应认识到,这种预处理可以显著减少所产生的副产物,最终产物主要由具有饱和脂肪酰基的槐糖酯组成。还可以由氢化预处理获得更便利的处理。
本文中还提供了一种用于使用由式(vii)描述的槐糖脂二聚物作为高效诱导剂的方法。普赖斯(price)等人(碳水化合物研究(carbohyd.res.),348:33-41(2012))最近描述了这种化合物,但普赖斯等人并未认识到其在基因诱导方面的潜力。与其它已知天然槐糖脂(例如乙酰化和脱乙酰化内酯型或酸性槐糖脂)相反,即使二聚槐糖脂以痕量存在,也能如本文中所描述在木霉属中令人惊讶地诱导基因表达。用于槐糖脂二聚物的合适发酵宿主包括例如假丝酵母菌。用于这种发酵方法的适当原料的实例包含葡萄糖和植物油,包括(但不限于)芥花籽油、大豆油、玉米油或棕榈油。在某些实施例中,式(vii)化合物可以从假丝酵母菌培养物中分离为粗混合物,并且仍具有令人惊讶的强诱导作用。
本文中还提供了一种通过使甲酸与天然槐糖苷在非水性条件下反应,随后完全裂解不需要的甲酸酯来产生槐糖的方法。所属领域中当前已知若干种低产率方法,包括直接合成(考克森(coxon)和弗莱彻(fletcher),有机化学杂志(j.org.chem.),26(8):2892-2894(1961))、与甜菊苷八乙酸酯进行乙酸和氢溴酸反应随后进行脱乙酰化(维斯(vis)和弗莱彻,美国化学会志(j.am.chem.soc.),78:4709-4710(1956))和对甜菊苷进行稀盐酸处理随后进行纯化(草壁(kusakabe)等人,农业与生物化学(agric.biol.chem.),51(8):2255-2256(1987))。
本发明描述了一种提高槐糖产率的简单方法,其使用甲酸与天然槐糖苷在非水性条件下反应,随后裂解不需要的甲酸酯。在一个方面,槐糖苷是由作为其组分之一的槐糖组成的任何化合物。槐糖苷的实例包括甜菊苷、槐糖脂和类黄酮槐糖苷。在一个实施例中,可以用另一种酸来催化甲酸反应。合适的酸催化剂的实例包括硫酸(h2so4)和盐酸(hcl),或酸催化剂混合物,其浓度(重量%)在约0.05%至约1%之间。适当的浓度包括0.05%、0.10%、0.15%、0.20%、0.30%、0.50%、0.75%和1%。
在一个实施例中,槐糖苷是由发酵宿主产生的槐糖脂,所述发酵宿主包括(但不限于)假丝酵母菌。实质上非水性条件可以包含以重量计不超过约10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或小于1%的水含量。
在一些实施例中,所述甲酸处理是在高温下进行。在某些实施例中,所述甲酸的酸甲酰分解可以在至少40℃的温度下进行。在其它实施例中,甲酰分解可以在至少80℃、至少90℃、至少100℃、至少110℃或至少120℃的温度下进行。在其它实施例中,甲酰分解可以在40℃与120℃之间或100℃与120℃之间的温度下进行。可以在高温下使天然槐糖脂混合物与甲酸接触,持续一定范围的时间,例如从数分钟到数小时。
在一个实施例中,从经过处理的槐糖苷裂解甲酸酯涉及在溶剂中用碱处理反应混合物。合适的碱的实例包括(但不限于)甲醇钠(ch3nao)和氨(nh3)。合适的溶剂的实例包括(但不限于)甲醇、乙醇和1-丙醇。
在另一个实施例中,首先可以用甲酸酐或乙酸酐预处理槐糖苷,以产生在所有开放羟基上受甲酸酯和/或乙酸酯保护的化合物。然后,在这预处理之后进行甲酸处理,以便在c-1'端基位置上选择性地裂解槐糖苷,随后从羟基上完全裂解甲酸酯和乙酸酯。所属领域的技术人员应认识到,这种预处理可由于c-1'端基位置上的选择性有所改良而显著增加槐糖产率。
在又另一个实施例中,可以在氢化反应之后首先进行基于槐糖苷的天然内酯型和/或酸性槐糖脂的甲酸处理,以去除其脂肪酰基上的潜在不饱和度。所属领域的技术人员应认识到,这种预处理可以显著减少所产生的副产物,且由于对槐糖脂进行了氢化预处理,故预期更方便对槐糖进行处理。
可以通过所属领域中已知的方法从最终反应混合物中分离槐糖并且加以纯化。合适的纯化方法包括例如色谱法、吸附、提取、沉淀、再沉淀、结晶和再结晶。
制备天然内酯型槐糖脂和二聚槐糖脂的方法
可以使用酵母由微生物培养物制备上文提到的天然内酯型槐糖脂混合物和槐糖脂二聚物。合适的酵母菌株可选自例如以下各属:假丝酵母属、斯塔摩酵母属(starmerella)、红酵母属(rhodotorula)和拟威克酵母属(wickerhamiella)。适用于槐糖脂产生的特定菌株包括例如假丝酵母菌(例如atcc22214、nrrly-30816)、斯塔摩酵母属bombicola、蜂生假丝酵母(candidaapicola)、假丝酵母属riodocensis、星形假丝酵母(candidastellata)和假丝酵母属nrrly-27208。(参见库兹曼(kurtzman)等人,欧洲微生物学会联合会微生物通讯(femsmicrobiol.lett.),311:140-146(2010))。
在一些实施例中,由酵母假丝酵母菌或蜂生假丝酵母产生天然槐糖脂混合物。举例来说,假丝酵母菌具有首先将来自于植物油的三酸甘油酯裂解成容易被酵母吸收的游离脂肪酸的活性细胞外脂肪酶系统。脂肪酸然后通过细胞色素p450的作用在最后一个或倒数第二个碳上进行羟基化。然后通过两个糖基转移酶的作用将槐糖添加到羟基化脂肪酸上。(参见弗雷拉科(fleurackers),欧洲脂质科学与技术杂志(eur.j.lipidsci.technol.),108:5-12,(2006))。乙酰化和内酯化完成了槐糖脂形成,然后由酵母分泌。
用于产生槐糖脂的发酵程序对于所属领域的技术人员一般是已知的。用于产生天然槐糖脂的发酵中所使用的合适的碳底物可以包括疏水性底物,例如植物油(例如芥花籽油、大豆油、玉米油、棕榈油、椰子油、葵花籽油、棉籽油或橄榄油)、脂肪酸(例如棕榈酸、油酸、反油酸、亚油酸、α-亚麻酸或硬脂酸)、脂肪酸酯(例如脂肪酸甲酯或脂肪酸乙酯)、烷烃(例如十五烷、十六烷、十七烷或十八碳烷)和脂肪醇(例如十五醇、十六醇、十七醇或十八醇)。
用于产生天然槐糖脂的发酵中所使用的碳底物的长度一般取决于发酵宿主。举例来说,在使用假丝酵母属宿主(例如假丝酵母菌)的某些实施例中,脂肪酸和/或烷烃具有介于15与18个碳原子之间的链长度。在一个变化方案中,碳链介于15与18个碳原子之间的脂肪酸可能优于碳链介于15与18个碳原子之间的烷烃。(参见冯·博加特(vanbogaert)等人,过程生物化学(processbiochem.),46(4):821-833(2011))。在一个实施例中,用于产生天然槐糖脂的发酵中所使用的碳底物是芥花籽油,其具有高c18含量和单不饱和脂肪酸链。此外,还应理解,可以使用其它较长或较短的碳底物,但可减短或伸长到15至18个碳成员的链以便与假丝酵母属宿主一起使用。
酵母典型地产生槐糖脂混合物,且所述混合物的槐糖脂分子通常具有一个在槐糖分子的c-1'位置上与羟基化脂肪酸连接的槐糖分子。天然槐糖脂混合物可包括呈内酯型或酸性形式的二乙酰化槐糖脂。对于由假丝酵母菌产生的天然槐糖脂混合物,二乙酰化内酯型槐糖脂的存在量(例如大于60%)典型地大于酸性槐糖脂(例如少于10%)。参见艾斯马(asmer)等人,美国油类化学家学会杂志(j.am.oilchem.soc.),65(9):1460-1466(1988);达维拉(davila),色谱学杂志(j.chromatography),648:139-149(1993);达维拉等人,工业微生物学杂志(j.indust.microbio.),13:249-257(1994);拉特塞普(ratsep)和沙阿(shah),微生物学方法杂志(j.microbio.methods),78:54-356(2009)。天然槐糖脂混合物的槐糖脂典型地在槐糖分子的c-6"和/或c-6'位置上具有乙酰基。参见冯·博加特等人,过程生物化学46(4):821-833(2011)。脂肪酸基团可以是饱和的或不饱和的,并且可以在长度上变化。典型地,天然槐糖脂混合物中的槐糖脂具有16至18个碳原子的脂肪酸链。
天然槐糖脂混合物的组成可取决于原料类型和培养条件。举例来说,如果原料是脂肪酸酯而不是植物油或游离脂肪酸,则可以产生更多的游离酸性槐糖脂。(参见阿什比(ashby)等人,美国公开专利申请案第2006/0199244号。)另一方面,如果使用例如十六烷或十七烷等烷烃,则产生更多的内酯型槐糖脂。(参见格伦斯(glenns)和库柏(cooper),美国油类化学家学会杂志(j.am.oilchemistsoc.),83(2):137-145(2006)。)
以下实例仅意在进一步说明本发明而不是意在限制本发明的范围,本发明的范围如权利要求书所界定。
实例
实例1.用于在木霉属中诱导基因表达的酶促制备的乳糖乙酸酯
本实例描述了使用酶催化转酯化由乳糖制备图1a中所描绘的乳糖乙酸酯,由此增强其在木霉属中的蛋白质诱导力。
首先在20ml玻璃闪烁小瓶中用0.20ml二甲亚砜(dmso)溶解25mgd-乳糖(西格玛-奥德里奇公司(sigma-aldrich))来开始制备。在这之后加入1.8ml叔戊醇、0.125g分子筛(sylosiv,格雷斯公司(wrgrace),哥伦比亚(columbia),马里兰州(md))和0.125g固定脂肪酶(lipozymetl,诺维信公司(novozymes),弗兰克林顿(franklinton),北卡罗来纳州(nc))。在振荡培育器内在50℃和150转/分下将混合物预培育1小时,此后加入0.142ml乙酸乙烯酯(西格玛-奥德里奇公司,圣路易斯(st.louis),密苏里州(mo))以引发转酯化反应。允许反应在振荡培育器内在50℃和150转/分下进行16小时。
在反应结束时,从闪烁小瓶中取出粗产物混合物且经由离心回收为上清液,其中使用speedvac浓缩器(savant,赛默科技公司(thermoscientific))蒸发溶剂。为了进行nmr和诱导研究,通过急骤色谱法从粗混合物中分馏出乳糖单乙酸酯。将5g自填充硅胶(飞世尔(fisher),230-400目)柱与洗脱液(1-丙醇:乙酸乙酯:水,4:5:1)一起用于等度洗脱。
使用具有waterszq2000质谱仪和waters2487uv检测器的waters2695hplc,经由lc-ms证实乳糖单乙酸酯的纯度。使用waterssymmetryc18柱(4.6×250mm,5μm),以含有0.1%甲酸的(5%/95%)乙腈和水洗脱液作为移动相,等度运行持续15分钟的总运行时间来进行分析。
为了准备使用木霉属的蛋白质诱导研究,首先制备柠檬酸盐基本培养基。如由英格兰等人(美国专利第7,713,725号)改性的培养基组合物由14.4g/l柠檬酸、4g/lkh2po4、6.35g/l(nh4)2so4、2g/lmgso4-7h2o、0.53g/lcacl2-2h2o和1ml/l痕量金属元素(包含5g/lfeso4-7h2o、1.6g/lmnso4-h2o和1.4g/lznso4-7h2o)组成。使用naoh将最终ph值调节到5.50。选择纤维素酶过度分泌者里氏木霉rut-c30作为宿主以测试蛋白质表达。它是获自atcc(56765),且开发为得自于亲本菌株ng14和野生型qm6a的经典突变发生的分解代谢去阻遏菌株(塞德尔(seidl)等人,英国医学研究理事会基因组学(bmcgenomics),9:327,(2008))。为了使木霉属增殖,首先将得自于atcc的冻干储备物溶解于无菌去离子水中,然后使用无菌环转移到pda(马铃薯右旋糖琼脂)板(teknovap0047)上。在室温下将pda板维持白色荧光下,且在大约7天之后,可见绿色木霉属孢子。另外,制备60%(w/v)葡萄糖储备液且用作对照和木霉属生长用碳源。
为了起始蛋白质诱导研究,首先将0.5ml葡萄糖储备液放到125ml三角烧瓶内的14ml柠檬酸盐基本培养基中,随后加入0.5ml预期诱导剂。对于葡萄糖(无诱导剂)对照,将0.5ml葡萄糖储备液放到14.5ml基本培养基中以得到最终葡萄糖浓度2%。为了开始发酵,使用无菌环从含有木霉属孢子的pda琼脂板去除大约1cm×1cm方形琼脂塞,并且放到欲测试的蛋白质诱导培养基中。在以175转/分进行振荡下将培养物放在28℃培育器内。在发酵第3天,收集样品并且分析羧甲基纤维素(cmc)内切葡聚糖酶活性。因为里氏木霉rut-c30是纤维素酶过度生产者,所以cmc活性与所诱导的蛋白质的量直接相关。cmc活性测定按照由曼德尔斯和里斯修改的程序利用0.3ml反应体积(细菌学杂志,73:269-278,(1957))。一个cmc单位表示在50℃和ph4.8的规定条件下在1分钟内释出1μmol还原糖(表示为葡萄糖当量)的活性。
表1中给出了cmc活性测定的结果,其显示已知诱导剂对比酶促制备的粗乳糖乙酸酯混合物和经纯化乳糖单乙酸酯的纤维素酶活性。含有乳糖单乙酸酯和乳糖二乙酸酯的粗乳糖单乙酸酯混合物已经非常强效而且效率很高。在0.8g/l下,其容易地胜过乳糖和纤维二糖在1.0g/l下的诱导力。其特异性诱导力(表示为单位数u/mg诱导剂)是未改性乳糖的14倍。
表1
*所有培养基都含有2%葡萄糖作为碳源。
即使不纯的粗乳糖酯混合物具有高度诱导性,相等质量的经纯化乳糖单乙酸酯也更加强效。乳糖单乙酸酯在0.09g/l、0.51g/l和1.05g/l下的特异性诱导活性分别是未改性乳糖的大约34、31和21倍(在第3天测量)。此外,0.09g/l(22.0u/mg)乳糖单乙酸酯的特异性诱导力几乎接近槐糖(26.9u/mg),这在当前是木霉属中纤维素酶诱导的黄金标准。
通过lc-ms证实经纯化的乳糖单乙酸酯含有摩尔质量384(402[m+nh4]+和407[m+na]+)。通过使用核磁共振(nmr;varian400mhz)进行分析进一步证实了乳糖单乙酸酯的结构。
基于1hnmr、13c-nmr和二维13c-1hhsqcnmr光谱,如图1a中所描绘的乳糖单乙酸酯被证实为在6"位置上经单乙酰化的乳糖的a和p端基异构体混合物。以下表2中概括了所分离的乳糖单乙酸酯洗脱分的质子和碳的分配。
表2
实例2.酶促制备的槐糖乙酸酯用于在木霉属中诱导基因表达
本实例显示,可以通过酶催化转酯化由槐糖制备槐糖乙酸酯,由此增强其在木霉属中的蛋白质诱导力。按照实例1中所描述的程序进行粗槐糖酯混合物、经纯化槐糖二乙酸酯的制备和随后的诱导研究,但乙酸乙烯酯的用量为0.026ml。
表3中所示的cmc活性结果比较了粗槐糖乙酸酯混合物和经纯化槐糖二乙酸酯的蛋白质诱导力与槐糖的蛋白质诱导力。在0.17g/l下,粗混合物即使不纯也已经高度有效而且强效。其在70.2u/mg下的特异性诱导力是未改性槐糖的约3倍。经纯化的槐糖二乙酸酯在0.12g/l下甚至更强效。其在193.3u/mg下的特异性诱导力是未改性槐糖的约7倍。
表3
*所有培养基都含有2%葡糖糖作为碳源。
使用与实例1中所描述相同的程序通过lc-ms分析粗槐糖乙酸酯混合物,且发现其由质量为384(402[m+nh4]+)的槐糖单乙酸酯、质量为426(444[m+nh4]+)的二乙酸酯和未反应槐糖的混合物组成。从lc-ms中证实了经过纯化的槐糖二乙酸酯的纯度。
实例3.用于在木霉属中诱导基因表达的酶促制备的槐糖棕榈酸酯
本实例显示,可以通过酶催化转酯化由槐糖制备属于式(ii)结构类别的槐糖棕榈酸酯,以进一步增强其在木霉属中的蛋白质诱导力。
按照实例1中所描述的程序进行粗槐糖棕榈酸酯混合物的制备和随后的诱导研究,但使用5mg槐糖作为底物且使用棕榈酸乙烯酯(美国东京化成工业公司(tciamerica),波特兰(portland),俄勒冈州(or))代替乙酸乙烯酯。不对粗产物混合物进行进一步纯化。
表4中所示的cmc活性结果比较了粗槐糖棕榈酸酯混合物的蛋白质诱导力与槐糖的蛋白质诱导力。在0.17g/l下,粗混合物即使不纯也已经高度有效而且强效。其在73.8u/mg下的特异性诱导力类似于粗槐糖乙酸酯混合物(表3)并且是未改性槐糖的约3倍。
表4
*所有培养基都含有2%葡萄糖作为碳源。
使用与实例1中所描述相同的程序,通过lc-ms分析粗槐糖单棕榈酸酯混合物,但使用(70%/30%)乙腈和含0.1%甲酸的水的移动相,并且纯化是以等度方式运行,总运行时间为30分钟。发现样品由摩尔质量为580(603[m+na]+)的单棕榈酸酯与质量为818(841[m+na]+)的二棕榈酸酯的混合物组成。
实例4.用于在木霉属中诱导基因表达的化学制备的乳糖乙酸酯
本实例显示,还可以通过化学催化转酯化由乳糖制备乳糖乙酸酯,以增强其在木霉属中的蛋白质诱导力。
首先通过在二甲亚砜(dmso)中制备0.4m乳糖溶液来开始所述程序。将所述溶液(2ml)与3mg碳酸钾(k2co3)催化剂混合,且在50℃下预热30分钟以活化催化剂。在去除未溶解的催化剂之后,通过以不同摩尔比(乙酸乙烯酯:乳糖)加入乙酸乙烯酯来起始反应以便控制取代度。各反应的体积为200μl且使用热循环仪在不搅拌的情况下将其加热到60℃后维持30分钟。随后的样品回收和诱导研究按照实例1中所描述的程序来进行。
表5中给出了cmc活性测定的结果。以2:1的乙酸乙烯酯:乳糖比率制备的粗乳糖乙酸酯混合物得到了最高诱导。其与纤维二糖和乳糖相比非常强效且高度有效。在0.91g/l下,其容易地胜过乳糖和纤维二糖在1.0g/l下的诱导力。其特异性诱导力(表示为单位数u/mg诱导剂)是未改性乳糖的13倍且类似于酶促制备的粗乳糖乙酸酯混合物(表1)。
表5
*所有培养基都含有2%葡萄糖作为碳源。
基于lc-ms分析,在变化的乙酸乙烯酯:乳糖比率下化学制备的粗乳糖乙酸酯混合物由具有多种取代度的乙酸酯混合物组成。在高乙酸乙烯酯:乳糖比率(例如4:1)下,大部分是三乙酸酯和二乙酸酯,而在较低比率(例如1:4)下,大部分是单乙酸酯和未改性乳糖。比率2:1得到最高诱导,产生了主要由单乙酸酯、二乙酸酯和三乙酸酯组成的产物。
实例5.用于在木霉属中诱导基因表达的化学制备的槐糖乙酸酯
本实例显示,还可以通过化学催化转酯化由槐糖制备槐糖乙酸酯,和可以如何对其进行进一步纯化以增强其在木霉属中的蛋白质诱导力。按照与实例4中所描述相同的程序化学制备槐糖乙酸酯的程序,且按照实例1中详细描述的程序进行随后的样品回收和诱导研究,但基于实例1中所描述的程序对粗混合物进行进一步纯化以分离槐糖二乙酸酯。
表6中示出了cmc活性测定的结果。以1:1的乙酸乙烯酯:槐糖比率制备的粗槐糖乙酸酯混合物得到了最高诱导。其非常强效且高度有效并且大大超过了未改性槐糖。在0.09g/l下,其特异性诱导力(表示为单位数u/mg诱导剂)是未改性槐糖的5倍,并且对粗混合物进行进一步纯化以分离槐糖二乙酸酯,且其特异性诱导是未改性槐糖的约8倍。
表6
*所有培养基都含有2%葡萄糖作为碳源。
基于lc-ms分析,在变化的乙酸乙烯酯:槐糖比率下化学制备的粗槐糖乙酸酯混合物由具有多种取代度的乙酸酯混合物组成。在高乙酸乙烯酯:槐糖比率(例如4:1)下,产物主要是三乙酸酯、四乙酸酯、五乙酸酯和六乙酸酯,而在较低比率(例如1:4)下,产物主要是二乙酸酯和单乙酸酯和未改性槐糖。比率1:1得到了最高诱导,且大部分产物是单乙酸酯、二乙酸酯和三乙酸酯。
通过lc-ms证实经纯化的槐糖二乙酸酯含有摩尔质量426(444[m+nh4]+和449[m+na]+)。通过使用核磁共振(nmr;varian400mhz)进行分析进一步证实槐糖二乙酸酯的结构。
基于1hnmr、13c-nmr和二维13c-1hhsqcnmr光谱,如图1b中所描绘的槐糖二乙酸酯被证实为在6'和6"位置上乙酰化的α-槐糖二酯。以下表7中概括了所分离的槐糖乙酸酯洗脱分的质子和碳的分配。
表7
实例6.用于在曲霉属中诱导基因表达的化学制备的麦芽糖乙酸酯
本实例显示,还可以通过化学催化转酯化由麦芽糖制备麦芽糖乙酸酯,以增强其在曲霉属中的蛋白质诱导力。化学制备麦芽糖乙酸酯和随后进行样品回收的程序沿袭与实例4中所描述的程序相同的程序。为了准备使用曲霉属的蛋白质诱导研究,首先用1g/lkh2po4、2g/lnh4cl、0.5g/lmgso4-7h2o、0.2mg/lcuso4-5h2o、12.5mg/lfeso4-7h2o、1mg/lznso4-7h2o和0.09mg/lmnso4制备基本培养基。在室温下将获自美国农业研究菌种保藏中心(arsculturecollection)的黑曲霉(nrrl330)维持在pda板上且允许生成孢子,持续一周。为了进行接种,首先去除2cm×2cm面积的琼脂塞,并且悬浮在5ml无菌水中。利用剧烈搅拌从琼脂上洗掉孢子且在125ml三角烧瓶中,在14ml培养基和作为碳源的1%山梨糖醇存在下,使用1ml悬浮液作为接种液。允许培养在振荡培育器(28℃和200转/分)内进展2天,此时加入诱导剂。再过24小时之后,按照与巴顿等人(细菌学杂志,1972,111(3):771-777)所描述的那些程序类似的程序测定培养物的淀粉酶活性。
表8中示出了淀粉酶活性测定的结果。以2:1的乙酸乙烯酯:麦牙糖比率制备的粗麦牙糖乙酸酯混合物得到了最高诱导。其与麦芽糖相比更强效且高度有效。在0.05g/l下,其特异性诱导力(138.1u/mg)是未改性麦芽糖(44.0u/mg)的3倍。
表8
*所有培养基都含有1%山梨糖醇作为碳源。
基于lc-ms分析,在变化的乙酸乙烯酯:麦牙糖比率下化学制备的粗麦牙糖乙酸酯混合物由具有多种取代度的乙酸酯混合物组成。在高乙酸乙烯酯:麦芽糖比率(例如4:1)下,产物主要是三乙酸酯、四乙酸酯、五乙酸酯和六乙酸酯,而在较低比率(例如1:2)下,产物主要是三乙酸酯、二乙酸酯和单乙酸酯和未改性麦芽糖。比率2:1得到了最高诱导,且产物主要是单乙酸酯、二乙酸酯和三乙酸酯。
实例7.用于在木霉属中诱导基因表达的获自天然内酯型槐糖脂的甲酸处理的槐糖酯
本实例描述了一种使用甲酸将非诱导性天然内酯型槐糖脂转化成具有由图1d和图2描述的结构的新颖而且高诱导性的槐糖酯的高度有效的方法。为了制备天然内酯型槐糖脂,使用假丝酵母菌(atcc22214)。玻璃瓶中的冻干储备物样品是获自atcc,且首先将其转移到酵母提取物、蛋白胨、右旋糖(ypd)培养肉汤中,然后允许在28℃下生长48小时(两天)。然后将培养物与灭菌甘油混合以制备含有20%甘油的最终培养物。然后使用含1ml各种菌培养物的冷冻小瓶建立细胞库,并且存储在-80℃下。
为了由芥花籽油产生天然槐糖脂,首先制备产生培养基,且其包括以下组分:100g/l葡萄糖、10g/l酵母提取物、1g/l尿素和100g/l芥花籽油(crisco,斯马克公司(thej.m.smuckercompany),奥尔维尔(orrville),俄亥俄州(oh))。基于制造商所提供的数据,芥花籽油具有64%主要来自于油酸脂肪酸的单不饱和脂肪和29%主要来自于亚油酸和α-亚麻酸脂肪酸的多不饱和脂肪。为了起始发酵,将1ml来自于如上制备的冷冻小瓶的假丝酵母菌菌种放到在28℃和250转/分(rpm)下培育的250ml三角烧瓶内的50ml产生培养基中。在7天之后,培养基中出现呈粘性棕色油相形式的槐糖脂,且在一些情况下,槐糖脂结晶成黄色至白色残余物。使用分液漏斗分离棕色油性槐糖脂,并且使用乙酸乙酯等度洗脱,使用自填充硅胶柱(飞世尔公司,230-400目)进行进一步纯化以回收二乙酰化内酯型槐糖脂。为了回收主要由二乙酰化内酯型槐糖脂组成的结晶槐糖脂,允许槐糖脂静置直到形成沉渣,通过倾析和用水洗涤随后冷冻干燥来回收。由得自于lc-ms的结果证实所收集样品的纯度,且发现是摩尔质量为688(706[m+h2nh4]+和711[m+na]+)的经衍生而具有羟基油酸酯脂肪基团的二乙酰化内酯型槐糖脂。
下一个步骤是用甲酸处理。所述过程开始于将5mg二乙酰化内酯型槐糖脂溶解于200μl甲酸中。在某些运行中,在这个步骤之后加入0.31μl(0.15%)浓硫酸。在热循环仪中在不进行搅拌的情况下将反应混合物加热到80℃后维持30分钟。然后加入水(1ml)以使样品沉淀,随后离心以回收沉淀物并且在speedvac中干燥以去除残余水和甲酸。然后将经过干燥的样品于200μl乙酸中溶液化成甲醇(3:2v/v)溶液,并且加热到90℃后维持6小时,以便从经过处理的槐糖脂裂解不需要的甲酸酯。在这个步骤之后使用speedvac进行另一个干燥步骤以去除乙酸和甲醇。按照实例1中所描述的程序,在木霉属中测试呈粗产物混合物形式的最终样品的诱导。
表9中所示的cmc活性结果比较了由天然内酯型槐糖脂的甲酸处理获得的粗槐糖酯与其它已知诱导剂的蛋白质诱导力。与已知诱导剂相比,所测试的样品即使不纯也高度有效而且强效。相对于葡萄糖对照,天然二乙酰化内酯型槐糖脂不具诱导性,在甲酸处理之后,其在0.33g/l下的特异性诱导增强了52倍。如果将0.15%硫酸与甲酸一起使用,则在0.03g/l浓度下的特异性诱导增强了多达487倍。即使作为不纯的粗样品,所述混合物在496.5u/mg下的特异性诱导力也是当前同类中最佳诱导剂槐糖的18倍。
表9
*所有培养基都含有2%葡萄糖作为碳源。
实例8.用于在木霉属中诱导基因表达的获自c.bombicola培养物的天然槐糖脂二聚物酯
本实例说明图1e中所描绘的天然槐糖脂二聚物也可以充当木霉属中的基因表达的高度有效诱导剂。根据实例7中所描述的程序,由假丝酵母菌培养物制备含有槐糖脂二聚物的粗样品,并且典型地收集为棕色油性残余物。除芥花籽油以外,还使用大豆油和玉米油作为原料(crisco,斯马克公司,奥尔维尔,俄亥俄州)。在大部分情况下,假丝酵母菌酵母不产生二聚槐糖脂。在很少的情况下,产生痕量且通过lc-ms揭示其存在,lc-ms显示摩尔质量为1030、1028、1072、1070、1114和1112(分别为1053[m+na]+、1051[m+na]+、1095[m+na]+、1093[m+na]+、1137[m+na]+和1135[m+na]+)。摩尔质量1030和1028分别表示经衍生而具有油酸酯或亚油酸酯脂肪基团的二乙酰化槐糖脂二聚物。摩尔质量1072和1070分别表示经衍生而具有油酸酯或亚油酸酯脂肪基团的三乙酰化二聚物。摩尔质量1114和1112分别表示经衍生而具有油酸酯或亚油酸酯脂肪基团的四乙酰化二聚物。不进一步分离这些二聚化合物,且按照实例1中所描述的程序,使用粗样品进行诱导研究。
表10中所示的cmc活性结果比较了获自假丝酵母菌培养物的粗槐糖脂二聚物混合物与其它已知诱导剂的蛋白质诱导力。与已知的诱导剂相比,粗样品即使不纯(如lc-ms和tlc所示)也高度有效而且强效。不含二聚物的粗样品的诱导性显著低于含有二聚物的样品。在0.90g/l下,在芥花籽油上生长的含有二聚物的样品的特异性诱导(19.7u/mg)是无二聚物的样品所产生的诱导的7倍,并且几乎达到槐糖的诱导(26.9u/mg)。因为这些二聚物仅作为痕量存在于粗样品中,所以经过纯化的二聚化合物在分离后就可能甚至更强效。
表10
*所有培养基都含有2%葡萄糖作为碳源。
实例9.使用甲酸由天然槐糖苷产生槐糖
为了最适用于商业应用,槐糖需要更便宜而且更容易获得。本实例提供了一种用于由在非水性条件下对天然槐糖苷(甜菊苷和槐糖脂)进行甲酸处理而以高产率产生槐糖的简单而且有效的方法。所述程序类似于实例7中所描述的程序,但在甲酸处理之后将样品冻干,然后在室温下,在含0.5m甲醇钠的甲醇中溶液化15分钟。这个过程去除了不需要的甲酸酯或脂肪酯以产生槐糖。在使用speedvac进行另一个干燥步骤以去除甲醇之后,通过hplc(waters2695,401r1检测器和bioradhpx-87h柱)分析样品以测定槐糖浓度。作为比较,按照草壁等人(农业与生物化学,1987,51(8):2255-2256)详细描述的程序,用0.1n盐酸处理甜菊苷以产生槐糖。
表11中的结果显示,当与草壁所描述的稀盐酸处理相比较时,甲酸处理产生显著有所增加的产率。通过使用甜菊苷作为起始材料,使用甲酸处理的槐糖产率增加到三倍。通过使用二乙酰化内酯型槐糖脂作为起始材料,当对甲酸处理补充添加0.15%硫酸时,槐糖产率加倍。
表11
实例10.使用槐糖酯作为固相发酵中基因表达的诱导剂
使用固相发酵生产酶和其它蛋白质产物依赖于微生物(特别是丝状真菌)在无自由流动液体的潮湿固体底物上的生长。与液体深层发酵相反,固相发酵在一些情形下在性能和生产成本两方面都可提供显著优势。本实例显示,具有图1d和图2所描述的结构的槐糖酯可以用作固相发酵中使用里氏木霉产生纤维素酶的非常有效的诱导剂。
所使用的固体底物是购自本地宠物供应商店的麦麸与玉米芯的1:1掺合物。每次运行由放到125ml烧瓶中的8克这种掺合物组成,然后通过高压釜处理进行灭菌。然后加入实例1中所描述的柠檬酸盐基本培养基(ph4.8)。所加入的柠檬酸盐培养基的量是5.3ml、8ml、12ml、18.7ml,由此分别得到40%、50%、60%和70%的起始水分含量。所使用的槐糖酯是获自天然内酯型槐糖脂的甲酸处理的粗混合物(实例7)。对于每次运行,然后将与柠檬酸盐基本培养基预混的粗槐糖酯(10mg)混入固体底物中。通过将2ml里氏木霉预培养物接种液(来自于第2天,实例1)混入固体底物中,随后在28℃下在不振荡的情况下培育烧瓶来起始发酵。在第3天从各烧瓶收集固体样品且用10倍体积的50mm柠檬酸盐缓冲液(ph4.8)进行处理,并且如实例1中所描述分析cmc活性。
表12中的结果显示,不管起始水分含量如何,在使用里氏木霉的固相发酵中,向固体底物中加入槐糖酯诱导剂都能够显著提高纤维素酶产生。在40%、50%、60%和70%起始水分下,所观测到的每克固体底物的纤维素酶活性提高分别是4倍、7倍、12倍和5倍。
表12
尽管本文中已经显示并且描述了本发明的优选实施例,但所属领域的技术人员应显而易见,所述实施例仅以举例方式提供。所属领域的技术人员现在应能在不背离本发明的情况下想到许多变化、改变和替代。应理解,可以采用本文中所描述的本发明实施例的各种替代方案来实施本发明。希望以下权利要求书界定本发明的范围且从而涵盖在这些权利要求及其等效物范围内的方法和结构。
- 还没有人留言评论。精彩留言会获得点赞!